2. 100700 北京,中国中医科学院中医基础理论研究所
2. Institute of Basic Theory for Chinese Medicine, China Academy of Chinese Medical Sciences, Beijing, 100700, China
缺血再灌注损伤(ischemia-reperfusion injury,IRI)是指器官或组织经历缺血再灌注后,不能使其功能恢复,反而加重功能障碍及结构损伤的病理生理过程。内皮细胞的IRI导致一系列严重的病理生理问题,如显著减少冠状动脉内皮依赖性舒张[1-2]等,并在器官或组织损伤的发生、发展中起重要作用。尽管已经研究了针对内皮细胞IRI的治疗策略,但仍面临治疗失败的风险。因此,确定一种有效的药物治疗方法来治疗血管IRI是该领域研究的焦点[3]。
缺氧复氧(anoxia-reoxygenation, AR)是一种常用的体外模拟IRI的方法,目前已被广泛用于IRI对于多种细胞的损伤机制及药物研究中。而AR条件下的人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)常被用于建立体外模拟缺血/再灌注损伤引起的血管变化的模型系统[4-5]。AR造成的血管内皮损伤在IRI导致的血管损伤中起重要作用。研究发现AR可造成包括骨髓干细胞的早衰[6]、H9c2细胞的氧化应激及ROS的过度释放[7],HUVECs细胞增殖、迁移和细胞黏附的过度抑制[8]在内的多种细胞的多种损伤。在筛选可以有效治疗这种血管内皮损伤的化合物中,中药黄芪作为一种对心血管系统方面药用价值较高的草本植物,因其功效和相关制剂在临床的广泛应用而备受关注[9]。研究显示黄芪注射液可以有效提高再灌注心肌的抗氧化能力,减轻心肌IRI[10]。临床病例观察结果提示黄芪注射液对老年高血压患者的血管弹性指标及血管损伤指标均有明显改善[11]。黄芪注射液还可以通过激活HIF-1α/VEGF信号转导通路促进脑缺血再灌注损伤大鼠脑内血管新生而改善血管损伤[12]。但目前黄芪注射液对缺血再灌注导致的血管内皮损伤的影响及机制尚不明确。
因此,本研究利用HUVECs细胞构建AR模型以模拟缺血再灌注导致的血管内皮损伤,并从细胞增殖、氧化应激、早衰等方面综合观察黄芪注射液对AR模拟的缺血再灌注的改善作用及其机制,探索KNDC1/p53通路在AR损伤模型及黄芪注射液干预中的作用,为IRI导致的血管损伤的治疗提供一个新的候选药物。
1 材料与方法 1.1 细胞与药物HUVECs购自美国Sciencell公司。黄芪注射液由石家庄神威药业有限公司生产,每毫升原液相当于原药材2 g,使用时按照对应用量分别稀释400、200、100倍。
1.2 主要试剂包括:胎牛血清(Gibco公司,美国);ECM培养基(Sciencell公司,美国);胰蛋白酶(HyClone公司,美国);细胞衰老β-半乳糖苷酶染色试剂盒(上海碧云天生物技术有限公司);BCA试剂盒、TRIzol(Thermo Fisher Scientific公司,美国);One Step RT-PCR试剂盒(TaKaRa公司,日本);RIPA裂解液(北京索莱宝有限公司,美国);抗KNDC1抗体、噻唑蓝(MTT)(Sigma公司);抗p53、p-p53、p21、GAPDH抗体(CST公司,美国);山羊抗兔的二抗(北京中杉金桥生物有限公司);总超氧化物歧化酶(superoxide dismutases, SOD)检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)检测试剂盒(南京建成生物工程研究所)。
1.3 黄芪注射液的配制按照所需的浓度将黄芪注射液按比例加入到缺氧平衡后的培养基中,制备终浓度分别为5、10、20 mg/mL的含药缺氧培养基,并使用生理盐水配平加入药液的总体积。AR组及对照组则需加入同等体积的生理盐水以保持一致。
1.4 AR细胞模型的建立与实验分组参照文献[13]AR条件并作少许改良。取出液氮罐中冻存的HUVECs进行常规复苏。复苏后用ECM培养基(含有浓度为10%的胎牛血清、100 U的双抗及表皮生长因子)于5%CO2细胞培养箱中37 ℃培养,每2天换液1次,选择P10代的HUVECs细胞,分为对照组、AR模型组和不同浓度黄芪注射液干预组。其中对照组细胞无特殊处理并在正常条件下(20%O2, 5%CO2)培养8 h,AR模型组细胞吸弃原孔的培养基并加入缺氧环境中平衡2 h后的ECM培养基。随后将细胞置于5%CO2-95%N2 (体积比)缺氧培养箱中37 ℃缺氧孵育6 h,然后更换为正常ECM培养基,正常细胞培养条件下(20%O2, 5%CO2)37 ℃复氧孵育2 h。黄芪注射液干预组于缺氧处理时分别加入终浓度为5、10、20 mg/mL的缺氧含药培养基。AR结束后,收集细胞用于后续实验研究。
1.5 细胞活力检测以2×103/孔的接种密度将HUVECs细胞接种于96孔板中。对照组始终在完全培养基中于5%CO2细胞培养箱中37 ℃培养。处理组则待细胞贴壁后吸弃各孔培养基,换成黄芪注射液终浓度为0、5、10、20 mg/mL的ECM培养基。如上所述缺氧6 h、复氧2 h后,加入5 g/L的MTT溶液20 μL,继续培养4 h。培养结束后,弃去培养基并加入150 μL DMSO避光震荡10 min,在多功能微孔板检测仪上测定490 nm处的光密度值[D(490)]。计算各组细胞的活性,细胞活性=D(490)实验组/D(490)对照组×100%。
1.6 细胞SA-β-gal染色以3×104/孔的接种密度将HUVECs细胞接种于6孔板中,对照组培养基不变,处理组待细胞贴壁后移去各孔培养基,换成黄芪注射液终浓度为0、5、10、20 mg/mL的ECM培养基。如上所述缺氧6 h、复氧2 h后,按照SA-β-gal染色试剂盒说明书进行检测。
1.7 细胞SOD活性检测收集各组细胞,PBS重悬后,按照SOD活性检测说明书检测细胞SOD活性。
1.8 一步法RT-PCR检测细胞KNDC1转录水平TRIzol法提取细胞总RNA,并用无RNA酶水溶解。Nanodrop测定RNA浓度并调平。参照One Step TB Green© PrimeScriptTM RT-PCR试剂盒说明书,以GAPDH为内参,测定KNDC1 mRNA表达。其中反应条件为:反转录反应,42 ℃ 5 min,95 ℃预变性10 s;PCR反应,95 ℃ 5 s,60 ℃ 30 s循环40次。引物序列:KNDC1,正义链5′-CAGGCTTCTTTCCCTACTGTTCGT-3′,反义链5′- CCGCTGCTTGTTTTGATAGTTCTC-3′;GAPDH,正义链5′-CGCTGAGTACGTCGTGGAGTC-3′,反义链5′-GCTGATGATCTTGAGGCTGTTGTC-3′。
1.9 Western blot检测细胞内KNDC1、p53、p-p53、p21蛋白的表达采用RIPA裂解缓冲液提取各组细胞蛋白。BCA试剂盒定量并配平各组蛋白后煮沸变性。然后通过SDS-PAGE分离蛋白并转移到PVDF膜上。在37 ℃条件下,用含5%脱脂牛奶的TBST封闭2 h,加入相应的一抗4 ℃震荡过夜。其中抗体p53、p-p53、p21及KNDC1的稀释比例为1 :1 000。随后TBST洗涤条带4次,每次15 min。洗涤好的条带加入到稀释好的辣根过氧化物酶(HRP)标记的山羊抗兔二抗中,室温孵育2 h。以GAPDH为内源性参考蛋白。根据制造商的说明,使用ECL Plus检测系统对蛋白进行可视化检测,使用ImageJ软件分析条带灰度值。
1.10 统计学分析所有实验重复3次,采用SPSS 17.0统计软件,结果以x±s表示。对各组数据进行单因素方差分析,并使用LSD检验分析各组间治疗效果的显著性。以P < 0.05为差异有统计学意义。
2 结果 2.1 黄芪注射液改善AR所致的HUVECs细胞的增殖抑制与对照组相比,AR组细胞相对活力显著降低(P < 0.01),而不同浓度的黄芪注射液均可有效改善AR导致的增殖抑制。当黄芪注射液浓度达到10 mg/mL时,细胞相对活力显著增加(P < 0.05,图 1)。因此,黄芪注射液可显著改善AR所致的HUVEC细胞的增殖抑制并呈现良好的量效关系。
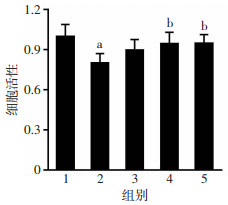
|
| 1:对照组;2:AR组;3:AR+5 mg/mL黄芪注射液组;4:AR+ 10 mg/mL黄芪注射液组;5:AR+20 mg/mL黄芪注射液组;a:P < 0.01, 与对照组比较;b:P < 0.05,与AR组比较 图 1 黄芪注射液改善AR所致的HUVEC细胞的增殖抑制(n=6) |
2.2 黄芪注射液改善AR所致的HUVECs细胞早衰
AR可导致衰老HUVECs细胞数量的显著增加(P < 0.01)。黄芪注射液干预后,随着加入黄芪注射液浓度的增加,AR所致的衰老HUVECs细胞数量逐渐减少,呈现良好的量效关系。当加入浓度为10 mg/mL黄芪注射液时,与AR组细胞相比,衰老细胞数量明显降低(P < 0.05)。而20 mg/mL黄芪注射液则可显著缓解AR导致的HUVECs细胞早衰(P < 0.01),并恢复到AR处理前的细胞衰老程度(图 2)。

|
| A:各组染色后细胞衰老情况;B:各组细胞染色阳性比例 1:对照组;2:AR组;3:AR+5 mg/mL黄芪注射液组;4:AR+10 mg/mL黄芪注射液组;5:AR+20 mg/mL黄芪注射液组;a:P < 0.01, 与对照组比较;b:P < 0.05,c:P < 0.01,与AR组比较 图 2 SA-β-gal染色检测黄芪注射液改善AR处理所致的HUVECs细胞早衰 |
2.3 黄芪注射液改善AR所致的HUVECs细胞SOD和GSH-Px活性的降低
AR处理的HUVECs细胞的相对SOD活性及相对GSH-Px活性均降低25%左右。而加入不同浓度黄芪注射液的细胞, 其相对SOD及GSH-Px活性均显著增加并呈现良好的浓度依赖性,即黄芪注射液可显著改善AR所致的HUVECs细胞的相对SOD及GSH-Px活性降低(P < 0.05,P < 0.01,图 3)。

|
| 1:对照组;2:AR组;3:AR+5 mg/mL黄芪注射液组;4:AR+10 mg/mL黄芪注射液组;5:AR+20 mg/mL黄芪注射液组;a:P < 0.05,b:P < 0.01,与对照组比较;c:P < 0.05,d:P < 0.01,与AR组比较 图 3 黄芪注射液改善AR所致的HUVECs细胞SOD(A)和GSH-Px(B)活性的降低 |
2.4 黄芪注射液阻断AR所致的HUVECs细胞KNDC1 mRNA及蛋白表达升高
与对照组相比,AR可显著增加HUVECs细胞KNDC1 mRNA的表达(P < 0.01)。黄芪注射液干预后,随着浓度的增加,细胞中KNDC1 mRNA表达较AR模型组逐渐降低。且5、10、20 mg/mL黄芪注射液均可显著降低KNDC1 mRNA表达(P < 0.01)。其中,20 mg/mL的黄芪注射液可以完全抵消AR对HUVECs细胞KNDC1 mRNA表达的促进作用。同时,与对照组相比,AR处理组细胞KNDC1蛋白含量显著增加(P < 0.05,P < 0.01),其中相对分子量为191×103的KNDC1蛋白含量较相对分子量为54×103的KNDC1蛋白增加更为明显。加入黄芪注射液后,随着浓度的增加,细胞中相对分子量为191×103的KNDC1蛋白含量显著降低(P < 0.01),而相对分子量为54×103的KNDC1蛋白含量没有明显变化。其中,20 mg/mL黄芪注射液可使细胞中KNDC1蛋白含量降低到正常水平(图 4)。
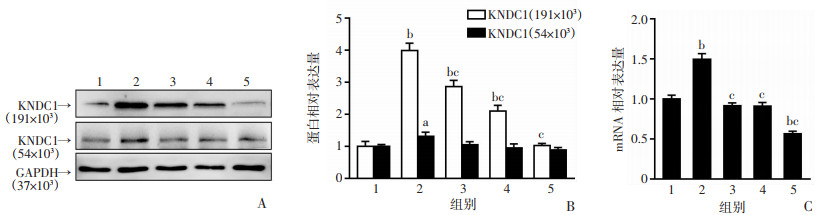
|
|
1:对照组;2:AR组;3:AR+5 mg/mL黄芪注射液组;4:AR+10 mg/mL黄芪注射液组;5:AR+20 mg/mL黄芪注射液组;a:P < 0.05,b:P < 0.01,与对照组比较;c:P < 0.01,与AR组比较 A、B:Western blot检测各组细胞KNDC1蛋白表达;C:RT-PCR检测各组细胞KNDC1 mRNA表达 图 4 黄芪注射液阻断AR所致的HUVECs细胞KNDC1 mRNA及蛋白表达升高 |
2.5 黄芪注射液对AR处理的HUVECs细胞p53/p21通路的影响
与对照组相比,AR处理组细胞中p21蛋白含量及p-p53/p53显著增加(P < 0.01)。黄芪注射液干预后,随着浓度的增加,细胞中p21蛋白含量及p-p53/p53较AR处理组显著减少(P < 0.05,P < 0.01)。当黄芪注射液浓度达到20 mg/mL时,细胞p21蛋白含量及p-p53/p53均降低到正常水平(图 5)。
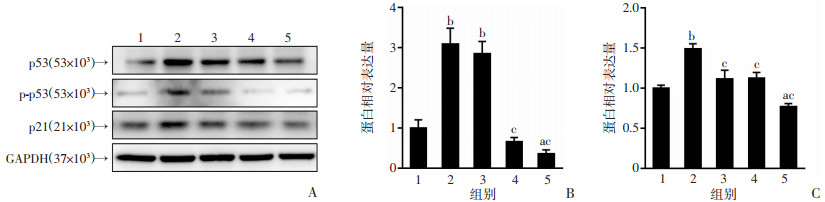
|
|
1:对照组;2:AR组;3:AR+5 mg/mL黄芪注射液组;4:AR+10 mg/mL黄芪注射液组;5:AR+20 mg/mL黄芪注射液组;a:P < 0.05,b:P < 0.01,与对照组比较;c:P < 0.01,与AR组比较 A:Western blot检测各组细胞p53/p21通路蛋白表达;B:各组细胞p-p53/p53蛋白相对表达量分析;C:各组细胞p21蛋白相对表达量分析 图 5 黄芪注射液对AR处理的HUVECs细胞p53/p21通路的影响 |
3 讨论
IRI是急性心肌梗死后伴随各种组织器官血液再灌注而产生的严重机体损伤,目前已成为继循环休克、器官移植后死亡的又一个主要致死原因[14]。虽然恢复的血流可以供给机体氧和营养,但再灌注对组织器官损伤的加重往往导致更严重的机体损伤。目前存在多种关于IRI损伤的推测,包括氧化应激、炎症、细胞凋亡和线粒体功能障碍等[15]。其中内皮功能障碍是缺血再灌注后炎症损伤和血管损伤的最早事件[16],因此内皮细胞是IRI治疗的理想靶点之一[17]。研究发现:在缺血时尤其是再灌注时,由于血管细胞内黄嘌呤氧化酶增多、线粒体功能受损和儿茶酚胺氧化等途径导致抗氧化酶活性降低,从而引发氧化应激并造成内皮细胞的结构损坏及功能障碍[18]。由此可见,缺血再灌注导致的内皮细胞抗氧化系统紊乱在血管损伤中具有重要意义。AR模型是模拟体内IRI的常用体外模型,有研究指出缺氧可以导致间充质干细胞早衰[19]。给予大鼠4个周期的缺血再灌注处理后,年轻大鼠的肾脏同样出现过早衰老的迹象[20]。然而,AR模型是否会导致HUVECs细胞同样出现衰老现象尚不清楚。因此,本研究采用HUVECs细胞AR处理模型模拟缺血再灌注环境。细胞增殖活性的检测结果表明:HUVECs经缺氧6 h、复氧2 h后,细胞活性明显下降(P < 0.01),形态学观察结果显示:部分细胞开始变细变长,细胞形态较不规则,细胞排列从铺路石状镶嵌排列变得杂乱无章。SA-β-gal衰老染色结果证实:AR条件能够诱导细胞的早衰,AR处理后的HUVECs数量减少到处理前的70%左右。同时,细胞抗氧化酶SOD和GSH-Px的活性也明显下降(P < 0.01)。此实验结果与已报道的HUVECs缺氧复氧后的特点相近[21-22],证实AR模型造模成功。该结果提示AR可导致包括细胞增殖抑制、氧化应激及细胞早衰在内的多种内皮细胞损伤。
氧化应激也被证明在血管损伤中发挥关键作用。其涉及的ROS、抗氧化酶及其他信号分子被证实广泛地参与到血管损伤及修复过程中[23]。其中内源性或外源性过度和/或持续刺激造成内皮细胞氧化应激,并可改变其功能。这些变化会导致心血管疾病的发生,包括动脉硬化[24]。同时,过度氧化应激是血管疾病中内皮功能障碍和提早衰老的常见原因[25]。氧化应激损伤内皮细胞的活动和功能,增强细胞衰老[26]。如何改善内皮细胞受损或衰老情况,是血管修复中的重要问题[27]。本研究发现黄芪注射液可改善AR所致的内皮细胞中SOD及GSH-Px活性的降低,并使细胞活性明显增加。衰老染色结果证明黄芪注射液还可显著改善AR所致的内皮细胞早衰,提示黄芪注射液通过提高内皮细胞内抗氧化酶活性改善氧化应激,保护内皮细胞,减轻AR模型下细胞的氧化损伤及提早衰老。研究表明黄芪注射液可以降低缺氧环境下视网膜神经节细胞p53的高表达[28],降低大鼠再灌注后脑皮质神经元p53的高表达,升高其热休克蛋白70(HSP70)、蛋白激酶B(PKB)表达水平,改善神经元的功能损伤[29]。然而,黄芪注射液能否通过调节p53表达改善AR导致的HUVECs细胞水平仍未可知。
前期研究发现:KNDC1[kinase non-catalytic C-lobe domain (KIND) containing1, v-KIND]作为与衰老及氧化应激均相关、功能类似p66Shc的一种蛋白,与p53蛋白联系密切。进一步研究表明:KNDC1过表达可以启动p53信号通路,通过促进p53表达加速细胞衰老[30]。对KNDC1的敲低实验同样证实KNDC1与p53在内皮细胞衰老方面的作用[31]。因此,我们推测KNDC1有希望和p53一样成为治疗内皮细胞衰老损伤的作用靶点。为了研究黄芪注射液对细胞AR模型中KNDC1/p53通路的影响,我们检测了各组细胞KNDC1、p53、p-p53、p21蛋白表达。结果显示:黄芪注射液可明显降低AR导致的HUVECs细胞KNDC1、p53、p-p53、p21蛋白表达量的增加。前期研究表明KNDC1在HUVEC衰老中发挥重要的作用,KNDC1过表达可使HUVEC明显衰老[32],细胞增殖能力明显减弱。由此可见,KNDC1/p53通路可能参与AR诱导的HUVEC细胞氧化损伤及早衰,而黄芪注射液对AR导致的HUVECs细胞氧化应激与衰老的改善可能与下调KNDC1/p53通路有关。
综上所述,本研究建立了HUVECs细胞的AR模型并证实黄芪注射液可改善AR诱导的HUVECs损伤,其机制可能是通过下调KNDC1/p53通路蛋白表达改善细胞氧化应激、衰老及促进细胞增殖。本研究从内皮功能障碍的药物改善出发,为IRI引起的血管损伤的治疗提供了一定的理论支持。其中,黄芪注射液作为临床常用的治疗心肌疾病的药物具有良好的安全性,有望成为治疗血管损伤的有效药物。然而,本实验中用于改善HUVECs细胞AR损伤的最佳药物剂量略高于黄芪注射液治疗心肌疾病的最高剂量,提示临床应用黄芪注射液治疗缺血再灌注导致的血管损伤的给药剂量可能会略高于目前心肌疾病治疗的给药剂量。故黄芪注射液在体内改善血管损伤的效果及其给药剂量有待验证,其机制是否也与KNDC1/P53通路的下调有关仍需进一步研究。
| [1] |
LAUDE K, RICHARD V, THUILLEZ C. Coronary endothelial cells: a target of ischemia reperfusion and its treatment?[J]. Arch Des Maladies Du Coeur et Des Vaisseaux, 2004, 97(3): 250-254. |
| [2] |
ZHANG L Q, RUAN Z H, LIANG J Q, et al. Protective effect of propofol on ischemia-reperfusion injury detected by HPLC-MS/MS targeted metabolic profiling[J]. Eur J Pharmacol, 2018, 833: 69-78. DOI:10.1016/j.ejphar.2018.05.039 |
| [3] |
FERDINANDY P, HAUSENLOY D J, HEUSCH G, et al. Interaction of risk factors, comorbidities, and comedications with ischemia/reperfusion injury and cardioprotection by preconditioning, postconditioning, and remote conditioning[J]. Pharmacol Rev, 2014, 66(4): 1142-1174. DOI:10.1124/pr.113.008300 |
| [4] |
ZHANG Y S, LI W J, ZHANG X Y, et al. Ganoderma atrum polysaccharide ameliorates anoxia/reoxygenation-mediated oxidative stress and apoptosis in human umbilical vein endothelial cells[J]. Int J Biol Macromol, 2017, 98: 398-406. DOI:10.1016/j.ijbiomac.2017.01.071 |
| [5] |
SCHRAMM R, APPEL F, REINACHER M, et al. Atherosclerosis aggravates ischemia/reperfusion injury in the gut and remote damage in the liver and the lung[J]. Inflamm Res, 2011, 60(6): 555-567. DOI:10.1007/s00011-010-0304-3 |
| [6] |
张凤祥.缺氧/氧再灌注诱导心肌细胞衰老的机制及其干预研究[D].南京: 南京医科大学, 2007. ZHANG F X. Study on the mechanism and intervention of hypoxia/oxygen reperfusion induced senescence of myocardial cells[D]. Nanjing: Nanjing Medical University, 2007. |
| [7] |
DENG Y Z, XIAO L, ZHAO L, et al. Molecular mechanism underlying hypoxic preconditioning-promoted mitochondrial translocation of DJ-1 in hypoxia/reoxygenation H9c2 cells[J]. Molecules, 2019, 25(1): 71. DOI:10.3390/molecules25010071 |
| [8] |
ZHAO S, WANG Y, ZHANG X, et al. Melatonin protects against hypoxia/reoxygenation-induced dysfunction of human umbilical vein endothelial cells through inhibiting reactive oxygen species generation[J]. Acta Cardiologica Sinica, 2018, 34(5): 424-431. DOI:10.6515/ACS.201809_34(5).20180708A |
| [9] |
姚红旗, 侯雅竹, 王贤良, 等. 黄芪心血管药理作用研究进展[J]. 河南中医, 2019, 39(2): 302-306. YAO H Q, HOU Y Z, WANG X L, et al. Advances in pharmacological effects of Huangqi on cardiovascular system[J]. Henan Tradi Chin Med, 2019, 39(2): 302-306. DOI:10.16367/j.issn.1003-5028.2019.02.0075 |
| [10] |
关凤英, 李红, 于秀霞, 等. 黄芪注射液预适应对大鼠实验性心肌缺血再灌注损伤的保护作用及其机制[J]. 中国老年学杂志, 2010, 30(21): 3126-3129. GUAN F Y, LI H, YU X X, et al. Protective effect and mechanism of Astragalus injection preconditioning on experimental myocardial ischemia-reperfusion injury in rats[J]. Chin J Gerontol, 2010, 30(21): 3126-3129. |
| [11] |
徐银祯, 李兰芳, 党万军. 黄芪注射液对老年高血压患者血管功能及左心室重塑的影响[J]. 内科, 2018, 13(6): 843-846. XU Y Z, LI L F, DANG W J. Effects of Astragalus injection on vascular function and left ventricular remodeling of elderly patients with hypertension[J]. Intern Med China, 2018, 13(6): 843-846. |
| [12] |
余晴晴, 柏建峰, 王江军. 黄芪注射液对脑缺血再灌注损伤大鼠脑内血管新生及HIF-1α/VEGF信号转导通路的影响[J]. 蚌埠医学院学报, 2017, 42(10): 1309-1313. YU Q Q, BAI J F, WANG J J. Effect of Astragalus injection on the angiogenesis and HIF-1α/VEGF signal pathwayin brain tissue of rats with cerebral ischemia reperfusion injury[J]. J Bengbu Med Coll, 2017, 42(10): 1309-1313. |
| [13] |
牛其芳.硝酸盐转运蛋白Sialin在人脐静脉内皮细胞缺氧复氧模型的初步探究[D].北京: 首都医科大学, 2016. NIU Q F. A preliminary research on Sialin, a nitrate transporter in Anoxia reoxygeneration model of human umbilical vein endothelial cells[D]. Beijing: Capital Medical University, 2016. |
| [14] |
CHA X X, HAN S N, YU J, et al. Inulin with a low degree of polymerization protects human umbilical vein endothelial cells from hypoxia/reoxygenation-induced injury[J]. Carbohydr Polym, 2019, 216: 97-106. DOI:10.1016/j.carbpol.2019.03.016 |
| [15] |
YANG M J, LINN B S, ZHANG Y M, et al. Mitophagy and mitochondrial integrity in cardiac ischemia-reperfusion injury[J]. Biochim et Biophys Acta Mol Basis Dis, 2019, 1865(9): 2293-2302. DOI:10.1016/j.bbadis.2019.05.007 |
| [16] |
BERNSTEIN D L, ZULUAGA-RAMIREZ V, GAJGHATE S, et al. miR-98 reduces endothelial dysfunction by protecting blood-brain barrier (BBB) and improves neurological outcomes in mouse ischemia/reperfusion stroke model[J]. J Cerebr Blood Flow Metab, 2019. DOI:10.1177/0271678X19882264 |
| [17] |
GAO X, BI Y, CHI K, et al. Glycine-nitronyl nitroxide conjugate protects human umbilical vein endothelial cells against hypoxia/reoxygenation injury via multiple mechanisms and ameliorates hind limb ischemia/reperfusion injury in rats[J]. Biochem Biophys Res Commun, 2017, 488(1): 239-246. DOI:10.1016/j.bbrc.2017.05.053 |
| [18] |
连瑞珍, 郑玉云. 内皮功能障碍、氧化应激与心肌缺血再灌注损伤[J]. 疾病监测与控制, 2013, 7(7): 416-419. LIAN R Z, ZHENG Y Y. Oxidative stress and endothelial dysfunction, myocardial ischemic reperfusion injury[J]. J Dis Monit Control, 2013, 7(7): 416-419. |
| [19] |
XING J Y, YING Y Q, MAO C X, et al. Hypoxia induces senescence of bone marrowmesenchymal stem cells via altered gut microbiota[J]. Nat Commun, 2018, 9(1): 2020. DOI:10.1038/s41467-018-04453-9 |
| [20] |
JANKAUSKAS SS, PEVZNER I B, ANDRIANOVA N V, et al. The age-associated loss of ischemic preconditioning in the kidney is accompanied by mitochondrial dysfunction, increased protein acetylation and decreased autophagy[J]. Sci Rep, 2017, 7: 44430. DOI:10.1038/srep44430 |
| [21] |
JIANG J, CHEN D Y, LIU Z T, et al. Effect of N-perfluorooctane on hypoxia/reoxygenation injury in human umbilical vein endothelial cells[J]. Acta Cardiol Sin, 2016, 32(6): 716-722. |
| [22] |
唐容, 李袁静, 高凌云. eNOS谷胱甘肽化在缺氧预适应保护人脐静脉内皮细胞缺氧复氧损伤中的作用及机制[J]. 重庆医科大学学报, 2018, 43(3): 326-331. TANG R, LI Y J, GAO L Y. Role of eNOS glutathionylaiton in hypoxic preconditioning protecting human umbilical vein endothelial cells from hypoxia and reoxygenation injury[J]. J Chongqing Med Univ, 2018, 43(3): 326-331. DOI:10.13406/j.cnki.cyxb.001588 |
| [23] |
LYLE A N, GRIENDLING K K. Modulation of vascular smooth muscle signaling by reactive oxygen species[J]. Physiol Bethesda Md, 2006, 21: 269-280. DOI:10.1152/physiol.00004.2006 |
| [24] |
CAI H, HARRISON D G. Endothelial dysfunction in cardiovascular diseases: the role of oxidantstress[J]. Circ Res, 2000, 87(10): 840-844. DOI:10.1161/01.RES.87.10.840 |
| [25] |
WU J Z, XIA S J, KALIONIS B, et al. The role of oxidative stress and inflammation in cardiovascularaging[J]. Biomed Res Int, 2014, 2014: 1-13. DOI:10.1155/2014/615312 |
| [26] |
CASE J, INGRAM D A, HANELINE L S. Oxidative stress impairs endothelial progenitor cellfunction[J]. Antioxid Redox Signal, 2008, 10(11): 1895-1907. DOI:10.1089/ars.2008.2118 |
| [27] |
ERUSALIMSKY J D. Vascular endothelial senescence: from mechanisms topathophysiology[J]. J Appl Physiol, 2009, 106(1): 326-332. DOI:10.1152/japplphysiol.91353.2008 |
| [28] |
贾茜钰, 刘勤, 张书, 等. 黄芪注射液对模拟高原缺氧环境大鼠视网膜缺氧诱导因子-1α、p53表达的影响[J]. 中华眼底病杂志, 2016, 32(4): 423-427. JIA X Y, LIU Q, ZHANG S, et al. Astragalus injection' effect on the expression of hypoxia-inducible factor-1α and p53 in the retina of rats under hypoxia environment[J]. Chin J Ocular Fundus Dis, 2016, 32(4): 423-427. DOI:10.3760/cma.j.issn.1005-1015.2016.04.018 |
| [29] |
颜玲, 黄德彬, 刘锦红, 等. 黄芪多糖对脑缺血再灌注大鼠脑皮质中HSP70、PKB和P53蛋白表达的影响[J]. 中国病理生理杂志, 2012, 28(9): 1610-1617. YAN L, HUANG D B, LIU J H, et al. Effects of Astragalus polysaccharide on expression of HSP70, PKB and P53 in rat cerebral cortex with cerebral ischemia and reperfusion[J]. Chin J Pathophysiol, 2012, 28(9): 1610-1617. |
| [30] |
姬劲锐, 镐振选, 刘静, 等. 激酶非催化的C-叶域蛋白质1对人脐静脉内皮细胞衰老作用的影响及机制[J]. 心肺血管病杂志, 2018, 37(2): 156-161. JI J R, HAO Z X, LIU J, et al. Molecular mechanism of overexpression of kinase non-catalytic C-lobe domin containing on senescence of human umbilical vein endothelial cells[J]. J Cardiovasc Pulmon Dis, 2018, 37(2): 156-161. DOI:10.3969/j.issn.1007-5062.2018.02.018 |
| [31] |
ZHANG C Y, ZHEN Y Z, LIN Y J, et al. KNDC1 knockdown protects human umbilical vein endothelial cells fromsenescence[J]. Mol Med Rep, 2014, 10(1): 82-88. DOI:10.3892/mmr.2014.2201 |
| [32] |
李开济, 郝晓方, 章广玲, 等. 重组人KNDC1腺病毒表达载体的构建及其促HUVEC衰老作用[J]. 基础医学与临床, 2015, 35(11): 1447-1452. LI K J, HAO X F, ZHANG G L, et al. Construction of human recombinant KNDC1 adenovirus and its effect of promoting HUVEC senescence[J]. Basic Med Sci Clin, 2015, 35(11): 1447-1452. |



