2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系:防原医学教研室,全军复合伤研究所,创伤、烧伤与复合伤国家重点实验室,重庆市纳米医学工程研究中心;
3. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系:火箭军医学教研室
2. State Key Laboratory of Trauma, Burns and Combined Injury, Department of Anti-radiation Medicine, Chongqing Engineering Research Center for Nanomedicine, Institute of Combined Injury, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Department of Rocket Force Medicine, College of Preventive Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
肠道菌群(gut microbiota,GM)是人体内最大的微生物共生系统,越来越多的研究表明肠道菌群及其代谢产物在机体正常生理功能维持和疾病演变过程中发挥着重要作用。肠道菌群可参与阿尔茨海默病、哮喘、糖尿病和肿瘤等多种疾病的发生、发展过程[1-4],例如清除肠道菌群可抑制阿霉素等化疗药物所致肠道损伤中白细胞的浸润速度[5]。此外,通过益生菌等手段恢复和重建正常的肠道菌群组成,对多种慢性疾病显示出良好的治疗效果[6]。
骨髓造血组织和胃肠道组织中细胞增殖旺盛,且对多种损伤因素高度敏感[7],是电离辐射损伤的主要靶器官。目前肠道菌群对骨髓造血和胃肠道组织稳态维持及放射损伤后再生修复影响的研究报道较少。本课题通过饮用抗生素清除小鼠肠道菌群,探讨肠道菌群对小鼠骨髓造血和肠上皮稳态维持及放射损伤后再生修复过程的影响。
1 材料与方法 1.1 实验动物6~8周龄C57BL/6J小鼠购自北京华阜康生物科技有限公司,体质量18~22 g,在SPF环境中适应性饲养1周后用于实验。动物实验相关操作符合实验动物伦理要求。
1.2 主要试剂和仪器抗生素包括氨苄西林、万古霉素、甲硝唑和新霉素,均购自美国Sigma公司。胎牛血清(FBS)购自以色列BI公司。肠类器官培养所使用基质胶为Biocoat Matrigel (356234),购自美国Corning公司。大鼠抗BrdU抗体和兔抗Chromogranin A抗体购自美国Abcam公司,HRP标记山羊二抗购自碧云天公司,DAB显色试剂盒购自北京中杉公司,阿尔新兰购自美国Sigma公司。使用X-Rad 320辐照仪对实验小鼠进行全身照射,照射剂量为8 Gy。
1.3 抗生素饮水配制及饮用按下列浓度配制抗生素饮水:氨苄西林1 g/L,万古霉素0.35 g/L,甲硝唑1 g/L,新霉素1 g/L,充分溶解混匀。为了减轻小鼠的饮水抗拒,在饮水中加入2%蔗糖改善抗生素饮水口感。实验分2组:Abx组小鼠饮用抗生素饮水,对照组小鼠饮用正常饮水;观测小鼠的平均饮水量,在第21天时将Abx组抗生素饮水更换为正常饮水。
1.4 外周血指标测定于不同时间点经小鼠尾静脉取外周血10 μL,加入140 μL缓冲液,使用Sysmex XT-2000i血液分析仪测定外周血中不同组分的含量。
1.5 肠类器官培养分离小鼠中段小肠并用冷PBS冲洗,纵向剖开肠管后将小肠剪成2~3 mm组织块,加入含青霉素/链霉素和5 mmol/L EDTA的PBS溶液后,冰浴30 min。弃上清并用冷PBS洗涤2次。吹打组织,释放肠隐窝,用70 μm孔径细胞筛过滤悬液,调整隐窝密度后,按每微升Matrigel含10个肠隐窝进行接种,接种后24 h评估肠类器官形成效率。
1.6 组织取材与染色于小鼠取材前90 min腹腔注射BrdU,取材股骨和小肠并用10%中性甲醛固定。标本常规脱水后,制备石蜡切片并进行组织染色。HE和阿尔新兰染色按照试剂盒操作说明进行。免疫组化染色使用pH=6.0枸橼酸盐缓冲液煮沸15 min进行抗原修复。含1% Triton X-100的抗体封闭液室温条件下封闭30 min后,滴加BrdU或Chromogranin A工作液(1 :200),4 ℃冰箱孵育过夜。PBS清洗3次后滴加HRP标记二抗工作液,室温孵育30 min后,洗去未结合二抗,DAB显色并复染胞核,中性树胶封片。
1.7 定量PCR检测取材的各组小肠组织经液氮速冻后保存于-80 ℃冰箱。使用RNAiso(TaKaRa)提取总RNA,经Nano2000测定RNA浓度与纯度。使用TaKaRa公司PrimeScriptTM RT reagent Kit with gDNA Eraser进行反转录,获取cDNA。所用引物由华大生物合成,引物序列见表 1。使用SYBR© Premix Ex TaqTM Ⅱ配制反应液。使用Bio-Rad荧光定量PCR仪进行扩增和检测,反应程序为:95 ℃预变性5 min,95 ℃ 10 s,60 ℃ 10 s,72℃ 10 s,40次循环。β-actin作为内参,使用2-ΔΔCt法进行数据处理。
| 基因名称 | 正义链(5′-3′) | 反义链(5′-3′) | 产物/bp |
| Lgr5 | CCTACTCGAAGACTTACCCAGT | GCATTGGGGTGAATGATAGCA | 165 |
| Olfm4 | CAGCCACTTTCCAATTTCACTG | GCTGGACATACTCCTTCACCTTA | 175 |
| Axin2 | AGTGCAAACTCTCACCCACC | TCGCTGGATAACTCGCTGTC | 196 |
| Mki67 | ATCATTGACCGCTCCTTTAGGT | GCTCGCCTTGATGGTTCCT | 104 |
| IL-1b | ACCTCACAAGCAGAGCACAA | TTGGCCGAGGACTAAGGAGT | 200 |
| Bhlha15 | GCTGACCGCCACCATACTTAC | TGTGTAGAGTAGCGTTGCAGG | 178 |
| Lyz1 | ATGGAATGGCTGGCTACTATGG | ACCAGTATCGGCTATTGATCTGA | 310 |
| β-actin | GGCTGTATTCCCCTCCATCG | CCAGTTGGTAACAATGCCATGT | 154 |
1.8 图像采集及数据分析
使用Olympus BX51显微镜采集病理染色和类器官图像,使用Image J软件进行形态学测定和计数。数据统计使用GraphPad Prism 7.0软件,两组间比较采用t检验。检验水准:α=0.05。
2 结果 2.1 清除肠道菌群对小鼠整体状况的影响单纯在饮水中加入抗生素后饮水口感较差,Abx组小鼠每日饮水量较对照组减少。在抗生素饮水中添加2%蔗糖改善口感后,Abx组与对照组小鼠的日均饮水量为3~4 mL,两组小鼠间日均饮水量无明显差别,可排除饮水量减少对Abx组小鼠的影响。Abx组和对照组小鼠在精神状态、活动力方面无明显差别。排除饮水和进食差异后,发现Abx组小鼠在饮用抗生素后第21天的体质量为(18.17±0.45)g,显著低于对照组[(21.74±0.47)g, P<0.01]。因此,清除肠道菌群可导致小鼠体质量减少。
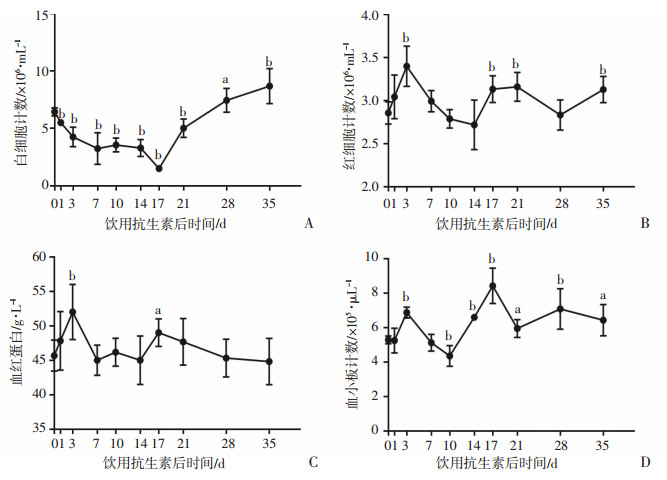
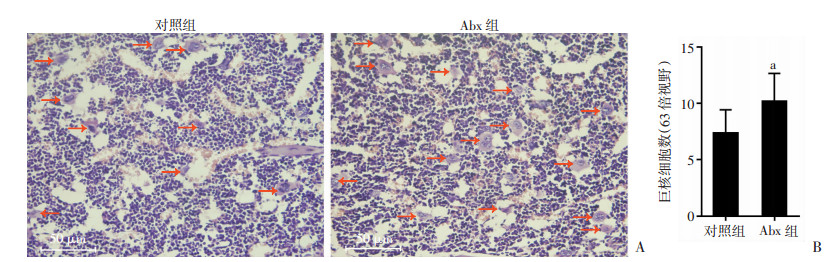
2.2 清除肠道菌群导致小鼠骨髓造血功能改变外周血检测发现,Abx组小鼠白细胞迅速下降,至第17天降至最低点后逐渐恢复,在第21天时仍显著低于正常水平。红细胞、血红蛋白和血小板均经历早期先增加后降低改变,其中红细胞和血红蛋白在第14天降至最低,血小板在第10天降至最低。实验第21天移除抗生素饮水后,外周血白细胞、红细胞、血红蛋白和血小板水平逐渐恢复(图 1)。HE染色显示:第21天时Abx组骨髓内巨核细胞数量较对照组显著增多(P<0.01,图 2)。表明清除肠道菌群可引起小鼠骨髓造血功能改变。
|
|
a: P<0.05,b: P<0.01,与0 d比较 A:白细胞水平;B:红细胞水平;C:血红蛋白含量;D:血小板水平 图 1 饮用抗生素后Abx组小鼠外周血指标动态变化(n=6) |
|
| A:骨髓HE染色红色箭头示巨核细胞;B:2组巨核细胞计数(n=3) a:P<0.01,与对照组比较 图 2 饮用抗生素后21 d Abx组小鼠骨髓HE染色 |
2.3 清除肠道菌群导致小鼠肠干细胞活性降低
抗生素处理21 d后,Abx组小肠长度为(36.80±0.49)cm,显著长于对照组[(33.20±1.02)cm,P<0.05]。Abx组肠隐窝深度较对照组明显减少(P<0.01,图 3A)。Abx组BrdU阳性隐窝细胞数较对照组显著减少(P<0.01,图 3B)。Abx组肠干细胞标志物Lgr5、Olfm4和Axin2的mRNA含量较对照组显著降低(P<0.05),增殖细胞标志物Mki67的mRNA含量也较对照组显著降低(P<0.01)。此外,Abx组潘氏细胞溶菌酶(Lyz1)基因表达较对照组明显降低(P<0.01),同时维持潘氏细胞分泌功能所需的Mist1基因的mRNA含量有所降低,但差异无统计学意义(图 3C)。对照组和Abx组抗生素处理5 d小鼠肠隐窝,结果表明Abx组肠隐窝形成类器官数量显著减少(P<0.05,图 4)。证实清除肠道菌群可降低肠干细胞活性进而导致肠隐窝增殖能力明显降低。

|
|
a: P<0.05,b: P<0.01,与对照组比较 A:HE染色观察肠隐窝深度(n=5);B:免疫组化染色观察小肠BrdU阳性表达(S-P, n=5);C:qPCR检测相关基因的表达(n=3) 图 3 清除肠道菌群对小鼠肠道形态和干细胞的影响 |

|
| A:光镜观察培养24 h两组肠类器官形态;B:两组肠隐窝形成类器官数量(n=5) a:P<0.05,与对照组比较 图 4 抗生素处理后5 d Abx组肠隐窝形成类器官能力显著降低 |
2.4 清除肠道菌群导致放射损伤小鼠存活时间缩短并抑制骨髓造血功能重建
全身8 Gy放射损伤后,Abx组照后存活时间较对照组明显缩短(P<0.01,图 5)。骨髓HE染色发现:8 Gy照射后3 d,Abx组骨髓空虚现象较对照组更加严重,而照射后7 d,对照组骨髓中有核细胞数量有所恢复,但Abx组骨髓中有核细胞仍很少,且可见含有大量红细胞的骨髓内出血灶(图 6A)。Abx组小鼠在照射前和照射后1 d外周血白细胞计数均显著低于对照组(P<0.01),照射后3 d两组小鼠外周血白细胞计数均很低(图 6B)。结果证实清除肠道菌群可导致小鼠放射损伤后存活时间明显缩短,同时骨髓造血损伤加重,骨髓造血重建受抑制。

|
| 图 5 8 Gy全身放射损伤后两组小鼠存活曲线(n=9) |

|
|
A:HE染色观察小鼠骨髓形态;B:照射前后外周血白细胞计数(n=6) a:P<0.01,与对照组比较 图 6 清除肠道菌群加重8 Gy照射后所致骨髓造血损伤 |
2.5 清除肠道菌群延缓放射损伤肠道再生修复过程
HE染色可见:8 Gy照射后3 d,对照组小肠隐窝深度增加明显,Abx组肠隐窝稀疏且明显变浅,Abx组BrdU阳性隐窝增殖细胞数较对照组明显减少(图 7A)。Abx组和对照组小肠长度在受照后1、3 d时差异无统计学意义(图 7B)。8 Gy照射后3 d,Abx组肠隐窝深度显著低于对照组(P<0.01,图 7C);Abx组BrdU阳性隐窝细胞数显著少于对照组(P<0.01,图 7D)。8 Gy照射后3 d,Abx组肠干细胞标志物基因Axin2(图 7E)、增殖细胞标志物Mki67(图 7F)和炎症反应标志物IL-1b基因(图 7G)的mRNA含量均显著低于对照组。证实清除肠道菌群导致肠道再生修复能力明显下降。

|
|
a: P<0.05,b: P<0.01,与对照组比较 A:照射后3 d HE、BrdU免疫组化染色观察小鼠小肠形态变化;B:照射后两组小肠长度比较(n=3);C:照射后3 d两组隐窝深度比较(n=5);D:照射后3 d两组BrdU阳性隐窝细胞数比较(n=5);E:照射后3 d两组Axin2 mRNA相对表达量比较(n=3);F:照射后3 d两组Mki67 mRNA相对表达量比较(n=3);G:照射后3 d两组IL-1b mRNA相对表达量比较(n=3) 图 7 清除肠道菌群导致8 Gy放射损伤后小鼠肠道再生修复能力降低 |
2.6 清除肠道菌群导致肠干细胞向分泌系肠上皮细胞分化能力改变
采用阿尔新兰染色观察8 Gy照射后7 d的对照组和Abx组小肠杯状细胞,结果显示:Abx组阿尔新兰阳性细胞数显著多于对照组(P<0.01,图 8A、B)。使用Chromogranin A免疫组化显示内分泌肠上皮细胞,可见Abx组肠隐窝中内分泌肠上皮细胞数量显著少于对照组(P<0.01,图 8C、D)。证实清除肠道菌群可引起肠道放射损伤重建过程中肠干细胞谱系分化能力发生改变。

|
|
a:P<0.01,与对照组比较 A:阿尔新兰染色观察小肠杯状细胞形态;B:两组肠绒毛中杯状细胞数比较(n=4);C:Chromogranin A免疫组化染色观察内分泌肠上皮细胞形态;D:两组肠隐窝中内分泌肠上皮细胞数比较(n=4) 图 8 8 Gy放射损伤后7 d两组杯状细胞和内分泌肠上皮细胞形态及数量 |
3 讨论
肠道菌群作为人体最大的共生系统,又被称作人体的第二生态系统,越来越多的研究证实肠道菌群及其代谢产物在人体健康维持和疾病发病机理及临床治疗效果中发挥着重要作用[8]。电离辐射暴露能够引起包括骨髓和胃肠道在内的辐射敏感组织发生放射损伤,研究肠道菌群对放射损伤前后骨髓造血功能和肠上皮屏障功能的影响,将有助于进一步阐明放射敏感组织稳态维持和再生修复的调控机制和发掘放射损伤救治的新靶点。
本研究结果表明饮用抗生素清除肠道菌群可致小鼠体质量明显下降,抗生素处理后21 d,小鼠外周血白细胞显著低于正常水平,与临床报道长期服用抗生素可引发骨髓抑制相吻合,但直接将抗生素作用于造血干细胞并不能导致其出现相应改变[9-10]。因此,服用抗生素引起骨髓造血功能改变的根本原因在于清除了肠道菌群并降低血循环中肠道菌群代谢产物的浓度。值得注意的是,清除肠道菌群过程中白细胞、红细胞、血红蛋白和血小板水平并非持续降低或升高,而是具有一定的时相性,提示使用抗生素研究肠道菌群对机体的作用时,需仔细考虑观察时相点对实验结果的影响。目前国内外尚无肠道菌群对巨核细胞和血小板调控的研究报道,本研究证实清除肠道菌群后17~21 d可导致血小板和巨核细胞显著增多,由于巨核细胞可促进造血干细胞再生,提示今后可从肠道菌群代谢产物中筛选促进放射损伤造血重建的新化合物。
肠干细胞微环境由上皮细胞(主要是潘氏细胞)和间质细胞(主要是巨噬细胞)组成。已发现肠道菌群可通过释放DNA和代谢分子影响肠道巨噬细胞活性[10],结肠可通过形成隐窝结构避免肠道菌群产生的丁酸盐对肠干细胞造成的损伤[11],但肠道菌群是否影响潘氏细胞而改变肠干细胞活性,目前尚不清楚。潘氏细胞在肠道免疫和肠干细胞稳态调控中发挥着重要作用。例如肠道菌群及其代谢产物可通过Toll样受体(TLR)和MyD88等分子刺激潘氏细胞分泌溶菌酶,从而调控肠黏膜天然免疫功能[12],潘氏细胞还可分泌Wnt3、EGF、R-Spondin1等生长因子来维持肠干细胞更新和分化[13]。本研究发现清除肠道菌群可引起潘氏细胞Lyz1和Mist1基因表达下调,潘氏细胞分泌功能降低可造成维持肠干细胞所需各类生长因子含量减少,进而引起肠道增殖能力和类器官形成能力下降。本研究证实肠道菌群可通过其代谢产物直接作用于上皮来源肠干细胞微环境,为深入研究肠干细胞微环境调控提供了新线索。
本研究结果显示:清除肠道菌群可导致放射损伤后小鼠存活时间显著缩短,同时骨髓和肠道再生速度显著降低,其可能原因主要包括两点:第一,清除肠道菌群的小鼠在受照前骨髓造血功能和肠干细胞增殖活性已受到抑制;第二,放射损伤后造血和肠道再生过程需要肠道菌群来源的某些刺激分子。本研究结果提示应进一步优化放射损伤患者临床救治过程中的抗生素使用方案,避免长期过量使用抗生素而延缓肠道菌群对造血和肠道再生的促进作用,通过合理补充适当菌株重建肠道微生态可有助于放射损伤后骨髓造血和肠上皮屏障的重建[6]。本研究结果显示:清除肠道菌群可引起放射损伤后杯状细胞和内分泌肠上皮细胞数量发生显著改变,由于Notch信号通路主要调控肠干细胞向分泌系肠上皮细胞分化,所以肠道菌群代谢物可能对Notch通路中的相关分子具有调控作用。此外,内分泌肠上皮细胞可通过去分化机制促进受损肠干细胞的再生[14-15],清除肠道菌群后肠隐窝中内分泌上皮细胞的减少可能是放射损伤后肠道再生受抑制的另一原因。
综上所述,本研究发现肠道菌群可影响小鼠骨髓造血和肠上皮稳态维持及放射损伤后的再生修复。该研究为深入理解骨髓造血调控和肠上皮稳态维持以及再生修复机制提供了新的实验证据,有助于进一步优化放射损伤和盆腹部放疗患者的抗生素使用方案。
| [1] |
FERREIRA M R, ANDREYEV H J N. Editorial: Gut microbiota and chemotherapy- or radiation-induced gastrointestinal mucositis[J]. Aliment Pharmacol Ther, 2014, 40(6): 733-734. DOI:10.1111/apt.12905 |
| [2] |
TROMPETTE A, GOLLWITZER E S, YADAVA K, et al. Gut microbiota metabolism of dietary fiber influences allergic airway disease and hematopoiesis[J]. Nat Med, 2014, 20(2): 159-166. DOI:10.1038/nm.3444 |
| [3] |
MA E L, SMITH A, DESAI N, et al. Bidirectional brain-gut interactions and chronic pathological changes after traumatic brain injury in mice[J]. Brain Behav Immun, 2017, 66: 56-69. DOI:10.1016/j.bbi.2017.06.018 |
| [4] |
KIM M S, KIM Y, CHOI H, et al. Transfer of a healthy microbiota reduces amyloid and tau pathology in an Alzheimer's disease animal model[J]. Gut, 2020, 69(2): 283-294. DOI:10.1136/gutjnl-2018-317431 |
| [5] |
CARR J S, KING S, DEKANEY C M. Depletion of enteric bacteria diminishes leukocyte infiltration following doxorubicin-induced small intestinal damage in mice[J]. PLoS ONE, 2017, 12(3): e0173429. DOI:10.1371/journal.pone.0173429 |
| [6] |
CUI M, XIAO H W, LI Y, et al. Faecal microbiota transplantation protects against radiation-induced toxicity[J]. EMBO Mol Med, 2017, 9(4): 448-461. DOI:10.15252/emmm.201606932 |
| [7] |
徐珍妮, 欧静, 王钰, 等. Lewis肺腺癌对小鼠肠道干细胞及其微环境的影响[J]. 第三军医大学学报, 2020, 42(12): 1155-1162. XU Z N, OU J, WANG Y, et al. Effect of Lewis lung cancer on mouse intestinal stem cells and their microenvironment[J]. J Third Mil Med Univ, 2020, 42(12): 1155-1162. DOI:10.16016/j.1000-5404.202002046 |
| [8] |
ROUTY B, DEROSA L, DUONG C P M, et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors[J]. Science, 2018, 359(6371): 91-97. DOI:10.1126/science.aan3706 |
| [9] |
JOSEFSDOTTIR K S, BALDRIDGE M T, KADMON C S, et al. Antibiotics impair murine hematopoiesis by depleting the intestinal microbiota[J]. Blood, 2017, 129(6): 729-739. DOI:10.1182/blood-2016-03-708594 |
| [10] |
LEE S, KIM H, YOU G, et al. Bone marrow CX3CR1+ mononuclear cells relay a systemic microbiota signal to control hematopoietic progenitors in mice[J]. Blood, 2019, 134(16): 1312-1322. DOI:10.1182/blood.2019000495 |
| [11] |
KAIKO G E, RYU S H, KOUES O I, et al. The colonic crypt protects stem cells from microbiota-derived metabolites[J]. Cell, 2016, 165(7): 1708-1720. DOI:10.1016/j.cell.2016.05.018 |
| [12] |
MENENDEZ A, WILLING B P, MONTERO M, et al. Bacterial stimulation of the TLR-MyD88 pathway modulates the homeostatic expression of ileal Paneth cell α-defensins[J]. J Innate Immun, 2013, 5(1): 39-49. DOI:10.1159/000341630 |
| [13] |
SATO T, VAN ES J H, SNIPPERT H J, et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts[J]. Nature, 2011, 469(7330): 415-418. DOI:10.1038/nature09637 |
| [14] |
AMCHESLAVSKY A, SONG W, LI Q, et al. Enteroendocrine cells support intestinal stem-cell-mediated homeostasis in Drosophila[J]. Cell Rep, 2014, 9(1): 32-39. DOI:10.1016/j.celrep.2014.08.052 |
| [15] |
MURATA K, JADHAV U, MADHA S, et al. Ascl2-dependent cell dedifferentiation drives regeneration of ablated intestinal stem cells[J]. Cell Stem Cell, 2020, 26(3): 377-390. DOI:10.1016/j.stem.2019.12.011 |



