2. 134003 吉林 通化,通化金马药业集团股份有限公司研发部
2. Department of R&D, Tonghua Jinma Pharmaceutical Group Co., Ltd. Tonghua, Jilin Province, 134003, China
便秘主要表现为持续排便困难、排便不尽感或排便次数减少,同时病程较长[1],其发生与患者的饮食结构、运动、年龄因素和药物滥用等有一定的关系[2-3],长期的便秘易引起患者的焦虑、抑郁情绪,并导致肠壁的损伤,进一步诱发肠道疾病,影响患者生活质量[4]。目前临床常用药物如蒽醌类、5-HT受体激动剂等药物具有一定的副作用,长期使用效果不佳[5]。研究显示便秘患者或动物的肠道菌群具有明显的改变,通过使用益生菌制剂,可对便秘产生一定的治疗作用,同时对肠道菌群具有调节作用[6-7]。
复方嗜酸乳杆菌片是一种用于治疗便秘的复合益生菌制剂,由中国株嗜酸乳杆菌、日本株嗜酸乳杆菌、粪链球菌和枯草杆菌4种菌粉组成复方片剂,目前尚缺乏对该复方药物治疗作用的深入实验研究数据。本研究通过给予便秘小鼠复方嗜酸乳杆菌片,同时设置酚酞阳性对照,观察益生菌制剂和传统治疗便秘药物之间的差异,探讨复方嗜酸乳杆菌片对便秘的改善作用及其机制。
1 材料与方法 1.1 实验动物SPF级8~12周龄昆明种小鼠60只,体质量22~25 g,由辽宁长生生物技术股份有限公司提供,许可证号:SCXK(辽)2015-0001。饲养于长春中医药大学SPF级动物房中,自由摄入食物和水。
1.2 药物、试剂及仪器复方地芬诺酯片(产品批号1810020)购自常州康普药业有限公司;复方嗜酸乳杆菌片(产品批号20190512)购自通化金马药业集团股份有限公司;酚酞片(产品批号180610)购自山西亨瑞达制药有限公司;HE染色试剂盒(产品批号:171431)购于北京索宝来科技有限公司;石蜡切片机(LEICA, RM2235);正置荧光显微镜(OLYMPUS, BX53);电热恒温鼓风干燥箱(上海精宏实验设备有限公司,DHG-9240A)。
1.3 方法 1.3.1 实验给药实验中治疗给药组均以临床等效剂量进行给药,复方嗜酸乳杆菌片每日人用剂量3 g,酚酞片每日人用剂量150 mg,根据人鼠药物剂量换算关系表换算,20 g小鼠剂量=人用剂量×0.002 6,再经换算得每只鼠每日给药量为复方嗜酸乳杆菌片0.39 g/kg,酚酞19.5 mg/kg。
1.3.2 小肠运动实验40只昆明种小鼠,分为正常组(Nor)、模型组(Mod)、菌片组(YJK)和阳性组(PT),每组10只,雌雄各半。采用一次性便秘造模的方法进行实验[8],菌片组灌胃复方嗜酸乳杆菌片,阳性组灌胃酚酞片,正常组和模型组灌胃蒸馏水,灌胃14 d,第15天给予地芬诺酯5 mg/kg,给药30 min后,各组小鼠采用0.4 mL/只进行碳墨灌胃,25 min后处死动物,解剖分离肠系膜,剪取上端自幽门、下端至回盲部的肠管,轻拉成直线测量小肠碳墨推进率。
1.3.3 粪便含水量检测20只昆明种雄性小鼠分为正常组(Nor)、模型组(Mod)、菌片组(YJK)、阳性组(PT),每组5只,以复方地芬诺酯10 mg/kg造便秘模型[9],正常组灌胃蒸馏水,模型组灌胃复方地芬诺酯混悬液,菌片组灌胃复方地芬诺酯+复方嗜酸乳杆菌混悬液,阳性组灌胃复方地芬诺酯+酚酞混悬液,连续给药21 d。给药第14~15天,分别收集每只小鼠新鲜粪便,称量粪便质量,放置60 ℃烘箱,4 h后再次称量,测定粪便含水量。粪便含水量(%)=(粪便湿质量-粪便干质量)/粪便湿质量。
1.3.4 肠道病理切片HE染色如1.3.3所述动物给药结束,处死后取结肠部位,于4%多聚甲醛固定,乙醇梯度脱水、二甲苯透明、石蜡包埋、制备5 μm切片、摊片,60 ℃烤片4 h,按照HE染色试剂盒进行染色,于200倍显微镜下观察结肠病理变化。
1.3.5 16S rRNA测序如1.3.3所述动物给药结束,处死后收集结肠粪便,存放于液氮中,样品交由上海美吉生物医药科技有限公司完成基因测序,测得的结果通过美吉生物云平台进行分析。
1.4 统计学分析使用SPSS 21.0统计软件,计量资料用x±s表示,两组间比较采用配对t检验,多组间比较采用协方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 动物行为状态在给药期间,正常组动物被毛光洁,反应机敏,活动自如,粪便光亮,排便正常。模型组动物行动较为迟缓,粪便干燥粗糙,排便困难。
2.2 小肠碳墨推进情况相较于正常组,模型组碳墨推进率明显下降(P < 0.01),表明小鼠肠道蠕动减慢,在复方嗜酸乳杆菌和酚酞片的干预下,碳墨推进率均有明显提高(P < 0.01),表明复方嗜酸乳杆菌具有促进肠道蠕动,提高胃肠动力的效果(表 1)。
| 组别 | 推进长度/cm | 小肠总长/cm | 推进率(%) |
| 正常组 | 33.80±3.06 | 46.05±3.61 | 73.46±4.39 |
| 模型组 | 19.43±1.81 | 46.53±1.63 | 41.89±5.10a |
| 菌片组 | 22.54±1.16 | 46.25±1.19 | 48.74±3.28b |
| 阳性组 | 25.15±3.47 | 45.73±2.66 | 54.99±9.60b |
| a: P < 0.01,与正常组比较;b: P < 0.01,与模型组比较 | |||
2.3 小鼠粪便含水量变化
与模型组相比,正常组小鼠粪便含水量较高(P < 0.01),而菌片组和阳性组粪便含水量均有所提高(P < 0.05,表 2)。
| 组别 | 含水量(%) |
| 正常组 | 52.74±6.28 |
| 模型组 | 35.87±5.44a |
| 菌片组 | 42.83±4.76b |
| 阳性组 | 41.22±5.89b |
| a: P < 0.01,与正常组比较;b: P < 0.05,与模型组比较 | |
2.4 肠道病理切片观察
正常组小鼠结肠杯状细胞完整,而模型组结肠杯状细胞大量破裂,肠道损伤严重,菌片组和阳性组与模型组相比有所改善,结肠杯状细胞损伤较小(图 1箭头示)。
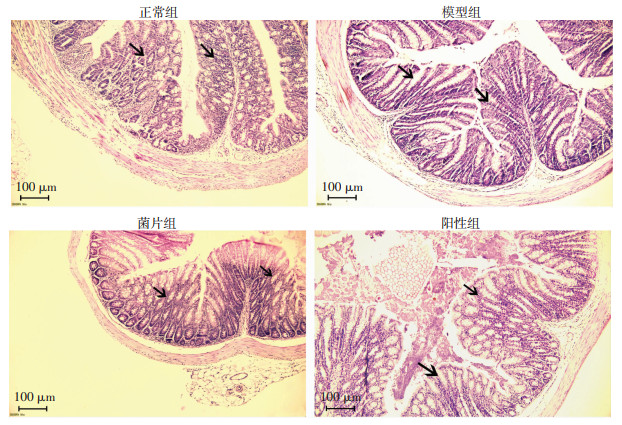
|
| 箭头示结肠杯状细胞损伤情况 图 1 各组小鼠肠道病理切片观察 (HE) |
2.5 肠道菌群16S rRNA检测 2.5.1 样本稀释曲线及Venn图
在可操作分类单元(operational taxonomic units,OTU)水平中,样本稀释曲线都趋于平缓且分布较为集中,说明测序数据量足够大,可以反映样本中绝大多数的微生物信息(图 2),Venn图(图 3)显示:各组间肠道菌群的组成具有一定的差异。
|
| 图 2 各组样本稀释曲线 |
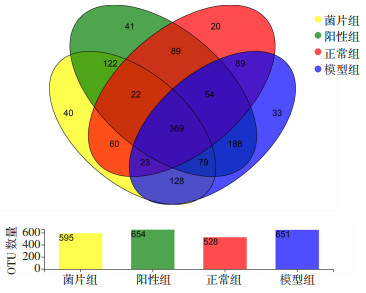
|
| 图 3 各组OTU数量Venn图 |
2.5.2 肠道菌群多样性分析
对菌群进行α多样性分析,Shannon指数表示物种丰富度和物种的均匀度,是对群落结构的更综合性的反应,Shannon值越大,群落的多样性越高。相对于正常组,模型组的菌群多样性有显著性升高(P < 0.01),阳性组同样升高(P < 0.01),而给予复方嗜酸乳杆菌的菌片组,相对于模型组和阳性组,菌群多样性有所下降(P < 0.01),恢复至正常组水平(图 4A)。
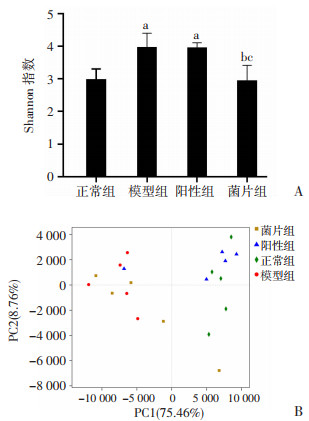
|
| A:α多样性分析 a: P < 0.01,与正常组比较;b: P < 0.01,与模型组比较;c: P < 0.01,与阳性组比较;B: β多样性的PCA分析 图 4 各组小鼠肠道菌群多样性分析 |
基于β多样性的PCA分析,不同颜色或形状的点代表不同分组的样本,通过点之间的距离体现不同样本间的差异程度。可见正常组与模型组具有较大差异,菌片组更接近正常组的肠道菌群组成,而酚酞组与正常组差异较大,与便秘模型组较为接近(图 4B)。
2.5.3 肠道菌群门水平变化在门水平进行分析,共得到9个门,其中拟杆菌门和厚壁菌门占据主导地位,结果显示:便秘对这两个菌门会造成较大的影响,模型组厚壁菌门较正常组相对丰度显著下降(P < 0.05),拟杆菌门相对丰度增加(P < 0.05),阳性组的肠道菌群组成与模型组类似,而使用复方嗜酸乳杆菌的菌片组对菌群具有调节作用,使菌群组成在门水平上与正常组相似(P < 0.01;图 5,表 3)。
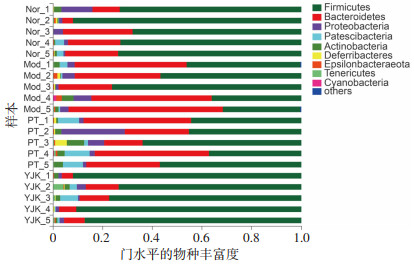
|
| 图 5 各组小鼠肠道菌群的门水平变化 |
| 组别 | 拟杆菌门 | 厚壁菌门 |
| 正常组 | 17.16±9.43 | 75.85±9.26 |
| 模型组 | 42.39±15.26a | 49.12±17.99a |
| 菌片组 | 8.96±3.63b | 84.06±8.28b |
| 阳性组 | 32.16±12.61 | 49.39±10.68 |
| a: P < 0.05,与正常组比较;b: P < 0.01,与模型组比较 | ||
2.5.4 肠道菌群属水平变化
属水平上分析,相对于正常组,模型组Lactobacillus、Ruminococcaceae、Candidatus相对丰度下降(P < 0.05,P < 0.01),Muribaculaceae、Parabacteroides、Intestinimonas、Tyzzerella相对丰度上升(P < 0.05,P < 0.01),在给予复方嗜酸乳杆菌干预后,以上几种菌属向正常组有着不同程度的回调(P < 0.05,P < 0.01;图 6,表 4)。
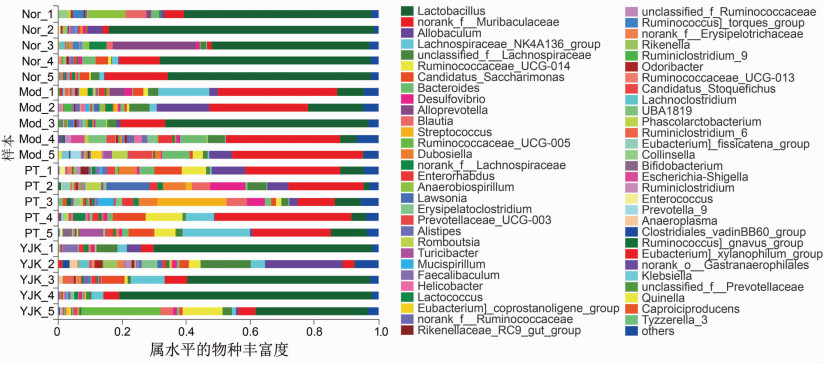
|
| 图 6 肠道菌群的属水平变化 |
| 组别 | Lactobacillus | Muribaculaceae | Ruminococcaceae | Parabacteroides | Intestinimonas | Candidatus | Tyzzerella |
| 正常组 | 64.00±12.27 | 8.33±7.78 | 1.31±0.11 | 0.10±0.12 | 0.01±0.01 | 0.045 4±0.038 1 | 0.002 6±0.002 0 |
| 模型组 | 18.89±25.71a | 31.75±10.53a | 0.48±0.13a | 0.34±0.17c | 0.13±0.09c | 0.004 3±0.004 3c | 0.012 9±0.005 2a |
| 菌片组 | 48.03±21.14b | 5.01±1.33d | 1.11±0.10d | 0.15±0.15 | 0.02±0.01b | 0.119 2±0.015 4b | 0.006 8±0.008 4 |
| 阳性组 | 6.61±3.66 | 26.37±11.34b | 0.75±0.22b | 0.12±0.09 | 0.04±0.05 | 0.094 3±0.128 6 | 0.006 0±0.007 2 |
| a: P < 0.01,c: P < 0.05,与正常组比较;b: P < 0.05,d: P < 0.01,与模型组比较 | |||||||
3 讨论
便秘在临床发病率高,治疗该疾病的药物种类也较为繁多。随着对肠道菌群在人类疾病中重要性认识的不断深入,越来越多的研究者开始尝试采用益生菌治疗肠道疾病[10]。目前临床上已有较多案例使用益生菌制剂治疗便秘,取得了较好的疗效。有研究对患者肠道菌群进行前后自身对照研究,发现其肠道菌群紊乱改善,菌群结构组成向健康人群靠拢[11-12]。复方嗜酸乳杆菌片的临床治疗结果显示:患者的排便情况有明显的好转,治疗有效率较高[13]。本课题组前期在对便秘小鼠进行粪便菌群选择性培养中发现,不同组动物之间菌群含量具有差异,复方嗜酸乳杆菌片可提高肠道菌群中益生菌的含量[14]。本研究对小鼠使用复方地芬诺酯进行便秘造模,给予复方嗜酸乳杆菌片治疗,实验结果显示:复方嗜酸乳杆菌片对便秘具有较好的治疗效果,可以提高小肠的运动能力,使小肠推进率显著加快,增加粪便含水量,减轻了结肠组织中的病理损伤。
本研究通过16S rRNA对小鼠结肠粪便进行高通量测序,发现便秘模型与正常动物肠道菌群结构具有明显的差异,便秘动物的微生物丰富度和多样性较正常组显著上升,在门水平上,便秘模型组厚壁菌门较正常组相对丰度显著下降,拟杆菌门相对丰度增加,这与临床便秘患者肠道菌群研究结果相一致[15-16];通过益生菌的治疗,便秘小鼠肠道菌群结构在门水平上恢复到与对照组相似的水平。肠道菌群和代谢产物的变化可能是便秘病理生理改变的重要原因,研究显示产丙酸菌主要为拟杆菌门细菌,丁酸水平与厚壁菌门的相对丰度呈正相关,而粪便中的丁酸与缓解便秘症状有一定的关系[17]。在属水平上,相对于正常组,便秘模型组有7个属发生了显著性变化,其中Lactobacillus(乳杆菌属)、Muribaculaceae和Ruminococcaceae(瘤胃菌属)占比较大,模型组中Lactobacillus(乳杆菌属)含量显著性降低,这与其他研究者得到的结果相一致[18-19]。在动物肠道内,该类菌属可利用糖类物质,生成酸性代谢物,降低肠道pH,改善肠道微生物环境,调节宿主免疫系统[20-21]。在便秘模型中,Muribaculaceae含量显著性升高,该菌属为新确立的菌属名,曾被称为S24-7家族,在小鼠肠道中含量较高,属于拟杆菌门,Muribaculaceae的变化主要与各种饮食治疗、宿主条件或啮齿动物定殖过程有关[22-24],但该菌属的具体功能目前缺乏深入的研究。Ruminococcaceae主要发酵代谢产物为乙酸和甲酸,该菌属的丰度已被证明与肠道的运动能力呈正相关,在便秘人群中其丰度受到抑制[25-26]。
本研究给予便秘小鼠复方嗜酸乳杆菌片进行治疗,相较于模型组,菌片组的菌群丰度与正常组具有更高的相似性,提示复方嗜酸乳杆菌片具有改善肠道菌群结构的作用。嗜酸乳杆菌属于乳杆菌属,是动物肠道菌群中的重要微生物,对肠道中的微生态平衡具有调节作用[27]。粪链球菌与枯草杆菌可促进肠道微生物的纤维素代谢、碳水化合物代谢以及氨基酸代谢,对动物肠道发育以及物质的消化吸收具有调节作用[28]。这几种益生菌均可产生短链脂肪酸,参与机体氧化功能、调节肠道平衡并改善肠道功能[29]。
本研究同时设立酚酞片作为阳性对照组,结果显示:酚酞片对于便秘模型小鼠的排便具有良好的促进作用,但对肠道菌群的结构影响不大,便秘患者若长期服用刺激性泻药,部分患者可能会出现药物依赖、电解质紊乱等药物副作用。因此,在临床治疗便秘中,可以根据患者自身情况,选用益生菌制剂,通过调节肠道菌群的微生态平衡,或结合适当的化学药物进行治疗,改善患者临床症状。
利益冲突 声明在课题研究和文章撰写过程,没有因其岗位角色影响文章观点和对数据结果的报道,不存在利益冲突
| [1] |
林柳兵, 沈艳婷, 阙任烨, 等. 功能性便秘与肠道微生态的中西医研究进展[J]. 辽宁中医杂志, 2017, 44(4): 884-887. LIN L B, SHEN Y T, QUE R Y, et al. Research progress of functional constipation and intestinal micro ecology in traditional Chinese medicine and western medicine[J]. Liaoning J Tradit Chin Med, 2017, 44(4): 884-887. DOI:10.13192/j.issn.1000-1719.2017.04.071 |
| [2] |
FOROOTAN M, BAGHERI N, DARVISHI M. Chronic constipation: a review ofliterature[J]. Medicine, 2018, 97(20): e10631. DOI:10.1097/MD.0000000000010631 |
| [3] |
王冬冬, 吴相柏. 功能性便秘的诊治进展[J]. 中国全科医学, 2019, 22(24): 3016-3022. WANG D D, WU X B. Advances in the diagnosis and treatment of functional constipation[J]. Chin Gen Pract, 2019, 22(24): 3016-3022. DOI:10.12114/j.issn.1007-9572.2019.00.062 |
| [4] |
沈旭丹, 吉梦馨, 翟齐啸, 等. 具有肠道动力及肠道菌群调节功能乳杆菌的筛选及功能评价[J]. 食品科学, 2019, 40(15): 154-161. SHEN X D, JI M X, ZHAI Q X, et al. Screening and functionality evaluation of Lactobacillus able to regulate intestinal motility and flora[J]. Food Sci, 2019, 40(15): 154161. DOI:10.7506/spkx1002-6630-20180817-175 |
| [5] |
黄林生, 高仁元, 严雪冰, 等. 慢性功能性便秘患者的肠道菌群分析[J]. 中华结直肠疾病电子杂志, 2017, 6(2): 121-126. HUANG L S, GAO R Y, YAN X B, et al. Structure analysis of the gutmicrobiota in chronic functional constipation patients[J]. Chin J Color Dis, 2017, 6(2): 121-126. DOI:10.3877/cma.j.issn.2095-3224.2017.02.008 |
| [6] |
TOUW K, RINGUS D L, HUBERT N, et al. Mutual reinforcement of pathophysiological host-microbe interactions in intestinal stasismodels[J]. Physiol Rep, 2017, 5(6): e13182. DOI:10.14814/phy2.13182 |
| [7] |
OJETTI V, IANIRO G, TORTORA A, et al. The effect of Lactobacillus reuteri supplementation in adults with chronic functional constipation: a randomized, double-blind, placebo-controlled trial[J]. J Gastrointest Liver Dis, 2014, 23(4): 387-391. DOI:10.15403/jgld.2014.1121.234.elr |
| [8] |
郑立新, 蔡祥焜, 乔秋爽, 等. 复方地芬诺酯致小鼠便秘模型剂量的优化[J]. 广州中医药大学学报, 2018, 35(4): 717-720. ZHENG L X, CAI X K, QIAO Q S, et al. Optimization of dosage of compounddiphenoxylate for establishing mouse constipation model[J]. J Guangzhou Univ Tradit Chin Med, 2018, 35(4): 717-720. DOI:10.13359/j.cnki.gzxbtcm.2018.04.030 |
| [9] |
贾红慧, 袁洁, 李强华, 等. 实验条件对复方地芬诺酯小鼠便秘模型的影响[J]. 中药药理与临床, 2008, 24(4): 70-72. JIA H H, YUAN J, LI Q H, et al. Effects of experimental conditions on the compound constipation model of diphenoxylate in mice[J]. Pharmacol Clin Chin Mater Med, 2008, 24(4): 70-72. DOI:10.3969/j.issn.1001-859X.2008.04.033 |
| [10] |
李中信, 赵召龙, 成士超. 2018版ESPCG《益生菌在下消化道症状管理中的应用国际共识》更新解读[J]. 中国全科医学, 2018, 21(24): 2899-2903. LIZ X, ZHAO Z L, CHENG S C. Interpretation of the Probiotics in the Management of Lower Gastrointestinal Symptoms in Clinical Practice: an evidence-based International Guide Updated in 2018[J]. Chin Gen Pract, 2018, 21(24): 2899-2903. DOI:10.12114/j.issn.1007-9572.2018.00.170 |
| [11] |
TABBERS M M, DE MILLIANO I, ROSEBOOM M G, et al. Is Bifidobacterium breve effective in the treatment of childhood constipation? Results from a pilot study[J]. Nutr J, 2011, 10(1): 1-5. DOI:10.1186/1475-2891-10-19 |
| [12] |
潘登登, 沈通一, 秦环龙. 益生菌制剂治疗慢性便秘的临床方案及策略[J]. 上海预防医学, 2019, 31(10): 794-798. PAN D D, SHEN T Y, QIN H L. Probiotic preparation in treatment of chronic constipation: its clinic regimen andstrategy[J]. Shanghai J Prev Med, 2019, 31(10): 794-798. DOI:10.19428/j.cnki.sjpm.2019.19524 |
| [13] |
王育光, 李刚, 马燕. 复方嗜酸乳杆菌对功能性便秘的改善效果观察[J]. 中国实用医药, 2016, 11(25): 219-220. WANG Y G, LI G, MA Y. Observation on the improvement effect of compound Lactobacillus acidophilus on functional constipation[J]. China Pract Med, 2016, 11(25): 219-220. DOI:10.14163/j.cnki.11-5547/r.2016.25.148 |
| [14] |
周凯旋, 李丽静, 孙桂媛, 等. 复方嗜酸乳杆菌片对便秘的研究[J]. 人参研究, 2019, 31(4): 24-26. ZHOU K X, LI L J, SUN G Y, et al. Study on constipation by compound Lactobacillus acidophilus tablets[J]. J Ginseng Res, 2019, 31(4): 24-26. DOI:10.19403/j.cnki.1671-1521.2019.04.007 |
| [15] |
JALANKA J, MAJOR G, MURRAY K, et al. The effect ofPsyllium husk on intestinal microbiota in constipated patients and healthy controls[J]. Int J Mol Sci, 2019, 20(2): 433. DOI:10.3390/ijms20020433 |
| [16] |
ZHU L X, LIU W S, ALKHOURI R, et al. Structural changes in the gutmicrobiome of constipated patients[J]. Physiol Genom, 2014, 46(18): 679-686. DOI:10.1152/physiolgenomics.00082.2014 |
| [17] |
WANG L L, CHEN C L, CUI S M, et al. Adhesive Bifidobacterium induced changes in cecal microbiome alleviated constipation in mice[J]. Front Microbiol, 2019, 10: 1721. DOI:10.3389/fmicb.2019.01721 |
| [18] |
李根林, 张颜语, 李寒冰. 复方地芬诺酯建立大鼠便秘模型及对肠道菌群的影响[J]. 中国组织工程研究, 2016, 20(49): 7404-7410. LI G L, ZHANG Y Y, LI H B. Effect of constipation induced by diphenoxylate on intestinal flora in a rat[J]. J Clin Rehabilit Tissue Eng Res, 2016, 20(49): 7404-7410. DOI:10.3969/j.issn.2095-4344.2016.49.016 |
| [19] |
黄毅溦, 金鑫, 娜迪拉·巴吾尔江, 等. 三联益生菌对便秘小鼠肠道推进功能改善及其对小鼠肠道菌群调节作用的研究[J]. 中国微生态学杂志, 2018, 30(4): 402-408. HUANG Y W, JIN X, BAURJAN N, et al. The promoting and regulating effects of triple probiotics on the intestine and intestinal peristalsis in mice with constipation[J]. Chin J Microecol, 2018, 30(4): 402-408. DOI:10.13381/j.cnki.cjm.201804008 |
| [20] |
TANKOU S K, REGEV K, HEALY B C, et al. A probiotic modulates themicrobiome and immunity in multiple sclerosis[J]. Ann Neurol, 2018, 83(6): 1147-1161. DOI:10.1002/ana.25244 |
| [21] |
费苏, 夏永军, 艾连中, 等. 乳酸菌在肠道内黏附定殖的研究进展[J]. 工业微生物, 2020, 50(2): 58-62. FEI S, XIA Y J, AI L Z, et al. Research progress of lactic acid bacteria colonization in intestine[J]. Ind Microbiol, 2020, 50(2): 58-62. DOI:10.3969/j.issn.1001-6678.2020.02.010 |
| [22] |
LAGKOUVARDOS I, LESKER T R, HITCH T C A, et al. Sequence and cultivation study of Muribaculaceae reveals novel species, host preference, and functional potential of this yet undescribed family[J]. Microbiome, 2019, 7(1): 1-15. DOI:10.1186/s40168-019-0637-2 |
| [23] |
TROPINI C, MOSS E L, MERRILL B D, et al. Transient osmotic perturbation causes long-term alteration to the gutmicrobiota[J]. Cell, 2018, 173(7): 1742-1754. DOI:10.1016/j.cell.2018.05.008 |
| [24] |
SHEN T C D, CHEHOUD C, NI J, et al. Dietary regulation of the gutmicrobiota engineered by a minimal defined bacterial consortium[J]. PLoS ONE, 2016, 11(5): e0155620. DOI:10.1371/journal.pone.0155620 |
| [25] |
MARTONI C J, EVANS M, CHOW C E T, et al. Impact of a probiotic product on bowel habits and microbial profile in participants with functional constipation: a randomized controlledtrial[J]. J Dig Dis, 2019, 20(9): 435-446. DOI:10.1111/1751-2980.12797 |
| [26] |
ZHUANG M, SHANG W T, MA Q C, et al. Abundance of probiotics and butyrate-production microbiome manages constipation via short-chain fatty acids production and hormones secretion[J]. Mol Nutr Food Res, 2019, 63(23): e1801187. DOI:10.1002/mnfr.201801187 |
| [27] |
余奕宏, 丁小娟, 丁筑红, 等. 嗜酸乳杆菌GIM1.208产β-葡萄糖苷酶培养基及发酵条件优化[J]. 中国酿造, 2020, 39(3): 88-93. YU Y H, DING X J, DING Z H, et al. Optimization of medium and fermentation conditions for β-glucosidase production by Lactobacillus acidophilus GIM1.208[J]. China Brew, 2020, 39(3): 88-93. DOI:10.11882/j.issn.0254-5071.2020.03.018 |
| [28] |
王汉星, 虎千力, 杨建涛, 等. 饲粮中添加粪链球菌与枯草芽孢杆菌对断奶仔猪生长性能和肠道健康的影响[J]. 动物营养学报, 2020, 32(5): 2074-2086. WANG H X, HU Q L T, YANG J T, et al. Effects of dietary Streptococcus faecalis and Bacillus subtilis on growth performance and intestinal health of weaned piglets[J]. Chin J Animal Nutr, 2020, 32(5): 2074-2086. DOI:10.3969/j.issn.1006-267x.2020.05.016 |
| [29] |
KONG X F, JI Y J, LI H W, et al. Colonic luminalmicrobiota and bacterial metabolite composition in pregnant Huanjiang mini-pigs: effects of food composition at different times of pregnancy[J]. Sci Rep, 2016, 6(1): 37224. DOI:10.1038/srep37224 |



