骨髓增生异常综合征(myelodysplastic syndrome,MDS)是一组起源于造血干细胞的髓系克隆性疾病,具有较大的异质性,其临床表现及疾病预后存在明显差异。BCL2L10(B-cell lymphoma 2 like 10)基因属于Bcl-2家族成员,通过与Apaf-1结合阻断其与Bcl-XL形成复合物,从而引起细胞凋亡[1-2]。但也有研究认为BCL2L10为抗凋亡蛋白, 可以阻断由减少IL-3或Bax诱导的细胞凋亡。研究发现,BCL2L10表达受甲基化调控,其异常表达与血液系统恶性肿瘤、肝癌、胃癌、乳腺癌等多种肿瘤的发生、转移、耐药及预后密切相关[7]研究发现,在MDS和急性非淋巴细胞白血病中,BCL2L10表达升高与去甲基化药物抵抗相关。BCL2L10基因过表达可抑制急性髓系白血病细胞株HL-60增殖并促进细胞凋亡[8]。BCL2L10表达水平与MDS患者预后分层是否具有相关性尚不明确。本研究旨在探讨不同危险度分层的MDS患者骨髓细胞中BCL2L10表达水平及其启动子甲基化状态与疾病预后的关系。
1 资料与方法 1.1 研究对象收集2011年2月至2017年10月空军军医大学唐都医院收治的原发未治MDS患者56例(MDS组),均符合维也纳诊断标准[9-10],其中男性31例,女性25例,年龄20~89岁,中位年龄69岁,检测标本为科室液氮冻存的骨髓标本。患者进行MICM分类诊断,并按照2016年WHO修订的分型标准进行分型。另收集同期非白血病标本30例(非白血病对照组),其中初诊未治缺铁性贫血18例(男性6例,女性12例,中位年龄54岁),营养性贫血12例(男性7例,女性5例,中位年龄66岁),检测标本为新鲜采集的骨髓标本。入组患者均按照MDS修正的国际预后积分系统(IPSS-R评分系统)[11-12]对56例MDS患者进行评分,IPSS-R评分≤4.5定义为低/中危MDS组(low/median risk MDS,L/MR MDS),IPSS-R评分>4.5定义为高危MDS组(high risk MDS,HR MDS)。
1.2 骨髓标本中BCL2L10表达量检测RNA提取采用Qiagen总RNA提取试剂盒说明进行。应用TaKaRa逆转录试剂盒说明扩增cDNA,取1 μL cDNA作为模板,于ABI 7500荧光定量PCR仪上采用SYBR Green(TaKaRa公司)法检测BCL2L10表达量,以β-actin作为内参。记录各个反应管Ct值,使用2-△△Ct对结果进行相对定量分析。
1.3 甲基化特异性PCR(methylation specific PCR,MSP)检测基因组DNA提取参照Qiagen公司DNA提取试剂说明书进行。利用UCSC基因组浏览器(http://genome.ucsc.edu/)查询并分析BCL2L10基因序列,参考文献[13],分别设计并合成BCL2L10基因启动子区CpG岛甲基化和非甲基化引物(表 1)。
| 基因 | 基因组位置 | 引物序列(5′→3′) | 产物长度/bp |
| BCL2L10-M(正向) | -70 | AATATATCGGGGGTCGGGGGTC | 180 |
| BCL2L10-M(反向) | +110 | AACTCGATACGCTCCCGCAACG | |
| BCL2L10-U(正向) | -70 | AATATATTGGGGGTTGGGGGTT | 186 |
| BCL2L10-U(反向) | +116 | AACAACAACTCAATACACTCCCA |
基因组DNA亚硫酸氢化处理:采用CpGenomeTM DNA 修饰试剂盒(Chemicon International Inc.),获得修饰后的DNA片段进一步采用Promega公司DNA纯化试剂盒纯化。BCL2L10基因启动子区甲基化PCR:反应在9700 PCR仪(Applied Biosystems)上进行,总反应体系25 μL,1.5 mmol/L MgCl2,0.1 mmol/L dNTP,0.4 μmol/L上下游引物,GoldTM DNA Polymerase(Thermo Fisher)1 U,模板DNA 2 μL。反应条件:95 ℃变性5 min,95 ℃ 30 s,62 ℃(甲基化)/59 ℃(非甲基化)30 s,72 ℃ 60 s,循环40次,72 ℃延伸8 min。PCR产物经3%琼脂糖凝胶电泳,EB染色,紫外灯下观察条带位置并照相。
1.4 统计学分析采用SPSS19.0统计软件,BCL2L10基因表达水平差异比较采用z检验和t检验,两组间阳性率的比较采用χ2检验,P<0.05为差异有统计学意义
2 结果 2.1 两组患者骨髓组织中BCL2L10基因表达差异采用real-time PCR方法对比分析了非白血病对照组患者与MDS患者骨髓组织中BCL2L10基因表达水平,发现与30例非白血病对照组患者相比,MDS患者BCL2L10基因表达水平降低(P<0.05,图 1)。
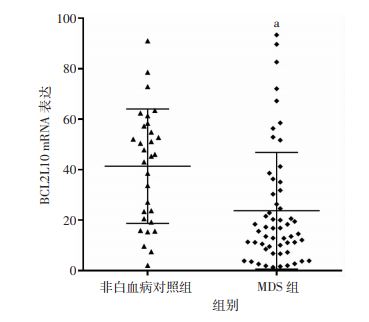
|
| a: P<0.05,与非白血病对照组比较 图 1 非白血病对照组与MDS患者骨髓组织中BCL2L10基因表达水平 |
2.2 BCL2L10基因表达水平与MDS患者危险度的关系
56例MDS患者按照MDS修正的国际预后积分系统(IPSS-R评分系统)分为低/中危MDS组(IPSS-R评分≤4.5)33例,高危MDS组(IPSS-R评分>4.5)23例。与非白血病对照组相比,低/中危MDS组患者骨髓标本BCL2L10基因表达水平无明显差异(P>0.05),而高危MDS组患者骨髓标本中BCL2L10基因表达显著低于非白血病对照组和低/中危组MDS患者(P<0.05,图 2)。
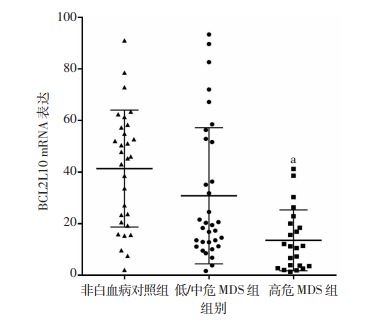
|
| a: P<0.05,与非白血病对照组和低/中危MDS组比较 图 2 不同危险度分层MDS患者骨髓组织中BCL2L10基因表达 |
2.3 用甲基化特异性PCR检测MDS患者BCL2L10 基因启动子区甲基化状态
30例非白血病对照组患者骨髓标本中,11例(36.67%)检测到BCL2L10基因启动子区甲基化(图 3A);56例MDS患者骨髓标本中,23例(41.07%)检测到BCL2L10基因启动子区甲基化,33例低/中危MDS组有10例(30.30%)检测到BCL2L10基因启动子区甲基化(图 3B);而23例高危MDS组有13例(56.52%)检测到BCL2L10基因启动子区甲基化(图 3C)。高危MDS组患者BCL2L10基因启动子区甲基化阳性率显著高于非白血病对照组和低/中危MDS组(P<0.05)。
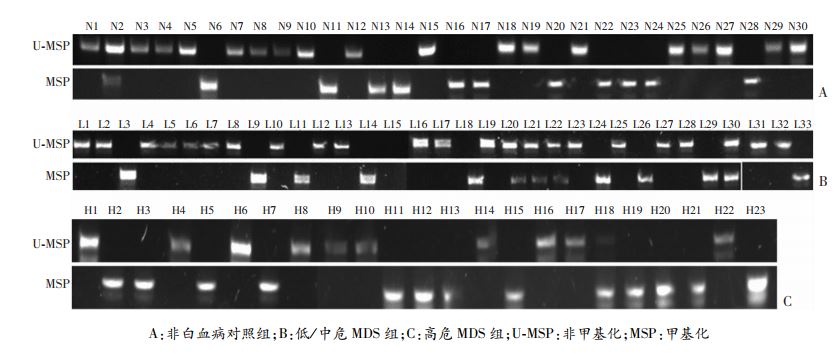
|
| a: A:非白血病对照组;B:低/中危MDS组;C:高危MDS组;U-MSP:非甲基化;MSP:甲基化 图 3 非白血病对照组患者与MDS患者BCL2L10基因启动子区甲基化状态检测 |
2.4 BCL2L10基因启动子区甲基化状态与MDS患者临床特征之间的关系
如表 2所示,BCL2L10基因启动子区甲基化状态与MDS患者的年龄、性别均无统计学差异(P>0.05),与MDS患者骨髓原始细胞比例具有明显的相关性(P<0.05),24例原始细胞比例≤5%的MDS标本中,5例检测到BCL2L10基因启动子区甲基化(阳性率20.83%),在32例原始细胞比例>5%的MDS标本中,18例检测到BCL2L10基因启动子区甲基化(阳性率56.25%),提示BCL2L10基因启动子区甲基化状态与骨髓组织中原始细胞比例密切相关(P<0.05,表 2)。BCL2L10基因启动子区甲基化状态与MDS患者的危险度分层密切相关,高危组MDS患者BCL2L10基因启动子区甲基化阳性率显著高于低/中危组MDS患者(χ2=3.85,P<0.05)及非白血病对照组患者(χ2=4.91,P<0.05),而低/中危组MDS患者骨髓中BCL2L10基因启动子区甲基化阳性率与非白血病对照>0.05)。
| 临床特征 | 例数 | BCL2L10基因启动子甲基化+ | BCL2L10基因启动子甲基化- | χ2值 | P值 |
| 年龄/岁 | |||||
| <60 | 19 | 7 | 12 | 0.21 | >0.05 |
| ≥60 | 37 | 16 | 21 | ||
| 性别 | |||||
| 男 | 31 | 11 | 20 | 0.90 | >0.05 |
| 女 | 25 | 12 | 13 | ||
| 原始细胞比例 | |||||
| ≤5% | 24 | 5 | 19 | 7.11 | <0.05 |
| >5% | 32 | 18 | 14 | ||
| 危险度分层 | |||||
| 低/中危MDS组 | 33 | 10 | 23 | 3.85 | <0.05 |
| 高危MDS组 | 23 | 13 | 10 |
2.5 BCL2L10基因表达水平与生存期的关系
56例MDS患者中,24例未给予去甲基化药物治疗。将24例患者BCL2L10表达量的中位值作为阈值分为高表达组和低表达组,对两组患者3年总生存率(overall survival,OS)进行统计分析发现,BCL2L10高表达组3年生存率为83.3%,低表达组仅为50.0%,两组比较差异无统计学意义(P=0.072,图 4A)。同时采用GEPIA数据库对BCL2L10在急性髓系白血病中进行预后比较,同样发现低表达组的预后较高表达组差,但差异无统计学意义(P=0.084,图 4B)。
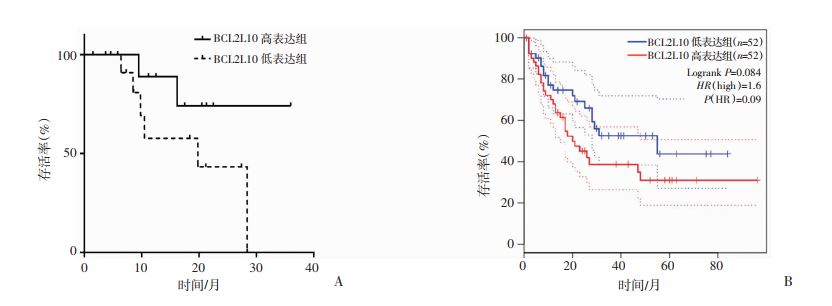
|
| A:MDS患者3年生存曲线;B:GEPIA数据库中BCL2L10基因表达水平对患者生存的影响 图 4 BCL2L10基因表达水平与MDS患者总生存率的关系 |
3 讨论
BCL2L10,也称为Diva、Bcl-b或Boo,是Bcl-2蛋白质家族的成员,广泛参与调节细胞凋亡和自噬的信号通路[1-14],但BCL2L10基因在恶性肿瘤中的功能尚不完全一致,NAUMANN等[15]发现,BCL2L10与Bcl-2家族蛋白功能类似,通过与APAF-1结合,抑制人神经胶质瘤细胞凋亡。与之相反,在胃癌、AML中,BCL2L10基因作为促凋亡基因,抑制肿瘤的进展[16]。本研究检测56例MDS患者及30例非白血病对照组患者骨髓细胞中BCL2L10基因表达及其启动子甲基化情况。发现MDS患者BCL2L10基因表达水平较非白血病对照组患者降低,在41.0%的MDS患者骨髓细胞中检测到BCL2L10启动子甲基化,并与其低表达相关,表明启动子甲基化导致的BCL2L10沉默可能参与了MDS发生发展的关键步骤。
VOSO等[17]研究发现,BCL2L10基因启动子高甲基化的MDS患者其IPSS评分多为高危组,且表现为预后差、易转向AML转化、总生存期短等特征。因此,本研究按照IPSS-R评分系统将56例MDS患者进行分组,并分别对比分析了不同危险度分层的MDS患者BCL2L10基因表达差异及其启动子甲基化状态,发现高危组MDS患者骨髓标本中BCL2L10基因表达水平显著低于非白血病对照组患者和低/中危组MDS患者,而高危组MDS患者BCL2L10基因启动子甲基化阳性率较非白血病对照组和低/中危组明显升高,提示该基因表达水平及其启动子甲基化状态可作为MDS诊断的分子标记、预后判断及治疗靶点。
2018年美国NCCN关于MDS诊疗指南中,明确将地西他滨、阿扎胞苷等去甲基化药物作为高危组MDS患者治疗的首选药物[18]。MIKATA等[16]研究发现,使用1 μmol/L地西他滨处理胃癌细胞24 h,可引起BCL2L10 基因启动子区CpG岛发生去甲基化,BCL2L10蛋白表达升高,从而引起胃癌细胞发生凋亡,因此BCL2L10 基因是地西他滨作用靶标之一。地西他滨能够逆转对阿霉素耐药的HL-60/ADR的耐药性,并提高Kasumi-1对化疗药物的敏感性,并且对于复发/难治的急性非淋巴细胞白血病患者,将地西他滨作为化疗前预处理药物,可以增强患者对化疗药物的敏感性,提高总生存,改善患者预后[19]。本研究也证实采用地西他滨治疗的MDS患者中,BCL2L10高表达组患者3年OS高于BCL2L10高表达组患者,尽管没有统计学意义,可能与纳入的患者数较少有关。BCL2L10 基因作为地西他滨作用的重要靶基因之一,其甲基化水平决定了去甲基化药物的治疗效果和临床反应,本研究为MDS临床治疗提供了重要的理论依据。
| [1] |
LINDSTEN T, ROSS A J, KING A, et al. The combined functions of proapoptotic Bcl-2 family members bak and bax are essential for normal development of multiple tissues[J]. Mol Cell, 2000, 6(6): 1389-1399. DOI:10.1016/s1097-2765(00)00136-2 |
| [2] |
LEE S Y, KWON J, WOO J H, et al. Bcl2l10 mediates the proliferation, invasion and migration of ovarian cancer cells[J]. Int J Oncol, 2020, 56(2): 618-629. DOI:10.3892/ijo.2019.4949 |
| [3] |
WU H L, JEFFREY MEDEIROS L, YOUNG K H. Apoptosis signaling and BCL-2 pathways provide opportunities for novel targeted therapeutic strategies in hematologic malignances[J]. Blood Rev, 2017, 32(1): 8-28. DOI:10.1016/j.blre.2017.08.004 |
| [4] |
NOUGAREDE A, POPGEORGIEV N, KASSEM L, et al. Breast cancer targeting through inhibition of the endoplasmic reticulum-based apoptosis regulator Nrh/BCL2L10[J]. Cancer Res, 2018, 78(6): 1404-1417. DOI:10.1158/0008-5472.CAN-17-0846 |
| [5] |
BAI Y, WANG J, HAN J, et al. BCL2L10 inhibits growth and metastasis of hepatocellular carcinoma both in vitro and in vivo[J]. Mol Carcinog, 2017, 56(3): 1137-1149. DOI:10.1002/mc.22580 |
| [6] |
XU J D, FURUYA T, CAO X X, et al. Loss of BCL2L10 protein expression as prognostic predictor for poor clinical outcome in gastric carcinoma[J]. Histopathology, 2010, 57(6): 814-824. DOI:10.1111/j.1365-2559.2010.03720.x |
| [7] |
VIDAL V, ROBERT G, GOURSAUD L, et al. BCL2L10 positive cells in bone marrow are an independent prognostic factor of azacitidine outcome in myelodysplastic syndrome and acute myeloid leukemia[J]. Oncotarget, 2017, 8(29): 47103-47109. DOI:10.18632/oncotarget.17482 |
| [8] |
FABIANI E, LEONE G, GIACHELIA M, et al. Analysis of genome-wide methylation and gene expression induced by 5-aza-2′-deoxycytidine identifies BCL2L10 as a frequent methylation target in acute myeloid leukemia[J]. Leuk Lymphoma, 2010, 51(12): 2275-2284. DOI:10.3109/10428194.2010.528093 |
| [9] |
VALENT P, HORNY H P, BENNETT J M, et al. Definitions and standards in the diagnosis and treatment of the myelodysplastic syndromes: Consensus statements and report from a working conference[J]. Leuk Res, 2007, 31(6): 727-736. DOI:10.1016/j.leukres.2006.11.009 |
| [10] |
ARBER D A, ORAZI A, HASSERJIAN R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J]. Blood, 2016, 127(20): 2391-2405. DOI:10.1182/blood-2016-03-643544 |
| [11] |
SCHANZ J, TüCHLER H, SOLÉ F, et al. New comprehensive cytogenetic scoring system for primary myelodysplastic syndromes (MDS) and oligoblastic acute myeloid leukemia after MDS derived from an international database merge[J]. J Clin Oncol, 2012, 30(8): 820-829. DOI:10.1200/jco.2011.35.6394. |
| [12] |
VOSO M T, FENU S, LATAGLIATA R, et al. Revised international prognostic scoring system (IPSS) predicts survival and leukemic evolution of myelodysplastic syndromes significantly better than IPSS and WHO prognostic scoring system: validation by the gruppo Romano mielodisplasie Italian regional database[J]. J Clin Oncol, 2013, 31(21): 2671-2677. DOI:10.1200/jco.2012.48.0764 |
| [13] |
MIKATA R, FUKAI K, IMAZEKI F, et al. BCL2L10 is frequently silenced by promoter hypermethylation in gastric cancer[J]. Oncol Rep, 2010, 23(6): 1701-1708. DOI:10.3892/or_00000814 |
| [14] |
HE J F, DENG L, LIU H P, et al. BCL2L10/BECN1 modulates hepatoma cells autophagy by regulating PI3K/AKT signaling pathway[J]. Aging, 2019, 11(2): 350-370. DOI:10.18632/aging.101737 |
| [15] |
NAUMANN U, WEIT S, WISCHHUSEN J, et al. Diva/Boo is a negative regulator of cell death in human glioma cells[J]. FEBS Lett, 2001, 505(1): 23-26. DOI:10.1016/s0014-5793(01)02768-5 |
| [16] |
MIKATA R, YOKOSUKA O, FUKAI K, et al. Analysis of genes upregulated by the demethylating agent 5-aza-2′-deoxycytidine in gastric cancer cell lines[J]. Int J Cancer, 2006, 119(7): 1616-1622. DOI:10.1002/ijc.21968 |
| [17] |
VOSO M T, FABIANI E, PICIOCCHI A, et al. Role of BCL2L10 methylation and TET2 mutations in higher risk myelodysplastic syndromes treated with 5-azacytidine[J]. Leukemia, 2011, 25(12): 1910-1913. DOI:10.1038/leu.2011.170 |
| [18] |
MONTALBANBRAVO G, TAKAHASHI K, PATEL K P, et al. Impact of the number of mutations in survival and response outcomes to hypomethylating agents in patients with myelodysplastic syndromes or myelodysplastic/myeloproliferative neoplasms[J]. Oncotarget, 2018, 9(11): 9714-9727. DOI:10.18632/oncotarget.23882 |
| [19] |
JIANG X J, WANG Z X, DING B J, et al. The hypomethylating agent decitabine prior to chemotherapy improves the therapy efficacy in refractory/relapsed acute myeloid leukemia patients[J]. Oncotarget, 2015, 6(32): 33612-33622. DOI:10.18632/oncotarget.5600 |



