自身免疫性溶血性贫血(autoimmune hemolytic anemia,AIHA)是由于机体免疫功能紊乱、产生自身抗体、导致红细胞破坏加速超过骨髓代偿时发生的贫血[1]。根据自身抗体作用于红细胞所需温度,分为温抗体型、冷抗体型、混合型[2]。临床上,AIHA按其病因可分为原发性(50%)或继发于淋巴增生性疾病(20%),自身免疫性疾病(20%),感染、肿瘤及其他(10%)。原发性AIHA一线治疗以糖皮质激素为主,但长期使用激素副作用明显而难以坚持,且很多患者在激素减量过程中出现激素依赖或停药后很快复发。对于复发或激素依赖的AIAH患者二线治疗仍有争议,切脾、利妥昔单抗(美罗华)、环孢素(cyclosporin A,CsA)、霉酚酸酯(mycophenolate Mofeti, MMF)等疗效各有不同,且目前并无确定的二线用药优选推荐,急需探索新的治疗方案[3]。
西罗莫司(sirolimus, SRL)由吸水性链霉菌产生,抑制哺乳动物mTOR靶点,诱导异常淋巴细胞凋亡,增加调节性T细胞的数量[4],诱导免疫耐受。据报道,西罗莫司对许多免疫介导的血细胞减少症[5],如自身免疫性淋巴增生综合征(autoimmune lymphoproliferative symdrome,ALPS)、免疫血小板减少症(immune thrombocytopenia,ITP)[6]和Evans综合征(Evans syndrome, ES)具有疗效和良好的耐受性[7]。国外有个案报道SRL治疗难治性AIAH疗效可,安全性好,疗效持久[8]。目前尚无大规模临床数据报道。本研究回顾性分析本中心2016年1月至2019年1月使用SRL治疗复发/难治性原发性AIHA的疗效和安全性,为复发/难治AIHA的优选用药提供了临床证据。
1 资料与方法 1.1 病例资料收集本中心2016年1月至2019年1月使用SRL治疗复发/难治性原发性AIHA患者。纳入标准:门诊诊断明确的复发/难治性原发性AIHA患者,诊断标准参照文献[3, 9-12]。难治性AIAH定义:规范应用糖皮质激素(Glucocorticoid,GC)治疗至少3周无反应,或需GC长期治疗,维持血液学反应剂量超过等效泼尼松15 mg/d。复发性AIHA定义:规范应用GC治疗获得完全或部分血液学反应的患者,停药或维持治疗过程中血红蛋白再下降和网织红细胞绝对值进一步升高,需要再次治疗。患者年龄≥18岁,性别不限。排除标准:合并其他恶性肿瘤、活动性感染、心肝肾功能不全或其他严重疾病者;妊娠或哺乳期的妇女;继发性溶血性贫血;有西罗莫司使用禁忌证患者。
1.2 治疗方法使用西罗莫司胶囊,首次口服剂量4 mg/d,维持口服2 mg/d,监测血药谷浓度维持在5~15 ng/mL,2个月时评判初始疗效,无效者换药;有效者继续服药,至少6个月,后缓慢减量,如减量中存在病情反复,则维持时间更久(1~2年)。
1.3 疗效标准及观察指标完全缓解(CR):血红蛋白(HGB)≥120 g/L(男性)或≥110 g/L(女性),无溶血表现,不强调直接Coombs试验阴性;部分缓解(PR):血红蛋白>90 g/L或血红蛋白升高>20 g/L且不依赖血制品输注;无效(NR):血红蛋白没有达到PR水平[12]。
不良反应监测参考CTCAE 4.0,评估血液学不良反应(包括血小板、白细胞及红细胞计数)和非血液学不良反应(肝功能、肾功能、血压、血糖、真菌、CMV、EB病毒感染等)。
主要观察指标:西罗莫司治疗AIHA的总反应率=完全缓解率+部分缓解率(ORR=CR+PR),次要观察指标:西罗莫司副反应。
1.4 统计学分析采用GraphPad Prism 7软件进行统计分析和作图。连续变量以
共纳入16例复发/难治的原发性AIHA患者(Evans综合征1例),其中男性2例,女性14例,中位年龄50(35~72)岁,西罗莫司使用前,中位病程9(3~120)个月。患者入组西罗莫司治疗前接受过一线糖皮质激素治疗,或者二线环孢素、美罗华等治疗,其中激素依赖11例,激素抵抗2例,3例患者接受过二线治疗(其中1例环孢素治疗失败,1例美罗华治疗失败,1例美罗华环孢素均失败),见表 1。
| 临床特征 | 例数 | 比例(%) |
| 年龄 | ||
| ≥50岁 | 9 | 56.25 |
| <50岁 | 7 | 43.75 |
| 性别 | ||
| 男性 | 2 | 12.50 |
| 女性 | 14 | 87.50 |
| 从诊断到入组时间 | ||
| ≥12个月 | 7 | 43.75 |
| <12个月 | 9 | 56.25 |
| 前期治疗 | ||
| 激素抵抗 | 2 | 12.50 |
| 激素依赖 | 11 | 68.75 |
| 激素+美罗华 | 1 | 6.25 |
| 激素+环孢素 | 1 | 6.25 |
| 激素+美罗华+环孢素 | 1 | 6.25 |
| 入组时血红蛋白 | ||
| ≥70 g/L | 9 | 56.25 |
| < 70 g/L | 7 | 43.75 |
2.2 随访及疗效分析
16例患者可评估疗效(服药≥2个月),在西罗莫司治疗2个月时,8例(50%)患者对治疗有效,其中3例(18.75%)达到CR,5例(31.25%)达到PR,8例NR(50%);当入组3个月时,有效率上升,有11例(68.75%)患者对SRL治疗有效,其中7例(43.75%)获得CR,4例(25%)获得PR,对SRL治疗无效例数减少为5例(31.25%),有3例患者持续服药后获得CR或PR;入组6个月时,10例患者对SRL治疗有效,前期达到PR的1例复发;入组12个月,仍有7例完全缓解,复发2例,总反应率ORR为56.25%(表 2)。随访至2020年2月,远期随访中位时间12(2~42)个月,对SRL有效8例患者,持续缓解,其中7例CR,1例PR。完全缓解患者中5例已停药,停药后仍处于持续缓解状态,最长停药时间24个月。2例患者达CR后停药复发,1例再次给予SRL仍然有效,重新达到CR。见表 3。
| 入组时间 | n | ORR | CR | PR | RE | NR |
| 2个月 | 16 | 8(50.00) | 3(18.75) | 5(31.25) | - | 8(50.00) |
| 3个月 | 16 | 11(68.75) | 7(43.75) | 4(25.00) | - | 5(31.25) |
| 6个月 | 16 | 10(62.50) | 7(43.75) | 3(18.75) | 1(6.25) | 5(31.25) |
| 12个月 | 16 | 9(56.25) | 7(43.75) | 2(12.50) | 2(12.50) | 5(31.25) |
| ORR=CR+PR | ||||||
| 编号 | 性别 | 起效时间 | 最佳疗效 | 最佳疗效时 HGB/g·L-1 |
达最佳疗效 时间 |
副反应(AE) | SRL谷浓度 /ng·mL-1 |
AE结局 | 随访时间 | 随访结束时疾病状态 |
| 1 | 男 | 10 d | CR | 128 | 19个月 | 口腔溃疡 | 13.7 | 恢复 | 42个月 | CR,已停药2个月 |
| 2 | 女 | 27 d | CR | 117 | 6个月 | / | 8.0 | / | 36个月 | CR,已停药24个月 |
| 3 | 女 | 30 d | CR | 110 | 3个月 | / | 10.0 | / | 26个月 | 停药2年后RE,肺部感染去世 |
| 4 | 女 | / | NR | / | / | / | 9.6 | / | 11个月 | NR |
| 5 | 女 | 35 d | CR | 129 | 14个月 | / | 7.2 | / | 22个月 | 停药4个月后RE,再次使用SRL无效 |
| 6 | 女 | 41 d | CR | 136 | 12个月 | / | 5.1 | / | 42个月 | SRL减量中HGB减少,加回剂量后再次CR,持续服药中 |
| 7 | 男 | 25 d | CR | 140 | 6个月 | 皮肤瘙痒,双下肢水肿 | 12.1 | 恢复 | 32个月 | CR,已停药6个月 |
| 8 | 女 | / | NR | / | / | / | / | / | 2个月 | NR |
| 9 | 女 | 29 d | CR | 132 | 3个月 | 低钾 | 11.0 | 恢复 | 19个月 | CR,持续服药中 |
| 10 | 女 | 20 d | PR | 101 | 1个月 | 轻度肝损害 | 16.8 | 恢复 | 5个月 | 服药5个月后RE,换他克莫司 |
| 11 | 女 | / | NR | / | / | / | / | / | 2个月 | NR |
| 12 | 女 | / | PR | / | 1个月 | 肺部感染 | 15.4 | 恢复 | 2个月 | NR |
| 13 | 女 | 34 d | PR | 95 | 3个月 | 胆固醇高,血糖偏高 | 11.3 | 恢复 | 12个月 | PR,持续服药中 |
| 14 | 女 | 27 d | CR | 114 | 3个月 | / | 8.0 | / | 12个月 | CR,已停药7个月 |
| 15 | 女 | / | NR | / | / | / | 10.3 | / | 7个月 | NR |
| 16 | 女 | 33 d | CR | 114 | 5个月 | / | / | / | 12个月 | CR,已停药4月 |
| SRL:西罗莫司;CR:完全缓解;PR:部分缓解;NR:无效;RE:复发;HGB:血红蛋白;AE:副反应 | ||||||||||
患者服用西罗莫司起效的中位起效时间为29(10~41)d,达到完全缓解的中位时间为90 d(图 1A、B)。患者达到最佳疗效时9例CR,3例PR,总反应率75%(12/16),另外4例NR。治疗前患者平均HGB为72.6 g/L, 最佳反应时平均HGB为120.8 g/L(P < 0.000 1,图 1C、表 3)。
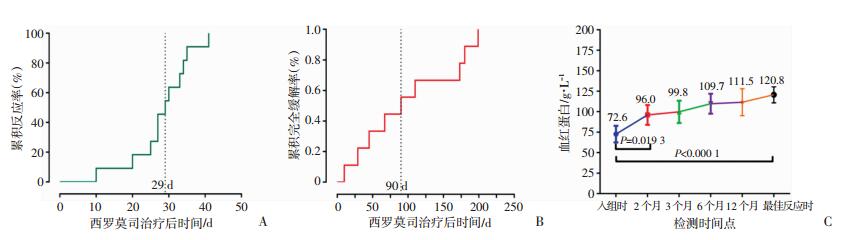
|
| 图 1 西罗莫司治疗AIHA的累积反应率(A)、完全缓解率(B)以及血红蛋白(C)变化趋势 |
2.3 副作用
口服SRL患者中,6例患者出现药物相关副作用,分级1~2级。患者均可耐受,副作用主要是:1例口腔溃疡(药物浓度13.7 ng/mL),1例低钾(浓度11 ng/mL),1例皮肤瘙痒双下肢水肿(浓度12.1 ng/mL),1例轻度肝损害(浓度16.8 ng/mL),1例轻微总胆固醇增高,血糖增高(浓度11.3 ng/mL),1例患者肺部感染(浓度15.4 ng/mL),经调整西罗莫剂量后以及给予对症处理后均好转(表 3)。
3 讨论AIHA是一种临床上常见的溶血性疾病,糖皮质激素是治疗AIHA的一线药物,起效快,整体有效率达70%~85%[13],但是激素副作用明显,多数患者不耐受,且长期缓解率不足20%,50%~80%的患者需要接受二线治疗[14]。目前二线治疗并没有统一的标准,如脾切除、利妥昔单抗、钙调磷酸酶抑制剂环孢素以及细胞毒免疫制剂环磷酰胺等,以上药物或单用或联合糖皮质激素[15]。使用免疫调节剂西罗莫司治疗复发/难治性AIHA,既往有个案报道[8, 15]。我中心使用SRL疗效好,从给药2个月到随访截止,总反应率维持在50%~75%,患者达到CR后病情稳定不易复发,最长停药时间24个月。
AIHA发病机制复杂,包括细胞免疫、体液免疫异常。①免疫调节异常:Th2细胞功能异常产生过量细胞因子,导致体液免疫亢进;CD4+CD25+调节性T细胞的比例可能是AIHA发病的一个重要因素;②自身免疫耐受异常:如树突状细胞增多,活化B细胞产生自身抗体;③红细胞膜抗原分子改变:微生物或药物引起导致自身抗体识别异常;④免疫监视功能降低[16]。以上决定了AIHA的治疗在遵循原则下需体现个体化。对于复发/难治性AIHA的二线治疗中,脾切除是推荐之一。脾脏是产生自身抗体及温抗体型AIHA患者红细胞破坏的主要场所,但目前尚无指标能预示脾切除疗效。一项大型回顾性研究中,脾切除对温抗体型及混合型患者有效率75%,其中2/3的患者不需要进一步治疗,而对冷抗体型患者疗效差。脾切除后感染发生率高,其他并发症有静脉血栓、肺栓塞、肺动脉高压等,患者主观接受度不强,故脾切除只适合年轻且能耐受手术的患者,不作为激素无效的AIHA的首选二线方案[17]。
研究报道利妥昔单抗治疗AIHA的标准剂量为每周375 mg/m2×4周,有效率为75%~83%,但仍有40%的患者出现缓解后复发,长期缓解率不足30%,另外小剂量美罗华每周100 mg×4周联合小剂量激素维持治疗也能取得较好的临床疗效[18],但小剂量美罗华疗效持续时间相对较短,约一半患者治疗后1年内复发[12]。美罗华治疗溶血性贫血初始有效率高,但长期缓解率低,复发率高,且价格偏高,输注中可能发生严重过敏反应,以及发生(乙肝)病毒激活或感染[19]。这给患者带来一定的不便,不利于临床广泛使用。
西罗莫司与哺乳动物mTOR结合,阻断T淋巴细胞由G1期进入S期,从而抑制T淋巴细胞及B淋巴细胞活化,抑制B细胞产生抗体[20]。西罗莫司作为mTOR抑制剂,可诱导异常淋巴细胞凋亡,增加外周血Treg细胞、MDSC细胞比例,降低Th2细胞比例,重建外周免疫耐受。因此,西罗莫司治疗AIHA有充分的理论依据[6, 20]。西罗莫司临床上主要用于实体器官移植后排斥反应,作为一种疗效好、副作用少、无肾毒性的新型免疫抑制剂,已经被越来越多用于血液病的治疗。国外BRIDE等[5]报道了西罗莫司单药在复发/难治免疫性血细胞减少患者中,30例患者中有21例对西罗莫司反应良好,其中20例达到血液学完全缓解,1例达到部分缓解。我们将西罗莫司尝试用于16例复发/难治的原发性AIHA患者,治疗3个月时有效率达68.75%,长期(随访至2020年2月)有效率50%,且不良反应轻微,随浓度调整而好转。随访过程中最佳反应率可达到75%。并且达到完全缓解患者长期缓解率高,持续停药时间2~24个月,少数复发患者再次口服西罗莫司也能重新达到CR,但随访中也出现部分患者对西罗莫司依赖,在减量中病情反复。由于SRL毒副作用比较轻微,故建议缓解后宜缓慢减量,可以小剂量长期维持,帮助建立稳定的免疫耐受。对于5例西罗莫司无效患者,回顾病史发现,有2例同时合并慢性乙型病毒性肝炎,其他3例均有抗核抗体谱检测的异常(1例抗核抗体ANA阳性,抗RO抗体阳性;1例抗着丝粒抗体阳性,ANA阳性;1例ANA阳性)。乙肝病毒和抗核抗体谱异常提示患者体内可能合并复杂的免疫异常情况,这类患者也许对单药西罗莫司不敏感,联合用药可能会取得较好临床疗效。这值得临床进一步探索。
本研究中有6例患者出现不良反应,均较轻微且可耐受,经调整药物浓度后完全好转,考虑跟药物浓度偏高有关,故强调在治疗随访中,浓度的监测很重要,避免因严重毒副反应中断治疗,降低疗效。我们的经验是西罗莫司保持在8~10 ng/mL,浓度越高越易出现毒副作用。当然药物浓度和疗效及安全性有无线性关系,需要进一步观察探讨。另外,AIHA属于自身免疫性疾病,不管是使用一线糖皮质激素,还是二线利妥昔单抗、环孢素或西罗莫司,均属于免疫抑制治疗。因此,在治疗AIHA期间需全程预防感染,特别是年龄偏大或有基础疾病患者。本研究中有1例患者在SRL停药2年后发生肺部感染而去世,需要引起重视。
西罗莫司治疗成人复发/难治的原发性AIHA有效,且副作用轻微,安全性好,约50%患者可获得长期缓解。除了脾切除和利妥昔单抗,SRL可以作为复发/难治性AIHA的优先选择。今后,我们将进一步积累西罗莫司治疗AIHA的样本数和随访时间,同时也积极探索西罗莫司在一线治疗AIHA中的效果。另外积极寻找可靠预测指标,帮助预判哪部分患者对SRL可能有效,是实现精准治疗的基础和方向。
| [1] |
BARCELLINI W, GIANNOTTA J, FATTIZZO B. Autoimmune hemolytic anemia in adults:primary risk factors and diagnostic procedures[J]. Expert Rev Hematol, 2020, 13(6): 585-597. DOI:10.1080/17474086.2020.1754791 |
| [2] |
邵宗鸿, 郑萌颖. 自身免疫性溶血性贫血治疗进展[J]. 临床血液学杂志, 2016, 29(6): 855-860. SHAO Z H, ZHENG M Y. Progress in the treatment of autoimmune hemolytic anemia[J]. J Clin Hematol, 2016, 29(6): 855-860. DOI:10.13201/j.issn.1004-2806.2016.11.001 |
| [3] |
中华医学会血液学分会红细胞疾病(贫血)学组. 自身免疫性溶血性贫血诊断与治疗中国专家共识(2017年版)[J]. 中华血液学杂志, 2017, 38(4): 265-267. Red Blood Cell Disease (Anemia) Group of Chinese Medical Association. Chinese expert consensus on the diagnosis and treatment of autoimmune hemolytic Anemia (2017)[J]. Chin J Hematol, 2017, 38(4): 265-267. DOI:10.3760/cma.j.issn.0253-2727.2017.04.001 |
| [4] |
PERL A. Activation of mTOR (mechanistic target of rapamycin) in rheumatic diseases[J]. Nat Rev Rheumatol, 2016, 12(3): 169-182. DOI:10.1038/nrrheum.2015.172 |
| [5] |
BRIDE K L, VINCENT T, SMITH-WHITLEY K, et al. Sirolimus is effective in relapsed/refractory autoimmune cytopenias:results of a prospective multi-institutional trial[J]. Blood, 2016, 127(1): 17-28. DOI:10.1182/blood-2015-07-657981 |
| [6] |
FENG Y M, XIAO Y S, YAN H J, et al. Sirolimus as rescue therapy for refractory/relapsed immune thrombocytopenia:results of a single-center, prospective, single-arm study[J]. Front Med (Lausanne), 2020, 7: 110. DOI:10.3389/fmed.2020.00110 |
| [7] |
KNIGHT Z A, SCHMIDT S F, BIRSOY K, et al. A critical role for mTORC1 in erythropoiesis and Anemia[J]. Elife, 2014, 3: e01913. DOI:10.7554/eLife.01913 |
| [8] |
PARK J A, LEE H H, KWON H S, et al. Sirolimus for refractory autoimmune hemolytic anemia after allogeneic hematopoietic stem cell transplantation:a case report and literature review of the treatment of post-transplant autoimmune hemolytic anemia[J]. Transfus Med Rev, 2016, 30(1): 6-14. DOI:10.1016/j.tmrv.2015.09.001 |
| [9] |
GO R S, WINTERS J L, KAY N E. How I treat autoimmune hemolytic anemia[J]. Blood, 2017, 129(22): 2971-2979. DOI:10.1182/blood-2016-11-693689 |
| [10] |
BARCELLINI W, FATTIZZO B, ZANINONI A, et al. Clinical heterogeneity and predictors of outcome in primary autoimmune hemolytic anemia:a GIMEMA study of 308 patients[J]. Blood, 2014, 124(19): 2930-2936. DOI:10.1182/blood-2014-06-583021 |
| [11] |
高清妍, 刘晨曦, 李园, 等. 小剂量利妥昔单抗治疗12例难治/复发原发性自身免疫性溶血性贫血患者疗效分析[J]. 中华血液学杂志, 2017, 38(12): 1075-1077. GAO Q Y, LIU C X, LI Y, et al. A monocentric retrospective study of low-dose rituximab in the treatment of 12 cases refractory or relapsed idiopathic autoimmune hemolytic anemia patients[J]. Chin J Hematol, 2017, 38(12): 1075-1077. DOI:10.3760/cma.j.issn.0253-2727.2017.12.016 |
| [12] |
范斯斌, 王志军, 毛强, 等. 复发/难治自身免疫性溶血性贫血患者脾切除术疗效分析[J]. 中华血液学杂志, 2019, 40(2): 132-136. FAN S B, WANG Z J, MAO Q, et al. Outcomes of splenectomy in relapsed/refractory autoimmune hemolytic anemia[J]. Chin J Hematol, 2019, 40(2): 132-136. DOI:10.3760/cma.j.issn.0253-2727.2019.02.007 |
| [13] |
ZANELLA A, BARCELLINI W. Treatment of autoimmune hemolytic anemias[J]. Haematologica, 2014, 99(10): 1547-1554. DOI:10.3324/haematol.2014.114561 |
| [14] |
KAMESAKI T, TOYOTSUJI T, KAJⅡ E. Characterization of direct antiglobulin test-negative autoimmune hemolytic anemia:a study of 154 cases[J]. Am J Hematol, 2013, 88(2): 93-96. DOI:10.1002/ajh.23356 |
| [15] |
DUCASSOU S, LEVERGER G, FERNANDES H, et al. Benefits of rituximab as a second-line treatment for autoimmune haemolytic anaemia in children:a prospective French cohort study[J]. Br J Haematol, 2017, 177(5): 751-758. DOI:10.1111/bjh.14627 |
| [16] |
阮长耿, 沈志祥, 黄晓军. 高级职称卫生专业技术资格考试指导用书, 血液病学高级教程, 精装珍藏本[M]. 北京: 中华医学音像电子出版社, 2016: 28. RUAN C G, SHEN Z X, HUANG X J. Guidance book for senior professional title health professional and technical qualification examination, Hematology-Advanced Course, Hardcover collection[M]. Beijing: China Medical Electronic Audiovisual Press, 2016: 28. |
| [17] |
BARCELLINI W. Immune hemolysis:diagnosis and treatment recommendations[J]. Semin Hematol, 2015, 52(4): 304-312. DOI:10.1053/j.seminhematol.2015.05.001 |
| [18] |
程朗, 刘正媛, 陈曦, 等. 小剂量利妥昔单抗靶向控制循环B淋巴细胞治疗难治性自身免疫性溶血性贫血[J]. 临床血液学杂志, 2020, 33(5): 316-319. CHENG L, LIU Z Y, CHEN X, et al. Treatment of refractory autoimmune hemolytic anemia with low dose rituximab targeting circulating B lymphocytes[J]. J Clin Hematol, 2020, 33(5): 316-319. DOI:10.13201/j.issn.1004-2806.2020.05.005 |
| [19] |
王化泉, 邢莉民, 邵宗鸿. 自身免疫性溶血性贫血的治疗进展[J]. 中华医学杂志, 2016, 96(26): 2111-2114. WANG H Q, XING L M, SHAO Z H. Progress in the treatment of autoimmune hemolytic anemia[J]. Natl Med J China, 2016, 96(26): 2111-2114. DOI:10.3760/cma.j.issn.0376-2491.2016.26.019 |
| [20] |
SOLIMAN G A. The mammalian target of rapamycin signaling network and gene regulation[J]. Curr Opin Lipidol, 2005, 16(3): 317-323. DOI:10.1097/01.mol.0000169352.35642.06 |



