2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系毒理学研究所;
3. 463000 河南 驻马店,中国人民解放军第990医院泌尿外科
2. Institute of Toxicology, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Urology, No. 990 Hospital of PLA, Zhumadian, Henan Province, 463000, China
精子尾部鞭毛是其运动所必需的一种特定细胞器。鞭毛的完整性对正常精子功能的维持至关重要。鞭毛结构缺陷常导致精子的运动能力减弱或缺失,从而引起男性不育。精子鞭毛由4部分组成:连接头部的颈段,包含轴丝及周围螺旋状线粒体鞘的中段、被纤维鞘包裹的主段以及末段[1]。其中主段约占尾部的3/4。主段中包裹于轴丝和外部致密纤维外的纤维鞘是一种独特的细胞骨架结构,由纵向柱状体和环状肋板组成[2]。纤维鞘为鞭毛运动发挥重要支撑作用并在提供能量方面发挥重要作用。精子形成过程中,特异性基因在睾丸内适时有序表达引导各细胞结构的有序形成,包括精子鞭毛的骨架结构形成并与对应蛋白的精确有序装配等,保证精子结构及功能的形成[3]。钙结合酪氨酸磷酸化调节蛋白(calcium-binding tyrosine phosphorylation-regulated protein,CABYR)以及纤维鞘CABYR结合蛋白(fibrous sheath CABYR-binding protein,FSCB)均在精子形成过程中特异性表达并定位于精子鞭毛纤维鞘上,而且该两种蛋白均具有钙结合能力,在精子获能过程中均可发生磷酸化作用,提示该两种蛋白极有可能参与了精子运动功能的调节[4-5]。同时,本课题组前期研究发现FSCB、CABYR蛋白可形成巨分子蛋白复合物,装配于纤维鞘的骨架蛋白AKAPs上,共同参与发挥纤维鞘的生理功能[5];但Fscb单基因敲除小鼠并没有显示明显的精子表型改变[6]。因此,为探讨FSCB/CABYR蛋白复合物在纤维鞘中的生理作用及参与精子运动调节的机制,本研究应用CRISPR/Cas9系统靶向敲除小鼠Cabyr基因,并与前期建立的Fscb基因敲除小鼠模型[7]进行交叉繁育,建立Fscb/Cabyr双基因敲除动物模型,为深入探讨FSCB和CABYR蛋白缺失后精子形态结构、活力、授精能力等的可能改变奠定研究基础。
1 材料与方法 1.1 主要材料大肠杆菌、LB琼脂平板、C57BL/6J小鼠、pUC57-T7-gRNA表达载体、Cas9表达载体、PCR纯化试剂盒均由南京大学模式动物研究所提供;T7Ultra试剂盒、MEGAshortscript试剂盒(AM1345)购自Ambion公司,DH5α感受态购自Transgene公司,限制性内切酶BsaⅠ、DraⅠ、AgeⅠ、T4Ligase/T4Bufer连接酶、Taq酶和dNTP等均购自NEB公司,质粒小量提取试剂盒购自中国天根生化科技有限公司,琼脂糖胶回收试剂盒购自中国康为世纪公司,豚鼠抗-FSCB抗体由李彦锋教授研究制备,兔抗- CABYR抗体、山羊抗兔IgG购自武汉三鹰Proteintech公司,山羊抗豚鼠IgG购自中国博奥生物有限公司。
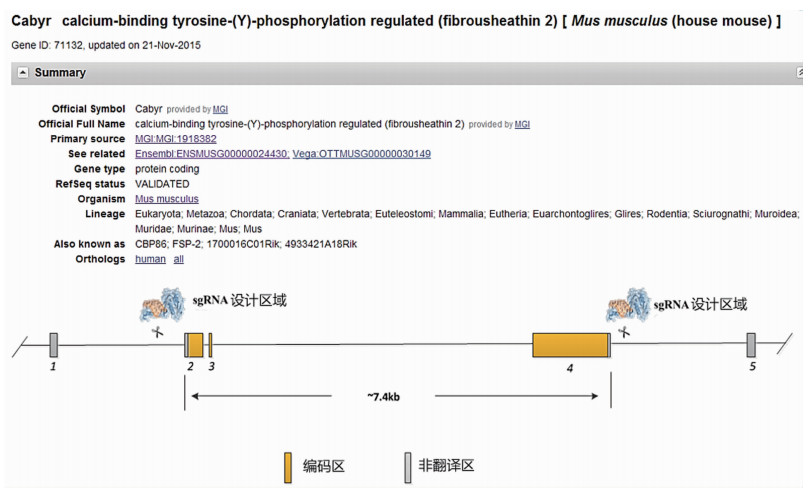
1.2 方法 1.2.1 sgRNA设计和寡聚核苷酸链的合成鼠Cabyr基因定位于第18条染色体(Chromosome 18: 12 741 324~12 755 146,ENSMUSG00000024430),含有7种转录本,本研究选择Cabyr-001转录本,该转录本包含5个外显子,其中3个属于编码外显子,转录本长度1 557 bp,翻译453个氨基酸。针对该基因,通过在线免费设计sgRNA的软件(http://crispr.mit.edu/),设计4条(2对)针对Cabyr基因的sgRNA核苷酸链(表 1,图 1)。将sgRNA寡核苷酸单链以逐步降温的方法退火成双链,程序如下:95 ℃,5 min;94 ℃,1 min,-1 ℃/循环,22个循环;72 ℃,30 min;71 ℃,1 min,-1 ℃/循环,46个循环;4 ℃保持备用。
| sgRNA名称 | sgRNA序列(5′→3′) | PAM |
| S1 | CGATCTAGCACTTATTAAGA | AGG |
| S2 | CCCACTGCTTACTAATGCAC | AGG |
| S3 | ATGGACTTTGGCCAGTTGGC | AGG |
| S4 | GTACTCTCACATACTGTTTC | TGG |
|
| 图 1 Cabyr基因及sgRNA设计示意图 |
1.2.2 sgRNA表达载体构建
将4条sgRNA寡核苷酸双链稀释至0.5 μmol/L。用BsaⅠ酶切pUC57-T7-gRNA质粒使其线性化,回收后稀释至50 mg/L,然后与4条寡核苷酸双链分别进行连接。连接体系:线性化的pUC57-T7-gRNA质粒2 μL,sgRNA寡核苷酸双链6 μL,T4连接酶1 μL,T4缓冲液1 μL,16 ℃连接6 h或过夜。连接后转化感受态大肠杆菌,涂布于含125 μg/mL卡那霉素的LB琼脂平皿上进行培养。次日在LB琼脂平板上挑取具有卡那霉素抗性的单克隆菌落,溶于20 μL LB液中,涡旋后,将部分菌液接种到LB液中,37 ℃,半径=50 mm,250 r/min下振摇培养,另一部分的菌液提取质粒DNA,进行测序鉴定。鉴定正确的阳性克隆保存备用。
1.2.3 sgRNA和Cas9表达载体的体外转录sgRNA的表达载体pUC57-T7-gRNA-sgRNA经DraⅠ酶切线性化,Cas9表达载体经Age Ⅰ酶切线性化,两者均经酚氯仿抽提纯化后,溶于无核酸酶的水中作为模板,用于体外转录。sgRNA的体外合成利用MEGA shortscript试剂盒(Ambion,AM1354)在体外通过T7RNA聚合酶完成。Cas9mRNA的合成利用Ultra试剂盒(Ambion,AM1345)在体外通过T7RNA聚合酶完成。上述载体转录合成均在南京大学模式动物研究所完成。
1.2.4 Cas9/sgRNA的原核注射获得F0代初建鼠转录好的sgRNA和Cas9 mRNA混合并调整浓度至每种sgRNA 10 ng/μL和20 ng/μL,显微注射法将RNA混合物注射到C57BL/6J鼠受精卵的雄核和细胞质中,用C57BL/6J小鼠作为假孕受体鼠,移植成功后获得基因敲除的初建鼠。实验中小鼠编号为“数字”加“#”上标表示,如“1#”,以此逐一编号。
1.2.5 Cabyr基因敲除小鼠基因鉴定及测序F0代初建鼠在出生7~14 d时,剪取鼠尾组织提取基因组DNA。设计2对包含sgRNA作用靶点的鉴定引物,引物F1:5-TAGTGCCTGTATGGACGTTATTTGG-3,R1:5-AATGCCACAGCCCAAATAAACG-3;引物F2:5-TAG-TGCCTGTATGGACGTTATTTGG-3,R2:5- GTCTTGAG-GCCATAGGGTACAACA-3。PCR反应体系25 μL。反应条件:95 ℃ 5 min;[98 ℃ 30 s,65 ℃ 30 s(每循环降0.5 ℃),72 ℃ 45 s]×20循环;(98 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s)×20循环;72 ℃ 5 min;保存于10 ℃。PCR产物用1.5%的琼脂糖凝胶电泳分离,通过PCR产物进行判断可能的阳性鼠及鉴定纯合性。引物1用以检测靶基因相应位点产生了突变的阳性鼠,扩增片段大小为600 bp,野生型无该600 bp条带;引物2用以检测纯合性,非纯合小鼠扩增产物大小为630 bp,纯合突变小鼠此PCR产物消失。通过PCR鉴定表明靶点DNA系列可能存在突变,进一步通过TA克隆、测序检查确定突变。
1.2.6 Fscb/Cabyr双基因敲除鼠模型的建立及鉴定以Fscb杂合小鼠与Cabyr杂合小鼠交叉繁育获得双杂合雄鼠,进而以双杂合雄鼠与背景鼠通过体外受精获得大量同代Fscb/Cabyr(++/+-)、Fscb/Cabyr(+-/++)、Fscb/Cabyr(+-/+-)、Fscb/Cabyr(++/++)型小鼠以用于扩增繁育。以上各种基因型小鼠互配,产仔后行PCR鉴定基因型,最终获得Fscb/Cabyr(--/--)双基因敲除纯合子,同时可获得一定数量的杂合子。
1.2.7 Western blot检测FSCB、CABYR蛋白在睾丸精子内的表达取Fscb/Cabyr(++/+-)、Fscb/Cabyr(--/+-)、Fscb/Cabyr(++/++)、Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)5种基因型雄鼠,将附睾及睾丸组织用RIPA蛋白裂解液提取蛋白作Western blot检测。电泳电压为80 V恒压约30 min,待溴酚蓝进入分离胶层,将电压调节至120 V恒压至电泳结束。常规在预冷转移缓冲液中进行转膜,FSCB组电压80 V恒压240 min,CABYR组电压80 V恒压120 min。PVDF膜以3%BSA封闭1 h后,一抗4 ℃孵育过夜(抗-FSCB抗体1 :1 000稀释,抗-CABYR抗体1 :500稀释)。TBST洗膜15 min×3次,常温孵育二抗1 h(山羊抗豚鼠IgG 1 :2 000稀释,山羊抗兔IgG 1 :1 000稀释)。TBST洗膜15 min×3次,曝光。
1.2.8 免疫荧光观察FSCB、CABYR蛋白在基因敲除小鼠精子上的表达按前述方法取小鼠附睾精子,置于HTF中37 ℃获能1 h后,取10 μL涂于载玻片上,充分干燥后,4%多聚甲醛固定30 min,再于室温干燥后,使用或储存于-20℃冰箱备用;取精子涂片室温下复温20 min,PBS清洗3次×5 min;加快速抗原修复液孵育15 min,PBS清洗3次×5 min;取含5‰ Triton X-100的PBS孵育15 min, 再用PBS清洗3次×5 min;加免疫染色封闭液37 ℃孵育60 min, 弃封闭液,勿洗;加稀释后一抗(抗-FSCB 1 :400,抗-CABYR 1 :200),4 ℃孵育过夜, 用含3‰ Tween-20的PBS清洗3次×5 min;加1 :400稀释后相应二抗,37 ℃孵育60 min, 弃二抗,用含3‰ Tween-20的PBS清洗3次×5 min;取DAPI室温避光染核,孵育15 min,用含3‰ Tween 20的PBS清洗3次×5 min;抗荧光猝灭封片剂封片后立即置于荧光显微镜下观察,拍照。
2 结果 2.1 表达载体的构建以BsaⅠ酶切处理pUC57-T7-GDNA质粒使其线性化,进而与4条设计的sgRNA寡核苷酸双链黏性末端分别匹配连接,经测序验证证实成功构建4种pUC57-T7-GDNA-sgRNA表达载体。
2.2 Cabyr基因敲除小鼠获得将pUC57-T7-GDNA-sgRNA和Cas9表达载体进行体外转录,通过显微注射法将转录好的sgRNA和Cas9 mRNA混合物注射入144枚C57BL/6J小鼠受精卵内,存活128枚,将128枚受精卵移植进7只假孕小鼠体内,妊娠6只,出生14只,存活11只。PCR鉴定提示5只阳性小鼠可能(图 2),进而行基因测序结果显示:产生3#、6#、7#和10#四种不同敲除基因型,并均产生移码。8#测序为双峰,提示可能PCR产物是双克隆而不是单纯目标敲除序列的基因型。最终选择3#、10#两只嵌合体雌鼠与背景鼠回交繁育,分别命名为A株和B株。将两株获得的后代进一步行PCR鉴定(图 3)及基因测序(图 4),结果显示:3#后代17#、18#、19#、22#均在16 976~24 600 bp区域发生7 625 bp的删除,获得3雄1雌共4只阳性小鼠;10#后代12#、13#、15#均在16 990~24 549 bp区域发生7 560 bp的删除和24 603位点的1bp的插入,获得3只雌性阳性小鼠,并显示Cas9/sgRNA引导的基因突变可稳定遗传。将F1代杂合子雄鼠与雌鼠交配以获得纯合子Cabyr基因敲除小鼠,获得两株Cabyr基因敲除小鼠品系并进一步将同一个品系小鼠互配繁殖,同时获得的A株杂合子小鼠用于进一步与Fscb基因敲除小鼠交配以获得双基因敲除纯合子小鼠模型。

|
|
1~11:F0代小鼠;DL2000:DNA分子质量标准;B6:野生型对照鼠;N:阴性对照 A:应用鉴定引物1进行PCR扩增后电泳结果阳性鼠扩增片段大小为600 bp;野生型无600 bp条带;B:应用鉴定引物2进行PCR扩增后电泳结果非纯合小鼠扩增产物大小为630 bp;纯合突变小鼠此PCR产物消失;提示3#、6#、7#、8#和10#可能为阳性小鼠 图 2 Cabyr基因敲除后F0代小鼠PCR鉴定结果 |

|
|
11~23:F1代小鼠;DL2000:DNA分子质量标准;B6:野生型对照鼠;N:阴性对照 A、C:应用鉴定引物1进行PCR扩增后电泳结果阳性鼠扩增片段大小为600 bp;野生型无600 bp条带;B、D:应用鉴定引物2进行PCR扩增后电泳结果非纯合小鼠扩增产物大小为630 bp;纯合突变小鼠此PCR产物消失;提示12#、13#、15#、17#、18#、19#和22#为阳性小鼠 图 3 Cabyr基因敲除后F1代小鼠PCR基因型鉴定 |

|
| 图 4 F1代小鼠基因测序结果 |
2.3 Fscb/Cabyr双基因敲除小鼠的获得
以Fscb杂合小鼠与Cabyr杂合小鼠交叉繁育获得Fscb/Cabyr(+-/+-)双杂合雄鼠,以双杂合雄鼠与背景鼠经体外受精获得同一代Fscb/Cabyr(++/+-)、Fscb/Cabyr(+-/++)、Fscb/Cabyr(+-/+-)、Fscb/Cabyr(++/++)型小鼠后,以Fscb/Cabyr(++/+-)雌雄互配,以Fscb/Cabyr(--/+-)雄鼠配Fscb/Cabyr(+-/+-)雌鼠,以Fscb/Cabyr(+-/+-)雄鼠配Fscb/Cabyr(--/+-)雌鼠,Fscb/Cabyr(--/+-)雌雄互配,从而最终获得Fscb/Cabyr(--/--)双基因敲除纯合子小鼠,并PCR进行基因型鉴定,同时获得Fscb/Cabyr(++/--)型小鼠及各种杂合子小鼠,以用于进一步生殖能力验证实验。
2.4 各型敲除小鼠睾丸中FSCB、CABYR蛋白表达验证对各基因型雄鼠睾丸蛋白进行FSCB、CABYR相关蛋白Western blot分析,蛋白表达情况如图 5所示:FSCB蛋白在Fscb/Cabyr(--/--)、Fscb/Cabyr(--/+-)的基因型中未表达,在Fscb/Cabyr(++/--)、Fscb/Cabyr(++/++)、Fscb/Cabyr(++/+-)三种基因型中正常表达;CABYR蛋白在Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)的基因型中未表达,在Fscb/Cabyr(++/+-)、Fscb/Cabyr(--/+-)两种基因型中表达明显降低,而在Fscb/Cabyr(++/++)基因型中正常表达。

|
| 图 5 FSCB、CABYR蛋白在双基因敲除纯合子小鼠及杂合子中表达的Western blot分析 |
2.5 免疫荧光检测FSCB、CABYR蛋白在Fscb/Cabyr双基因敲除小鼠精子上的表达
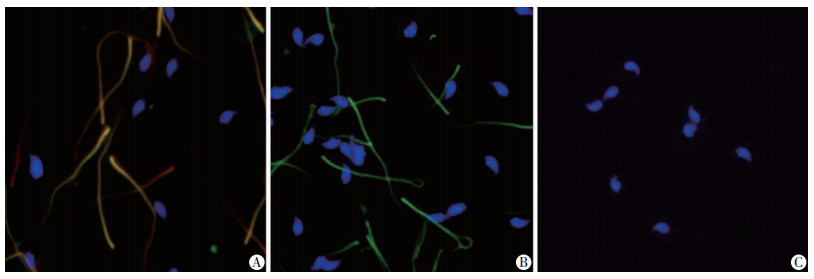
取Fscb/Cabyr(++/++)、Fscb/Cabyr(--/--)、Fscb/Cabyr(++/--)三种基因型雄鼠精子样本,经相应抗体免疫荧光染色后,置于荧光显微镜下选取视野拍照,结果显示:Fscb/Cabyr (++/++)除头部着色外,尾部主段同时有绿色和红色荧光(呈黄色),表明其主段同时有FSCB、CABYR蛋白表达。Fscb/Cabyr (++/--)尾部主段出现FSCB的绿色荧光,无CABYR的红色荧光;Fscb/Cabyr(--/--)小鼠精子仅头部着蓝色荧光,尾部未出现FSCB、CABYR蛋白荧光(图 6)。
|
|
FSCB为绿色标记;CABYR为红色标记;合成后为黄色标记;精子头部DAPI染色为蓝色 A:Fscb/Cabyr(++/++);B:Fscb/Cabyr(++/--);C:Fscb/Cabyr(--/--) 图 6 免疫荧光检测FSCB、CABYR蛋白在野生型、Cabyr单基因敲除和Fscb/Cabyr双基因敲除小鼠精子上的表达(×100) |
3 讨论
精子纤维鞘是精子鞭毛主段所独有的,环绕于外致密纤维(ODF)和轴丝之外的细胞骨架结构。基于现有研究,纤维鞘至少存在3方面作用:第一,发挥重要的结构性支撑作用,在精子运动中调节其柔韧度、鞭毛摆动方向及幅度[2]。第二,在为精子鞭毛运动提供能量方面具有重要作用。糖酵解是精子活力的主要能量来源。而大多数糖酵解酶定位于纤维鞘上,因而精子运动所需的糖酵解产生的能量被整合于纤维鞘中。第三,纤维鞘是多种重要信号传导通路和代谢通路的支架[8-10]。迄今为止,研究发现的纤维鞘相关蛋白有20多种,其主要结构成分是A激酶锚定蛋白家族(AKAPs)的AKAP3和AKAP4[11]。在对纤维鞘的相关功能研究中,已经发现纤维鞘的正常功能对精子运动至关重要,相关基因缺陷可能导致纤维鞘发育异常(DFS),影响轴丝和ODF结构[12],并可能影响能量产生,导致精子运动障碍。如Akap4突变小鼠表现为纤维鞘形态发育异常,AKAP3和甘油醛3-磷酸脱氢酶-S(GAPDS)表达水平降低,糖酵解和能量产生减少,从而导致精子运动能力极差[13]。同时,某些基因缺陷可影响相关信号通路,导致精子运动能力下降和授精能力显著降低或丧失,如Rho信号通路通过定位于纤维鞘的rhophilin相关蛋白1 (ROPN1)和rhophilin发挥作用,ROPN1和ropporin样基因(ROPN1L)双突变小鼠既表现出纤维鞘结构和形态的异常(主段变薄和碎裂),伴随着AKAP3水平的降低,同时也出现精子活力和PKA依赖性信号传导过程的缺陷,从而导致男性不育[11]。
本研究组长期致力于纤维鞘相关蛋白CABYR和FSCB的功能研究并已经获得多方面认识。CABYR是一种纤维鞘上既具有钙结合能力,又在获能过程中进行磷酸化调节的多态性精子运动和获能相关蛋白。该蛋白在精子形成后期表达并逐渐迁移至精子纤维鞘上,在获能过程中不但发生由PKA介导的丝氨酸/苏氨酸磷酸化,而且发生由酪氨酸激酶(TKs)介导的酪氨酸磷酸化,尤其是其磷酸化的同时还表现出钙结合能力的显著提高,显示该蛋白依赖于获能过程的磷酸化作用在钙信号传导中具有重要调节作用[4]。本研究组前期对CABYR蛋白的研究证实其不同异构体可形成二聚体和寡聚体参与纤维鞘的装配,通过免疫共沉淀和酵母双杂交技术还证实,CABYR蛋白和纤维鞘骨架蛋白AKAP3、AKAP4及Rho信号通路蛋白ROPN1均具有明确的紧密相互作用,可能形成巨分子复合物,参与精子鞭毛运动[8, 10]。同时,本研究组在从事CABYR及其巨分子复合物研究中率先发现和鉴定了一种与CABYR结合的新蛋白FSCB[5]。鼠FSCB具有睾丸/精子特异性,仅在精子形成后期表达并最终迁移至精子纤维鞘上。同时该蛋白与CABYR相似,既具有钙结合能力,又可在获能后被PKA磷酸化[14]。而且,值得注意的是,有研究显示ROPN1基因缺陷小鼠精子内FSCB蛋白表达消失,而主要纤维鞘结构蛋白AKAP 3和AKAP4的表达并没有改变,这表明ROPN1可能直接与FSCB结合或通过与CABYR形成异二聚体,从而将其锚定于纤维鞘内[11]。上述研究表明在纤维鞘中,结构蛋白、信号通路蛋白、钙结合蛋白等多类蛋白之间具有复杂而紧密的相互作用关系,共同发挥纤维鞘的生理功能。而CABYR和FSCB蛋白可能在鞭毛纤维鞘上作为蛋白复合体的一部分发挥作用。为了明确FSCB和CABYR蛋白复合物在精子纤维鞘中的生理功能,本研究组前期首先尝试构建了FSCB基因敲除小鼠,并进行了相关表型观察,结果显示Fscb(--)、Fscb(+-)雄鼠精子密度、活率和各项运动参数与野生型均无明显差异。与野生型相比,杂合子和纯合子雄鼠精子与透明带完整卵细胞及无透明带卵细胞的结合和融合的能力均无差异。体内实验显示野生型、杂合子和纯合子雄鼠使雌鼠的受孕率和每胎雌鼠产仔数均无差异,表明敲除Fscb基因对雄性小鼠精子的运动功能及体内外受精能力均无明显影响,提示FSCB蛋白的独立缺失并不影响精子的功能,对于精子的运动和授精能力的维持,该蛋白并非不可或缺[6]。而近来针对CABYR的研究显示,Cabyr基因敲除后雄性小鼠表现出严重的生育能力低下,精子运动能力缺陷,双联微管的结构异常,纤维鞘明显紊乱,这表明纤维鞘对于轴丝的正确组装具有重要作用。而且,在纤维鞘的形成过程中,CABYR是雄性生殖所必需的蛋白[15]。基于本研究的前期发现,为进一步深入探讨FSCB和CABYR蛋白复合物在精子纤维鞘中的生理作用,以及该两种蛋白缺失可能对精子相关结构和功能造成的影响及其发生机制,本研究在构建Fscb单基因敲除小鼠的基础上,进一步进行了Cabyr基因的敲除,并构建了Fscb/Cabyr(--/--)双基因敲除小鼠。
基因敲除技术是体外研究基因功能的关键技术基础,是鉴定在男性生殖过程中某个基因是否必要的重要方法。为进一步探讨该两种蛋白的生理作用,前期本研究组已经建立了Fscb基因敲除小鼠模型,并对基因敲除后小鼠精子鞭毛的形态学及其授精功能的可能改变进行了研究,结果发现精子鞭毛形态学,精子的运动参数及授精能力均无明显改变。这一结果提示FSCB在精子中的功能可能并非不可取代。事实上,在生殖医学研究的起始阶段,很多基因在体内表达分析中被认为是生殖功能所必需的,但经基因敲除后相关研究后证实并非如此[16]。如蛋白酶、精子顶体酶曾被认为是在精子穿过透明带过程所必需的,后通过基因敲除小鼠研究证实缺乏这些蛋白的精子同样可以穿过透明带[17]。可见在精子发生和形成过程中,可能许多生理功能的完善存在某些代偿机制。为深入探讨FSCB与CABYR结合的复合物在精子中的生物学功能,本研究在前期已经获得Fscb单基因敲除小鼠模型的基础上,进一步采用CRISPR/Cas9系统及受精卵注射的方式成功建立两个能稳定遗传的Cabyr基因敲除小鼠模型品系,进而与前期建立的Fscb敲除小鼠模型[7]进行交叉繁育,最终获得Fscb/Cabyr(--/--)双基因敲除小鼠,为探讨FSCB蛋白及CABYR蛋白缺失后对小鼠精子的形态结构及功能的影响奠定了基础。
基于前期对CABYR蛋白、FSCB蛋白相关功能的研究,预期其复合物作为精子尾部纤维鞘的必要组成部分,在调节精子尾部韧性及活动能力等方面发挥重要作用,并且可能通过对精子Ca2+信号通路中通道蛋白CatSper的调控而发挥功能化调控作用。本研究后期将利用Fscb/Cabyr(--/--)双基因敲除小鼠,通过观察其精子形态学、运动参数、体内外授精功能的改变以及精子中钙离子浓度的改变,探讨FSCB及CABYR蛋白复合物在精子的功能及其作用中的可能机制。
| [1] |
LEHTI M S, SIRONEN A. Formation and function of the manchette and flagellum during spermatogenesis[J]. Reprod Camb Engl, 2016, 151(4): R43-R54. DOI:10.1530/REP-15-0310 |
| [2] |
EDDY E M, TOSHIMORI K, O'BRIEN D A. Fibrous sheath of mammalian spermatozoa[J]. Microsc Res Tech, 2003, 61(1): 103-115. DOI:10.1002/jemt.10320 |
| [3] |
KOLTHUR-SEETHARAM U, MARTIANOV I, DAVIDSON I. Specialization of the general transcriptional machinery in male germ cells[J]. Cell Cycle Georget Tex, 2008, 7(22): 3493-3498. DOI:10.4161/cc.7.22.6976 |
| [4] |
NAABY-HANSEN S, MANDAL A, WOLKOWICZ M J, et al. CABYR, a novel calcium-binding tyrosine phosphorylation-regulated fibrous sheath protein involved in capacitation[J]. Dev Biol, 2002, 242(2): 236-254. DOI:10.1006/dbio.2001.0527 |
| [5] |
LI Y F, HE W, JHA K N, et al. FSCB, a novel protein kinase A-phosphorylated calcium-binding protein, is a CABYR-binding partner involved in late steps of fibrous sheath biogenesis[J]. J Biol Chem, 2007, 282(47): 34104-34119. DOI:10.1074/jbc.M702238200 |
| [6] |
周庭友, 张勇, 张军, 等. FSCB基因敲除对雄性小鼠生殖功能的影响[J]. 第三军医大学学报, 2016, 38(15): 1729-1734. ZHOU T Y, ZHANG Y, ZHANG J, et al. Knockout of fibrous sheath CABYR-binding on reproductive function in male mice[J]. J Third Mil Med Univ, 2016, 38(15): 1729-1734. DOI:10.16016/j.1000-5404.201511059 |
| [7] |
周庭友, 孙中义, 张勇, 等. 鼠fscb基因靶向敲除载体的构建及动物模型的建立[J]. 第三军医大学学报, 2015, 37(15): 1527-1533. ZHOU T Y, SUN Z Y, ZHANG Y, et al. Construction of targeting vector and preparation of fibrous sheath CABYR-binding protein knockout mice using CRISPR/Cas9 system[J]. J Third Mil Med Univ, 2015, 37(15): 1527-1533. DOI:10.16016/j.1000-5404.201503197 |
| [8] |
LI Y F, HE W, MANDAL A, et al. CABYR binds to AKAP3 and Ropporin in the human sperm fibrous sheath[J]. Asian J Androl, 2011, 13(2): 266-274. DOI:10.1038/aja.2010.149 |
| [9] |
NAKAMURA N, DAI Q S, WILLIAMS J, et al. Disruption of a spermatogenic cell-specific mouse enolase 4 (Eno4) gene causes sperm structural defects and male infertility[J]. Biol Reprod, 2013, 88(4): 90-1-12. DOI:10.1095/biolreprod.112.107128 |
| [10] |
LI Y F, HE W, KIM Y H, et al. CABYR isoforms expressed in late steps of spermiogenesis bind with AKAPs and ropporin in mouse sperm fibrous sheath[J]. Reproductive Biol Endocrinol, 2010, 8(1): 1-19. DOI:10.1186/1477-7827-8-101 |
| [11] |
FIEDLER S E, DUDIKI T, VIJAYARAGHAVAN S, et al. Loss of R2D2 proteins ROPN1 and ROPN1L causes defects in murine sperm motility, phosphorylation, and fibrous sheath integrity[J]. Biol Reprod, 2013, 88(2): 41-1-10. DOI:10.1095/biolreprod.112.105262 |
| [12] |
BACCETTI B, COLLODEL G, ESTENOZ M, et al. Gene deletions in an infertile man with sperm fibrous sheath dysplasia[J]. Hum Reprod, 2005, 20(10): 2790-2794. DOI:10.1093/humrep/dei126 |
| [13] |
MIKI K, WILLIS W D, BROWN P R, et al. Targeted disruption of the Akap4 gene causes defects in sperm flagellum and motility[J]. Dev Biol, 2002, 248(2): 331-342. DOI:10.1006/dbio.2002.0728 |
| [14] |
LIU S L, NI B, WANG X W, et al. FSCB phosphorylation in mouse spermatozoa capacitation[J]. BMB Rep, 2011, 44(8): 541-546. DOI:10.5483/bmbrep.2011.44.8.541 |
| [15] |
YOUNG S A M, MIYATA H, SATOUH Y, et al. CABYR is essential for fibrous sheath integrity and progressive motility in mouse spermatozoa[J]. J Cell Sci, 2016, 129(23): 4379-4387. DOI:10.1242/jcs.193151 |
| [16] |
OKABE M. Mechanism of fertilization: a modern view[J]. Exp Animals, 2014, 63(4): 357-365. DOI:10.1538/expanim.63.357 |
| [17] |
BABA T, AZUMA S, KASHIWABARA S, et al. Sperm from mice carrying a targeted mutation of the acrosin gene can penetrate the oocyte zona Pellucida and effect fertilization[J]. J Biol Chem, 1994, 269(50): 31845-31849. |



