骨骼是高度血管化的器官,既往大量临床研究已证实在骨再生及修复过程中,骨的形成与血管生成密不可分。2014年,Ralf Adams团队首次发现骨组织的血管系统中存在一种特异性的血管亚型(H型),并证实机体成骨与H型血管数量呈正相关。H型血管和骨形成的关系研究逐渐成为骨生理学领域的热点问题[1]。在目前临床骨再生防治缺乏有效药物的困境下,以成骨-血管偶联的新视角探索兼具药物治疗功能的复合型材料体系,是未来促成骨治疗的主要方向之一。
本课题组前期开展了他汀类药物治疗股骨头缺血性坏死(ANFH)的初步探索,结果显示,普伐他汀全身给药不仅可促进成骨,还可改善ANFH大鼠内皮祖细胞功能障碍和自噬失调,促进血管新生[2]。他汀类药物口服给药生物利用度较低,要在骨组织中达到有效治疗浓度,需大幅提高给药剂量[3],这势必增加药物不良反应发生的风险,限制其临床应用。借助生物医学材料进行他汀类药物对骨组织的靶向递送成为一种理想的替代选择。聚醚醚酮(poly-ether-ether-ketone,PEEK)是临床广泛应用的骨组织植入材料,属于生物惰性材料,植入人体后的骨整合能力仍然亟待改善。课题组前期在此方面进行改性研究,通过水热-磺化法在PEEK表面构建三维网络结构,形成磺化聚醚醚酮(sulfonated-PEEK,SP),SP作为一种改良后的骨植入材料,具有良好的骨传导性和抗菌活性[4],其表面特殊的三维多孔结构非常适合作为药物吸附和转运的平台,可实现他汀类药物的有效装载和稳定缓释[5]。本研究选择磺化PEEK为负载平台,在SP表面负载辛伐他汀或普伐他汀,实现骨再生治疗目的,同时优化SP材料的成骨性能,并探索SP-他汀局部缓释系统促进骨再生的相关机制线索。
1 材料与方法 1.1 实验材料选取8周龄的C57雄性小鼠(上海南方模式生物科技股份有限公司),体质量为18~25 g。扫描电镜,型号为Hitachi S-3400N(Japan)。视频接触角仪,型号为SL200B。Micro Computed Tomography(micro-CT)成像仪,型号为SkyScan 1176,生产商为Bruker(USA)。Olympus荧光显微镜,型号为Ⅸ-71。
1.2 实验方法 1.2.1 样品制备使用浓硫酸对PEEK进行磺化,然后使用水热法除去残余在三维孔道结构中的含硫化合物。将磺化-水热处理的样品置于24孔板中,分别加入1 mL 0.16 mg/mL普伐他汀(Pra)、0.55 mg/mL辛伐他汀(Sim)、1.1 mg/mL Sim、2.2 mg/mL Sim,置于摇床上,24 h后取出样品,清洗晾干备用。
1.2.2 扫描电镜观察根据磺化PEEK材料上负载的上述药物及浓度的不同分为5组样品。在样品表面喷上铂金后,采用扫描电镜对样品的表面形貌进行观察。
1.2.3 水接触角检测将去离子水滴在材料表面的不同部位,测试3个数据,计算各部位的平均接触角。
1.2.4 骨损伤模型的建立及分组采用前期构建的磺化PEEK作为缓释载药平台,根据是否负载药物及给药浓度,实验分为5组,分别是SP组、SP-Pra 0.16 mg/mL组、SP-Sim 0.55 mg/mL组、SP-Sim 1.1 mg/mL组及SP-Sim 2.2 mg/mL组,每组各5只小鼠。各组小鼠腹腔注射戊巴比妥钠(0.1 mg/g体质量),麻醉后去除小鼠背毛,在脑中线处开口暴露颅骨,避开颅骨骨缝处,选择脑中线左侧颅骨部位,根据药物载体材料大小用水磨钻进行打磨,打磨强度一致,打磨时间4 min,打磨后将材料植入损伤处并固定,缝合皮肤。术后,小鼠分笼饲养,给予充足的水和食物,手术8周后取材。
1.2.5 Micro-CT检测使用micro-CT对小鼠颅骨样本进行检测,评估小鼠骨损伤处植入物周围的新骨再生情况。Micro-CT检测的具体参数为:电压65 kV,发射光使用1 mm铝过滤器过滤,分辨率为18 μm。使用NRecon软件(Skyscan Company,Bruker micro CT,German)对扫描后的二维和三维图像进行重构,使用DataViewer、CTAn及CTVol进行处理和分析。
1.2.6 H型血管检测将样本的切片于尼康倒置荧光显微镜下观察CD31+EMCN+双阳性H型血管图像(紫外激发波长330~380 nm,发射波长420 nm;FITC绿光激发波长465~495 nm,发射波长515~555 nm;CY3红光激发波长510~560 nm,发射波长590 nm)。
1.3 统计学方法采用GraphPad Prism 7统计软件进行数据分析,运用双因素方差分析(two-way analysis of the variance)和多重比较检验(Tukey’s multiple comparison tests),以P < 0.05认为有统计学差异。
2 结果 2.1 各组材料表面形貌的扫描电镜观察结果图 1为未负载药物的SP组及载药后各组材料扫描电镜图片。SP表面存在三维网络结构(图 1),有利于药物装载。将Pra和Sim负载到SP的三维孔道结构后的表面形貌与SP基本相同,并未改变其孔道结构(图 1)。
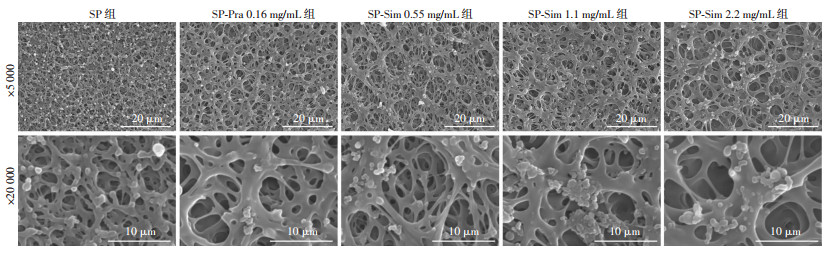
|
| 图 1 各组材料扫描电镜图 |
2.2 接触角分析结果
未负载药物的SP组与SP-Sim 0.55 mg/mL组、SP-Sim 1.1 mg/mL组及SP-Sim 2.2 mg/mL组相比较,水接触角未显示出明显差异,而SP-Pra 0.16 mg/mL组表面的水接触角,则明显小于SP组(图 2)。这可能与Pra的分子结构有关,该药含有较多羟基官能团。

|
| 1:SP组;2:SP-Pra 0.16 mg/mL组;3:SP-Sim 0.55 mg/mL组;4:SP-Sim 1.1 mg/mL组;5:SP-Sim 2.2 mg/mL组;a:P < 0.01,与SP-Pra 0.16 mg/mL组比较 图 2 各组材料表面水接触角分析 |
2.3 颅骨损伤模型的建立
小鼠颅骨暴露面积略大于药物载体材料(图 3A);使用水磨钻对颅骨进行打磨,建立骨损伤状态,但损伤并未穿透颅骨(图 3B);打磨后将材料植入损伤处,由于打磨部位有凹陷,同时使用组织凝胶进行固定,保证材料在实验过程中保持在骨损伤部位(图 3C);完成植入后对皮肤进行缝合(图 3D)。
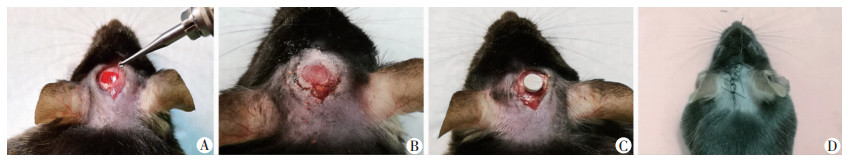
|
| A:颅骨的暴露并定位;B:颅骨打磨;C:材料植入并固定;D:皮肤缝合 图 3 建立小鼠颅骨损伤模型 |
2.4 损伤处骨再生情况
在对小鼠颅骨损伤处样本横断面的CT检测成像中(图 4A),我们发现小鼠新骨生长的厚度各组间存在差异(图 4B)。SP组小鼠再生新骨厚度最低,而负载他汀类药物的SP缓释系统组的小鼠新骨生长厚度均高于未负载药物的SP组小鼠,其中SP-Sim 1.1 mg/mL组及SP-Sim 0.55 mg/mL组小鼠新骨生长厚度显著高于其他组小鼠,SP-Sim 1.1 mg/mL组骨伤愈合情况最优。
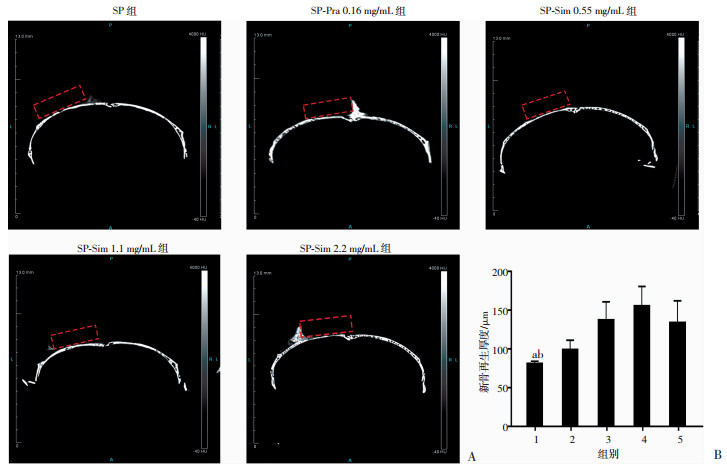
|
| A:各组小鼠颅骨损伤处新骨生长情况代表性图像;B:各组小鼠新骨生长厚度统计分析1:SP组;2:SP-Pra 0.16 mg/mL组;3:SP-Sim 5.5 mg/mL组;4:SP-Sim 1.1 mg/mL组;5:SP-Sim 2.2 mg/mL组;a:P < 0.01,与vs SP-Sim 1.1 mg/mL组比较;b:P < 0.05,与SP-Sim 0.55 mg/mL组比较 图 4 小鼠颅骨损伤处CT影像学表现及分析结果 |
2.5 新骨中成血管情况
在SP-Sim 1.1 mg/mL组材料植入后,对新骨生长的促进作用显著好于其他组,因此进一步分析SP-Sim 1.1 mg/mL组、SP-Pra 0.16 mg/mL组及SP组等3组小鼠植入材料周围颅骨血管生成情况。结果显示,SP-Pra 0.16 mg/mL组及SP组小鼠植入材料周围颅骨几乎没有新生血管长入,SP-Sim 1.1 mg/mL组可观察到CD31及EMCN双阳血管的表达(图 5)。

|
| 图 5 小鼠植入材料周围颅骨H型血管生长情况 |
3 讨论
骨骼系统疾病因其高发病率、高致残率和高致死率,成为影响国家经济社会发展的重大公共卫生问题。据统计,中国65岁以上骨质疏松人群中,约1/2的女性和1/5的男性存在骨折风险[6]。2018年骨科植入材料需求量突破200亿元,并以30%的年增长率持续增长。兼具药物治疗功能的新型植入材料是未来骨缺损治疗的发展方向,具有重要的社会、经济、科学意义。
聚醚醚酮(PEEK)作为一种半结晶性的高分子材料,具有与骨组织匹配的弹性模量、稳定的化学性质、射线可透过性和热稳定性等诸多优点,被广泛地应用到包括脊柱融合器、髋关节等硬组织植入领域。然而,PEEK属于生物惰性材料,长期临床使用中发现植入人体后骨整合能力较差,与周围组织结合不佳,植入体引发的骨折愈合不良和功能障碍仍是PEEK材料面临的一个难题[7-8]。另一方面,目前骨代谢疾病的治疗药物大多集中在抑制破骨细胞的功能和分化上,骨组织蓄积低,需要长期、甚至终生服药,全身毒副作用明显。为增强骨植入材料的临床修复效果,降低全身给药毒副反应,借助生物医学材料进行促成骨药物的靶向递送成为一种理想的替代选择。
他汀类药物属于3-羟基-3-甲基戊二酰辅酶A (HMG-CoA)还原酶抑制剂,可将羟甲基戊二酸单酰辅酶A转化为甲羟戊酸,有效抑制体内HMG-CoA还原酶及胆固醇的合成,临床广泛用于治疗原发性高胆固醇血症及冠心病。本课题组前期开展了他汀类药物治疗股骨头缺血性坏死(ANFH)的初步探索,结果显示,普伐他汀口服不仅可促进成骨,还可改善骨缺血大鼠的血管新生[2]。由于他汀类药物需大剂量口服才可达到骨组织治疗浓度,为实现药物在骨组织的有效蓄积,降低其全身毒副作用(肝损伤和肌溶解),我们进一步构建了新型他汀局部缓释系统[5]。本研究成功建立了小鼠颅骨损伤模型,并初步观察了磺化PEEK-他汀缓释系统的促成骨功能。研究结果显示SP-Sim 1.1 mg/mL缓释系统对损伤颅骨的促成骨作用显著优于未负载药物的SP组,并存在剂量相关性,这一结果与其他文献报道一致[9],可能与辛伐他汀的脂溶性特点及促血管生成作用有关。
研究显示,他汀类药物除降脂作用外,还具有多效血管保护作用,可抑制血小板聚集和血栓沉积,通过影响FMD、cfPWV、SLIT3等因子改善血管内皮功能[5, 10-11]。H型血管是骨组织血管系统中存在一种特异性的血管亚型,高水平表达内皮细胞黏附分子CD31和内皮粘蛋白EMCN[1],主要分布在长骨干垢端,在皮质骨中也有少量表达。在骨的生长、发育、重建及修复的过程中,H型血管不仅提供了基础的营养物质,还通过分泌各种细胞因子参与了成骨过程的重要调控。研究显示,H型血管的内皮细胞可分泌血小板衍生生长因子-BB(PDGF-BB)[12-13],通过影响成骨细胞的信号转导促进成骨作用[13];H型血管还能调控循环细胞促进基础物质的代谢,参与成骨细胞、破骨细胞和血管内皮细胞之间的相互作用,影响新骨生成和骨伤修复[14]。本研究通过对颅骨中CD31和EMCN荧光检测分析损伤骨中的H型血管情况。结果显示,SP-Sim 1.1 mg/mL组小鼠损伤颅骨中可见CD31和EMCN的双阳性表达,SP-Pra 0.16 mg/mL和SP组并未发现明显的H型血管,这与上述3组的骨再生情况相一致,也进一步提示我们他汀类药物的促成骨作用可能与其保护H型血管的功能有关,相关机制需进一步研究。
本研究初步证实了磺化PEEK-他汀缓释系统具有促成骨治疗作用,在实现骨再生治疗的同时可优化SP材料的成骨性能,辛伐他汀的成骨效果优于普伐他汀,机理可能与H型血管保护作用相关,相关机制将在后续工作中进一步阐明。磺化PEEK-他汀的缓释系统将为临床他汀类药物用于骨骼系统疾病的治疗提供新的潜在策略。
| [1] |
KUSUMBE A P, RAMASAMY S K, ADAMS R H. Coupling of angiogenesis and osteogenesis by a specific vessel subtype in bone[J]. Nature, 2014, 507(7492): 323-328. DOI:10.1038/nature13145 |
| [2] |
LIAO Y, ZHANG P, YUAN B, et al. Pravastatin protects against avascular necrosis of femoral head via autophagy[J]. Front Physiol, 2018, 9: 307. DOI:10.3389/fphys.2018.00307 |
| [3] |
PAPADIMITRIOU K, KARKAVELAS G, VOUROS I, et al. Effects of local application of simvastatin on bone regeneration in femoral bone defects in rabbit[J]. J Cranio-Maxillo-Facial Surg, 2015, 43(2): 232-237. DOI:10.1016/j.jcms.2014.11.011 |
| [4] |
OUYANG L P, ZHAO Y C, JIN G D, et al. Influence of sulfur content on bone formation and antibacterial ability of sulfonated PEEK[J]. Biomaterials, 2016, 83: 115-126. DOI:10.1016/j.biomaterials.2016.01.017 |
| [5] |
LIAO Y, OUYANG L P, CI L, et al. Pravastatin regulates host foreign-body reaction to polyetheretherketone implants via miR-29ab1-mediated SLIT3 upregulation[J]. Biomaterials, 2019, 203: 12-22. DOI:10.1016/j.biomaterials.2019.02.027 |
| [6] |
SI L, WINZENBERG T M, JIANG Q, et al. Projection of osteoporosis-related fractures and costs in China: 2010-2050[J]. Osteoporosis Int, 2015, 26: 1929-1937. DOI:10.1007/s00198-015-3093-2 |
| [7] |
PANAYOTOV I V, ORTI V, CUISINIER F, et al. Polyetheretherketone (PEEK) for medical applications[J]. J Mater Sci: Mater Med, 2016, 27(7): 1-11. DOI:10.1007/s10856-016-5731-4 |
| [8] |
NAJEEB S, ZAFAR M S, KHURSHID Z, et al. Applications of polyetheretherketone (PEEK) in oral implantology and prosthodontics[J]. J Prosthodont Res, 2016, 60(1): 12-19. DOI:10.1016/j.jpor.2015.10.001 |
| [9] |
MOSHIRI A, SHAHREZAEE M, SHEKARCHI B, et al. Three-dimensional porous gelapin-simvastatin scaffolds promoted bone defect healing in rabbits[J]. Calcif Tissue Int, 2015, 96(6): 552-564. DOI:10.1007/s00223-015-9981-9 |
| [10] |
LIU A M, WU Q H, GUO J C, et al. Statins: Adverse reactions, oxidative stress and metabolic interactions[J]. Pharmacol Ther, 2019, 195: 54-84. DOI:10.1016/j.pharmthera.2018.10.004 |
| [11] |
CHIANG K H, CHENG W L, SHIH C M, et al. Statins, HMG-CoA reductase inhibitors, improve neovascularization by increasing the expression density of CXCR4 in endothelial progenitor cells[J]. PLoS ONE, 2015, 10(8): e0136405. DOI:10.1371/journal.pone.0136405 |
| [12] |
DA BANDEIRA D S, CASAMITJANA J, CRISAN M. Pericytes, integral components of adult hematopoietic stem cell niches[J]. Pharmacol Ther, 2017, 171: 104-113. DOI:10.1016/j.pharmthera.2016.11.006 |
| [13] |
TSAI H C, TZENG H E, HUANG C Y, et al. WISP-1 positively regulates angiogenesis by controlling VEGF-A expression in human osteosarcoma[J]. Cell Death Dis, 2017, 8(4): e2750. DOI:10.1038/cddis.2016.421 |
| [14] |
WANG J M, GAO Y, CHENG P Z, et al. CD31hiEmcnhi vessels support new trabecular bone formation at the frontier growth area in the bone defect repair process[J]. Sci Rep, 2017, 7: 4990. DOI:10.1038/s41598-017-04150-5 |



