2. 610083 成都,西部战区总医院心血管内科;
3. 400042 重庆,陆军军医大学(第三军医大学)大坪医院心血管内科
2. Department of Cardiology, General Hospital of Western Theater Command, Chengdu, Sichuan Province, 610083;
3. Department of Cardiology, Daping Hospital, Army Medical University (Third Military Medical University), Chongqing, 400042, China
《中国高血压防治指南(2018年修订版)》指出我国高血压的患病率仍呈升高趋势,中国高血压调查最新数据显示2012-2015中国成人高血压患病粗率为27.9[1]。早在1963年,BORST和BORST-DE GEUS就提出高血压是由于肾脏相对钠排泄减少引起的[2], GUYTON等[3]进一步指出血压的长期控制取决于肾脏钠排泄功能对体内钠含量的调控。且在遗传性高血压中,发现肾脏钠排泄缺陷是高血压发病机制的核心[4]。而肾近端小管上皮细胞是负责尿钠吸收的重要部位,钠重吸收是由钠-钾-ATP酶直接或间接驱动[5],钠-钾-ATP酶的活性受多种因子和通路的调节。研究显示钠-钾-ATP酶与Wnt/β-catenin信号之间存在密切联系[6],Wnt/β-catenin通路激活可增强钠-钾-ATP酶活性[7-8]。DKK1是Wnt/β-catenin信号通路的典型抑制剂,能与Wnt竞争性结合低密度脂蛋白相关蛋白5和6(LRP5/6),使GSK3β去磷酸化,从而阻止β-catenin细胞内积累,抑制Wnt/β-catenin信号通路。DKK1是一种低分子量可溶性分泌蛋白,表达于成骨细胞、骨细胞、皮肤、前列腺、胎盘、内皮细胞和肾脏组织等[9-10]。以往研究表明DKK1作为Wnt/β-catenin信号通路的典型抑制剂参与了多种疾病的发病机制[9]。DKK1是否也能通过Wnt/β-catenin信号通路调节肾小管上皮细胞的钠-钾-ATP酶活性而影响尿钠排泄?是一个值得研究的课题。因此,本研究探讨DKK1在高血压状态时以β-catenin依赖性方式调节肾小管上皮细胞的钠-钾-ATP酶活性影响尿钠排泄,并在血压调节中发挥作用, 为临床高血压的控制提供新的思路。
1 材料与方法 1.1 主要器材及试剂器材包括:无创鼠尾测压仪(北京softron公司),大鼠代谢笼(江苏赛昂斯公司),尿液分析仪(南京普郎医疗公司),手术器械盒、微量注射泵(浙江史密斯公司)。试剂包括:BCA蛋白浓度检测试剂盒(碧云天公司);超微量钠-钾-ATP酶检测试剂盒A070-2(南京建成生物技术公司),重组DKK1蛋白(recombinant human DKK1,rhDKK1;美国R & D Systems, Minneapolis, MN),兔抗DKK1抗体(英国abcam公司),兔抗β-catenin抗体(美国Cell Signaling Technology),鼠抗α-Tubulin抗体(中国,Proteintech Group),DKK1小干扰RNA(锐博生物),BIO(GSK3β Inhibitor XIX,美国Merck公司,是特异性GSK3β抑制剂,对GSK3β的IC50= 53 nmol/L,稳定β-catenin防止其磷酸化降解),ICRT 14 (美国Abmole,ICRT 14是β-catenin反应性转录的有效抑制剂,在Wnt途径活性测定中,IC50=40.3 nmol/L,直接影响核β-catenin与TCF4之间的相互作用)。DKK1定量PCR引物(正向序列:5′-GGATTCATGCTGGGATGCTG-3′;反向序列5′-AGGCCTTGTCACATGATCCA-3′),GAPDH定量PCR引物(正向序列:5′- AGGCCCCTCCTGTTGTTATG-3′:反向序列:5′-GGACCTCATGGCCTACATGG-3′),引物均由广东锐博生物合成。
1.2 动物实验 1.2.1 实验动物及处理8~10周龄雄性正常血压大鼠(Wistar-Kyoto,WKY)、雄性原发性高血压大鼠(spontaneously hypertensive rats,SHR)来自北京Vital River实验动物技术公司。2.5%戊巴比妥麻醉后,剔除脖颈处鼠毛,用皮肤剪横向剪开皮肤,约2 cm长,放入已注入配制好的重组DKK1蛋白溶液[6 ng/(g·d)]的微泵,缝合皮肤,待大鼠醒后放回笼中。时间2周,在埋泵前用无创鼠尾测压仪测量1次血压,记为0周。
1.2.2 无创鼠尾血压测量及24 h尿钠分析分别在埋泵后1、2周测量血压和收集尿液。采用无创鼠尾测血压前,在安静环境下于40 ℃条件预热大鼠10 min;每只大鼠至少测量5次血压,两次测量至少间隔2 min, 取平均值为最终血压。将大鼠放入代谢笼,1只/笼,在标准饲养环境下保证自由饮水和进食适应1 d;在代谢笼开口内侧贴一薄层纱布过滤粪便,下方接50 mL离心管收集尿液;24 h后收集离心管和尿液,并称量离心管;利用收集尿液前后离心管重量差值计算24 h尿量,尿液分析仪检测钠浓度计算24 h尿钠排泄情况,并用体质量校正。
1.2.3 组织免疫荧光染色肾组织标本包埋浸蜡后置于冰上使其凝固。用切片机切为4 μm厚的组织切片,烘干备用。组织切片脱蜡水化后进行抗原修复。风干后抗原封闭30 min,一抗孵育过夜(DKK1抗体1 :50)。PBS冲洗后用二抗(1 :200稀释)室温避光孵育1 h。DAPI染色液避光室温下孵育5 min,PBS冲洗后封片剂,采用荧光显微镜观察。
1.3 细胞处理 1.3.1 细胞培养大鼠肾近端小管上皮细胞株(WKY-RPT细胞株、SHR-RPT细胞株均来自美国Georgetown Washington大学Dr. Pedro A. Jose实验室[25]),细胞培养采用10%胎牛血清DMEM/F-12培养基并放在37 ℃且含5%CO2的细胞培养箱中培养。采用siDKK1、重组蛋白DKK1(400 ng/mL)、BIO(5 μmol/L)、ICRT 14(10-3 mmol/mL)处理细胞,用于进行钠-钾-ATP酶活性检测或供提取蛋白以进行下一步实验。
1.3.2 siRNA干扰实验取无菌1.5 mL EP管加入500 μL的Opti-MEM培养基、60 nmol siRNA,室温放置5 min。取另一离心管中加入相应量的脂质体LipofectamineTM2000稀释在Opti-MEM培养基中室温放置5 min。混合以上含有siRNA和LipofectamineTM2000的培养基室温孵育15 min。混合液加入细胞密度约80%的细胞培养皿中,37 ℃、5%CO2细胞培养箱中培养6 h后, 换新鲜培养基,孵育48~72 h。其中转染无关siRNA的细胞为WKY组和SHR组,转染靶向DKK1的siRNA细胞分组为WKY+siDKK1组和SHR+siDKK1组,转染靶向DKK1的siRNA细胞和加入ICRT 14组为SHR+siDKK1+ICRT 14组。
1.3.3 重组DKK1蛋白干预细胞将WKY-RPT和SHR-RPT细胞前1 d传代至6孔板,待细胞密度为60%~70%,培养基中加入重组DKK1蛋白至浓度为400 ng/mL,37 ℃、5%C02细胞培养箱中培养72 h。其中空白对照组为WKY组和SHR组,加入DKK1蛋白组为WKY+DKK1和SHR+DKK1,同时加入DKK1蛋白和BIO组为SHR+DKK1+BIO组。
1.4 细胞及组织钠-钾-ATP酶活性检测 1.4.1 细胞匀浆制备将已完成预处理的6孔板中的培养基弃去,加入1 mL预冷的生理盐水并冲洗3次之后,在各孔中加入1 mL预冷的生理盐水冰上操作,刮脱细胞转移至1.5 mL离心管中。4 ℃离心3 000 r/min×5 min,再清洗3次。弃上清加入约500 μL的低渗缓冲液(Tris HCl 10 mmol/L;EDTA 1 mmol/L pH=7.5),混匀,放置冰上使细胞充分裂解5 min, 4 ℃离心,15 000 r/min×6 min,在制备好的细胞匀浆中加入250~350 mL的4 ℃生理盐水,使细胞膜蛋白浓度达到约1 mg/mL。
1.4.2 肾组织匀浆制备大鼠腹腔注射戊巴比妥钠, 取腰部切口切开皮肤和肌肉, 迅速取出肾脏放入盛有生理盐水的培养皿中,在体视显微镜下除去包膜,取适量(0.1~0.2 g)肾皮质,在冰冷的生理盐水中漂洗除去血液,滤纸拭干准确称量,放入5 mL的匀浆管中。按质量(g) :体积(mL)=1 :9的比例加入9倍体积的生理盐水于匀浆管中,冰水浴条件下, 用眼科小剪尽快剪碎组织块。匀浆管将下端插入盛有冰水混合物的器皿中,将捣杆垂直插入套管中,上下转动研磨数至充分研碎,制成10%的匀浆液。4 ℃,3 000 r/min离心10 min,取上清再用生理盐水按1 :9稀释成1%组织匀浆。
1.4.3 钠-钾-ATP酶活性检测超微量钠-钾-ATP酶检测试剂盒检测钠-钾-ATP酶活性,根据说明书操作步骤先进行酶促反应,所得溶液按3 500 r/min离心10 min,取上清液进行定磷,在636 nm处测各管光密度值D(636),BCA法测定蛋白浓度。规定每小时每毫克组织蛋白的组织中ATP酶分解ATP产生1 μmol无机磷的量为1个ATP酶活力单位,即微摩尔磷/mg蛋白/h[μmol/(mg·h)]。计算公式:ATPase活力(U/mg)=[测定D(636)-对照D(636)]÷[标准D(636)-空白D(636)]×标准品浓度(0.02 μmol/mL)×6 ×7.8÷待测样本蛋白浓度(mg/mL)。
1.5 总RNA的提取和RT-PCR检测用TRIzol试剂盒提取RNA,核酸检测仪(Nanodrop2000)测光密度值。配置逆转录反应液:10 μL的RT混合液,4 μL的5×PrimeScript Buffer,0.5 μL的RNase Inhibitor (40 U/μL),1 μL的PrimeScript RNAase(200 U/μL),4.5 μL的无酶水,在PCR仪上进行逆转录反应:30 ℃(10 min),42 ℃(30 min),95 ℃(5 min),4 ℃保存。100 μL无酶离心管中配制RT-PCR反应液(20 μL体系):DEPC水7 μL,cDNA 1 μL,引物各1 μL,SYBR 10 μL。在12×8 PCR反应管中加入上述混合液,各样本做3个复孔,以排除上样及系统误差。反应条件如下:PCR起始激活阶段95 ℃,3 min;三步循环反应:退火延长为39个循环:变性95 ℃,10 s;退火62 ℃,30 s;延长72 ℃,30 s;Bio-Rad系统软件自动获取Ct值并进行分析。
1.6 蛋白提取及免疫印迹法检测DKK1和β-catenin的表达按蛋白提取试剂盒(碧云天)说明进行操作,提取WKY和SHR大鼠肾脏组织蛋白和细胞蛋白,BCA法测定蛋白浓度,加入上样缓冲液,100 ℃煮5 min。10%SDS-PAGE电泳后转移至NC膜(Bio-Rad公司,美国),再用5%脱脂牛奶封闭1h,分布孵育相应的一抗(DKK1 1 :500,β-catenin 1 :500,α-Tubulin 1 :500),4 ℃条件下,孵育过夜。次日取出膜复温后回收一抗,加入相应二抗(羊抗兔1 :1 000)避光室温孵育1 h,TBST冲洗后使用荧光扫描仪对膜进行扫描,应用Image J软件定量分析。
1.7 统计学分析采用SPSS 22.0统计软件,数据以x±s或百分表示,两组间比较采用t检验, 组内使用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 WKY和SHR大鼠肾脏中DKK1的表达Western blot和免疫荧光检测结果显示:SHR大鼠肾脏中DKK1表达低于WKY大鼠(P < 0.05,图 1)。而Western blot检测结果显示:SHR大鼠肾脏中β-catenin表达高于WKY大鼠(P < 0.05,图 2)。
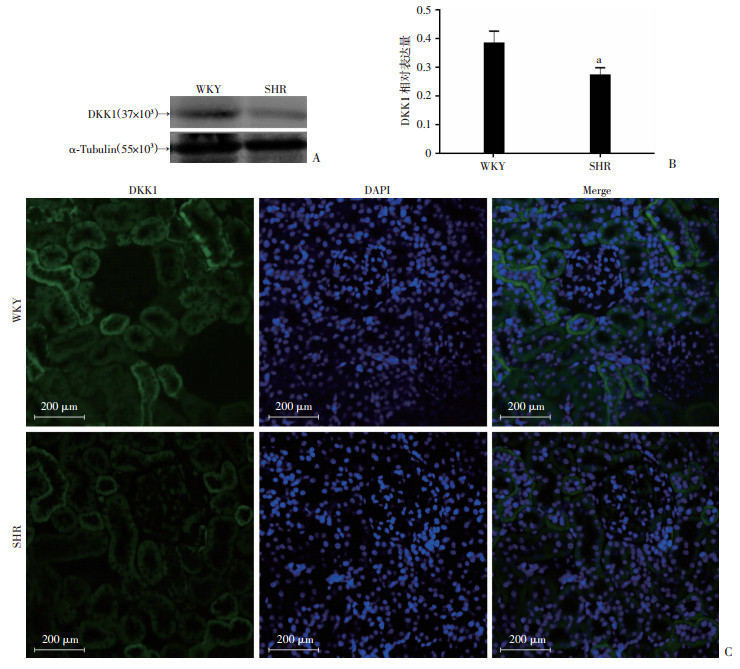
|
| A:Western blot检测结果;B:半定量分析a:P < 0.05, 与WKY大鼠比较;C:免疫荧光检测DKK1表达 图 1 Western blot和免疫荧光检测SHR和WKY大鼠肾脏中DKK1的表达 |
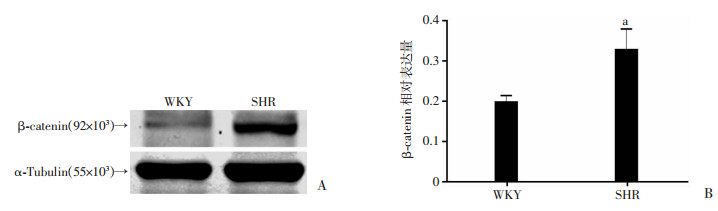
|
| A:Western blot检测结果;B:半定量分析 a:P < 0.05, 与WKY组比较 图 2 Western blot检测SHR和WKY大鼠肾脏中β-catenin表达 |
2.2 DKK1对SHR大鼠尿钠排泄及血压的影响
给予WKY和SHR大鼠外源性重组DKK1蛋白2周后,与WKY大鼠相比,SHR大鼠收缩压降低(图 3A)、尿量增多(图 3B)、尿钠排泄增多(图 3C)。WKY组与WKY+DKK1组间比较,尿钠虽有上升趋势,但差异无统计学意义(图 3C),收缩压和尿量差异无统计学意义(图 3A、B)。同时使用超微量Na+-K+-ATP酶检测试剂盒检测发现肾皮质钠-钾-ATP酶活性降低(图 3D)。
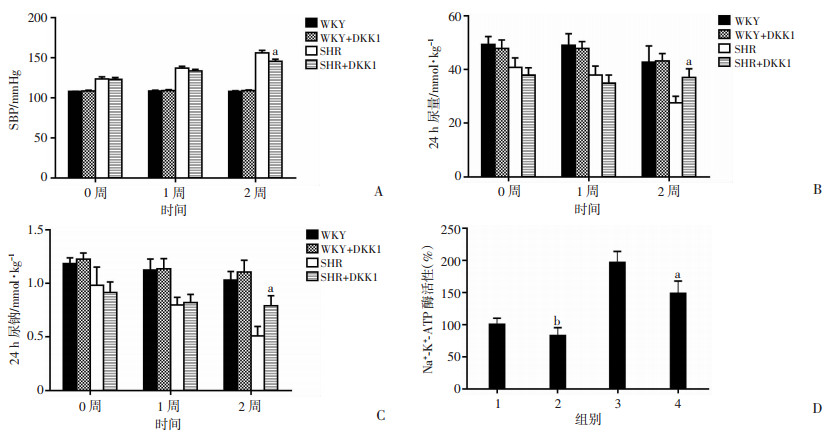
|
|
1:WKY;2:WKY+DKK1;3:SHR;4:SHR+DKK1; a:P < 0.05, 与SHR比较;b:P < 0.05, 与WKY比较 A:收缩压(SBP);B:24 h尿量;C:24 h尿钠;D:WKY和SHR大鼠肾组织钠-钾-ATP酶活性 图 3 DKK1对SHR大鼠收缩压、尿钠、尿量及肾钠-钾-ATP酶活性的影响 |
2.3 外源性DKK1蛋白对钠-钾-ATP酶活性的影响
Western blot显示SHR-RPT细胞DKK1表达低于WKY-RPT细胞(图 4A、B)。在WKY-RPT和SHR-RPT细胞培养基中加入重组DKK1蛋白(400 ng/mL),发现钠-钾-ATP酶活性明显降低(图 4C)。
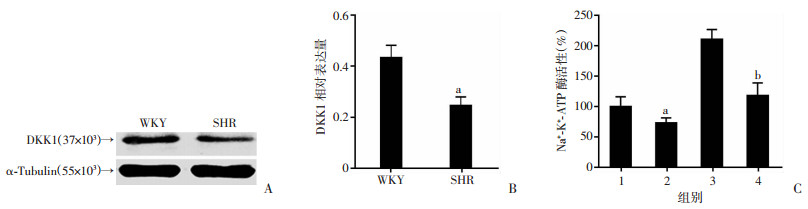
|
|
1:WKY;2:WKY+DKK1;3:SHR;4:SHR+DKK1;a:P < 0.05,与WKY比较;b:P < 0.05,与SHR比较 A:Western blot检测WKY-RPT和SHR-RPT细胞DKK1表达;B:半定量分析;C:WKY-RPT和SHR-RPT细胞加入重组DKK1蛋白后钠-钾-ATP酶活性 图 4 DKK1蛋白对各组大鼠钠-钾-ATP酶活性的影响 |
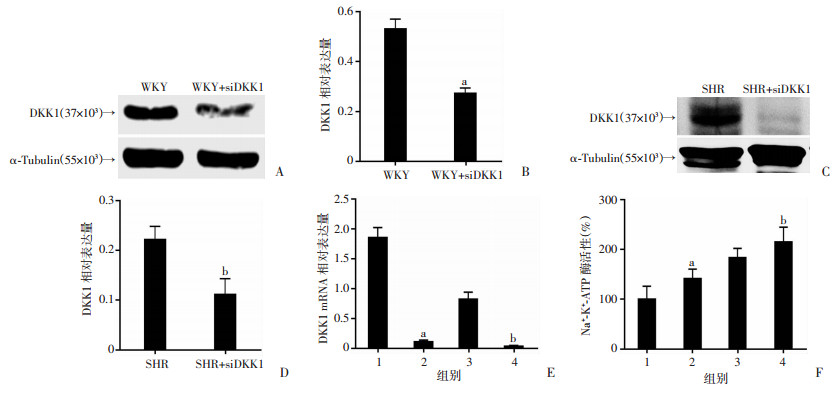
2.4 降低DKK1表达对钠-钾-ATP酶活性的影响
Western blot和RT-PCR检测显示:siDKK1干预细胞后,DKK1表达下降(图 5A~E), 检测钠-钾-ATP酶活性发现siDKK1干预后钠-钾-ATP酶活性升高(图 5F)。
|
|
1:WKY;2:WKY+siDKK1;3:SHR;4:SHR+siDKK1; a:P < 0.05, 与WKY比较;b:P < 0.05, 与SHR比较 A~D:Western blot检测WKY(A、B)和SHR(C、D)大鼠siDKK1干扰效率;E:RT-PCR检测siDKK1干扰效率;F:超微量Na+-K+-ATP酶检测试剂盒检测siDKK1干扰后细胞钠-钾-ATP酶活性 图 5 降低DKK1表达对钠-钾-ATP酶活性的影响 |
2.5 DKK1通过β-catenin调节钠-钾-ATP酶活性
在SHR-RTP细胞观察到β-catenin表达高于WKY-RPT细胞(图 6A、B)。SHR-RPT细胞外源性增加DKK1蛋白后,SHR-RPT细胞β-catenin表达减少(图 6C、D,即抑制了Wnt/β-catenin信号通路),前面已证明SHR-RPT细胞外源加入DKK1蛋白能降低钠-钾-ATP酶活性,加入BIO抑制GSK3β(即激活Wnt/β-catenin信号)发现逆转DKK1蛋白引起的钠-钾-ATP酶活性降低的现象(图 6E)。DKK1可能是通过抑制Wnt/β-catenin信号通路降低钠-钾-ATP酶活性。

|
|
1:WKY;2:SHR;3:SHR+DKK1;4:SHR+DKK1+BIO; a:P < 0.05, 与WKY比较;b:P < 0.05, 与SHR比较;c:P < 0.05, 与SHR+DKK1比较 A、B:Western blot检测WKY-RPT和SHR-RPT细胞β-catenin表达;C、D:Western blot检测SHR-RPT细胞外源加入重组DKK1蛋白后β-catenin表达;E:检测SHR-RPT细胞分别加DKK1和DKK1+BIO后钠-钾-ATP酶活性;BIO:GSK3β特异性抑制剂 图 6 DKK1通过β-catenin调节钠-钾-ATP酶活性 |
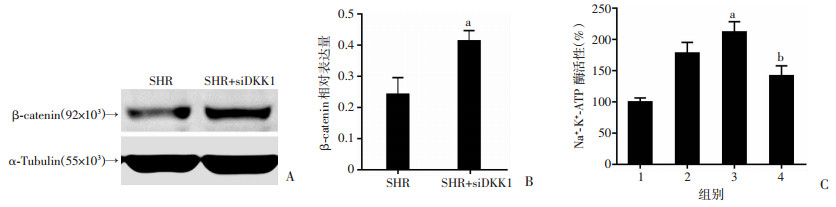
2.6 DKK1通过Wnt/β-catenin核转录信号调节钠-钾-ATP酶活性
已证明DKK1调节β-catenin从而影响钠-钾-ATP酶活性,为进一步明确DKK1通过Wnt/β-catenin信号传导通路调节钠-钾-ATP酶活性,在siDKK1引起β-catenin表达升高(图 7A、B)、钠-钾-ATP酶活性增加(图 5F)的情况下,观察抑制β-catenin核信号转录后对钠-钾-ATP酶活性的影响。结果显示:SHR-RPT细胞内β-catenin核转录抑制剂ICRT 14逆转了siDKK1引起的钠-钾-ATP酶活性升高的现象(图 7C)。提示DKK1通过抑制β-catenin核信号转录,降低钠-钾-ATP酶活性。
|
|
1:WKY;2:SHR;3:SHR+siDKK1;4;SHR+siDKK1+ICRT 14;a:P < 0.05, 与SHR比较;b:P < 0.05, 与SHR+siDKK1比较 A、B:Western blot检测SHR-RPT细胞加入siDKK1后β-catenin表达;C:SHR-RPT细胞分别加入siDKK1和siDKK1+ICRT 14后钠-钾-ATP酶活性;ICRT 14:β-catenin核信号转录抑制剂 图 7 DKK1调节β-catenin核转录影响钠-钾-ATP酶活性 |
3 讨论
以往研究表明Wnt/β-catenin在高血压各相关疾病如心脏、血管重构、肾脏损伤等方面发挥重要调节作用,因此,Wnt/β-catenin已被认为是高血压发生、发展的重要调节通路[11]。众所周知,DKK1是Wnt/β-catenin的重要抑制剂,通过该通路参与了多种疾病的发生发展[9]。且以往研究表明在心血管相关疾病如冠心病、糖尿病心血管损害、肾病的患者血清或组织中DKK1蛋白水平显著改变[12-14]。因此,我们猜想DKK1在高血压中是否也通过Wnt/β-catenin通路参与了血压的调节。肾脏作为血压长期调节的重要调节器官,要求其必须根据Na+摄入量的变化而做出快速反应,以防止钠水潴留导致血压升高。临床和实验观察均有力支持了肾脏在长期血压调节中的核心地位,并且发现各种形式的慢性高血压均对肾脏产生损害,出现肾脏尿钠排泄异常[15]。多项研究表明肾脏在受到各种各样的伤害刺激后可激活Wnt/β-catenin信号通路[16-18],包括高血压对肾脏的刺激作用,研究显示血管紧张素Ⅱ引起的高血压中Wnt/β-catenin信号被激活,并引起肾功能障碍,抑制Wnt/β-catenin后降低了高血压引起的蛋白尿、血清肌酐和尿素氮水平,且血压下降[18],说明Wnt/β-catenin信号通路是高血压与肾脏密切联系的纽带之一。肾脏对血压的调节主要取决肾小管上皮细胞对Na+重吸收强度,而这一过程由钠-钾-ATP酶调控。已发现Wnt/β-catenin信号与钠-钾-ATP酶之间可以相互调节[6-8, 19],目前Wnt/β-catenin信号通路仍是DKK1发挥作用的主要通路,但DKK1对钠-钾-ATP酶是否存在调节作用尚不清楚。
临床研究显示非肥胖高血压患者血清DKK1水平较血压正常者低[20],血清较低的DKK1水平可能与高血压相关。动物研究发现SHR大鼠体内Wnt/β-catenin被激活,并且出现心肌细胞内DKK1表达水平下降[21]。综上,我们使用SHR大鼠,观察DKK1是否在SHR大鼠肾脏中表达也发生改变,且是否能影响肾尿钠排泄功能和血压。结果显示:SHR大鼠肾脏DKK1表达较WKY大鼠降低,而β-catenin趋势相反。证明SHR大鼠肾脏内Wnt/β-catenin信号活性增强。随后外源性加入重组人DKK1蛋白,观察到是否对尿钠和血压有影响,结果发现:SHR大鼠泵入DKK1后与对照组相比,尿钠和尿量有较明显升高,且血压下降,
正常情况下,Wnt/β-catenin未被激活时,β-catenin如果不与细胞膜上钙粘蛋白(Cadherin)结合形成细胞间连接的组成部分,则会被激酶糖原合成酶激酶3β(GSK3β)组成的复合物磷酸化从而降解。当Wnt蛋白与细胞膜受体结合激活信号通路后促进GSK3β磷酸化失活,β-catenin得以在细胞质中积累,继而入核后参与转录调节。Wnt/β-catenin通路能调节钠-钾-ATP酶活性与β-catenin密切相关。β-catenin作为Wnt/β-catenin信号传导的关键因子,近几年研究表明β-catenin可能从两方面调节钠-钾-ATP酶活性:一是经Wnt/β-catenin通路,入核后与TCF/LEFl转录因子相互作用调节靶基因的转录,如研究表明在角膜内皮细胞中激活Wnt/β-catenin增加了其钠-钾-ATP酶活性[22];二是直接作用,如研究发现β-catenin在非洲爪蟾卵母细胞中至少部分独立于SGLT1直接与钠-钾-ATP酶相互作用[23]。另外,在大鼠肾近端小管上皮中β-catenin与Catherine共定位,当β-catenin/Catherine复合物的完整性被破坏后,引起钠-钾-ATP酶细胞膜上的重新分布[16],但该文章未明确指出β-catenin是直接还是间接调节钠-钾-ATP酶。因为β-catenin/Catherine复合物解离通常会导致β-catenin核信号传导的激活[19, 24],因此β-catenin/Catherine复合物解离后,对肾小管上皮细胞钠-钾-ATP酶的影响可能是直接作用,也可能是解离后的β-catenin进入细胞核通过转录调控调节钠-钾-ATP酶。因为DKK1是Wnt/β-catenin信号通路的重要抑制剂,所以我们本研究更倾向于转录调节对钠-钾-ATP酶的影响。因此,我们提出了这样一个假设:DKK1在Wnt信号传导中以β-catenin依赖性方式调节肾小管上皮细胞的钠-钾-ATP酶活性。
前面实验结果已显示SHR大鼠肾脏中DKK1表达下降而β-catenin水平增高。为验证以上假设,我们在SHR-RPT细胞培养基中外源加入重组人DKK1蛋白,发现β-catenin下降及钠-钾-ATP酶活性降低,加入BIO(GSK3β抑制剂)激活β-catenin信号转录后,发现钠-钾-ATP酶活性下降,表明DKK1能降低钠-钾-ATP酶活性,且可能通过Wnt/β-catenin介导。为表明确实DKK1改变能引起Wnt/β-catenin改变而影响钠-钾-ATP酶活性,在SHR-RPT细胞中降低DKK1的表达,观察到β-catenin增多(即Wnt/β-catenin激活)和钠-钾-ATP酶活性升高,且在SHR-RPT细胞降低DKK1表达的情况下加入ICRT14,抑制β-catenin核信号转录,逆转了之前降低DKK1后钠-钾-ATP酶活性升高的现象。表明DKK1调节β-catenin核信号从而影响钠-钾-ATP酶活性,也说明DKK1对血压的调节作用至少部分归功于其对肾脏尿钠排泄功能的调节。此外,因为钠-钾-ATP酶活性是细胞极性的前提[18],且膜上β-catenin与Wnt/β-catenin通路之间可以相互调节[19, 22],所以DKK1/Wnt/β-catenin降低钠-钾-ATP酶活性时可能会引起β-catenin/Catherine复合物解离,改变RPT细胞膜钠-钾-ATP酶分布,进一步破坏细胞极性和钠-钾-ATP酶功能,导致细胞不能泵出多余的钠离子,从而影响RPT细胞内环境稳态,导致细胞损伤。研究表明Wnt/β-catenin在急性肾损伤中可根据时间不同,可呈现出相反的结果[18]。考虑到DKK1与Wnt/β-catenin信号的紧密关系,因此,高血压中DKK1是否也可能根据作用时间不同对RPT细胞功能促进或抑制?而自发性高血压较低的DKK1水平是否是有利于机体在长期的高血压病程中缓解靶器官损伤的进程?这些都需要更加系统的研究和更长的实验周期来证明。除此之外,实验中发现WKY-RPT细胞在加入重组DKK1蛋白后钠-钾-ATP酶活性降低,而WKY大鼠却无显著变化,可能由于正常机体内DKK1稳态发生改变时,肾脏自身或与各器官系统相互调节,维持肾脏功能处于相对正常状态,即使短期内钠-钾-ATP酶活性发生改变可能也无较明显的肾功能障碍表现,而在细胞实验中WKY-RPT细胞无其他外援,所以钠-钾-ATP酶活性有较明显改变,WKY肾皮质钠-钾-ATP酶活性升高,也说明这种可能性。
本研究存在局限性, 如实验周期较短,SHR组与SHR+DKK1组血压差异不悬殊, WKY组与WKY+DKK1组相比虽无差异,但24 h尿钠有升高趋势,也许更长期的实验周期可获得更明显的改变。此外还有一种可能,因为DKK1表达紊乱后涉及多系统及器官的Wnt/β-catenin信号传导的改变,且在不同器官系统中可能发挥不同功能,产生相反的调节效应。如在心肌细胞阻断Wnt信号通路后可抑制心肌细胞纤维化,而在血管系统中较高的DKK1可促进血管钙化。所以体内DKK1稳态改变对血压的调节可能是一个多系统参与的复杂的过程。最后,血压改变情况是综合调节后的结果,具体机制如何还需要进一步更加系统和完善的研究来证明。
综上所述,本研究结果提示:在自发性高血压大鼠中DKK1至少部分通过Wnt/β-catenin信号通路抑制肾小管钠-钾-ATP酶活性,增加尿钠排泄,从而降低血压。
| [1] |
刘力生. 中国高血压防治指南(2018年修订版)[J]. 中国心血管杂志, 2019, 24(1): 24-56. LIU L S. 2018 Chinese guidelines for the management of hypertension[J]. Chin J Cardiovas Med, 2019, 24(01): 24-56. |
| [2] |
BORST J G, BORST-DE GEUS A. Hypertension explained by Starling's theory of circulatory homoeostasis[J]. Lancet, 1963, 1(7283): 677-682. DOI:10.1016/s0140-6736(63)91443-0 |
| [3] |
GUYTON A C, COLEMAN T G, COWLEY A V Jr, et al. Arterial pressure regulation. Overriding dominance of the kidneys in long-term regulation and in hypertension[J]. Am J Med, 1972, 52(5): 584-594. DOI:10.1016/0002-9343(72)90050-2 |
| [4] |
JOHNSON R J, LANASPA M A, GABRIELA SÁNCHEZ-LOZADA L, et al. The discovery of hypertension: evolving views on the role of the kidneys, and current hot topics[J]. Am J Physiol Renal Physiol, 2015, 308(3): F167-F178. DOI:10.1152/ajprenal.00503.2014 |
| [5] |
CURTHOYS N P, MOE O W. Proximal tubule function and response to acidosis[J]. Clin J Am Soc Nephrol, 2014, 9(9): 1627-1638. DOI:10.2215/cjn.10391012 |
| [6] |
CASTILLO A, ORTUÑO-PINEDA C, FLORES-MALDONADO C, et al. Ouabain modulates the adherens junction in renal epithelial cells[J]. Cell Physiol Biochem, 2019, 52(6): 1381-1397. DOI:10.33594/000000097 |
| [7] |
HATOU S, YOSHIDA S, HIGA K, et al. Functional corneal endothelium derived from corneal stroma stem cells of neural crest origin by retinoic acid and Wnt/β-catenin signaling[J]. Stem Cells Dev, 2013, 22(5): 828-839. DOI:10.1089/scd.2012.0286 |
| [8] |
LI B M, REN J A, YANG L, et al. Lithium inhibits GSK3β activity via two different signaling pathways in neurons after spinal cord injury[J]. Neurochem Res, 2018, 43(4): 848-856. DOI:10.1007/s11064-018-2488-9 |
| [9] |
HUANG Y, LIU L, LIU A G. Dickkopf-1: Current knowledge and related diseases[J]. Life Sci, 2018, 209: 249-254. DOI:10.1016/j.lfs.2018.08.019 |
| [10] |
HIRATA H, HINODA Y, NAKAJIMA K, et al. Wnt antagonist DKK1 Acts as a tumor suppressor gene that induces apoptosis and inhibits proliferation in human renal cell carcinoma[J]. Int J Cancer, 2011, 128(8): 1793-1803. DOI:10.1002/ijc.25507 |
| [11] |
ABOU ZIKI M D, MANI A. Wnt signaling, a novel pathway regulating blood pressure? State of the art review[J]. Atherosclerosis, 2017, 262: 171-178. DOI:10.1016/j.atherosclerosis.2017.05.001 |
| [12] |
UELAND T, ÅKERBLOM A, GHUKASYAN T, et al. Admission levels of DKK1 (dickkopf-1) are associated with future cardiovascular death in patients with acute coronary syndromes[J]. Arterioscler Thromb Vasc Biol, 2019, 39(2): 294-302. DOI:10.1161/ATVBAHA.118.311042 |
| [13] |
REGISTER T C, HRUSKA K A, DIVERS J, et al. Plasma Dickkopf1 (DKK1) concentrations negatively associate with atherosclerotic calcified plaque in African-Americans with type 2 diabetes[J]. J Clin Endocrinol Metab, 2013, 98(1): E60-E65. DOI:10.1210/jc.2012-3038 |
| [14] |
THAMBIAH S, ROPLEKAR R, MANGHAT P, et al. Circulating sclerostin and Dickkopf-1 (DKK1) in predialysis chronic kidney disease (CKD): relationship with bone density and arterial stiffness[J]. Calcif Tissue Int, 2012, 90(6): 473-480. DOI:10.1007/s00223-012-9595-4 |
| [15] |
HALL J E, GRANGER J P, DO CARMO J M, et al. Hypertension: physiology and pathophysiology[J]. Compr Physiol, 2012, 2(4): 2393-2442. DOI:10.1002/cphy.c110058 |
| [16] |
JIANG J, DE AN, BURGHARDT R C, et al. Disruption of cadherin/catenin expression, localization, and interactions during HgCl2-induced nephrotoxicity[J]. Toxicol Sci, 2004, 80(1): 170-182. DOI:10.1093/toxsci/kfh143 |
| [17] |
WANG Y P, ZHOU C J, LIU Y H. Wnt signaling in kidney development and disease[J]. Prog Mol Biol Transl Sci, 2018, 153: 181-207. DOI:10.1016/bs.pmbts.2017.11.019 |
| [18] |
XIAO L X, XU B, ZHOU L L, et al. Wnt/β-catenin regulates blood pressure and kidney injury in rats[J]. Biochim Biophys Acta Mol Basis Dis, 2019, 1865(6): 1313-1322. DOI:10.1016/j.bbadis.2019.01.027 |
| [19] |
CONTRERAS R G, FLORES-MALDONADO C, LÁZARO A, et al. Ouabain binding to Na+, K+-ATPase relaxes cell attachment and sends a specific signal (NACos) to the nucleus[J]. J Membr Biol, 2004, 198(3): 147-158. DOI:10.1007/s00232-004-0670-2 |
| [20] |
CHEN K, ZHOU M D, WANG X M, et al. The role of myokines and adipokines in hypertension and hypertension-related complications[J]. Hypertens Res, 2019, 42(10): 1544-1551. DOI:10.1038/s41440-019-0266-y |
| [21] |
SHAO S, CAI W W, SHENG J, et al. Role of SDF-1 and Wnt signaling pathway in the myocardial fibrosis of hypertensive rats[J]. Am J Transl Res, 2015, 7(8): 1345-1356. |
| [22] |
HATOU S, YOSHIDA S, HIGA K, et al. Functional corneal endothelium derived from corneal stroma stem cells of neural crest origin by retinoic acid and Wnt/β-catenin signaling[J]. Stem Cells Dev, 2013, 22(5): 828-839. DOI:10.1089/scd.2012.0286 |
| [23] |
SOPJANI M, ALESUTAN I, WILMES J, et al. Stimulation of Na+/K+ ATPase activity and Na+ coupled glucose transport by β-catenin[J]. Biochem Biophys Res Commun, 2010, 402(3): 467-470. DOI:10.1016/j.bbrc.2010.10.049 |
| [24] |
MENG W X, TAKEICHI M. Adherens junction: molecular architecture and regulation[J]. Cold Spring Harb Perspect Biol, 2009, 1(6): a002899. DOI:10.1101/cshperspect.a002899 |
| [25] |
陈悦.多巴胺D1类受体与胃泌素受体相互作用对胃-肾促尿钠排泄轴的影响[D].重庆: 第三军医大学, 2014. CHEN Y.Effects of dopamine D1 receptor and gasatrin receptor interaction on the excretion axis of stomach-kidney sodium gonadotropin[D]. Chongqing: Third Military Medical University, 2014. |



