2. 400016 重庆,重庆医科大学:基础医学院放射医学教研室
2. Department of Radiological Medicine, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)是一种侵袭性非霍奇金淋巴瘤,是常见的淋巴恶性肿瘤之一,占所有淋巴瘤病例的30%~40%[1]。其临床表现多样,结果不可预测且高度多变。DLBCL的一线治疗方案是接受至少6周利妥昔单抗(Rituximab)联合CHOP(环磷酰胺、多柔比星、长春新碱、泼尼松)化疗。尽管利妥昔单抗的出现使DLBCL的疗效得到了极大改善,但是仍有近1/3的患者不能治愈[2]。因此,对未治愈患者预后不良因素进行分析,找到准确可靠能够指导临床治疗的预后相关因素,一直是近年来国内外研究的热点。本研究通过对重庆医科大学附属第一医院2015-2019年在R-CHOP治疗前进行18F-FDG PET/CT检查的76例DLBCL患者临床资料进行单因素及多因素预后分析,以期获得初步的预后相关因素结果,更好地指导临床工作。
1 资料与方法 1.1 病例来源收集重庆医科大学附属第一医院2015-2019年接受R-CHOP治疗前进行18F-FDG PET/CT检查的DLBCL患者76例,临床资料包括患者性别、初次确诊时年龄、初次确诊时间、PET/CT检查结果中最大标准摄取值(maximum standard uptake value,SUVmax)、Ann Arbor临床分期[3]、IPI评分[4]、患者血清中乳酸脱氢酶(LDH)值、有无B症状、发生事件日期(即死亡日期)。
纳入标准:①患者均经病理形态学及免疫组化分型诊断为弥漫大B细胞淋巴瘤;②治疗前均接受过18F-FDG PET/CT影像学检查;③患者年龄≥18岁;④采用的治疗方案均为R-CHOP方案。排除标准:①首次接受18F-FDG PET/CT影像学检查前已接受过化疗或放疗者;②放弃治疗者;③临床资料不完整者。本研究经本院伦理委员会审批通过(2020-335)。
1.2 免疫学标志物CD10、BCL-6、MUM-1及免疫分型采用免疫组化方法对CD10、干扰素调节因子(multiple myeloma oncogene 1, MUM1)和B细胞白血病淋巴瘤相关蛋白(BCL-6)3种免疫标记物进行染色,将DLBCL分成GCB亚型(CD10阳性、BCL阳性)与NGCB亚型(MUM1阳性)。76例DLBCL患者有50例做了免疫学标志物及免疫分型检测。
1.3 PET/CT检查在禁食6 h后,静脉注射18F-脱氧葡萄糖(18F-fluorodeoxy glucose,18F-FDG),注射活度按37 MBq/kg,安静休息60 min后行PET/CT显像。显像设备:Philips Gemini TOF-64;录入身高、体质量、注射净剂量及注射时间;CT参数:120 keV,80 mAs,层厚2 mm,FOV:600,从颅底扫描至股骨中部;PET参数:3D采集,90 s/床位,OSEM重建,层厚4 mm。由2名核医学医师和2名肿瘤学医师分别对PET/CT图像上的所有淋巴瘤病灶进行ROI勾画,各自统计SUVmax值(g/mL)。
1.4 观察因素分组及赋值对所有病例资料进行编号,数据均按照变量赋值进行分组并汇总,见表 1。
| 因素 | 分组及赋值 |
| 年龄 | ≤60岁=0,>60岁=1 |
| 性别 | 女=0,男=1 |
| 临床分期 | Ⅰ~Ⅱ期=0,Ⅲ~Ⅳ期=1 |
| B症状 | 无=0,有=1 |
| LDH | ≤310 IU/L为正常=0,>310 IU/L为升高=1 |
| IPI评分 | ≤2分=0,>2分=1 |
| SUVmax | ≤10为正常=0,>10为升高=1 |
| 生存结局 | 生存=1,死亡=2 |
1.5 随访
治疗后2年内每3个月随访,第3~4年内每半年随访,第5年后每年1次,直至终生随访。所有患者均 采用电话随访或门诊住院随访,并在2020年2月10日 对全部患者进行电话随访,确认患者预后。患者总生存期(overall survival,OS)以患者首次诊断为DLBCL至任何原因导致的死亡、失访或末次随访时间为止,生存时间以“月”计算。
1.6 统计学分析采用R-Studio软件进行统计分析。构建76例DLBCL患者Kaplan-Meier生存曲线,对年龄、SUVmax值等指标进行单因素生存分析,各组生存率比较采用Log-rank检验。将单因素分析结果中具有统计学意义的参数纳入Cox比例风险回归模型中进行多因素分析。根据PET/CT的SUVmax值,将76例DLBCL患者分为SUVmax≤10组和SUVmax>10组,采用χ2检验比较组间差异,以P<0.05为差异有统计学意义。
2 结果 2.1 临床资料特征76例DLBCL患者临床资料见表 2,男性35例,女性41例,中位年龄56(25~86)岁,发病高峰期为60~70岁。PET/CT检查显示SUVmax≤10共54例(71.1%),SUVmax>10共22例(28.9%)。随访期间存活54例(71.1%),死亡22例(28.9%)。
| 因素 | n | 期内死亡 | 期内存活 |
| 性别 | |||
| 男性 | 35 | 9(25.7) | 26(74.3) |
| 女性 | 41 | 13(31.7) | 28(68.3) |
| 年龄 | |||
| ≤60岁 | 45 | 6(13.3) | 39(86.7) |
| >60岁 | 31 | 16(51.6) | 15(48.4) |
| 临床分期 | |||
| Ⅰ~Ⅱ期 | 30 | 2(6.7) | 28(93.3) |
| Ⅲ~Ⅳ期 | 46 | 20(43.5) | 26(56.5) |
| LDH水平a | |||
| ≤310 IU/L | 47 | 8(17.0) | 39(83.0) |
| >310 IU/L | 21 | 9(42.9) | 12(57.1) |
| B症状 | |||
| 无 | 53 | 10(18.9) | 43(81.1) |
| 有 | 23 | 12(52.2) | 11(47.8) |
| SUVmax值 | |||
| ≤10 | 54 | 10(18.5) | 44(81.5) |
| >10 | 22 | 12(54.5) | 10(45.5) |
| IPI指数b | |||
| IPI≤2分 | 52 | 9(17.3) | 43(82.7) |
| IPI>2分 | 20 | 9(45.0) | 11(55.0) |
| 合计 | 76 | 22(28.9) | 54(71.1) |
| a:有8例患者未查到相关资料;b:有4例患者未查到相关资料 | |||
2.2 生存情况
76例患者生存时间最短为3个月,最长57个月,中位生存35个月,获得3年以上生存期的患者8例(10.5%),随着患者的总生存期延长,患者的生存率呈逐渐下降趋势(图 1)。
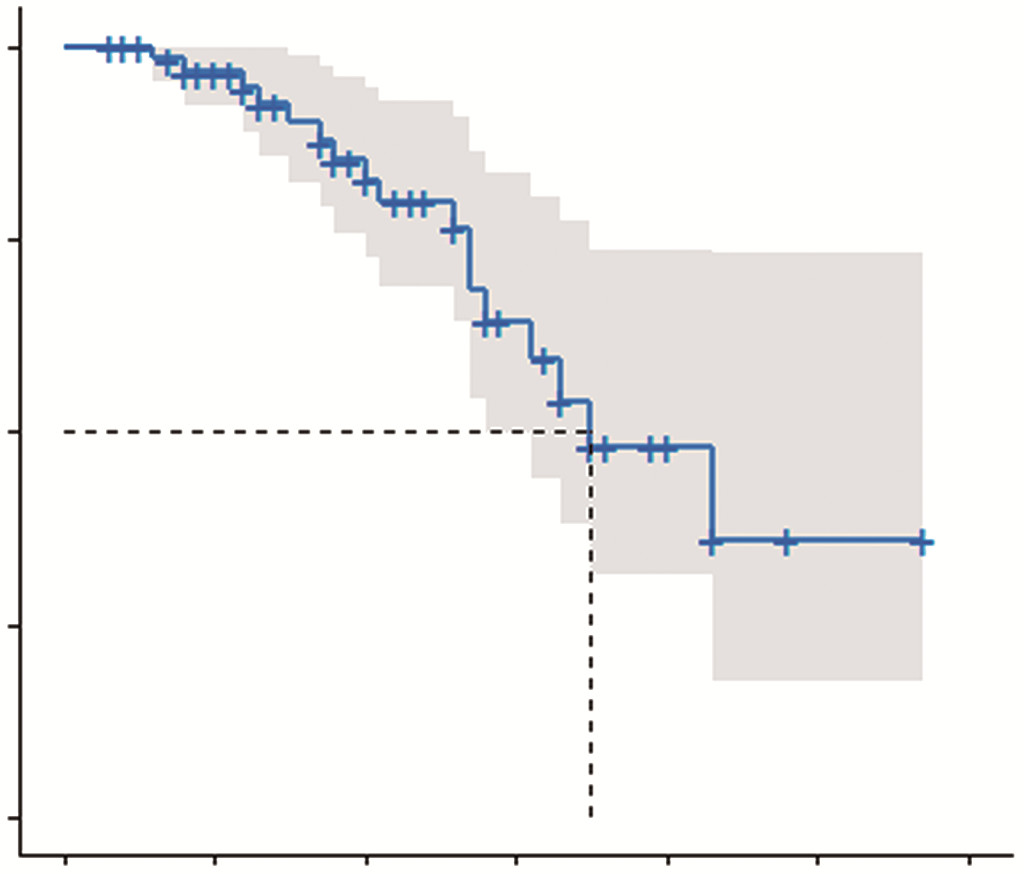
|
| 图 1 76例DLBCL患者的生存曲线 |
2.3 单因素预后分析
单因素预后分析((表 3)显示:①年龄≤60岁的预后较年龄>60岁更好(P<0.001);②在临床分期中,Ⅲ~Ⅳ期预后显著低于Ⅰ~Ⅱ期(P=0.011);③PET/CT的18F-FDG SUVmax值≤10的预后明显优于SUVmax值>10(P=0.034);④血清LDH值>310 IU/L的预后低于LDH值≤310 IU/L(P=0.037);⑤IPI评分≤2分的预后显著优于IPI评分>2分(P=0.01);⑥无B症状预后明显好于有B症状(P=0.039);⑦免疫学标志物BCL-6、CD10、MUM1以及免疫分型与患者预后无相关性(表 4)。
| 因素 | Log-rank P值 | RR(95%CI) |
| 性别(男vs女) | 0.230 | 0.60(0.25~1.40) |
| 年龄(>60 vs ≤60岁) | <0.001 | 6.47(2.52~16.62) |
| 临床分期(Ⅲ~ⅣvsⅠ~Ⅱ) | 0.011 | 5.40(1.26~23.20) |
| LDH水平(>310 vs ≤310IU/L) | 0.037 | 2.70(1.03~7.05) |
| B症状(有vs无) | 0.039 | 2.37(1.02~5.51) |
| SUVmax值(>10 vs ≤10) | 0.034 | 2.48(1.04~5.92) |
| IPI指数(>2 vs ≤2) | 0.010 | 3.23(1.27~8.23) |
| RR:相对危险度;CI:可信区间 | ||
| 病理亚型 | n(%) | Log-rank P值 | 2年OS(%) | χ2值 | P值 |
| BCL-6 | 0.42 | 0.164 | >0.05 | ||
| 阳性 | 38(76) | 36.8 | |||
| 阴性 | 12(24) | 25.0 | |||
| CD10 | 0.45 | <0.001 | >0.05 | ||
| 阳性 | 15(30) | 33.3 | |||
| 阴性 | 35(70) | 34.3 | |||
| MUM1 | 0.99 | 0.189 | >0.05 | ||
| 阳性 | 41(82) | 36.6 | |||
| 阴性 | 9(18) | 22.2 | |||
| 免疫分型 | 0.42 | 0.031 | >0.05 | ||
| GCB | 17(34) | 29.4 | |||
| NGCB | 33(66) | 36.4 |
2.4 多因素预后分析
多因素分析(表 5)发现,患者的年龄、SUVmax值以及IPI评分均对预后有影响。患者≤60岁的死亡风险显著低于>60岁,RR(>60岁vs ≤60岁)=12.56(3.32~47.54);患者SUVmax值>10的死亡风险明显高于SUVmax值≤10,RR(SUVmax>10 vs SUVmax ≤10)=3.11(1.04~9.34),而治疗前SUVmax>10和SUVmax≤10两组,组间差异分析结果显示在性别、分期、LDH水平、B症状以及IPI指数上的差异无统计学意义。患者IPI评分≤2的死亡风险小于评分>2,RR(>2分 vs ≤2分)=5.67(1.09~29.60)。
| 参数 | P值 | RR(95%CI) |
| 年龄(>60 vs ≤60岁) | <0.001 | 12.56(3.32~47.54) |
| 分期(Ⅲ+Ⅳ vs Ⅰ+Ⅱ) | 0.440 | 2.20(0.30~16.41) |
| SUVmax(>10 vs ≤10) | 0.043 | 3.11(1.04~9.34) |
| LDH(>310 vs ≤310 IU/L) | 0.299 | 1.91(0.57~6.42) |
| IPI评分(>2 vs ≤2) | 0.039 | 5.67(1.09~29.60) |
| B症状(有vs无) | 0.727 | 1.20(0.44~3.30) |
| RR:相对危险度;CI:可信区间 | ||
3 讨论
18F-FDG PET/CT显像不仅可提供人体内组织器官的解剖成像,还可显示功能及代谢信息,因此在临床上可清晰观察到淋巴瘤在体内的位置、分布、大小、代谢状态而应用于DLBCL的诊断、分期及疗效评价,从而指导临床有效治疗方式的选择,监测和评估淋巴瘤的治疗效果[5]。2007年美国JCO杂志(Journal of Clinical Oncology)发布了恶性淋巴瘤疗效评价的修订标准,在原有标准中融入了免疫组化(immunohistochemical,IHC)、流式细胞术(flow cytometry,FCM)、18F-FDG PET/CT显像[6]。2013年,《中国弥漫大B细胞淋巴瘤诊断与治疗指南》正式建议PET/CT应用于淋巴瘤患者的精确诊断和疗效评价。指南重点推荐包括PET/CT取代CT用于淋巴瘤分期的常规检查和利用五分量表(Deauville量表)评估缓解情况,DLBCL患者可用PET/CT取代骨髓活检评估骨髓受累情况,从而对肿瘤进行分期,PET/CT可用于治疗中期评估缓解情况等内容。
由于肿瘤病灶和正常组织的葡萄糖代谢能力不同,肿瘤组织需要摄取更多的葡萄糖类似物即显像剂18F-FDG,PET/CT扫描正是通过显示这种放射性浓度差来发现肿瘤。衡量摄取18F-FDG能力的大小可用标准摄取值(standard uptake value,SUV)表示。SUV值是PET在肿瘤显像中常用的半定量指标,等于病灶的放射性浓度(kBq/mL)除以注射剂量(MBq)再除以体质量(kg)[7]。一般来讲,恶性肿瘤摄取示踪剂的能力强于良性肿瘤,而良性肿瘤的摄取能力又高于正常组织,恶性程度越高,SUV值越高。因此,18F-FDG PET/CT 显像也可达到对肿瘤恶性程度分级的目的[8-9]。
多项研究[10-13]表明DLBCL治疗前的 PET/CT的 SUVmax与患者预后等有一定关系。本研究以SUVmax=10 作为界限,将76例患者分为SUVmax≤10组和SUVmax>10组,分析其临床资料,发现无论是单因素还是多因素分析,SUVmax值都与患者的总生存期相关。SUVmax>10组的死亡风险是SUVmax≤10组的3.11倍,表明同样接受R-CHOP治疗的DLBCL患者,如果SUVmax≤10则患者具有更好的生存率,更长的生存期。而且采用χ2检验比较组间差异显示,两组患者在性别、分期、LDH水平、B症状的有无以及IPI指数之间的差异均无统计学意义,进一步说明SUVmax对DLBCL患者R-CHOP方案治疗预后有一定临床指导意义。
本研究也发现,IPI≤2分的R-CHOP治疗患者整体生存率明显高于IPI>2分组(P=0.01), 后者死亡风险是前者的5.56倍,提示IPI指数可能是影响弥漫大B细胞淋巴瘤患者预后的因素之一。
本研究单因素预后分析发现,初诊时的年龄、临床分期、PET/CT的SUVmax值、LDH水平、有无B症状以及IPI评分为DLBCL患者的预后影响因素。而多因素分析显示年龄、SUVmax以及IPI评分可作为DLBCL患者R-CHOP方案治疗预后指标。一般情况下,单因素分析和多因素分析是相辅相成的,单因素分析可以初步探索各临床因素与预后的关系,并且在样本量不大的情况下可以通过单因素分析剔除部分无关的临床因素;而多因素分析则可以进一步排除其他混杂因素的影响,从而确定各因素与预后的相关性。并且若单因素与多因素结果一致,对于所得到的研究结论就比较可靠。
年龄超过60岁被确定为DLBCL患者的预后不良因素之一[14]。本研究显示,年龄≤60岁和>60岁的组间差异有统计学意义(P<0.05),后者患病的概率更高且预后更差。考虑到多数老年患者伴有某些心脑血管、呼吸系统等基础性疾病使得治疗更加困难,老年患者体内积累的毒性以及体质较弱通常会导致治疗提前终止[15],从而影响预后等情况,最终导致>60岁组患者病死率高于≤60岁组。因此,年龄是否为DLBCL独立预后指标仍需多地区、大样本进一步研究。
在免疫组化分型方面,王烨等[16]研究提示免疫分型与DLBCL患者的预后相关,然而朱海燕[17]、贾存东等[18]认为免疫学亚型与DLBCL的预后关系尚不明确,本研究也未发现GCB亚型患者的预后优于non-GCB亚型(P>0.05)。免疫学亚型对DLBCL预后的意义各研究结果存在很大差异,其原因可能是:①弥漫大B细胞淋巴瘤高度异质性,小样本研究可能会导致病例选择偏倚。②各研究组的随访时间不同。③本研究的随访时间较短,获得的病例数偏少,又属于单中心研究,存在统计学偏差。④不同地理区域的气候因素、饮食差异可能对DLBCL患者预后存在一定影响。
综上所述,年龄、临床分期、SUVmax值、LDH水平、IPI评分以及B症状与DLBCL的R-CHOP治疗预后存在关系,并且SUVmax与IPI评分对DLBCL患者的R-CHOP治疗有一定临床指导意义;当然本研究因样本量少,免疫分型是否可有效预测DLBCL预后,有待扩大样本量继续追踪进行更深一步研究。
| [1] |
VAIDYA R, WITZIG T E. Prognostic factors for diffuse large B-cell lymphoma in the R(X)CHOP era[J]. Ann Oncol, 2014, 25(11): 2124-2133. DOI:10.1093/annonc/mdu109 |
| [2] |
李晓倩, 张利玲. 中期18F-FDG-PET/CT在弥漫大B细胞淋巴瘤中的疗效评价方法及临床价值[J]. 临床血液学杂志, 2018, 31(11): 886-891. LI X Q, ZHANG L L. 18F-fluorodeoxyglucose positron emission tomography for interim response assessment of diffuse large B-cell lymphoma[J]. J Clin Hematol, 2018, 31(11): 886-891. DOI:10.13201/j.issn.1004-2806.2018.11.019 |
| [3] |
PARK S, MOON S H, PARK L C, et al. The impact of baseline and interim PET/CT parameters on clinical outcome in patients with diffuse large B cell lymphoma[J]. Am J Hematol, 2012, 87(9): 937-940. DOI:10.1002/ajh.23267 |
| [4] |
江茂情. 化疗中期18F-FDG PET/CT、国际预后指数(IPI)、分子表型及治疗方案在弥漫大B细胞淋巴瘤患者预后评估中的应用研究[D]. 广州: 南方医科大学, 2018. JIANG M Q. Mid-term chemotherapy 18F-FDG PET/CT, International Prognostic Index (IPI), molecular phenotype and therapeutic regimen in patients with diffuse large B-cell lymphoma[D]. Guangzhou: Southern Medical University, 2018. |
| [5] |
LI X Q, SUN X, LI J, et al. Interim PET/CT based on visual and semiquantitative analysis predicts survival in patients with diffuse large B-cell lymphoma[J]. Cancer Med, 2019, 8(11): 5012-5022. DOI:10.1002/cam4.2404. |
| [6] |
CHESON B D, FISHER R I, BARRINGTON S F, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification[J]. J Clin Oncol, 2019, 8(11): 5012-5022. DOI:10.1002/cam4.2404 |
| [7] |
FRIDRIK M A, JAEGER U, PETZER A, et al. Cardiotoxicity with rituximab, cyclophosphamide, non-pegylated liposomal doxorubicin, vincristine and prednisolone compared to rituximab, cyclophosphamide, doxorubicin, vincristine, and prednisolone in frontline treatment of patients with diffuse large B-cell lymphoma[J]. Eur J Cancer, 2016, 58: 112-121. DOI:10.1200/JCO.2013.54.8800 |
| [8] |
XU Y, XU G. A clinicopathologic progress of diffuse large B cell lymphoma[J]. Pract J Clin Med, 2014, 11(3): 196-200, 201.. |
| [9] |
PHANG K C, HUSSIN N H, ABDUL RAHMAN F, et al. Characterisation of immunogenotypes of diffuse large B-cell lymphoma[J]. Malays J Pathol, 2019, 41(2): 101-124. |
| [10] |
YANG G, LI Y Q, LIU X Y, 等. Correlation analysis between SUVmax of PET-CT and clinicalpathological factor and prognosis in the diffuse large B cell lymphoma[J]. Basic Clin Oncol, 2018, 31(2): 122-125. DOI:10.3969/j.issn.1673-5412.2018.02.010. |
| [11] |
ZHANG Y, WANG Y, LI Y, 等. 18F-FDG PET/CT在弥漫大B细胞淋巴瘤诊断和化疗中期疗效评价的研究[J]. 医学影像学杂志, 2018, 28(11): 1858-1863. |
| [12] |
TERAS L R, DESANTIS C E, CERHAN J R, 等. 2016 US lymphoid malignancy statistics by World Health Organization subtypes[J]. CA Cancer J Clin, 2016, 66(6): 443-459. DOI:10.3322/caac.21357 |
| [13] |
NGEOW J Y Y, QUEK R H H, NG D C E, et al. High SUV uptake on FDG-PET/CT predicts for an aggressive B-cell lymphoma in a prospective study of primary FDG-PET/CT staging in lymphoma[J]. Ann Oncol, 2009, 20(9): 1543-1547. DOI:10.1093/annonc/mdp030. |
| [14] |
HEDSTRM G, HAGBERG O, JERKEMAN M, 等. The impact of age on survival of diffuse large B-cell lymphoma—a population-based study[J]. Acta Oncol, 2015, 54(6): 916-923. DOI:10.3109/0284186x.2014.978367 |
| [15] |
DU Z G, BAO Y, TANG F, 等. Immunohistochemical profiles and their prognostic role in diffuse large B-cell lymphoma[J]. J Fudan Univ Med Sci, 2009, 36(3): 281-287. DOI:10.3969/j.issn.1672-8467.2009.03.007 |
| [16] |
WANG Y, MA X M, YUE N, 等. Clinicopathological characteristics and prognosis of primary diffuse large B cell lymphoma in central nervous system[J]. hin J Diagn Pathol, 2016, 23(10): 736-741. DOI:10.3969/j.issn.1007-8096.2016.10.006. |
| [17] |
ZHU H Y, LI F, ZHAO Y, 等. Model combined with clinical international prognostic index, pathological immunophenotype and interim PET/CT in the prognosis assessment of diffuse large B-cell lymphoma[J]. Chin J Med Imaging, 2019, 27(4): 298-301, 308.. DOI:10.3969/j.issn.1005-5185.2019.04.014. |
| [18] |
JIA C D, YANG L L, YUE N, 等. Immunological subtypes and prognostic analysis of diffuse large B cell lymphoma in Xinjiang Uygur people[J]. Chin J Gerontol, 2014, 34(7): 1798-1800. DOI:10.3969/j.issn.1005-9202.2014.07.031. |



