2. 400016 重庆,重庆医科大学:附属第一医院放射科病理科
2. Department of Pathology, Chongqing Medical University, Chongqing,400016, China
近年来,肺腺癌的发病率不断上升并成为肺癌中最常见的组织学类型[1]。根据2011年国际肺癌研究学会(International Association for the Study of Lung Cancer,IASLC)、美国胸科学会(American Thoracic Society,ATS)及欧洲呼吸病学会(European Respiratory Society,ERS)联合拟定的肺腺癌国际多学科分类标准[2](以下简称IASLC/ATS/ERS肺腺癌新分类)以及2015年世界卫生组织提出的肺癌病理学分类方法[3],浸润性肺腺癌按主要生长方式可分为贴壁状(lepidic-predominant pattern adenocarcinoma,LPA)、腺泡状(acinar-predominant pattern adenocarcinoma,APA)、乳头状(papillary-predominant pattern adenocarcinoma,PPA)、微乳头状(micropapillary-predominant pattern adenocarcinoma,MPP)及实性(solid-predominant pattern adenocarcinoma,SPA)等亚型。多项研究[2-4]表明,不同病理亚型肺腺癌患者的预后及生存期存在明显差异,其中LPA预后最好,其次为APA和PPA,而MPP和SPA预后最差。目前临床上对浸润性肺腺癌提倡全面、详细的组织学诊断模式,要得到准确可靠的病理诊断就需要对肿瘤进行全面取材。但是大多数中晚期肺癌患者失去了手术切除的机会,通过活检或纤维支气管镜等方法取得的组织小样本并不能完全满足病理诊断。胸部CT是肺癌诊断及疗效评估的首选影像学检查方法,既往鲜有大样本研究评估浸润性肺腺癌CT征象与不同病理亚型的关系。因此,本研究旨在通过纳入大样本病例探讨浸润性肺腺癌不同病理亚型的临床病理特征及CT征象的差异,以期寻找一种有助于鉴别浸润性肺腺癌病理亚型的无创性影像学方法,为其预后评估提供更多有价值的线索。
1 材料与方法 1.1 临床资料回顾性分析2013年7月至2019年7月本院经手术病理证实的单发浸润性肺腺癌患者422例,年龄24~83(61±14)岁,其中LPA 26例,APA 273例,PPA 53例,SPA 59例,MPA 11例;术前临床TNM分期Ⅰ~Ⅱ期340例,Ⅲ期82例,术后病理TNM分期Ⅰ~Ⅱ期317例,Ⅲ期68例,Ⅳ期37例。422个肿瘤中,表现为结节298个(病灶直径≤3 cm),表现为肿块124个(病灶直径 > 3 cm)。纳入标准:①术前2周内行胸部CT扫描;②胸部CT扫描前未接受过任何抗肿瘤治疗;③CT图像质量清晰,无明显伪影。排除标准:①肿瘤内存在多个比例相当的病理亚型且难以确定主要生长方式;②病理亚型为浸润性肺腺癌的变异型;③CT表现为多发结节或肿块。根据不同预后将浸润性肺腺癌的病理亚型分为两组,即预后良好的A组(LPA/APA/PPA)和预后不良的B组(SPA/MPA),其中A组352例,年龄24~81(61±14)岁,B组70例,年龄41~83(62±15)岁。鉴于LPA与APA/PPA的预后亦存在一定差异,故进一步将A组细分为A1组(LPA,26例)和A2组(APA/PPA,326例),记录各组患者的性别和吸烟史。
1.2 CT扫描方法采用Discovery 750 HD CT(GE Health care, Milwaukee, WI, USA)行胸部CT扫描。患者取仰卧位,扫描前行呼吸训练,扫描范围为肺尖至肋膈角水平,管电压为120 KeV,自动管电流,扫描层厚5 mm,层间距5 mm。98例行胸部CT平扫,324例行胸部CT增强扫描。增强扫描时通过肘正中静脉注入非离子型对比剂碘海醇(300 mgI/mL),注射剂量为1.5 mL/kg,总剂量为80~110 mL,注射速率为3.0 mL/s,动脉期扫描延迟时间为30 s。扫描结束后将原始图像重建为0.625~1.25 mm层厚的薄层图像,并传输至PACS系统。
1.3 图像分析由2名经验丰富的放射科医师采用双盲法单独阅读CT图像,有分歧时经讨论达成一致意见。分析及测量①病灶大小:于横断面CT肺窗图像上(窗宽:1600 HU,窗位:-600 HU)测量肿瘤最长径及其最大垂直径,取其平均值作为病灶大小;②病灶密度:分为实性密度和亚实性密度,实性密度即肺内软组织密度,其内肺血管及支气管均不能显示;亚实性密度又细分为纯磨玻璃密度(pure ground glass opacity,pGGO)和混杂磨玻璃密度(mixed ground glass opacity,mGGO),其中pGGO表现为肺内局灶性密度增高,其内血管及支气管仍能清楚显示,mGGO同时包含实性密度及pGGO;③病灶分布:中央型(累及段及段以上支气管)和周围型(累及段支气管以远);④病灶边缘有无:毛刺、分叶、胸膜牵拉征、血管集束征和充气支气管征;⑤病灶内有无:含气腔(包括空腔、空洞及假空洞)、坏死、钙化和胸腔积液。
1.4 病理组织学检查将切除的肿瘤按一个方向间隔1.0 cm连续性平行切开(不完全切断),每隔1.0 cm对肿瘤剖面至少取材一片,且每个肿瘤至少取材4片,其中肿瘤与正常组织的交界一定要取材,然后经4%甲醛溶液固定,并按常规方式行HE染色。由2名经验丰富的高年资病理科医师对HE切片进行独立阅片,包括浸润性肺腺癌的病理亚型、分化程度及病理TNM分期,意见有分歧时经讨论达成一致。根据“IASLC/ATS/ERS肺腺癌新分类”标准,以5%的百分比为增量记录观察野中浸润性肺腺癌的所有生长方式,最终定义百分比最高的生长方式为肺腺癌的主要病理亚型。在评估患者病理TNM分期时,结合术中所见、病理诊断及术前全身检查等结果,按照国际抗癌联盟和美国癌症联合委员会制定的第八版肺癌TNM分期(2017)进行评判。
1.5 统计学分析采用SPSS 24.0进行统计学分析。观察者间的诊断一致性采用Kappa检验,两组间定量资料比较时先进行正态检验,符合正态分布者以x±s表示,采用两独立样本t检验,不符合正态分布者用M(P25,P75)表示,采用Mann-Whitney U 检验。两组间定性资料的比较采用χ2检验,检验水准α=0.05。
2 结果 2.1 两位放射科医师和病理科医师的诊断一致性两位放射科医师对所有患者的病灶大小、病灶密度、病灶分布、有无毛刺、分叶、胸膜牵拉征、血管集束征、充气支气管征、含气腔、坏死、钙化及胸腔积液的诊断一致性均较好,Kappa值分别为0.863、0.848、0.855、0.768、0.836、0.862、0.737、0.845、0.887、0.867、0.863和0.887(P < 0.05)。
两位病理科医师对所有患者的病理亚型、分化程度及病理TNM分期的诊断一致性良好,Kappa值分别为0.871、0.906和0.865(P < 0.05)。
2.2 A组和B组临床病理特征及CT征象的比较 2.2.1 两组临床病理特征的比较A组以女性(57.10%)及不吸烟者(60.80%)多见,B组以男性(70.00%)及吸烟者(51.10%)多见,两组性别构成和吸烟史差异均有统计学意义(P < 0.05)。A组以中高分化腺癌(88.35%)多见,B组均表现为低分化腺癌(100%),A组淋巴结转移率(22.44%)低于B组(51.43%),同时病理TNM分期Ⅰ~Ⅱ期(78.98%)以A组多见,Ⅲ~Ⅳ期以B组多见(44.29%),两组肿瘤分化程度、淋巴结转移率及病理TNM分期差异均有统计学意义(P < 0.001),但两组远处转移率无明显统计学差异(P > 0.05),见表 1。
| 临床病理特征 | A组(n=352) | B组(n=70) | 统计值 | P值 |
| 性别 | 17.202 | <0.001a | ||
| 男性 | 151(42.90) | 49(70.00) | ||
| 女性 | 201(57.10) | 21(30.00) | ||
| 吸烟史 | 7.698 | 0.006a | ||
| 无 | 214(60.80) | 22(48.90) | ||
| 有 | 93(26.42) | 23(51.10) | ||
| 分化程度 | 54.568 | <0.001a | ||
| 低分化 | 41(11.65) | 70(100.00) | ||
| 中高分化 | 311(88.35) | 0(0.00) | ||
| 淋巴结转移 | 24.744 | <0.001a | ||
| 无 | 249(77.56) | 34(48.57) | ||
| 有 | 79(22.44) | 36(51.43) | ||
| 远处转移 | 2.910 | 0.094a | ||
| 无 | 335(95.17) | 63(90.00) | ||
| 有 | 17(4.83) | 7(10.00) | ||
| 病理学TNM分期 | 16.906 | <0.001a | ||
| Ⅰ~Ⅱ | 278(78.98) | 39(55.71) | ||
| Ⅲ~Ⅳ | 74(21.02) | 31(44.29) | ||
| a:χ2检验 | ||||
2.2.2 两组CT征象的比较
A组病灶平均直径明显小于B组(P < 0.001)。A组68.47%表现为实性密度,31.53%表现为亚实性密度,其中pGGO 1例(0.90%),mGGO 110例(99.10%),而B组均表现为实性密度(100%),两组间差异有统计学意义(P < 0.001)。A组血管集束征及充气支气管征发生率显著高于B组,而B组钙化、坏死及胸腔积液发生率显著高于A组(P < 0.05),但两组病灶分布、毛刺、分叶、胸膜牵拉征和含气腔的出现率差异均无统计学意义(P > 0.05,表 2,图 1、2)。
| CT特征 | A组(n=352) | B组(n=70) | 统计值 | P值 |
| 病灶大小c/mm | 22.50(15.50,29.50) | 34.50(21.88,47.13) | 4.628 | <0.001b |
| 病灶密度 | 28.864 | <0.001a | ||
| 亚实性 | 111(31.53) | 0(0) | ||
| 实性 | 241(68.47) | 70(100.00) | ||
| 病灶分布 | 2.503 | 0.120a | ||
| 中央型 | 8(2.27) | 4(5.70) | ||
| 周围型 | 344(97.73) | 66(94.30) | ||
| 毛刺 | 0.064 | 0.800a | ||
| 无 | 258(80.11) | 57(81.43) | ||
| 有 | 70(19.89) | 13(18.57) | ||
| 分叶 | 1.804 | 0.071a | ||
| 无 | 33(9.38) | 2(2.86) | ||
| 有 | 319(90.63) | 68(97.14) | ||
| 胸膜牵拉 | 2.179 | 0.140a | ||
| 无 | 80(22.73) | 23(32.86) | ||
| 有 | 272(77.27) | 47(67.14) | ||
| 血管集束征 | 36.965 | <0.001a | ||
| 无 | 196(55.68) | 66(94.29) | ||
| 有 | 156(44.32) | 4(5.71) | ||
| 充气支气管征 | 10.577 | 0.001a | ||
| 无 | 265(75.28) | 65(92.86) | ||
| 有 | 87(24.72) | 5(7.14) | ||
| 含气腔 | 2.086 | 0.149a | ||
| 无 | 269(76.42) | 59 (84.29) | ||
| 有 | 83(23.58) | 11(15.71) | ||
| 坏死 | 18.795 | <0.001a | ||
| 无 | 321(91.19) | 51(72.86) | ||
| 有 | 31(8.81) | 19(27.14) | ||
| 钙化 | 10.545 | 0.004a | ||
| 无 | 342(97.16) | 62(88.57) | ||
| 有 | 10(2.84) | 8(11.43) | ||
| 胸腔积液 | 21.645 | 0.001a | ||
| 无 | 324(99.43) | 62(88.57) | ||
| 有 | 2(0.57) | 8(11.43) | ||
| a:χ2检验;b:Mann-Whitney U检验;c:数据以M(P25,P75)表示 | ||||
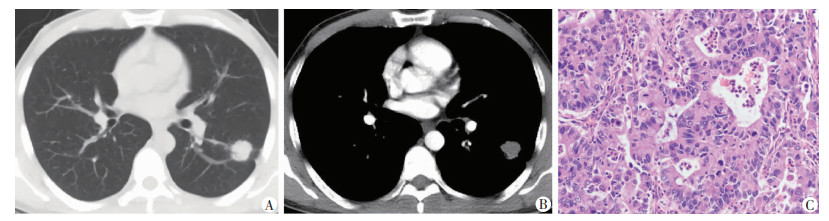
|
| A:横断面肺窗 CT 图像 示左肺下叶见不规则结节影,伴血管集束征、充气支气管征及胸膜凹陷征;B:横断面纵隔窗CT增强图像示该结节影强化均匀;C:HE染色观察肿瘤病理学形态(×200)示中高分化浸润性腺癌,以腺泡状生长方式为主 图 1 腺泡生长方式为主型浸润性肺腺癌患者(男性,41岁)CT及病理表现 |
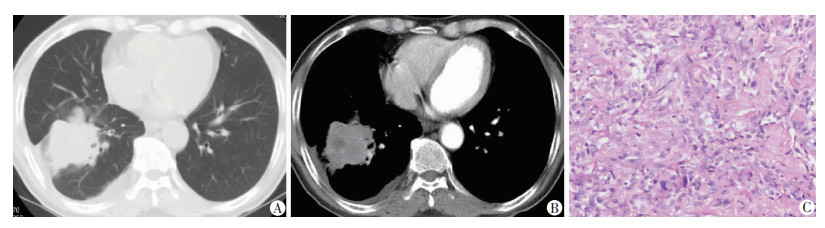
|
| A:横断面肺窗CT图像示右肺下叶见不规则肿块影,伴分叶征及右侧胸腔少量积液;B:横断面纵隔窗增强CT图像示肿块强化不均,其内见小斑片状低密度坏死区;C:HE染色观察肿瘤病理学形态(×200)示低分化浸润性腺癌,以实性生长方式为主 图 2 实性生长方式为主型浸润性肺腺癌患者(男性,62岁)CT及病理表现 |
2.3 A1组和A2组临床病理特征及CT征象的比较
A1组亚实性密度26例,包括pGGO 1例,mGGO 23例,实性密度2例,以亚实性密度(92.31%)为主。A2组亚实性密度87例,均为mGGO,实性密度239例,以实性密度(73.31%)为主,两组间差异有统计学意义(P < 0.001),但两组其余临床病理特征及CT征象均无明显统计学差异(P > 0.05)。
3 讨论近年来随着临床上对肺癌筛查力度的加大及检测手段的精进,肺腺癌的异质性也受到了愈来愈多的关注,IASLC/ATS/ERS肺腺癌新分类也重新定义了浸润性肺腺癌的病理亚型。研究表明,不同病理亚型的浸润性肺腺癌患者具有明显不同的预后,且肺癌的预后与病理分化程度、病理TNM分期、淋巴结及远处转移状态密切相关[5-6]。因此,本研究首先比较了腺癌患者不同病理亚型的临床特征(包括性别及吸烟状态)及与预后相关的病理特征(包括病理分化程度、淋巴结转移情况、远处转移情况及病理TNM分期)。本研究结果显示,男性及吸烟患者多见于SPA/MPA,这与QIAN等[7]的研究结果一致。同时笔者发现,与LPA/APA/PPA比较,SPA/MPA的病理分化程度更低,更容易发生淋巴结转移,且病理TNM分期多为III-IV期,提示SPA/MPA预后较LPA/APA/PPA差,这与PYO及MATSUZAWA等[8-9]的研究结果相符。但不同病理亚型间远处转移率无统计学差异,这可能与本组病例均为手术切除患者,发生远处转移的病例数较少有关。
本研究接下来着重分析了不同病理亚型浸润性肺腺癌与CT特征的关系,主要有以下几个发现:①就肿瘤大小而言,SPA/MPA的平均直径显著大于LPA/APA/PPA,这与CHANG等[10]的研究结果一致。分析原因可能与SPA/MPA病理分化程度较低,因而生长速度较快有关。②从肿瘤密度来看,LPA/APA/PPA在CT上可广泛表现为pGGO、mGGO及实性密度,其中pGGO占比(0.28%)最低,且仅见于LPA,其次为mGGO,占比为31.25%,实性密度占比最高,为68.47%,而SPA/MPA均表现为实性密度。LEDERLIN等[11]对174例手术切除肺腺癌的病理亚型及术前CT图像进行回顾性分析后提出,pGGO与贴壁式生长方式密切相关,而CT上实性密度影则与实性生长方式有着紧密联系。YOSHIDA等[12]认为MPA在高分辨率CT上更容易表现为实性结节,且腺癌中出现微乳头成分往往提示肿瘤恶性程度较高。这些发现均与本研究结果一致。有研究报道,无论肿瘤大小,磨玻璃成分占整个肿瘤成分越多,预后越好[13]。在本组病例中,磨玻璃密度影仅见于LPA/APA/PPA,且LPA磨玻璃成分常常占比较大,与前述研究结果相符。③在肿瘤分布方面,不同病理亚型的肺腺癌均以周围型分布为主,差异无统计学意义。④从肿瘤的形态学特征及邻近结构的改变来看,笔者发现LPA/APA/PPA血管集束征及充气支气管征的出现率均显著高于SPA/MPA。血管集束征反映了肿瘤的血管生成[14],有研究表明分化良好的肺癌较分化低者具有更充足的血供[15-16]。本组病例中LPA/APA/PPA多为中高分化腺癌,而SPA/MPA均为低分化腺癌,因而LPA/APA/PPA的血供更为丰富,CT图像上血管集束征的出现率亦更高。充气支气管征代表肿瘤内残留的含气支气管,SPA/MPA多为实体性生长,肿瘤容易压迫或破坏周围肺实质,因此充气支气管征在CT图像很难上观察到,而在LPA/APA/PPA尤其是LPA中,癌细胞多沿肺泡壁贴壁式生长,肺的支架结构仍然存在,瘤内支气管破坏相对较轻,故充气支气管征的出现率更高,这与LEDERLIN等[11]的研究结果相符。本研究还显示,SPA/MPA钙化及坏死的出现率高于LPA/APA/PPA。这主要是由于SPA/MPA分化程度较低,肿瘤生长迅速,容易造成瘤内缺血缺氧,从而发生坏死并出现营养不良性钙化[17]。⑤从胸膜改变来看,本研究发现SPA/MPA更容易发生胸腔积液,这可能与SPA/MPA容易经淋巴道转移,导致淋巴回流受阻,或肿瘤转移至胸膜,引起胸腔积液有关。
此外,本研究还比较了LPA与APA/PPA之间的临床病理特征及CT征象。结果显示,LPA与APA/PPA间仅病灶密度存在显著差异,而其余各临床病理特征及CT征象均无统计学差异。尽管LPA与APA/PPA都可以表现为实性密度和亚实性密度,但LPA以mGGO多见,而APA/PPA以实性密度多见。这一研究结果也表明笔者将LPA与APA/PPA归为一组,再与SPA/MPA进行比较的研究方法是合理可行的。
本研究尚存在一定的局限性。首先,我们仅选取了一个中心的资料进行回顾性分析,可能会出现数据选择上的偏倚。此外,本研究没有进一步比较APA与PPA、SPA与MPA在临床病理特征及CT征象方面的差异,我们将在后续研究中弥补以上不足。
综上所述,浸润性肺腺癌的不同病理亚型具有不同的临床病理及影像学特征。在临床病理特征方面,男性、吸烟、低分化、淋巴结转移及TNM分期III-IV期多见于以实体/微乳头状生长方式为主的浸润性腺癌;在CT特征方面,大病灶、实性密度、钙化、坏死及胸腔积液多见于以实体/微乳头状生长方式为主的浸润性腺癌,而血管集束征、充气支气管征多见于以贴壁/腺泡/乳头状生长方式为主的浸润性腺癌。熟悉这些差异有助于鉴别浸润性肺腺癌的病理亚型,为其预后评估提供更多有价值的线索。
| [1] |
刘琳, 焦宗林, 曾媛, 等. 浸润性肺腺癌不同病理亚型的研究进展[J]. 癌症进展, 2020, 18(5): 436-438, 466. LIU L, JIAO Z L, ZENG Y, et al. Advances in different subtypes of invasive lung adenocarcinoma[J]. Oncol Prog, 2020, 18(5): 436-438, 466. DOI:10.11877/j.issn.1672-1535.2020.18.05.02 |
| [2] |
TRAVIS W D, BRAMBILLA E, NOGUCHI M, et al. International association for the study of lung cancer/American thoracic society/European respiratory society international multidisciplinary classification of lung adenocarcinoma[J]. J Thorac Oncol, 2011, 6(2): 244-285. DOI:10.1097/JTO.0b013e318206a221 |
| [3] |
LANTUEJOUL S, ROUQUETTE I, BRAMBILLA E, et al. New WHO classification of lung adenocarcinoma and preneoplasia[J]. Ann Pathol, 2016, 36(1): 5-14. DOI:10.1016/j.annpat.2015.11.010 |
| [4] |
TSUTA K, KAWAGO M, INOUE E, et al. The utility of the proposed IASLC/ATS/ERS lung adenocarcinoma subtypes for disease prognosis and correlation of driver gene alterations[J]. Lung Cancer, 2013, 81(3): 371-376. DOI:10.1016/j.lungcan.2013.06.012 |
| [5] |
CAO Y, ZHU L Z, JIANG M J, et al. Clinical impacts of a micropapillary pattern in lung adenocarcinoma: a review[J]. Onco Targets Ther, 2016, 9: 149-158. DOI:10.2147/OTT.S94747 |
| [6] |
曾庆鹏, 赵峻. 基于国际新分类肺腺癌亚型的临床研究进展[J]. 肿瘤学杂志, 2019, 25(5): 387-393. ZENG Q P, ZHAO J. Progress on clinical research of lung adenocarcinoma subtypes based on new international new classification[J]. J Chin Oncol, 2019, 25(5): 387-393. |
| [7] |
QIAN F F, YANG W J, WANG R, et al. Prognostic significance and adjuvant chemotherapy survival benefits of a solid or micropapillary pattern in patients with resected stage IB lung adenocarcinoma[J]. J Thorac Cardiovasc Surg, 2018, 155(3): 1227-1235. DOI:10.1016/j.jtcvs.2017.09.143 |
| [8] |
PYO J S, KIM J H. Clinicopathological significance of micropapillary pattern in lung adenocarcinoma[J]. Pathol Oncol Res, 2018, 24(3): 547-555. DOI:10.1007/s12253-017-0274-7 |
| [9] |
MATSUZAWA R, KIRITA K, KUWATA T, et al. Factors influencing the concordance of histological subtype diagnosis from biopsy and resected specimens of lung adenocarcinoma[J]. Lung Cancer, 2016, 94: 1-6. DOI:10.1016/j.lungcan.2016.01.009 |
| [10] |
CHANG C, SUN X Y, ZHAO W L, et al. Minor components of micropapillary and solid subtypes in lung invasive adenocarcinoma (≤ 3 cm): PET/CT findings and correlations with lymph node metastasis[J]. Radiol Med, 2020, 125(3): 257-264. DOI:10.1007/s11547-019-01112-x |
| [11] |
LEDERLIN M, PUDERBACH M, MULEY T, et al. Correlation of radio- and histomorphological pattern of pulmonary adenocarcinoma[J]. Eur Respir J, 2013, 41(4): 943-951. DOI:10.1183/09031936.00056612 |
| [12] |
YOSHIDA Y, NITADORI J I, SHINOZAKI-USHIKU A, et al. Micropapillary histological subtype in lung adenocarcinoma of 2 cm or less: impact on recurrence and clinical predictors[J]. Gen Thorac Cardiovasc Surg, 2017, 65(5): 273-279. DOI:10.1007/s11748-017-0747-3 |
| [13] |
SUZUKI K, KUSUMOTO M, WATANABE S, et al. Radiologic classification of small adenocarcinoma of the lung: radiologic-pathologic correlation and its prognostic impact[J]. Ann Thorac Surg, 2006, 81(2): 413-419. DOI:10.1016/j.athoracsur.2005.07.058 |
| [14] |
CARMELIET P, JAIN R K. Molecular mechanisms and clinical applications of angiogenesis[J]. Nature, 2011, 473(7347): 298-307. DOI:10.1038/nature10144 |
| [15] |
LIN L Y, ZHANG Y, SUO S T, et al. Correlation between dual-energy spectral CT imaging parameters and pathological grades of non-small cell lung cancer[J]. Clin Radiol, 2018, 73(4): 412. DOI:10.1016/j.crad.2017.11.004 |
| [16] |
IWANO S, ITO R, UMAKOSHI H, et al. Evaluation of lung cancer by enhanced dual-energy CT: association between three-dimensional iodine concentration and tumour differentiation[J]. Br J Radiol, 2015, 88(1055): 20150224. DOI:10.1259/bjr.20150224 |
| [17] |
ZHU Y H, WANG X, ZHANG J, et al. Low enhancement on multiphase contrast-enhanced CT images: an independent predictor of the presence of high tumor grade of clear cell renal cell carcinoma[J]. AJR Am J Roentgenol, 2014, 203(3). DOI:10.2214/AJR.13.12297 |



