2. 200025 上海,上海交通大学医学院附属瑞金医院超声科;
3. 400010 重庆,重庆医科大学第二附属医院超声科;
4. 200233 上海,上海交通大学附属第六人民医院超声科,上海超声医学研究所
2. Department of Ultrasonography, Ruijin Hospital Affiliated to Shanghai Jiaotong University School of Medicine, Shanghai, 200025;
3. Department of Ultrasonography, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010;
4. Department of Ultrasonography, Shanghai Institute of Ultrasound Medicine, Sixth People's Hospital Affiliated to Shanghai Jiaotong University, Shanghai, 200233, China
靶向纳米颗粒因其能将治疗药物递送至目标肿瘤,并被肿瘤细胞特异性摄取而引起了广泛关注[1-2]。然而,由于血管内血流的冲刷及剪切力的作用阻碍了靶向纳米颗粒向血管壁靠近,进一步影响了纳米粒穿过血管与肿瘤细胞相互作用[3-4]。磁靶向是一种通过磁场产生物理磁吸引力,吸引纳米粒在实体瘤内长时间停留并通过磁力克服血管内血流的冲刷和剪切力,促进纳米粒向血管壁靠近的技术[5]。LVBBE等[6]已将这项技术用于人体表皮肿瘤的治疗。然而,传统磁靶向磁场的产生通常源自体外磁装置,这使得磁场的穿透深度随着组织深度的增加而逐渐缩短[7],深部组织由于磁力强度不足而较难受到磁场调控,这阻碍了磁靶向的进一步应用。
针对这一问题,本研究拟制备一种可注射的可磁化聚乳酸G-羟基乙酸共聚物(PLGA)掺杂钕铁硼(NdFeB)的生物磁铁(NdFeB/Fe3O4/PLGA,NFP)植入体。该植入体可在超声监控下通过注射器注入肿瘤中心位置并经溶剂交换后,由液体相转变为固体固定于肿瘤的中心位置,经磁化后作为生物磁体在体内产生磁场。同时,我们将利用该磁场通过所产生的磁力吸引磁性纳米颗粒特异性他富集于肿瘤部位这一特性,拟制备一种生物安全性好、具有磁响应能力磁性脂质体纳米粒(magnetic liposome nanoparticles, MLPs),与上述体内生物磁铁响应,以期实现高效的纳米粒在肿瘤的靶向富集。
1 材料与方法 1.1 材料、仪器及实验动物材料包括:乙酰丙酮铁[Fe(acac)3],油酸,油胺,N-甲基吡咯烷酮(N-methl-2-pyrrolidone,NMP,Sigma,美国)、PLGA(50:50 MW:40 000,济南岱罡生物科技有限公司)、NdFeB,细胞毒性检测试剂盒(上海碧云天生物技术有限公司),胎牛血清(Gbico, 美国),胆固醇,聚乙二醇-二硬脂酰磷脂酰乙醇胺(DSPE-PEG2000-NH2),二棕榈酰磷脂酰胆碱(DPPC,上海艾伟特科技有限公司),cy5.5-NHS(百灵威化学技术有限公司)。仪器包括:小动物活体荧光(VIEWORKS,韩国),酶标仪(TECAN,德国),透射电镜(JEM-2100F),扫描电镜(S4800),磁力测量计(HT108毫特斯拉计),充磁机(上海格磁电科技公司MEG2540D)。4T1细胞、HUVEC细胞购自中国科学院细胞库。4~6周SPF级雌性裸鼠30只,体质量18~22 g,购置并且饲养于上海市第六人民医院实验动物中心,动物实验符合上海市第六人民医院实验动物中心相关规定。
1.2 NFP生物磁铁的制备及表征首先将PLGA与NMP按1 mg :2 mL的比例将PLGA溶解于NMP中配制成均匀黄色混合液体。将NdFeB和Fe3O4粉末按质量比为6 :1的比例混合并在球磨机中均质化30 min,然后用天平称取一定量的NdFeB和Fe3O4混合均匀粉末加入PLGA/NMP溶液,使其最终溶液和粉末质量分数比为3 :5。所得黑色的NdFeB/Fe3O4/PLGA溶液在4 ℃下保存。将之前制备好的NdFeB/Fe3O4/PLGA溶液,放入1 mL注射器中,匀速注入生理盐水中,待NdFeB/Fe3 O4/PLGA变为固体后取出。将已经固体化的NdFeB/Fe3O4/PLGA生物磁铁,放置24 h,待其完全干燥后,用扫描电镜和能谱扫描进行观察和分析。
1.3 MLPs的制备及表征首先,用热分解成法制备脂溶性的超顺磁性Fe3O4纳米粒核。将1.40 g Fe(acac)3、8.90 g油酸和8.13 g油胺放入三口烧瓶中,搅拌并加热至120 ℃,保持2 h,整个操作过程在氮气保护条件下进行。然后分别依次升至220 ℃和300 ℃并各保持30 min,最后将黑色混合物冷却至室温并用正己烷和乙醇洗涤3次。最后,将洗涤过的混合物溶解在氯仿中,所得的脂溶性Fe3O4黑色溶液可在4 ℃条件下储存。用透射电镜表征其大小与形貌。将DPPC、DSPE-PEG2000-NH2、胆固醇、脂溶性Fe3O4按照70 :10 :10 :20的比例溶于10 mL氯仿中,装圆底烧瓶,使用减压旋转蒸发仪蒸干氯仿溶剂(60 ℃、100 r/min、1 h),之后加入PBS,在4 ℃恒温水浴条件下,将瓶壁上的黑灰色膜均匀分散。分散后的液体进行声振乳化(100 W、4 min)获得黑色悬浮液保存于4 ℃冰箱。使用透射电镜和马尔文粒径分析仪进行表征。
1.4 MLPs的体外溶血实验使用改良的体外溶血法对MLPs进行体外溶血评价。新西兰白兔耳中动脉采血,去除纤维蛋白,1 500 r/min、离心15 min分离红细胞,并以0.9%氯化钠注射液洗涤红细胞3~4次,直至离心后上层液不显红色。按所得红细胞体积加0.9%氯化钠溶液配制成5%的红细胞悬液,摇匀。取洁净离心管9支,编号,1~3号为实验组,4~6号为阳性对照组,7~9号为阴性对照组。依次向5%红细胞悬液加入浓度为1 mg/mL MLPs溶液(实验组)、蒸馏水(阳性对照组)及0.9%氯化钠溶液(阴性对照组)各1 mL,使离心管内溶液总体积为3 mL。在37 ℃的条件下孵育6 h,测量以上溶液在波长545 nm时的紫外光密度值D(545),并按以下公式计算。
溶血率高于5%即算溶血。
1.5 NFP生物磁铁体外磁性测试分别制备体积为25、50、75、100 μL的NFP生物磁铁固体,使用充磁机对其进行充磁并且用毫特斯拉计检测其充磁后的磁性。
1.6 体外细胞毒性实验在5% CO2、37 ℃的条件下孵育培养4T1细胞和HUVEC细胞,取对数期的细胞铺入96孔板。分别将NFP生物磁铁和MLPs按NFP生物磁铁25、50、75、100 μL的体积和MLPs 10、50、100、200 μg/mL的浓度进行分组,加入96孔板共孵育24 h和48 h。共孵育完成后,用PBS冲洗3次,每孔加入含10% CCK-8增殖/毒性探针的DMEM完全培养基100 μL,培养2 h后,用酶标仪测定每孔在波长450 nm的光密度值D(450),并用以下公式测定细胞存活率。
1.7 NFP生物磁铁体外磁靶向吸引MLPs富集效率的实验使用蠕动泵进行体外循环模拟实验,使用输液管模拟血管,将充磁完毕的NFP生物磁铁紧贴管壁,分别取循环运行0 h和2 h后的液体,使用ICP-OES行浓度定量分析,用以下公式进行体外磁靶向效率计算[8]。
使用碳二亚胺法将MLPs连接cy5.5探针,使用荧光成像观察材料在管壁上的停留情况。
1.8 小动物活体荧光检测NFP生物磁铁在裸鼠肿瘤内原位磁靶向吸引MLPs的富集效果在5% CO2、37 ℃的条件下孵育培养4T1细胞,取对数期细胞建立裸鼠4T1皮下移植瘤模型。待肿瘤长至大小约1 cm3时进行实验。将荷瘤裸鼠分为3组,第1组荷瘤裸鼠尾静脉单独注射cy5.5标记的MLPs;第2组在超声可视化监控下对裸鼠肿瘤中心部位进行注射NFP生物磁铁,24 h后通过尾静脉注射cy5.5标记的MLPs;第3组预先在超声可视化监控下对裸鼠肿瘤中心部位注射NFP生物磁铁,待24 h后NFP在体内完全固定在肿瘤部位后,对小鼠肿瘤内部NFP进行充磁,再通过尾静脉注射cy5.5标记的MLPs。对3组荷瘤裸鼠用活体荧光观察MLPs在肿瘤富集情况。
1.9 统计学分析采用Origin 8.5软件进行统计学分析,计量资料以x±s表示,多样本均数的比较采用单因素方差分析,两变量之间关系采用线性相关分析。P < 0.05为差异具有统计学意义。
2 结果 2.1 NFP生物磁铁的基本性质NFP溶液肉眼观察呈黑色液体,可通过1 mL注射器注射,在PBS中能与周围溶剂交换发生液态到固态的相变。扫描电镜和元素mapping分析结果显示:相变后的NFP生物磁铁在相变为固体后表面完整,各元素分布均匀(图 1)。

|
| A~C:NFP凝胶生物磁铁体外液固相变过程 NFP溶液可被吸入1 mL注射器中(A),再被注入生理盐水中(B),NFP溶液在生理盐水中发生相变,形成稳定的固态;D~E:NFP生物磁铁相变后不同放大倍数的扫描电镜图;F~K: NFP生物磁铁的元素Mapping图 F为扫描图,G~K分别代表元素Nd、Fe、B、O、C 图 1 NFP生物磁铁相变和形貌 |
2.2 NFP生物磁铁的体外磁性
毫特斯拉磁力探测计检测结果显示:25、50、75、100 μL的NFP生物磁铁的磁力分别为(350.14± 23.89)、(493.47±19.54)、(679.39±34.23)、(812.36± 27.99) Gs(图 2)。
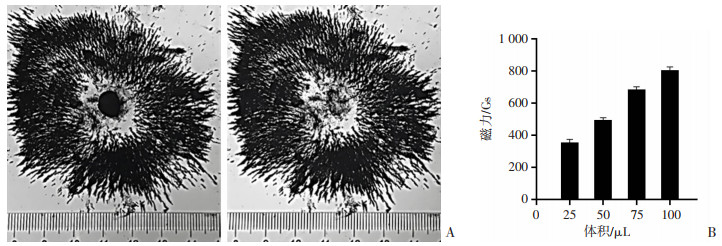
|
| A:充磁后的NFP生物磁铁能吸引周围铁粉形成磁力线;B:不同体积的NFP生物磁铁充磁后的磁力大小 图 2 NFP生物磁铁表征 |
2.3 MLPs的基本性质
脂溶性Fe3O4的透射电镜结果显示:成功制备出大小均一,粒径为(20±5) nm的Fe3O4纳米粒,可溶于有机溶剂。制备的MLPs纳米粒为黑色悬浊液,均匀分散,透射电镜结果显示:大小均一的MLPs壳层上有黑色的Fe3O4颗粒(图 3)。MLPs的粒径为(373.658±50.000)nm,电位为(-24.8±1.4)mV。

|
| A:透射电镜观察脂溶性Fe3O4;B:透射电镜观察MLPs 图 3 脂溶性Fe3O4和MLPs表征 |
2.4 MLPs的体外溶血率
将离心管在37 ℃条件下孵育6 h后,MLPs溶血率为4.20%(< 5%)。
2.5 NFP生物磁铁及MLPs细胞毒性当生物磁铁体积为0、50、75 μL和100 μL时,与4T1细胞系共孵育24 h和48 h后,细胞存活率分别为(100.00±4.34)%、(95.14±1.64)%、(92.61±1.00)%、(89.64±1.99)%和(100.00±4.34)%、(97.05±0.32)%、(91.16±1.54)%、(90.71±4.92)%,组间差异无统计学意义;与HUVEC细胞系共孵育24 h和48 h后,细胞存活率分别为(100.00±4.50)%、(96.14±1.93)%、(93.61±1.09)%、(86.64±2.05)%和(100.00±4.21)%、(92.05±0.93)%、(90.16±1.61)%、(89.71±5.37)%, 组间差异无统计学意义。当MLPs的浓度为0、10、20、50、100 μg/mL和200 μg/mL时,与4T1细胞系共孵育24 h和48 h后,细胞存活率分别为(100.00±2.99)%、(98.11±2.77)%、(95.20 ±5.06)%、(94.55±12.81)%、(94.57±7.41)%、(95.23± 8.71)%和(100.00±2.21)%、(97.70±8.99)%、(96.66±7.94)%、(95.87±14.91)%、(93.55±10.10)%、(93.15±4.48)%,各组间差异无统计学意义。与HUVEC细胞系共孵育24 h和48 h后,细胞存活率分别为(100.00±3.00)%、(93.11± 2.77)%、(92.20±5.06)%、(87.27±8.71)%、(88.55±6.81)%、(85.56±7.41)%和(100.00±6.21)%、(91.70±8.99)%、(88.66±7.94)%、(89.87±9.91)%、(87.55±10.10)%、(86.15±4.48)%,各组间差异无统计学意义。说明NFP生物磁铁和MLPs没有明显的细胞毒性。
2.6 NFP生物磁铁体吸引MLPs富集的体外磁靶向效率生物磁铁在体外模拟循环实验中期,靶向效率为65.96%,荧光成像结果显示:随着时间的变化,载荧光的MLPs在NFP生物磁铁所在的区域靶向富集(图 4)。

|
| A:循环运行0 h MLPs均匀分布;B:循环运行1 h MLPs开始在NFP生物磁铁靶向区域富集;C:循环运行2 h MLPs在NFP生物磁铁靶向区域富集明显增强 图 4 荧光成像观察体外循环模拟条件NFP生物磁铁捕获MLPS的过程 |
2.7 NFP生物磁铁吸引MLPs富集的体内靶向效果
经过超声引导注射的NFP生物磁铁可以在肿瘤的中心部位发生液固相变并使其固定,对荷瘤裸鼠实施NFP-MLPs磁靶向新方法,充磁后1 h,可见MLPs在肿瘤部位明显聚集,而未充磁组和单纯注射MLPs组均未见明显聚集(图 5、6)。

|
| A:植入前的裸鼠皮下肿瘤超声成像;B:超声可视化的植入过程;C:NFP生物磁铁通过液固相变后固定在肿瘤中心位置 图 5 超声可视化NFP生物磁铁的肿瘤原位植入过程 |
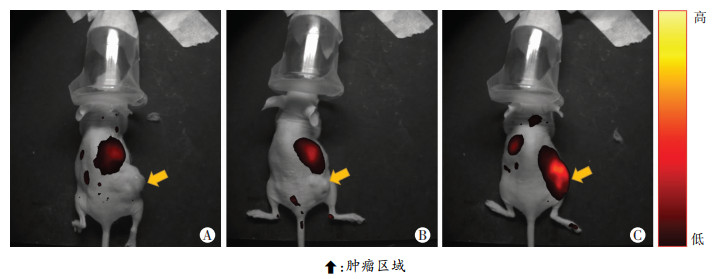
|
| A:空白对照;B:NFP生物磁铁未充磁(-)非靶向组;C:NFP生物磁铁充磁(+)靶向组 图 6 小动物活体荧光实验验证NFP-MLPs磁靶向药物递送的靶向效果 |
3 讨论
目前,磁靶向促进化疗药物的递送来治疗肿瘤已用于临床,但这种靶向方式面临着如下挑战:传统磁靶向作为物理磁靶向的方式,由于其磁性驱动装置多设置在体外,使之产生的磁力随着组织深度的增加而衰减,故其应用于深部肿瘤时,难以达到理想的靶向效率[9-10]。
本研究在之前液固相变植入体的基础上[11-12],成功制备了可在肿瘤原位被磁化的植入体(NFP),该植入体磁化后可在肿瘤原位产生磁场,通过磁力吸引具备磁响应能力的磁性脂质纳米颗粒富集于肿瘤。NFP生物磁铁在保证可注射的情况下,本研究在体外观察了它的液体到固体相变的过程,稳定的相变过程使得NFP植入体注射在肿瘤原位通过溶剂交换的原理变为固体不向周围组织外渗,超声监控的植入过程进一步证实了上述理论。同时,通过扫描电镜可见生物磁铁内的各个组分在相变后分布均匀,这可能由于NdFeB和Fe3O4粉末在制作前用球磨机预先均匀混合有关,这种均匀分布对生物磁铁充磁后能否产生均匀的磁场有着重要意义。体外生物磁铁充磁实验表明:经过充磁机处理后,NFP植入体被赋予了磁铁的性能,成为肿瘤原位生物磁铁。NFP生物磁铁的体外循环模拟靶向实验进一步证实:模拟循环中生物磁铁可以将MLPs捕获在靶向区域即生物磁铁磁场所覆盖的管壁范围内, 在流速模拟为0.3 cm/s时,其捕磁靶向获效率为65.96%。既往研究报道,使用磁场强度为1 250 Gs的永磁体作为磁靶向装置,体外循环模拟实验的捕获效率为71.4%[8],但永磁体用于活体深部组织时只能作为体外磁靶向装置使用,其原位的磁场强度会随着组织深度明显下降,其捕获效率也随之下降。但本研究中体外循环模拟实验可见NFP生物磁铁在肿瘤原位产生(812.36±27.99) Gs的磁场强度,克服了传统磁靶向面临的深部组织应用的问题,其体外循环模拟实验的结果也更加接近肿瘤内磁场覆盖的真实情况。利用乳化法制备的MLPs拥有良好的分散性,溶血实验结果显示:MLPs实验组的溶血率低于ISO规定的5%,这一结果符合静脉药物应用的安全性。细胞毒性增殖实验显示,NFP生物磁铁和MLPs对肿瘤细胞和正常细胞的生长均无明显的抑制作用,与其有良好的相容性。最后,荷瘤小鼠瘤内注射实验结果表明:生物磁体可在超声监控下注射在肿瘤中心部位,并通过液固相变作用变成固态稳定存在。将NFP生物磁铁稳定在肿瘤的中心位置,对肿瘤原位产生较均匀磁场有着重要意义,故影像监控下的植入必不可少。小动物活体荧光结果显示:MLPs成功聚集在植入生物磁铁的小鼠肿瘤内并且长时间停留,说明NFP生物磁铁作为磁靶向靶点,成功通过磁力使MLPs在肿瘤内部高效富集。
本研究制备的NFP生物磁铁植入体,虽然在细胞层面验证了其短期的细胞生物安全性,但长期的体内的毒性和如何降解代谢的过程仍有待研究。本研究中制备的MLPs并未装载任何药物,但脂质体装载阿霉素用于肿瘤化疗已经转化为临床药物,鉴于脂质体具备载药的能力,后续研究中还可进一步探索NFP生物磁铁联合载药MLPs靶向性增效化疗药物在目标区域的作用,以减少药物的全身毒副作用。随着超声造影与人工智能技术的结合,基于微气泡追踪的微血流超分辨率成像技术逐渐兴起,是未来超声的重要发展方向[13-14]。后续研究中,还可通过改变MLPs的制备方法,使之拥有超声造影剂的功能,并通过基于微气泡追踪的微血流超分辨率成像等新技术,监控NFP生物磁铁吸引下MLPs在肿瘤血管内克服血流冲刷和剪切力作用后贴壁血管的情况,对生物磁体磁靶向的效果进行更加深入的探究。
| [1] |
MASOOD F. Polymeric nanoparticles for targeted drug delivery system for cancer therapy[J]. Mater Sci Eng C Mater Biol Appl, 2016, 60: 569-578. DOI:10.1016/j.msec.2015.11.067 |
| [2] |
SHI J, KANTOFF P W, WOOSTER R, et al. Cancer nanomedicine: progress, challenges and opportunities[J]. Nat Rev Cancer, 2017, 17(1): 20-37. DOI:10.1038/nrc.2016.108 |
| [3] |
MAEDA H, WU J, SAWA T, et al. Tumor vascular permeability and the EPR effect in macromolecular therapeutics: a review[J]. J Control Release, 2000, 65(1/2): 271-284. |
| [4] |
WILHELM S, TAVARES A J, DAI Q, et al. Analysis of nanoparticle delivery to tumours[J]. Nat Rev Mater, 2016, 1(5): 16014. DOI:10.1038/natrevmats.2016.14 |
| [5] |
RIVIÈRE C, MARTINA M S, TOMITA Y, et al. Magnetic targeting of nanometric magnetic fluid loaded liposomes to specific brain intravascular areas: a dynamic imaging study in mice[J]. Radiology, 2007, 244(2): 439-448. DOI:10.1148/radiol.2442060912 |
| [6] |
LVBBE A S, BERGEMANN C, RIESS H, et al. Clinical experiences with magnetic drug targeting: a phase I study with 4'-epidoxorubicin in 14 patients with advanced solid tumors[J]. Cancer Res, 1996, 56(20): 4686-4693. |
| [7] |
SHAPIRO B, KULKARNI S, NACEV A, et al. Open challenges in magnetic drug targeting[J]. WIREs Nanomed Nanobiotechnol, 2015, 7(3): 446-457. DOI:10.1002/wnan.1311 |
| [8] |
MIRZABABAEI S N, GORJI T B, BAOU M, et al. Investigation of magnetic nanoparticle targeting in a simplified model of small vessel aneurysm[J]. J Magn Magn Mater, 2017, 426: 126-131. DOI:10.1016/j.jmmm.2016.11.044 |
| [9] |
GOODWIN S, PETERSON C, HOH C, et al. Targeting and retention of magnetic targeted carriers (MTCs) enhancing intra-arterial chemotherapy[J]. J Magn Magn Mater, 1999, 194(1/3): 132-139. DOI:10.1016/s0304-8853(98)00584-8 |
| [10] |
TAKEDA S-I, MISHIMA F, FUJIMOTO S, et al. Development of magnetically targeted drug delivery system using superconducting magnet[J]. J Magn Magn Mater, 2007, 311(1): 367-371. DOI:10.1109/tasc.2007.898413 |
| [11] |
唐秀珍, 王龙辰, 高维, 等. 磁性PLGA-NdFeB-Fe3O4原位植入物热消融治疗裸鼠乳腺癌[J]. 中国介入影像与治疗学, 2018, 15(6): 351-356. TANG X Z, WANG L C, GAO W, et al. PLGA-NdFeB-Fe3O4 implant for magnetic hyperthermia of mice bearing breast cancer[J]. Chin J Interv Imaging Ther, 2018, 15(6): 351-356. DOI:10.13929/j.1672-8475.201801012 |
| [12] |
CHEN Y, JIANG L, WANG R H, et al. Injectable smart phase-transformation implants for highly efficient in vivo magnetic-hyperthermia regression of tumors[J]. Adv Mater Deerfield Beach Fla, 2014, 26(44): 7468-7473. DOI:10.1002/adma.201402509 |
| [13] |
ZHENG Y Y, KRUPKA T, WU H P, et al. Direct measurement of blood flow velocity in small diameter vessels using contrast-enhanced ultrasound[J]. Ultrasound Med Biol, 2009, 35(8): S16. DOI:10.1016/j.ultrasmedbio.2009.06.063 |
| [14] |
ROY H S, ZUO G Q, LUO Z C, et al. Direct and Doppler angle-independent measurement of blood flow velocity in small-diameter vessels using ultrasound microbubbles[J]. Clin Imaging, 2012, 36(5): 577-583. DOI:10.1016/j.clinimag.2012.01.026 |






