2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院神经外科;
3. 400042 重庆,陆军军医大学(第三军医大学)野战外科研究所战伤休克与输血研究室,创伤、烧伤与复合伤国家重点实验室
2. Department of Neurosurgery, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. State Key Laboratory of Trauma, Burns and Combined Injury, Department of War Wound Shock and Blood Transfusion, Institute of Surgery Research, Army Medical University (Third Military Medical University), Chongqing, 400042, China
脑缺血再灌注(cerebral ischemia-reperfusion,IR)是指脑缺血致脑细胞损伤,恢复血液再灌注后细胞损伤出现进一步加重的现象[1]。再灌注会引起氧自由基(ROS)堆积、线粒体钙超载以及炎症反应过度激活,导致脑水肿和脑细胞坏死等继发性损伤,最终造成脑功能障碍甚至死亡[2]。对于缺血再灌注损伤的发生机制目前尚不清楚,再灌注损伤的防治还处于实验研究阶段。木犀草素(luteolin)是一种天然四羟基黄酮化合物,具有多种药理活性,广泛存在于蔬菜和水果中,常以糖基化形式存在。据报道,木犀草素不仅能抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡[3],还能作为还原剂增强生物体抗氧化系统的活性,减少神经病变的发生,对神经系统具有保护作用[4]。以往研究显示,木犀草素可以通过改善能量代谢、减少神经元凋亡、抑制炎症反应等多种途径改善缺血性脑组织的细胞功能[5]。最近研究发现木犀草素对于线粒体功能具有潜在调节作用[6],但具体调节机制有待深入研究。为此,本研究旨在探讨木犀草素是否可以通过线粒体途径直接保护神经元细胞免受缺血再灌注后氧化应激损伤,并深入探究其对线粒体ROS产生和清除的潜在调控机制。
1 材料与方法 1.1 主要试剂和仪器及实验分组神经母细胞瘤(SH-SY5Y)来源于中国科学院上海细胞库,传代并液氮保存于重庆医科大学第三临床实验中心。木犀草素(luteolin,纯度98%以上)购于美国Cayman化学公司(货号:10004161),使用二甲基亚砜(DMSO)溶解稀释后保存于-20 ℃中。木犀草素的给药方式如下:①动物水平:在大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)+木犀草素组,每组8只动物,大脑中动脉线栓抽出开始再灌注过程同时腹腔注射5 mg/kg木犀草素孵育24 h,MCAO组和正常组均腹腔注射同等剂量生理盐水孵育24 h。②细胞水平:在缺氧缺糖/复氧复糖(oxygen/glucose deprivation and re-oxygen/glucose,OGD/R)+木犀草素组,SH-SY5Y细胞缺氧缺糖阶段结束后更换为含有不同剂量木犀草素(10和50 μmol/L)的完全培养基孵育12 h[7],OGD/R组和正常组仅更换为完全培养基孵育12 h。TTC染色试剂(货号:T8170)购于上海索莱宝公司。MTT细胞增殖及细胞毒性检测试剂盒(货号:C0009)和活性氧检测试剂盒(货号:S0033)均购于上海碧云天公司。线粒体自噬检测试剂盒(货号:MD01)购于日本Dojindo公司。Drp1抗体(货号:ab56788)、β-actin抗体(货号:ab8226)、ANT抗体(adenine nucleotide translocase,货号:ab102032)均购于美国Abcam公司。线粒体染料(MitoTracker Deep Red FM,货号:8778)和Drp1 Ser616抗体(货号:3455)均购于美国Cell signaling公司。线粒体分离提取试剂盒(货号:MM-038)购于美国Invent公司。共聚焦显微镜(Leica TCS SP5,美国);双色红外荧光成像系统(Odyssey,美国);-70 ℃超低温冰箱(中科美菱,中国);超纯水系统(Heal Force,中国香港);酶联免疫检测仪(Thermo,美国)。
1.2 脑缺血再灌注MCAO模型制备方法取9只C57雄鼠(8周龄,21~25 g),10%水合氯醛(1 mL/100 g)腹腔麻醉后,将小鼠仰卧固定在手术台上;颈部备皮,取小鼠颈部正中切口,暴露左侧颈总动脉、颈外动脉和颈内动脉,将颈总动脉和颈内动脉分别放置显微动脉夹,将线栓经左颈外动脉切口插入颈内动脉,轻柔推进7~8 mm以阻止血液流入颈总动脉;将线栓与颈内动脉接近一条直线,移除颈内显微动脉夹,线栓至颈内动脉颅内段时迅速推进,遇到轻微阻力即可停止,阻断大脑中动脉。左侧大脑中动脉阻断1 h后将线栓抽出以实现颈内动脉血液再灌注24 h。
1.3 OGD/R模型制备将SH-SY5Y细胞接种在培养皿中,然后将培养基更换为低糖无血清培养基,待贴壁完全、细胞覆盖率在50%以上后,置于37 ℃密封罐中,进行缺氧处理。缺氧步骤为先通入缺氧气体(95%氮气和5%二氧化碳)15 min后关闭通气阀,10 min后重新开启通入缺氧气体,重复4次直到密封罐内氧气浓度低于0.2%并维持缺氧状态4 h。然后将培养基更换为完全培养基模拟复糖复氧状态,转入37 ℃培养箱中孵育12 h[8]。
1.4 靶向药物筛选分析利用CMap数据库(https://clue.io/query),对GSE63数据集中的抗氧化剂+IR组与IR组进行比对,获得差异基因,上传到CMap数据库query工具中,与其他药物基因表达谱数据进行比对并绘制比对曲线。筛选得到的药物相关实验次数越多,正数富集分数越高(通常选择90分以上),作用机制与抗氧化剂在IR治疗中的作用越类似。按实验次数>3,P < 0.05进行筛选。
1.5 TTC染色方法将每组用于TTC染色的小鼠脑组织取出,在-20 ℃条件下冷冻1~2 h,在冰盒上用刀片去除绣球和小脑,将大脑平均切成5片薄片,放入1%TTC染液中(PBS配制,注意避光),37 ℃染10~15 min,期间不断翻动切片,保证切片均匀着色,再将切片有顺序地摆放整齐,拍摄照片,通过软件计算梗死面积。
1.6 MTT细胞活力检测将SH-SY5Y细胞接种在96孔板中,待细胞贴壁单层铺满孔底后,加入由DMSO稀释不同浓度的木犀草素药物100 μL,设5个复孔。进行OGD/R处理后每孔加入10 μL MTT溶液(5 mg/mL),继续培养4 h。小心吸去孔内培养液,终止培养。每孔加入100 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的光密度值[D(490)]。同时设置调零孔(只加培养基100 μL,MTT 10 μL,二甲基亚砜100 μL)和空白孔(SH-SY5Y细胞、DMSO、培养基100 μL、MTT 10 μL、二甲基亚砜100 μL)。计算公式为细胞活力MTT值=[实验组D(490)值-空白组D(490)值]/[对照组D(490)值-空白组D(490)值]。
1.7 线粒体ROS含量测定将SH-SY5Y细胞接种在共聚焦培养皿中,贴壁后进行不同处理。PBS洗涤后,加入1%的ROS荧光探针,37 ℃孵育30 min。孵育结束后用PBS重复洗涤3次,将培养皿置于共聚焦显微镜下观察(绿色荧光激发波488 nm,红色荧光激发波633 nm)。
1.8 线粒体自噬流检测将SH-SY5Y细胞接种在共聚焦培养皿中,贴壁后进行不同处理。PBS洗涤后,按照试剂盒说明书[9]进行操作,在共聚焦显微镜下分别检测线粒体自噬小体形成和自噬溶酶体形成的完整自噬流过程。其中红色荧光强度代表自噬小体含量,反映自噬小体形成情况;而紫色荧光标记的线粒体和绿色荧光标记的溶酶体共定位情况代表线粒体自噬溶酶体含量,反映自噬溶酶体形成情况。
1.9 免疫荧光观察线粒体形态将SH-SY5Y细胞接种在共聚焦培养皿中,待贴壁完全细胞覆盖率在50%左右时,进行木犀草素和OGD/R处理。用PBS清洗3次后,加入用无血清培养基稀释MitoTracker Deep Red FM染料(1 :10 000),37 ℃孵育30 min,然后用无钙台式液清洗3次后,在激光共聚焦显微镜下观察细胞中线粒体形态。红色荧光激发波为633 nm,可见范围为655~670 nm。使用Image J软件对共聚焦图片中MitoTracker标记的线粒体的长度进行统计。
1.10 Western blot检测Drp1表达变化用刮板将经过处理的SH-SY5Y细胞从培养瓶壁上刮下收集在10 mL离心管中。4 ℃条件下1 200×g离心15 min,取上清加入上样缓冲液混匀后,105 ℃加热6 min使蛋白变性,冰上降温后放入蛋白盒-4 ℃保存。制备蛋白样品后使用10%的SDS PAGE凝胶电泳分离蛋白(100 V恒压,240 min)。湿转法将蛋白转移到PVDF膜上(350 mA恒流,90 min)。用5%脱脂奶粉封闭2 h后,用TBST洗涤3次,Drp1抗体、β-actin抗体和ANT抗体4 ℃孵育过夜,TBST洗涤3次,二抗室温孵育1 h,TBST洗涤4次后,使用Odysey双色红外荧光成像系统检测膜上目的蛋白表达变化。
1.11 统计学分析使用SPSS 17.0统计软件。定量资料以x±s表示,两组间均数比较采用独立样本t检验,多组间均数比较采用单因素方差分析,采用SNK法或者LSD法进行多重比较。检验水准α=0.05。
2 结果 2.1 靶向药物筛选发现木犀草素可能对脑缺血再灌注损伤有保护作用利用CMap公共数据库(https://clue.io/query)对缺血再灌注损伤具有潜在治疗效果的抗氧化剂进行筛选。发现木犀草素作为具有PI3K抑制效果的抗氧化剂,靶向药物分数为96.86,评分>90,提示在脑缺血再灌注治疗中可能具有重要作用(表 1、图 1A)。利用经典MCAO模型在动物水平模拟脑缺血再灌注,TTC染色结果显示MCAO组脑梗死面积为0.406 8 cm2,梗死率为15.75%,与正常组比较差异具有统计学意义(P < 0.05)。而使用木犀草素(5 mg/kg)干预后脑梗死面积减少为0.150 3 cm2,与MCAO组比较差异具有统计学意义(P < 0.05,图 1B、C),证实木犀草素对于脑缺血再灌注损伤有一定的治疗效果。
| 分数 | Pubchem ID号 | 名称 | 功能描述 |
| 90.57 | BRD-K19220233 | JNK-9L | JNK/p38抑制剂 |
| 91.62 | BRD-K00317371 | RITA | MDM抑制剂 |
| 91.90 | BRD-K91623615 | ABT-751 | Tubulin微管抑制剂 |
| 92.24 | BRD-K92991072 | PAC-1 | Caspase激动剂 |
| 93.38 | BRD-K63606607 | bufalin(布法林) | ATPase抑制剂 |
| 93.39 | BRD-K88568253 | iproniazid(异丙嗪) | 单胺氧化酶抑制剂 |
| 93.64 | BRD-K59753975 | vindesine(长春地辛) | Tubulin微管抑制剂 |
| 94.42 | BRD-A13122391 | triptolide(雷公藤内酯) | RNA聚合酶抑制剂,具有抗炎效果 |
| 94.79 | BRD-A24543851 | nornicotine(去甲烟碱) | 乙酰胆碱受体激动剂 |
| 95.79 | BRD-K82109576 | vincristine(长春新碱) | Tubulin微管抑制剂 |
| 95.94 | BRD-U82589721 | HG-5-113-01 | 蛋白激酶抑制剂 |
| 96.73 | BRD-K79090631 | CGP-60474 | CDK /VEGFR-2 /PKC抑制剂 |
| 96.86 | BRD-M16762496 | luteolin(木犀草素) | PIK-75/蛋白激酶抑制剂/PI3K抑制剂 |
| 97.96 | BRD-U51951544 | ZG-10 | JNK/p38抑制剂 |
| 97.99 | BRD-A11702965 | chromomycin-a3 | DNA结合剂 |

|
|
A:脑缺血再灌注损伤抗氧化剂靶向药物筛选比对曲线;B:TTC染色显示各组脑梗死面积;C:各组脑梗死面积统计分析(n=3) a: P < 0.05,与正常组比较; b: P < 0.05,与MCAO组比较 图 1 木犀草素靶向药物筛选及对MCAO模型脑梗死的改善作用 |
2.2 木犀草素减少OGD/R诱导的氧化应激损伤并且具有剂量依赖性
利用OGD/R处理SH-SY5Y细胞在细胞水平模拟脑缺血再灌注模型,通过MTT细胞活力测定方法观察木犀草素是否可以减少OGD/R诱导的细胞损伤。结果显示,OGD/R后SH-SY5Y细胞的MTT值约为正常对照组的50%,使用不同剂量木犀草素(10~100 μmol/L)处理后MTT值呈剂量依赖性增加。使用50 μmol/L的木犀草素处理SH-SY5Y细胞后,MTT值增加至83% (P < 0.05)。而使用100 μmol/L的木犀草素处理SH-SY5Y细胞后,MTT值并没有进一步增加(P>0.05,图 2A)。结果显示木犀草素可以保护OGD/R后的细胞功能,并且50 μmol/L的木犀草素对OGD/R诱导细胞损伤的保护效果已经达到了饱和状态。
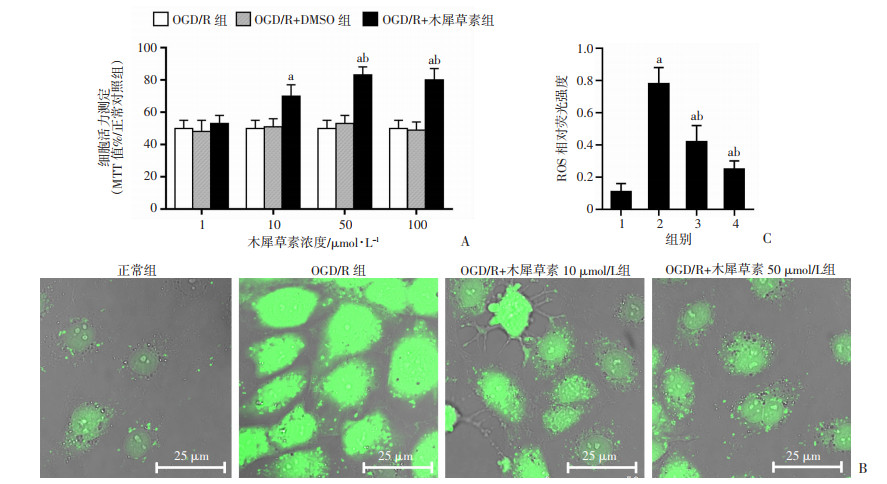
|
|
A:MTT法测定木犀草素对OGD/R处理SH-SY5Y细胞活力的影响(n=5);B:DCFH-DA荧光探针检测木犀草素对OGD/R处理SH-SY5Y细胞ROS产生的影响(n=3);a: P < 0.05,与正常组比较; b: P < 0.05,与OGD/R组比较;C:ROS相对荧光统计分析结果 1:正常组;2:OGD/R组;3:OGD/R+木犀草素10 μmol/L组;4:OGD/R+木犀草素50 μmol/L组 图 2 木犀草素对OGD/R处理SH-SY5Y细胞活力及ROS产生的影响 |
同时观察木犀草素对OGD/R后ROS产生的影响。激光共聚焦结果显示OGD/R后SH-SY5Y细胞中DCFH-DA荧光标记的ROS含量明显增加(P < 0.05),而木犀草素可以显著减弱OGD/R诱导的ROS的产生。ODG/R+木犀草素(10 μmol/L)组ROS含量是OGD/R组的53.8%(P < 0.05),ODG/R+木犀草素(50 μmol/L)组ROS含量是OGD/R组的32.1%(P < 0.05),差异均具有统计学意义,且存在剂量依赖性(图 2B)。
2.3 木犀草素通过改善自噬流减少OGD/R后破损线粒体ROS堆积为了探究木犀草素影响OGD/R后破损线粒体的堆积过程,首先在正常情况下检测自噬小体和自噬酶体形成情况,发现正常情况下自噬流过程是顺畅的(图 3)。激光共聚焦结果显示,OGD/R后线粒体自噬小体含量明显增多(红色荧光增强),但与溶酶体共定位情况明显减少(P < 0.05,图 4A),提示OGD/R后自噬流被明显抑制,破损线粒体被自噬小体包裹后生成大量线粒体自噬小体,但是无法及时有效地被溶酶体降解,造成破损线粒体的大量堆积。而木犀草素可以显著改善OGD/R后的自噬流过程(P < 0.05),减少破损线粒体的堆积,有助于OGD/R后ROS的清除。ODG/R+木犀草素(10 μmol/L)组和ODG/R+木犀草素(50 μmol/L)组线粒体自噬小体荧光强度比OGD/R组分别减少31.3%和64.6%(P < 0.05),而自噬小体与溶酶体共定位情况分别提高0.93和1.56倍(P < 0.05),提示木犀草素对OGD/R后自噬流的改善作用同样具有剂量依赖性(图 4B)。
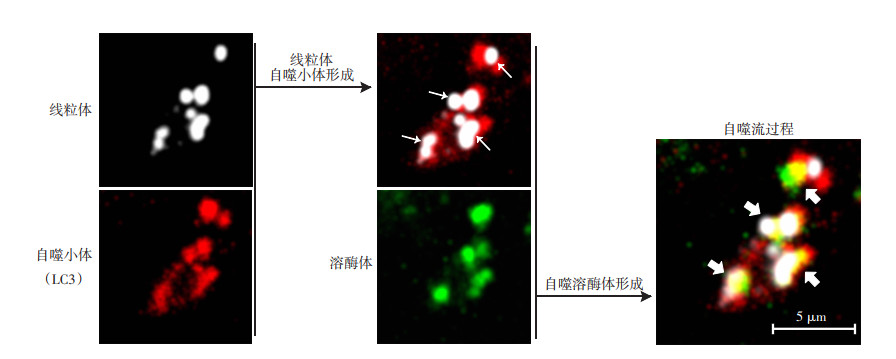
|
↑:示指自噬小体形成; :示指自噬溶酶体形成
图 3
正常情况下SH-SY5Y细胞完整自噬流过程 :示指自噬溶酶体形成
图 3
正常情况下SH-SY5Y细胞完整自噬流过程
|

|
| A:共聚焦显微镜观察木犀草素对OGD/R后自噬流的影响;B:木犀草素处理OGD/R诱导的SH-SY5Y细胞后自噬小体和自噬溶酶体统计结果(n=3) 1:正常组;2:OGD/R组;3:OGD/R+木犀草素10 μmol/L组;4:OGD/R+木犀草素50 μmol/L组;a: P < 0.05,与正常组比较; b: P < 0.05,与OGD/R组比较 图 4 木犀草素对OGD/R后自噬小体和自噬溶酶体形成的影响 |
2.4 木犀草素通过抑制Drp1活性减少OGD/R后线粒体ROS产生
Western blot结果显示,OGD/R后尽管Drp1蛋白表达没有明显变化(P>0.05),但是Drp1活性(Ser616)明显增高。木犀草素(10和50 μmol/L)处理后Drp1 Ser616磷酸化水平分别减少44.4%和85.2%(P < 0.05),提示木犀草素对OGD/R后Drp1活性有明显抑制作用。我们将线粒体成分蛋白分离提取后,Western blot结果显示,OGD/R后线粒体成分蛋白中Drp1表达明显增加(P < 0.05),细胞质成分蛋白中Drp1表达明显减低(P < 0.05),而使用木犀草素处理后可以明显抑制OGD/R后Drp1的线粒体转位情况(P < 0.05,图 5A~C)。
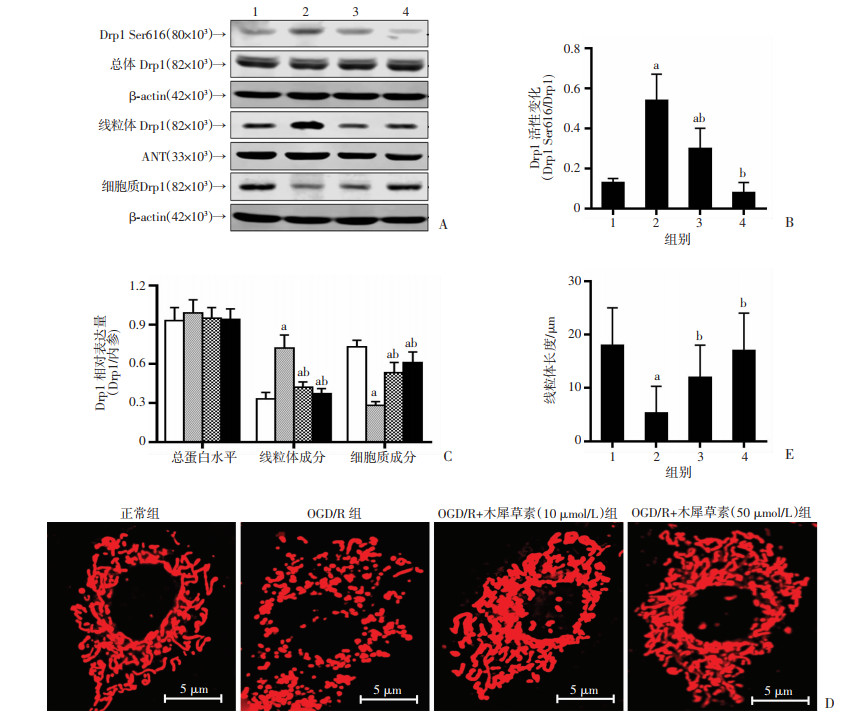
|
| A:Western blot检测结果;B:各组Drp1活性变化; C:各组成分蛋白Drp1表达变化;D、E:激光共聚焦观察木犀草素处理OGD/R诱导的SH-SY5Y细胞后线粒体形态变化及统计分析结果(n=3) 1:正常组;2:OGD/R组;3:OGD/R+木犀草素10 μmol/L组;4:OGD/R+木犀草素50 μmol/L组;a: P < 0.05,与正常组比较; b: P < 0.05,与OGD/R组比较 图 5 木犀草素对OGD/R后Drp1活性及SH-SY5Y细胞线粒体形态的影响 |
进一步观察木犀草素对OGD/R后SH-SY5Y细胞线粒体形态的影响,结果显示,OGD/R后活化Drp1发生线粒体转位后会造成线粒体碎片化,导致破损线粒体数量增加,线粒体长度明显缩短(P < 0.05),而木犀草素处理后线粒体形态和数量明显改善(P < 0.05,图 5D~E),提示木犀草素可以通过抑制Drp1活性减少破损线粒体的产生,进而抑制了OGD/R后ROS的过度生成。结果显示木犀草素除了可以通过改善自噬流增加OGD/R后ROS的清除效率,还可通过保护线粒体形态减少ROS产生,而这个过程可能与木犀草素对线粒体分裂蛋白Drp1的活性抑制有关。
3 讨论木犀草素是一种天然黄酮类化合物,广泛存在于西兰花、芹菜、苹果皮、卷心菜、胡萝卜等多种水果和蔬菜中[4]。由于其高效性和低副作用,木犀草素的药理学作用及机制近年来受到了广泛的关注。前期研究表明,木犀草素作为一种PI3K抑制剂可以通过抑制肿瘤细胞增殖、诱导细胞凋亡以及增敏抗癌药物活性等途径对于多种人类恶性肿瘤都有不同程度治疗效果[10-11]。近年来,大量研究表明木犀草素还是一种良好的神经保护剂,XU等[12]的研究发现2 nmol/L的木犀草素可以增强海马齿状回的突触传递,引发长时程增强,保护神经系统的学习和记忆能力。5 mg/kg木犀草素急性给药可以增加十字迷宫实验中小鼠进入开放臂区的次数和孔板实验中小鼠的探头次数,具有明显抗焦虑效果[13]。最新研究显示[14],木犀草素对于线粒体功能具有潜在调节作用,但具体机制并未完全阐明。本研究发现木犀草素可以通过线粒体保护机制改善脑缺血再灌注后氧化应激损伤,并且对于“活化Drp1诱导的破损线粒体增多导致ROS过度生成”过程和“自噬流受阻引起的破损线粒体无法及时降解导致ROS清除减少”过程都有明显调节作用。
Drp1是GTPase超家族成员,作为一种机械化学蛋白参与了线粒体分裂及线粒体功能调控等多种生命过程。近年来研究表明Drp1不同位点活性变化对于Drp1蛋白功能、线粒体稳态调节以及疾病的发生、发展都具有重要影响。我们前期在心脏[15]、血管[16-17]和肠道[18]的缺血性损伤中均发现线粒体分裂蛋白Drp1活化后可以诱导线粒体过度分裂,导致ROS大量生成。活性氧(ROS)是由氧连续单电子还原产生的一系列具有活泼化学反应的中间产物,具有双重效应,高浓度ROS可引起脂类过氧化、破坏蛋白质核酸结构和功能,引起机体损伤;而低浓度ROS可以充当信号分子参与机体正常生命活动。为防御ROS对机体造成的损害,体内存在辅酶Q、谷胱甘肽等抗氧化物质可以及时清除自由基而维护机体正常生理情况下ROS产生和清除平衡。在脑缺血再灌注后,线粒体损伤会导致ROS过度生成,通过诱导NLRP3等一系列炎症反应造成机体继发性损伤[2]。因此,降低线粒体ROS水平、及时清除受损线粒体、减少氧化应激损伤对脑缺血再灌注后细胞功能保护具有重要意义。本研究我们在OGD/R处理的SH-SY5Y细胞中同样观察到Drp1活性增高及破损线粒体增多的现象,而木犀草素可以抑制Drp1活性,减少其线粒体转位,最终达到保护脑缺血再灌注损伤后线粒体形态、减少ROS产生的效果。
线粒体自噬流包括线粒体自噬小体形成和自噬溶酶体降解两个过程。当饥饿、缺氧、应激等多种因素诱导自噬启动后,细胞内双层膜结构会包裹受损细胞器、变性蛋白核酸等物质形成自噬小体,再通过酸化与溶酶体融合形成自噬溶酶体,最终被各种溶解酶降解[19]。正常情况下线粒体自噬流可通过调控线粒体分裂融合,清除整个损坏或多余的线粒体,促进线粒体更新及ROS清除,对线粒体质量控制和防止氧化应激损伤具有重要意义。研究表明在多种神经系统疾病中均存在线粒体自噬异常,导致损伤线粒体聚集引起神经轴突退化变性、神经元萎缩及死亡等[20-22]。本研究发现木犀草素可以改善OGD/R后的自噬流过程,促进线粒体自噬小体的降解,最终达到加速脑缺血再灌注损伤后破损线粒体清除,减少ROS堆积的目的。我们前期研究发现活化Drp1对于谷胱甘肽代谢、辅酶Q等ROS清除机制也有重要影响[18, 22],并且我们在缺血损伤的血管组织中发现Drp1活化后可以通过Clec16a抑制Parkin的线粒体转位,对于线粒体自噬通路也有重要调节作用[16]。在线粒体去极化后,Drp1和PARKIN会共同募集到线粒体外膜PINK1周围介导自噬[23]。在心肌缺血损伤中,Ulk1诱导的高尔基体膜上磷酸化Rab9还可以与受损线粒体外膜上Rip1诱导的活化Drp1结合形成Ulk1-Rab9-Rip1-Drp1蛋白复合体参与线粒体自噬过程[24]。提示木犀草素对于脑缺血再灌注氧化应激损伤的保护机制中内在联系还需要深入探究。
综上,本研究发现木犀草素作为一种抗氧化剂对于脑缺血再灌注后氧化应激损伤具有明显保护作用,一方面它可以通过改善自噬流过程促进线粒体自噬小体的降解,加速ROS的清除效率;另一方面它还可以通过抑制Drp1活性保护线粒体形态,减少ROS的产生,最终防止脑缺血再灌注后ROS大量堆积,减少脑损伤。本研究为脑缺血再灌注损伤“清除与减少自由基”的防治策略及相关药物研发提供了实验依据,并且进一步证实“氧自由基稳态调节”是脑缺血再灌注防治的关键靶点。而针对木犀草素抑制ROS生成机制和加速ROS清除机制之间的内在联系,还需要后续深入探究。
| [1] |
LIU Z, ZENG X, DUAN C. Neuropsychological rehabilitation and psychotherapy of adult traumatic brain injury patients with depression: a systematic review and meta-analysis[J]. J Neurosurg Sci, 2018, 62(1): 24. DOI:10.23736/S0390-5616.17.03953-4 |
| [2] |
MINUTOLI L, PUZZOLO D, RINALDI M, et al. ROS-mediated NLRP3 inflammasome activation in brain, heart, kidney, and testis ischemia/reperfusion injury[J]. Oxidative Med Cell Longev, 2016, 2016: 2183026. DOI:10.1155/2016/2183026 |
| [3] |
IMRAN M, RAUF A, ABU-IZNEID T, et al. Luteolin, a flavonoid, as an anticancer agent: a review[J]. Biomed Pharmacother, 2019, 112: 108612. DOI:10.1016/j.biopha.2019.108612 |
| [4] |
NABAVI S F, BRAIDY N, GORTZI O, et al. Luteolin as an anti-inflammatory and neuroprotective agent: a brief review[J]. Brain Res Bull, 2015, 119: 1-11. DOI:10.1016/j.brainresbull.2015.09.002 |
| [5] |
AZIZ N, KIM M Y, CHO J Y, et al. Anti-inflammatory effects of luteolin: A review of in vitro, in vivo, and in silico studies[J]. J Ethnopharmacol, 2018, 225: 342-358. DOI:10.1016/j.jep.2018.05.019 |
| [6] |
WANG Q, WANG H, JIA Y, et al. Luteolin induces apoptosis by ROS/ER stress and mitochondrial dysfunction in gliomablastoma[J]. Cancer Chemother Pharmacol, 2017, 79(5): 1031-1041. DOI:10.1007/s00280-017-3299-4 |
| [7] |
LI L, ZHANG B, TAO Y Q, et al. DL-3-n-butylphthalide protects endothelial cells against oxidative/nitrosative stress, mitochondrial damage and subsequent cell death after oxygen glucose deprivation in vitro[J]. Brain Res, 2009, 1290: 91-101. DOI:10.1016/j.brainres.2009.07.020 |
| [8] |
MO Y, ZHU J L, JIANG A, et al. Compound 13 activates AMPK-Nrf2 signaling to protect neuronal cells from oxygen glucose deprivation-reoxygenation[J]. Aging (Albany NY), 2019, 11(24): 12032-12042. DOI:10.18632/aging.102534 |
| [9] |
ADEGOKE E O, ADENIRAN S O, ZENG Y, et al. Pharmacological inhibition of TLR4/NF-κB with TLR4-IN-C34 attenuated microcystin-leucine arginine toxicity in bovine Sertoli cells[J]. J Appl Toxicol, 2019, 39(6): 832-843. DOI:10.1002/jat.3771 |
| [10] |
CHENG W Y, CHIAO M T, LIANG Y J, et al. Luteolin inhibits migration of human glioblastoma U-87 MG and T98G cells through downregulation of Cdc42 expression and PI3K/AKT activity[J]. Mol Biol Rep, 2013, 40(9): 5315-5326. DOI:10.1007/s11033-013-2632-1 |
| [11] |
MEI Z B, DUAN C Y, LI C B, et al. Prognostic role of tumor PIK3CA mutation in colorectal cancer: a systematic review and meta-analysis[J]. Ann Oncol, 2016, 27(10): 1836-1848. DOI:10.1093/annonc/mdw264 |
| [12] |
XU B, LI X X, HE G R, et al. Luteolin promotes long-term potentiation and improves cognitive functions in chronic cerebral hypoperfused rats[J]. Eur J Pharmacol, 2010, 627(1/2/3): 99-105. DOI:10.1016/j.ejphar.2009.10.038 |
| [13] |
COLETA M, CAMPOS M G, COTRIM M D, et al. Assessment of luteolin (3', 4', 5, 7-tetrahydroxyflavone) neuropharmacological activity[J]. Behav Brain Res, 2008, 189(1): 75-82. DOI:10.1016/j.bbr.2007.12.010 |
| [14] |
XU H X, YU W J, SUN S Q, et al. Luteolin attenuates doxorubicin-induced cardiotoxicity through promoting mitochondrial autophagy[J]. Front Physiol, 2020, 11: 113. DOI:10.3389/fphys.2020.00113 |
| [15] |
DUAN C Y, CAO ZZ, TANG F Q, et al. MiRNA-mRNA crosstalk in myocardial ischemia induced by calcified aortic valve Stenosis[J]. Aging, 2019, 11(2): 448-466. DOI:10.18632/aging.101751 |
| [16] |
DUAN C Y, KUANG L, XIANG X M, et al. Drp1 regulates mitochondrial dysfunction and dysregulated metabolism in ischemic injury via Clec16a-, BAX-, and GSH-pathways[J]. Cell Death Dis, 2020, 11(4): 251. DOI:10.1038/s41419-020-2461-9 |
| [17] |
DUAN C Y, CHEN K, YANG G M, et al. HIF-1α regulates Cx40-dependent vasodilatation following hemorrhagic shock in rats[J]. Am J Transl Res, 2017, 9(3): 1277-1286. |
| [18] |
DUAN C Y, KUANG L, XIANG X M, et al. Activated Drp1-mediated mitochondrial ROS influence the gut microbiome and intestinal barrier after hemorrhagic shock[J]. Aging, 2020, 12(2): 1397-1416. DOI:10.18632/aging.102690 |
| [19] |
YIN Y, SUN G, LI E, et al. ER stress and impaired autophagy flux in neuronal degeneration and brain injury[J]. Ageing Res Rev, 2017, 34(34): 3-14. DOI:10.1016/j.arr.2016.08.008 |
| [20] |
FANG E F, HOU Y J, PALIKARAS K, et al. Mitophagy inhibits amyloid-β and tau pathology and reverses cognitive deficits in models of Alzheimer's disease[J]. Nat Neurosci, 2019, 22(3): 401-412. DOI:10.1038/s41593-018-0332-9 |
| [21] |
THORNTON C, JONES A, NAIR S, et al. Mitochondrial dynamics, mitophagy and biogenesis in neonatal hypoxic-ischaemic brain injury[J]. FEBS Lett, 2018, 592(5): 812-830. DOI:10.1002/1873-3468.12943 |
| [22] |
段晨阳, 向鑫明, 匡磊, 等. 活化Drp1介导谷胱甘肽代谢调节失血性休克后线粒体功能的研究[J]. 第三军医大学学报, 2020, 42(1): 50-58. DUAN C Y, XIANG X M, KUANG L, et al. Role of activated dynamin-related protein 1 -mediated glutathione metabolism in regulation of mitochondrial dysfunction after hemorrhagic shock[J]. J Third Mil Med Univ, 2020, 42(1): 50-58. DOI:10.16016/j.1000-5404.201907139 |
| [23] |
BUHLMAN L, DAMIANO M, BERTOLIN G, et al. Functional interplay between Parkin and Drp1 in mitochondrial fission and clearance[J]. Biochim Biophys Acta, 2014, 1843(9): 2012-2026. DOI:10.1016/j.bbamcr.2014.05.012 |
| [24] |
SAITO T, NAH J, OKA S I, et al. An alternativemitophagy pathway mediated by Rab9 protects the heart against ischemia[J]. J Clin Investig, 2019, 129(2): 802-819. DOI:10.1172/JCI122035 |



