失血性休克(hemorrhagic shock,HS)是由严重外伤或创伤所引起的严重并发症,是导致多器官功能障碍综合征发生、发展的重要原因之一。失血性休克时,缺血缺氧导致血管内皮功能失调,从而引起血管内皮屏障功能低下,导致血管通透性增高。血管通透性增高是休克患者出现组织水肿,引起毛细血管渗漏综合征,进而加重组织细胞缺氧和微循环障碍的关键环节[1],是失血性休克导致器官功能障碍的重要发病机制。因此,寻找预防和治疗失血性休克所致血管渗漏的措施,对降低失血性休克患者死亡率具有重要的临床意义。
周细胞(pericyte, PC)位于毛细血管壁外侧,由基底膜包绕,紧靠内皮细胞。其细胞突起呈放射状,沿血管长轴方向分布,这些突触与多个内皮细胞连接,盘踞在毛细血管上,可维持血管的稳定性和完整性,周细胞在血管上的覆盖率对血管渗漏起着决定性的作用[2]。既往研究表明,内皮细胞和周细胞之间的相互作用对于维持血管结构非常重要[3]。周细胞所分泌的神经营养因子可诱导内皮细胞claudin-5的表达增加,从而增强血脑屏障的功能[4]。TACHIBANA等[5]研究发现输注周细胞可明显改善阿尔茨海默病患者脑血管功能,改善微循环,且还能改善A-β的代谢。周细胞覆盖率的降低会导致血脑屏障的破坏[6]。DURHAN等[7]发现在糖尿病引起的视网膜血管损伤中,输注周细胞对视网膜血管内皮细胞具有保护作用。MCGUIRE等[8]发现周细胞所分泌的sphinogosine1-phosphate可上调内皮细胞VE-cadherin和N-cadherin的表达及下调Ang-2的表达,从而改善视网膜的内皮屏障功能。这些研究提示PC给心脑血管疾病及视网膜疾病的预防和救治带来新的希望。但周细胞能否保护失血性休克的血管内皮屏障功能,目前少见相关研究。
为此,本研究利用SD大鼠失血性休克模型,观察失血性休克后血管渗漏的变化情况以及输注PC后对血管渗漏的改善作用,明确PC对失血性休克大鼠血管内皮屏障功能的保护作用,为失血性休克的治疗提供新的方法。
1 材料与方法 1.1 实验动物与主要试剂 1.1.1 实验动物及分组12~14周龄健康SPF级SD大鼠,体质量200~220 g[陆军军医大学(第三军医大学)大坪医院实验动物中心提供],SD大鼠分为4组:假手术组(sham组)、失血性休克组(HS组)、乳酸林格氏液治疗组(lactated ringer’s solution,LR组)、PC治疗组(PC组),每组6只。假手术组仅插管,不放血,不输液。LR组静脉输注2倍失血量的LR,PC组将PC(106/只)加入LR中输注,休克对照组不予复苏。观察GFP-PC输注后不同时相点在肺静脉上的定植情况,发现输注12 h后绿色荧光标注周细胞(GFP-PC)定植最多,因此LR组和PC组在治疗后12 h开始取材做相应实验。
1.1.2 主要试剂周细胞专用培养基和FBS,购自美国Science cell公司;异硫氰酸荧光素标记的牛血清白蛋白(Albumin-fluorescein isothiocyanate conjugate,FITC-BSA)、伊文思蓝(Evans Blue),购自美国Sigma公司;Ⅰ型胶原酶,购自美国Sigma公司;胰蛋白酶、DMEM/F12培养基,购自美国HyClone公司;PC标志物PDGFR-β、NG-2,购自英国Abcam公司;闭锁小带蛋白1(Zonula Occludes-1,ZO-1)抗体,购自中国博士德公司;VE-cadherin,购自Thermo Fisher公司;2, 6-二异丙基苯胺(2, 6-Diisopropylaniline,DAPI),购自中国中杉金桥公司。
1.2 方法 1.2.1 大鼠失血性休克模型的建立SD大鼠实验前禁食,自由饮水12 h,根据科室建立方法[9],采用3%戊巴比妥钠(45 mg/kg)麻醉大鼠,右侧股动脉及股静脉(导管内径0.580 mm,外径0.965 mm)插管,股动脉插管经三通管连接注射器和血压计,供放血和观察血压,股静脉插管用于给药复苏。通过股动脉插管放血至血压30 mmHg,维持3 h后开始治疗,平均失血量约7~8 mL/只。
1.2.2 大鼠周细胞的培养及鉴定取初断乳SD大鼠的视网膜,剪碎,加入Ⅰ型胶原酶(2 g/L)中,置于37 ℃细胞培养箱中30 min,加入含有20% FBS的周细胞培养基。将滤液过50 μm滤网,收集含微血管片段的洗脱液,离心5 min。弃上清液, 加入适量PC专用培养基。当细胞长满到80%~90%后传代,取3~5代用于相关实验。采用细胞免疫荧光技术,用多聚甲醛固定细胞10 min后,0.3% Triton破膜1 min,5% BSA封闭30 min,加一抗PDGFR-β(1 :200)和NG-2(1 :200)4 ℃过夜,漂洗后孵荧光二抗,DAPI染核后在20倍激光共聚焦下观察。检测PC的标志性蛋白(PDGFR-β和NG-2)的表达。
1.2.3 大鼠肠系膜微血管静脉通透性测定麻醉SD大鼠,沿腹部正中开2~3 cm切口,暴露小肠。选取有丰富微血管的肠系膜固定。待大鼠稳定5 min后,选取直径30~50 μm,无明显弯曲的肠系膜微静脉观察,股静脉注射FITC-BSA(9 mg/kg),立即采用超灵敏摄像机(HAMAMATSU,C11440)记录各组大鼠在注射FITC-BSA后不同时相点(0、1、3、6 min)血管内和血管外间质的FITC荧光渗出图像。
1.2.4 FITC-BSA测定大鼠肺血管通透性SD大鼠股静脉注射FITC-BSA(9 mg/kg)2 h后,经颈静脉缓慢灌注生理盐水至肺组织变白,取大鼠右肺组织用4%多聚甲醛固定,用OCT胶包埋后行组织冰冻切片(切片厚度10~15 μm),用4%多聚甲醛固定15 min,0.1% Triton-X透膜5 min,DAPI(1 :100) 37 ℃孵育30 min,在激光共聚焦显微镜下观察肺组织中的FITC-BSA的渗出情况。利用平均光密度值反映肺组织中FITC-BSA的渗出值。
1.2.5 Evans Blue测定大鼠肺血管通透性SD大鼠股静脉注射Evans Blue (60 mg/kg),30 min后,用上诉方法取完整肺组织并将表面水分吸干,取左上肺叶称重,加入适量PBS进行匀浆,匀浆液移至离心机离心(8 000×g,10 min),取上清液用全波长酶标测定仪测定Evans Blue的光密度值D(562)。另取上清液用BCA蛋白测定试剂盒测定蛋白浓度,上清液中的Evans Blue的D(562)与蛋白浓度的比值为肺血管通透性的测定值。
1.3 统计学分析应用SPSS 13.0统计软件进行统计学处理,计量资料以x±s表示,多组比较采用单因素方差分析,组内两两比较采用t检验。检验水准α= 0.05。
2 结果 2.1 周细胞的鉴定提取的原代周细胞培养3~5代后,用PDGFR-β和NG-2鉴定周细胞。光镜下周细胞呈不规则三角形或多角形,胞体扁平、宽大。毛细血管周细胞的表面抗原标记物PDGFR-β和NG-2呈阳性表达(图 1)。
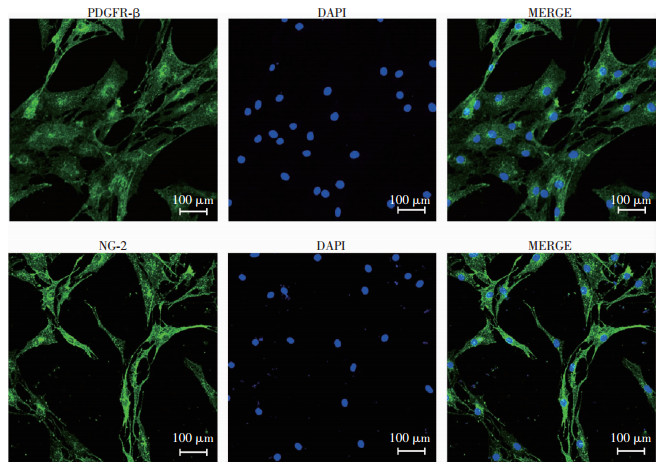
|
| 图 1 激光共聚焦观察周细胞的标志性蛋白(PDGFR-β和NG-2)的表达 |
2.2 输注周细胞后对大鼠肺静脉上周细胞数量的影响
用绿色荧光标记周细胞(GFP-PC)后,输注入失血性休克大鼠,分别观察在输注后不同时相点肺静脉上GFP-PC的定植情况,发现输注12 h后定植最多(图 2A)。
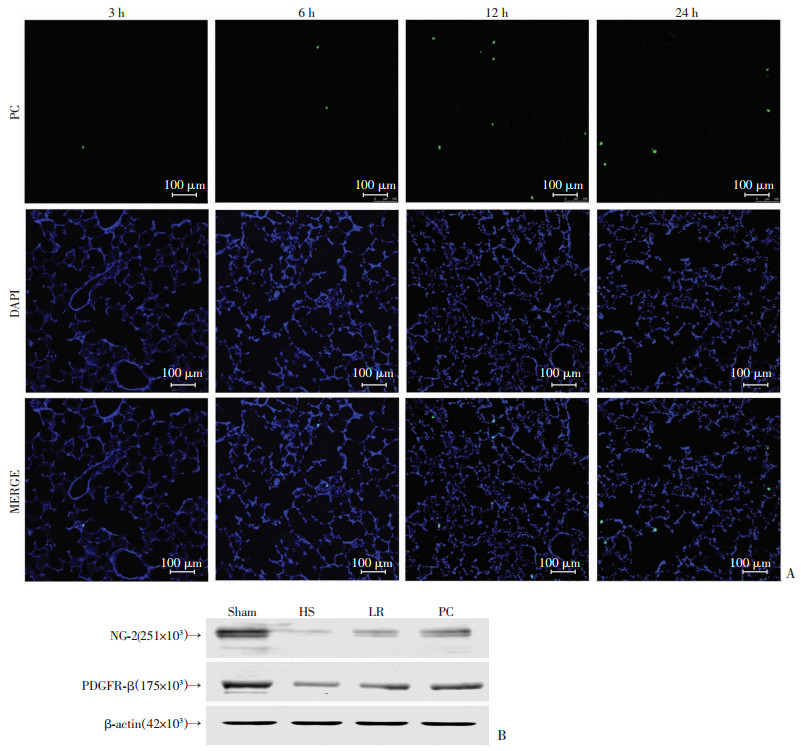
|
| A:不同时相点GFP-PC的定植情况;B:Western blot检测结果Sham:假手术组;HS:失血性休克组;LR:乳酸林格氏液治疗组;PC:PC治疗组 图 2 不同时相点GFP-PC的定植情况及各组大鼠肺血管上NG-2和PDGFR-β蛋白表达变化 |
与假手术组比,失血性休克组(血压30 mmHg,维持3 h)NG-2和PDGFR-β的表达显著降低。乳酸林格氏液复苏12 h后,NG-2和PDGFR-β的表达有轻微的升高。PC治疗12 h后,失血性休克大鼠血管NG-2和PDGFR-β的表达明显升高(图 2B)。
2.3 周细胞对失血性休克大鼠肺血管通透性的影响肺血管FITC-BSA渗漏结果示,与假手术组比,失血性休克组(血压30 mmHg,维持3 h)大鼠肺组织FITC-BSA平均光密度值增加近3倍(P < 0.01)。乳酸林格氏液治疗12 h后,肺组织FITC-BSA平均光密度部分降低,但差异无统计学意义(P>0.05);与LR组比,PC治疗12 h后,大鼠肺组织FITC-BSA平均光密度值降低40%。提示PC可以显著改善失血性休克所致的肺血管渗漏,见图 3。
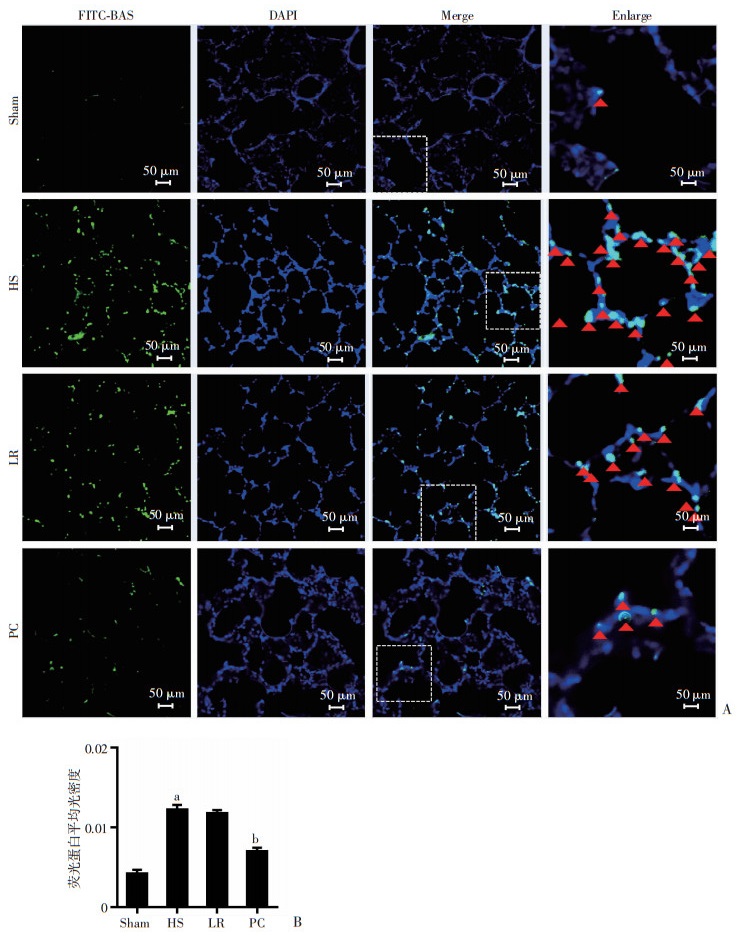
|
| A、B:肺组织FITC-BSA测定大鼠肺血管通透性; Sham:假手术组; HS:失血性休克组; LR:乳酸林格氏液治疗组; PC:PC治疗组; a:P < 0.01, 与Sham组比较; b:P < 0.001, 与LR组比较 图 3 周细胞对失血性休克大鼠肺血管通透性的影响 |
2.4 周细胞对失血性休克大鼠肠系膜微血管通透性的影响
与假手术组比较,失血性休克大鼠(血压30 mmHg,维持3 h)的肠系膜微血管通透性明显增加(P < 0.01);乳酸林格氏液治疗12 h后,肠系膜微血管的通透性部分改善,但差异无统计学意义(P>0.05);周细胞治疗12 h后,肠系膜微血管通透性明显降低,与乳酸林格氏液治疗组相比,降低35.27%(P < 0.01,图 4),提示周细胞可以明显改善失血性休克所致的肠系膜微血管损伤。
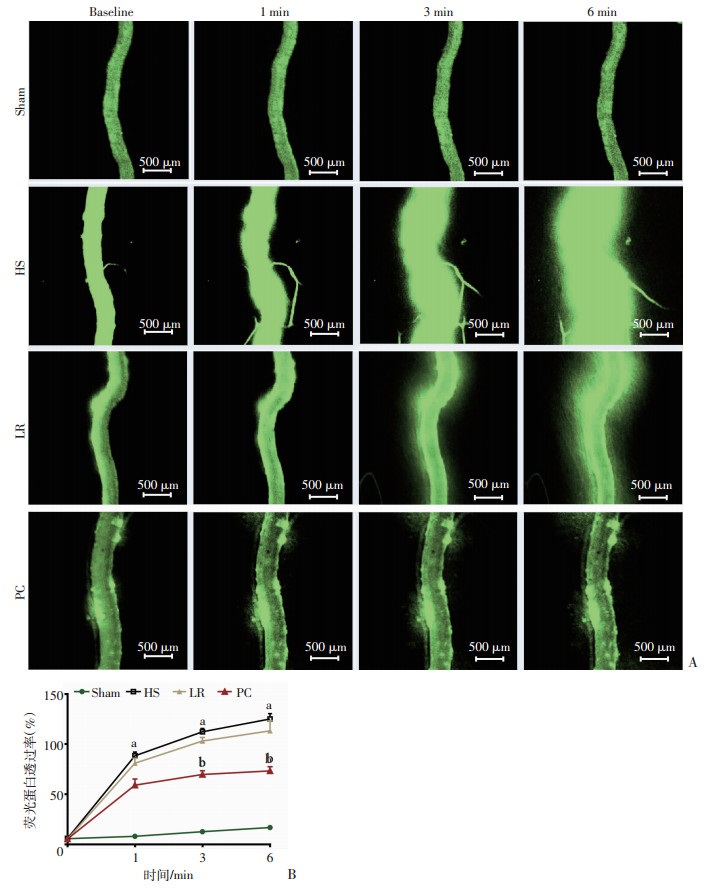
|
| A、B:肠系膜微血管对FITC-BSA透过率测定; Sham:假手术组; HS:失血性休克组; LR:乳酸林格氏液治疗组; PC:PC治疗组; a:P < 0.01, 与Sham组比较; b:P < 0.01与LR组比较 图 4 周细胞对失血性休克大鼠肠系膜微血管通透性的影响 |
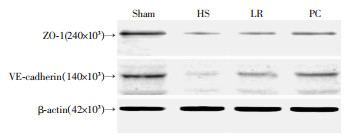
2.5 周细胞对失血性休克大鼠肺血管上ZO-1和VE-cadherin蛋白表达的影响
与假手术组比,失血性休克组(血压30 mmHg,维持3 h)ZO-1和VE-cadherin的表达明显降低。乳酸林格氏液复苏12 h后,ZO-1和VE-cadherin的表达有轻微的改变。周细胞治疗12 h后,失血性休克大鼠血管ZO-1和VE-cadherin的表达明显升高(图 5)。
|
| Sham:假手术组;HS:失血性休克组;LR:乳酸林格氏液治疗组;PC:PC治疗组 图 5 Western blot检测各组大鼠肺血管上ZO-1和VE-cadherin蛋白表达的变化 |
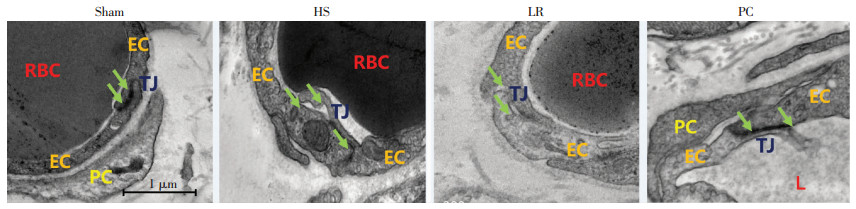
2.6 输注周细胞后对大鼠肺血管内皮细胞间紧密连接的影响
透射电镜观察结果示,与假手术组比,失血性休克组(血压30 mmHg,维持3 h)内皮细胞间紧密连接明显破坏。乳酸林格氏液治疗12 h后,紧密连接开放程度轻微降低。PC治疗12 h后,紧密连接开放程度显著降低(图 6)。
|
| EC:内皮细胞;PC:周细胞;RBC:红细胞;TJ:紧密连接;L:管腔;Sham:假手术组;HS:失血性休克组;LR:乳酸林格氏液治疗组;PC:PC治疗组 图 6 透射电镜观察各组大鼠肺血管内皮细胞间紧密连接的变化 |
3 讨论
失血性休克为严重外伤或创伤所引起的严重并发症,其发生率和病死率都很高。休克后血管渗漏可使血管内液体外渗,导致组织水肿和有效循环量的进一步下降,影响组织和器官功能,并最终发展为多器官功能障碍。因此,研究如何有效地保护或改善失血性休克血管内皮屏障功能具有极其重要的临床意义。目前有很多针对血管渗漏防治的研究,但效果并不显著。
目前已有文献证实周细胞输入可以改善心肌缺血,用于治疗急性心肌梗死[10];保护糖尿病视网膜血管疾病[11];调节脑内淀粉样β的代谢,用于治疗阿尔茨海默病[12]等疾病。周细胞具有干细胞特性,是一种多功能干细胞,其免疫原性低,一般不会产生免疫排斥反应,既往动物实验用于治疗多种疾病,初步肯定了周细胞治疗的可行性与安全性。本研究根据前期实验室结果[13]分别比较了输注不同浓度(3×105/只、6×105/只、106/只、3×106/只、6×106/只)周细胞的效果,发现以106/只浓度的周细胞治疗后,对血管通透性改善效果好,且存活时间更长,因此,本实验选择的周细胞输注剂量是106/只。
本研究发现,失血性休克后,休克大鼠肺血管周细胞的覆盖明显减少,周细胞相关标志物如PDGFR-β和NG-2表达均明显降低。内皮细胞间紧密连接破坏,肺血管ZO-1和VE-cadherin的表达明显降低。肺血管及肠系膜血管渗漏明显增加。输注周细胞12 h后,周细胞相关标志物如PDGFR-β和NG-2表达均明显增多。细胞形态恢复,内皮细胞间紧密连接开放程度明显降低,细胞间连接ZO-1和VE-cadherin的表达明显升高,肺血管及肠系膜血管通透性明显降低。结果提示PC可能是失血性休克血管渗漏的保护靶点,可能为失血性休克的救治带来全新的方向和希望。但其机制如何?目前尚不清楚,需要深入研究。
目前电镜结果显示,内皮细胞和周细胞之间的连接方式有3种: ①peg-socket盒;②缝隙连接(gap junctions);③粘附斑(adhesion plaques)[14-16]。周细胞与内皮细胞拥有超过1 000多个接触位点,可将相关的信号分子传递给内皮细胞,增加内皮细胞之间的黏附连接和紧密连接。周细胞通过分泌多种因子及趋化因子维持血管屏障稳定,调节内皮细胞增殖、迁移和分化,增加血管的屏障功能。如,ZHAO等[17]研究发现周细胞分泌的血管生成素-1(angiopoietin-1, Ang-1)可作用于VEC上的Tie-2受体,进而减少糖基化终末产物,加强内皮细胞间的连接和减少细胞凋亡,实现对糖尿病血管损伤的保护作用,同时,由于周细胞与内皮特殊的连接结构,周细胞可通过其数量的增加,增强了其与内皮缝隙连接、粘附连接的作用,从而增加了血管的屏障功能,改善失血性休克血管的渗漏情况。周细胞与内皮细胞之间通过上述连接对血管的形成、稳定以及渗透性方面起到了至关重要的作用[18]。
本研究结果提示输注周细胞12 h后,周细胞相关标志物如PDGFR-β和NG-2表达均明显增多,血管内皮细胞间紧密连接开放程度显著降低,肺血管及肠系膜血管通透性明显降低,肺血管ZO-1和VE-cadherin的表达明显升高。周细胞的输注可明显降低失血性休克大鼠血管的通透性,发挥对失血性休克大鼠血管渗漏的保护作用。其直接作用机制可能主要是周细胞与血管内皮细胞直接接触形成紧密和缝隙连接,产生物理覆盖和调节作用。另外,使用透射电镜观察到,输注周细胞12 h后失血性休克大鼠肺血管内皮细胞间紧密连接的变化,同时用采用蛋白免疫印迹法,测定输注周细胞12 h后失血性休克大鼠肺静脉紧密连接蛋白(ZO-1)的表达增加这一现象,但具体机制有待进一步研究。同时,我们会进一步观察周细胞是否通过携带保护因子或microRNA的微囊泡来实现对失血性休克血管通透性的保护作用。
| [1] |
HUA T F, YANG M, ZHOU Y Y, et al. Alda-1 prevents pulmonary epithelial barrier dysfunction following severe hemorrhagic shock through clearance of reactive aldehydes[J]. Biomed Res Int, 2019, 2019: 2476252. DOI:10.1155/2019/2476252 |
| [2] |
MA Q Y, ZHAO Z, SAGARE A P, et al. Blood-brain barrier- associated pericytes internalize and clear aggregated amyloid-β42 by LRP1-dependent apolipoprotein E isoform-specific mechanism[J]. Mol Neurodegener, 2018, 13: 57. DOI:10.1186/s13024-018-0286-0 |
| [3] |
ZONNEVILLE J, SAFINA A, TRUSKINOVSKY A M, et al. TGF-β signaling promotes tumor vasculature by enhancing the pericyte-endothelium association[J]. BMC Cancer, 2018, 18(1): 670. DOI:10.1186/s12885-018-4587-z |
| [4] |
SHIMIZU F, SANO Y, SAITO K, et al. Pericyte-derived glial cell line-derived neurotrophic factor increase the expression of claudin-5 in the blood-brain barrier and the blood-nerve barrier[J]. Neurochem Res, 2012, 37(2): 401-409. DOI:10.1007/s11064-011-0626-8 |
| [5] |
TACHIBANA M, YAMAZAKI Y, LIU C C, et al. Pericyte implantation in the brain enhances cerebral blood flow and reduces amyloid-β pathology in amyloid model mice[J]. Exp Neurol, 2018, 300: 13-21. DOI:10.1016/j.expneurol.2017.10.023 |
| [6] |
BELL R D, WINKLER E A, SAGARE A P, et al. Pericytes control key neurovascular functions and neuronal phenotype in the adult brain and during brain aging[J]. Neuron, 2010, 68(3): 409-427. DOI:10.1016/j.neuron.2010.09.043 |
| [7] |
DURHAM J T, DULMOVITS B M, CRONK S M, et al. Pericyte chemomechanics and the angiogenic switch: insights into the pathogenesis of proliferative diabetic retinopathy?[J]. Investig Ophthalmol Vis Sci, 2015, 56(6): 3441-3459. DOI:10.1167/iovs.14-13945 |
| [8] |
MCGUIRE P G, RANGASAMY S, MAESTAS J, et al. Pericyte-derived sphinogosine 1-phosphate induces the expression of adhesion proteins and modulates the retinal endothelial cell barrier[J]. Arterioscler Thromb Vasc Biol, 2011, 31(12): 107-115. DOI:10.1161/atvbaha.111.235408 |
| [9] |
ZHU Y, WU H L, WU Y, et al. Beneficial effect of intermedin 1-53 in septic shock rats: contributions of rho kinase and BKCA pathway-mediated improvement in cardiac function[J]. Shock Augusta Ga, 2016, 46(5): 557-565. DOI:10.1097/SHK.0000000000000639 |
| [10] |
CHEN C W, OKADA M, PROTO J D, et al. Human pericytes for ischemic heart repair[J]. Stem Cells, 2013, 31(2): 305-316. DOI:10.1002/stem.1285 |
| [11] |
MENDEL T A, CLABOUGH E B D, KAO D S, et al. Pericytes derived from adipose-derived stem cells protect against retinal vasculopathy[J]. PLoS ONE, 2013, 8(5): e65691. DOI:10.1371/journal.pone.0065691 |
| [12] |
TACHIBANA M, YAMAZAKI Y, LIU C C, et al. Pericyte implantation in the brain enhances cerebral blood flow and reduces amyloid-β pathology in amyloid model mice[J]. Exp Neurol, 2018, 300: 13-21. DOI:10.1016/j.expneurol.2017.10.023 |
| [13] |
张紫森, 刘良明. 周细胞对脓毒症大鼠血管反应性的保护作用[J]. 第三军医大学学报, 2019, 41(21): 2029-2034. ZHANG Z S, LIU L M. Role of pericyte in protecting the vascular reactivity in septic shock rats and its mechanism[J]. J Third Mil Med Univ, 2019, 41(21): 2029-2034. DOI:10.16016/j.1000-5404.201907039 |
| [14] |
STARK K, ECKART A, HAIDARI S, et al. Capillary and arteriolar pericytes attract innate leukocytes exiting through venules and 'instruct' them with pattern-recognition and motility programs[J]. Nat Immunol, 2013, 14(1): 41-51. DOI:10.1038/ni.2477 |
| [15] |
PROEBSTL D, VOISIN M B, WOODFIN A, et al. Pericytes support neutrophil subendothelial cell crawling and breaching of venular walls in vivo[J]. J Exp Med, 2012, 209(6): 1219-1234. DOI:10.1084/jem.20111622 |
| [16] |
ALON R, NOURSHARGH S. Learning in motion: pericytes instruct migrating innate leukocytes[J]. Nat Immunol, 2013, 14(1): 14-15. DOI:10.1038/ni.2489 |
| [17] |
ZHAO J L, CHEN L, SHU B, et al. Angiopoietin-1 protects the endothelial cells against advanced glycation end product injury by strengthening cell junctions and inhibiting cell apoptosis[J]. J Cell Physiol, 2015, 230(8): 1895-1905. DOI:10.1002/jcp.24920 |
| [18] |
BLERVAQUE L, PASSERIEUX E, POMIÈS P, et al. Impaired training-induced angiogenesis process with loss of pericyte-endothelium interactions is associated with an abnormal capillary remodelling in the skeletal muscle of COPD patients[J]. Respir Res, 2019, 20(1): 1-12. DOI:10.1186/s12931-019-1240-6 |



