2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系军事环境卫生学教研室;
3. 550025 贵阳,贵阳市妇幼保健院
2. Department of Military Environment Health, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Guiyang Maternal and Child Health Care Hospital, Guiyang, Guizhou Province, 550025, China
结直肠癌(colorectal cancer, CRC)是全球发病率排第3, 病死率排第2的恶性肿瘤。据估计, 2018年结直肠癌的新发病例数约为180万, 死亡病例约为88万[1]。在中国, 随着经济的发展及人们生活方式的改变, CRC发病率及病死率不断上升, 造成了严重的疾病负担。近年来, 尽管在结直肠癌的治疗方面取得很大进展, 但晚期和转移性结直肠癌患者总生存率的改善并不明显, 转移及复发是造成结直肠癌患者死亡的一大原因[2]。大量的流行病学研究提示, 饮酒不仅会造成癌症的发病率增高, 对于已经患癌的患者, 饮酒还会促进癌症的发展, 增加治疗难度, 但具体机制尚不清楚[3]。
乙醛作为乙醇代谢的中间产物, 具有很高的致畸、致癌、致突变毒性, 乙醛的致癌作用主要可通过与DNA形成加合物, 阻断DNA的甲基化过程, 阻断DNA的修复, 课题组前期的研究发现作为DNA损伤修复方式之一的同源重组修复与结直肠癌的发生具有关联性[4]。上皮间质转化(epithelial-mesenchymal transition, EMT)过程的激活, 通过导致细胞极性的丧失、细胞与细胞间连接的破坏、基底膜的降解以及细胞外基质的重组等在肿瘤侵袭转移及恶性进展中起着重要作用[5], 而各种内外因素导致的活性氧(reactive oxygen species, ROS)增加及氧化应激异常激活等多种因素与EMT激活密切相关[6-7]。由于酒精在人体的代谢过程中会产生大量ROS [8], 饮酒可能导致过量ROS的累积和氧化应激并通过促进癌症细胞发生EMT而促进CRC等相关肿瘤的进展。近期研究表明, 乙醇与肝癌、乳腺癌等肿瘤细胞的侵袭转移增加有关[9-10], 但其是否影响结直肠癌细胞侵袭迁移能力及具体机制仍有待明确。本研究拟通过建立CRC细胞体外乙醇作用模型, 研究乙醇对CRC细胞侵袭转移能力的影响, 并从EMT角度探索乙醇促进CRC侵袭转移作用的相关机制。
1 材料与方法 1.1 材料与试剂HT29购于陆军军医大学基础医学院中心实验室, SW480细胞购于美国ATCC公司, RPMI1640培养基、胰蛋白酶、PBS缓冲液、青霉素/链霉素购于Gibco公司, 胎牛血清购于HyClone公司, 细胞耗材购于中国海狸Beaver公司, 无水乙醇、乙醛检测试剂盒购于Sigma公司, CCK-8试剂购于日本东仁公司, Transwell细胞培养小室、Matrigel基质胶购于康宁(Corning)公司, 碘化丙啶/核糖核酸酶染色溶液、抗体染色缓冲液购于BD公司, DCFH-DA探针购于南京建成公司, 兔抗GAPDH、N-cadherin、E-cadherin和vimentin购自武汉三鹰公司, HRP标记山羊抗兔IgG抗体购自上海碧云天公司。
1.2 细胞培养人结直肠癌细胞HT29、SW480用含有10% FBS的1640培养基, 于37 ℃、5% CO2的饱和湿度培养箱中进行培养。
1.3 结直肠癌细胞乙醇染毒模型的建立为了防止乙醇挥发带来的影响, 采用密闭容器的方法来维持培养基中乙醇的浓度[11]。将细胞接种于细胞培养板, 于37 ℃培养24 h待细胞贴壁后, 加入含有10 mmol/L HEPES缓冲液的含乙醇培养基, 继续于细胞培养箱中培养24 h后进行后续实验。
1.4 CCK-8法检测细胞活性取对数生长期细胞, 按照1×104/孔接种于96孔板。细胞贴壁后弃细胞原液, 每孔分别加入含0、100、200、400、800、1 600 mmol/L乙醇的培养基100 μL, 每个浓度设置5个复孔。按照密闭染毒的方法, 置于细胞培养箱中继续培养, 24 h后每孔加入10 μL CCK-8溶液于细胞培养箱孵育75 min后, 采用多功能酶标仪检测450 nm处的光密度值D(450)。根据计算公式:抑制率=[(Ac-As)/(Ac-Ab)]×100%[As:实验孔(含有细胞培养基、CCK-8、乙醇), Ac:对照孔(含有细胞培养基、CCK-8, 不含乙醇), Ab:空白孔(不含细胞和乙醇的培养基、CCK-8)]。然后利用GraphPad软件计算乙醇染毒的IC50值。
1.5 细胞周期的检测将细胞接种于6孔板, 乙醇染毒24 h。预冷的PBS洗涤细胞1次, 将细胞消化收集在1.5 mL EP管中。用预冷的PBS清洗细胞3次, 弃去上清后, 逐滴加入1 mL于-20 ℃预冷的75%乙醇, 涡旋混匀细胞, 置于4 ℃避光固定18 h以上。2 000 r/min离心细胞5 min, 弃去上清, 清洗细胞2次, 以去除残留的乙醇, 第1次清洗使用PBS, 第2次清洗使用抗体染色缓冲液。离心去除染色液后, 向收集的细胞中加入500 μL PI/RNase染色液, 室温避光孵育15 min。上机前4 ℃避光保存样品, 并在1 h内上流式细胞仪检测。
1.6 细胞划痕实验先用记号笔在6孔板背面均匀划横线, 每条横线大约相隔0.5 cm, 横穿过孔, 每孔大约划5条横线。将细胞接种于6孔板中, 于细胞培养箱中培养24 h使细胞的融合度达到90%左右时, 用10 μL移液器的枪头沿培养板底部做“一”字划痕, 划痕时以直尺定位, 尽量使划痕垂直于之前的横线。用PBS洗去悬浮细胞, 重新加入含1% FBS的细胞培养基, 于倒置显微镜观察并拍照, 继续置于细胞培养箱中进行培养, 24 h后在同一位置拍照。迁移率=(初始划痕面积-相应点划痕面积)/初始划痕面积×100%。对照组与实验组均设置3个平行样本。
1.7 Transwell实验加Matrigel检测细胞侵袭能力, 不加Matrigel检测细胞迁移能力。具体操作:将Transwell小室置于24孔板中, 用事先预冷的移液器在冰上用不含胎牛血清的培养基将Matrigel基质胶按照1 :8稀释后加入到小室中, 室温下于通风橱中干燥2 h。将处于对数生长期的细胞消化后, 用无血清无抗生素的培养基制备成细胞悬液, HT29细胞按照1×106/孔、SW480细胞按照1.5×105/孔接种于Transwell小室上室中, 下室加入含10% FBS的完全培养基, 置于细胞培养箱待细胞贴壁后换成含乙醇的培养基(避免上下室中有气泡产生)。继续置于细胞培养箱中培养, 24 h后取出小室, 用棉签轻轻擦拭掉上室未迁移的细胞及Matrigel基质胶, 膜下面的细胞用无水甲醇固定30 min, 结晶紫染色10 min, 于显微镜下观察, 并随即挑选5个视野进行拍照, 计算穿过膜的细胞数的平均值。
1.8 用DCFH-DA探针法测定细胞内的ROS水平HT29、SW480细胞按照6×105/孔接种于6孔板中, 24 h待细胞贴壁后, 按密闭乙醇染毒24 h后弃培养基, 加入DCFH-DA于细胞培养箱中避光孵育30 min, 收集细胞并用PBS洗涤2次, 离心收集细胞后加入500 μL PBS重悬细胞, 流式细胞仪检测荧光强度, 结果表示为相对于对照组荧光强度的百分比。
1.9 Western blot检测上皮间质转化相关蛋白表达情况细胞刮收集细胞, 用RIPA裂解液于冰上裂解30 min, 12 000 r/min, 4 ℃离心10 min, 收集上清即为细胞总蛋白, 采用BCA试剂盒测定蛋白浓度, 定量好的蛋白按照蛋白总体积的1/5加入5×SDS-PAGE蛋白上样缓冲液, 混匀后于100 ℃变性10 min。以30 μg/孔蛋白上样量进行凝胶电泳。采用湿式转膜的方法将蛋白转移到PVDF膜上后, 封闭液封闭, 于4 ℃孵育一抗过夜。用TBST洗涤PVDF膜3次, 15 min/次; 加入二抗孵育1 h后再用TBST洗涤PVDF膜3次, 15 min/次, 洗去二抗, 采用ECL进行显影。
1.10 乙醇中间代谢产物乙醛的检测细胞经乙醇染毒24 h后, 将细胞置于4 ℃冰箱30 min, 使挥发进空气的乙醛融入到培养基中, 吸取细胞培养基, 参照试剂盒操作方法检测乙醛的浓度。
1.11 统计学分析采用SPSS 25.0统计软件进行分析, 数据以x±s表示, 采用单因素方差分析组间差异, 组间两两比较采用SNK法, 检验水准α=0.05。
2 结果 2.1 CRC细胞乙醇染毒模型的建立CCK-8检测结果显示, 0、100、200、400、800、1 600 mmol/L乙醇对HT29细胞的抑制率分别为:0、4.81%、17.92%、46.31%、76.80%、91.04%;对SW480细胞的抑制率分别为:0、3.49%、21.88%、44.68%、79.58%、91.34%, 存在明显的剂量反应关系(图 1)。根据结果, 运用相关回归分析可得, 乙醇对HT29细胞的IC50值为436 mmol/L, 对SW480细胞的IC50值为424 mmol/L。根据人中度饮酒及重度饮酒后血液中乙醇浓度在10~100 mmol/L之间, 及乙醇的生物相关浓度为43.4 mmol/L, 结合本次的实验结果, 以0 mmol/L为对照, 采用乙醇对两株细胞的1/10 IC50 43 mmol/L为最低染毒浓度, 依次递增, 设置86、172 mmol/L等浓度, 建立结直肠癌细胞低浓度乙醇作用模型, 进行后续实验。
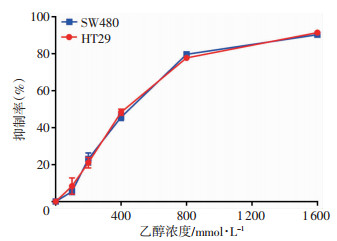
|
| 图 1 不同浓度乙醇对结直肠癌细胞的抑制率 |
2.2 乙醇对CRC细胞周期的影响
随着乙醇浓度的增大, 处于G1期细胞的占比增大, 在乙醇浓度达到86、172 mmol/L时, 对结直肠癌细胞G1具有明显的阻滞作用(P<0.05, 图 2)。
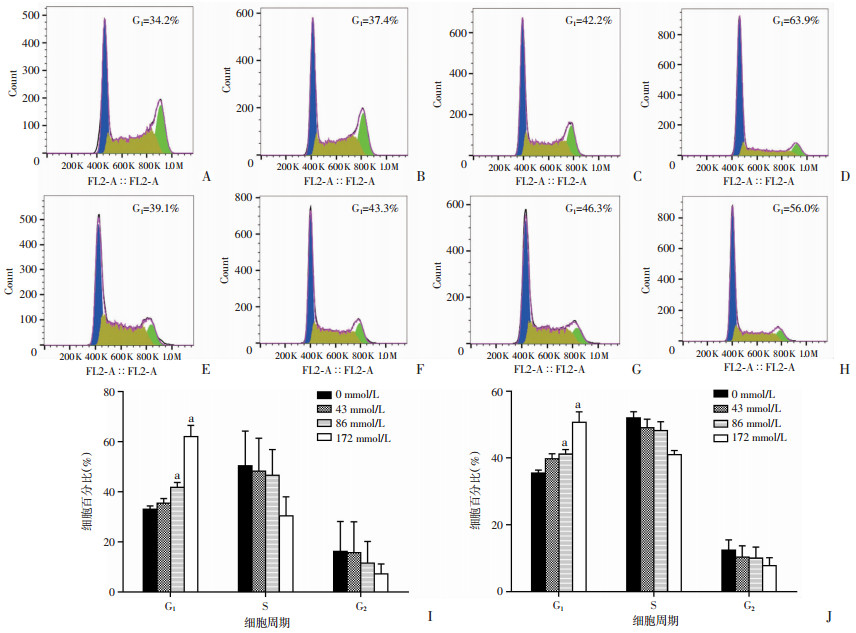
|
| A~D:分别为0、43、86、172 mmol/L乙醇处理后HT29周期检测结果; E~H :分别为0、43、86、172 mmol/L乙醇处理后SW480周期检测结果; I: HT29周期结果统计; J: SW480周期结果统计 a: P<0.05, 与0 mmol/L比较 图 2 不同浓度乙醇处理后流式细胞术检测细胞周期分布 |
2.3 低浓度乙醇增强CRC细胞体外迁移能力
利用Transwell在无Matrigel胶条件下及细胞划痕实验检测HT29和SW480细胞暴露于乙醇后其迁移能力的变化。Transwell实验结果显示, 相对于对照组(0 mmol/L), 乙醇各处理组细胞穿透小室的数量均增多, 差异具有统计学意义(P<0.05, 图 3)。细胞划痕实验结果显示, 与对照组(0 mmol/L)相比, 乙醇作用后细胞愈合百分比增大, 差异具有统计学意义(P<0.05, 图 4)。

|
| A~D:分别为0、43、86、172 mmol/L乙醇处理后HT29 Transwell实验结果; E~H:分别为0、43、86、172 mmol/L乙醇处理后SW480 Transwell实验结果; I:HT29穿膜细胞数比较; J: SW480穿膜细胞数比较; a:P<0.05, b:P<0.01, 与0 mmol/L比较 图 3 不同浓度乙醇对结直肠癌细胞纵向迁移能力的影响(×200) |
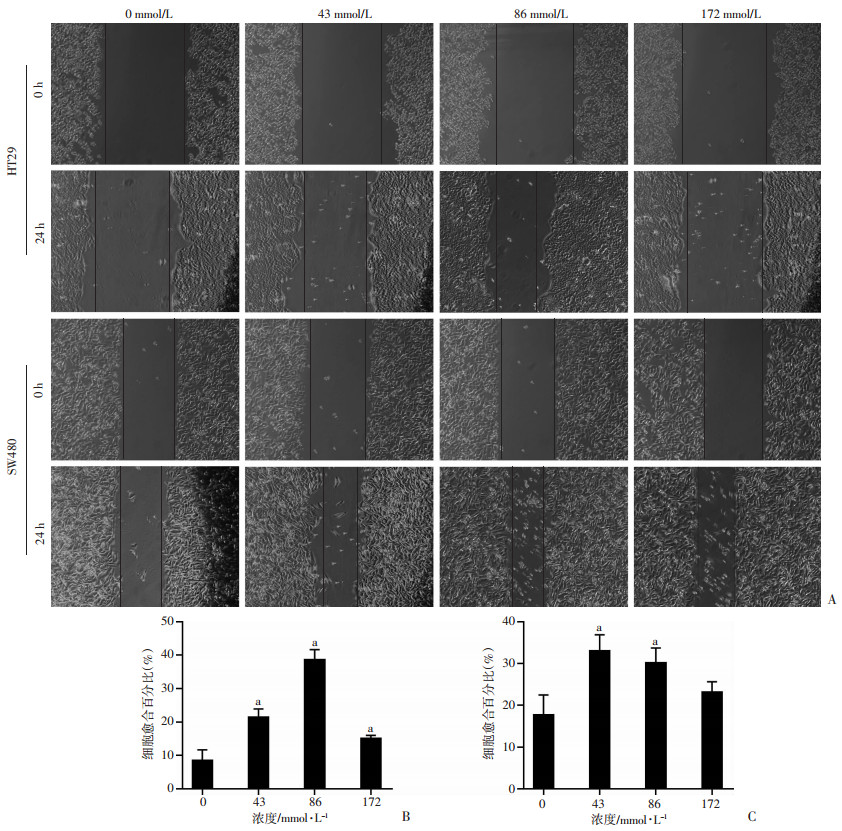
|
| A: HT29、SW480细胞划痕实验结果; B: HT29细胞愈合百分比比较; C: SW480细胞愈合百分比比较; a:P<0.01, 与0 mmol/L比较 图 4 不同浓度乙醇对结直肠癌细胞横向迁移能力的影响(×200) |
2.4 低浓度乙醇能增强CRC细胞体外侵袭能力
利用Transwell在有Matrigel胶条件下, 检测HT29和SW480细胞暴露于乙醇后其侵袭能力的变化, 实验结果见图 5。与对照组(0 mmol/L)相比, 乙醇各处理组细胞穿透小室的数量均增大, 且差异具有统计学意义(P<0.05)。

|
| A~D:分别为0、43、86、172 mmol/L乙醇处理后HT29 Transwell实验结果; E~H:分别为0、43、86、172 mmol/L乙醇处理后SW480 Transwell实验结果; I:HT29穿膜细胞数比较; J: SW480穿膜细胞数比较; a:P<0.05, b:P<0.01, 与0 mmol/L比较 图 5 不同浓度乙醇对结直肠癌细胞侵袭能力的影响(×200) |
2.5 乙醇暴露后增加CRC细胞内ROS的产生
分别用0、43、86、172 mmol/L浓度的乙醇处理CRC细胞HT29及SW480细胞24 h后, 流式细胞术检测各组细胞ROS水平, 结果如图 6所示。相对于对照组(0 mmol/L), 随着乙醇浓度的增加, 各乙醇处理组的ROS水平均增大(P<0.05)。
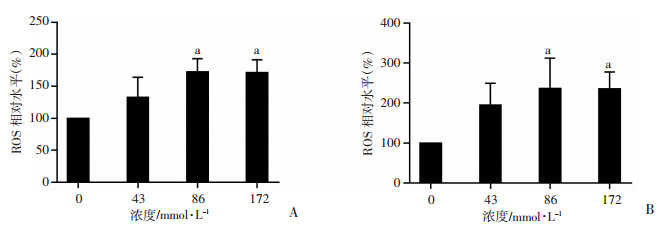
|
| A: HT29细胞; B: SW480细胞; a: P<0.05, 与0 mmol/L比较 图 6 不同浓度乙醇处理后流式细胞术检测细胞内ROS相对变化水平 |
2.6 乙醇对N-cadherin、E-cadherin和vimentin表达的影响
随乙醇处理剂量的增加, 在HT29细胞和SW480细胞中均表现为E-cadherin的表达逐渐降低, 而N-cadherin及vimentin的表达逐渐增加, 如图 5所示。对于HT29细胞, 与对照组(0 mmol/L)相比, 乙醇浓度为43 mmol/L时, E-cadherin、N-cadherin及vimentin的表达无明显变化(P>0.05), 当乙醇浓度升高至86 mmol/L和172 mmol/L时, E-cadherin的表达降低(P<0.05), N-cadherin及vimentin的表达增加(P<0.05)。对于SW480细胞, 随着乙醇浓度增加, E-cadherin的表达逐渐降低(P<0.05), N-cadherin及vimentin的表达增加(P<0.05)。
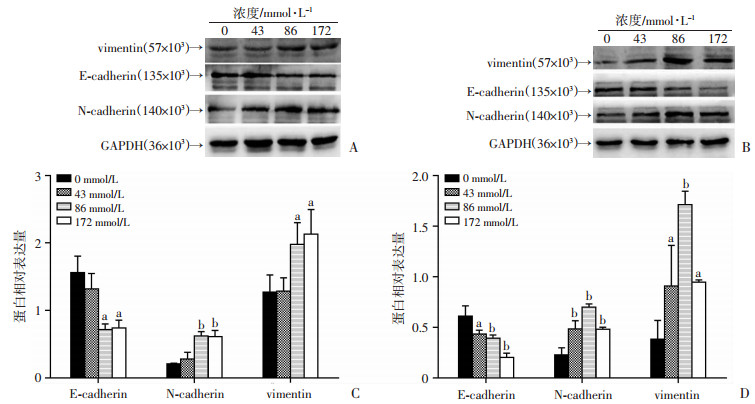
|
| A、C:HT29细胞Western blot检测结果和半定量分析结果; B、D:SW480细胞Western blot检测结果和半定量分析结果; a: P<0.05, b: P<0.01, 与0 mmol/L比较 图 7 Western blot检测不同浓度乙醇作用下HT29和SW480细胞EMT相关蛋白的表达 |
2.7 乙醇中间代谢产物乙醛的检测
分别用0、43、86、172 mmol/L乙醇处理HT29细胞, 利用乙醛检测试剂盒检测细胞中乙醛含量。结果显示, 随着乙醇浓度的升高, 细胞中乙醛浓度随之增大(P<0.05, 图 8)。
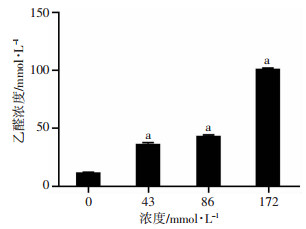
|
| a: P<0.05, 与0 mmol/L比较 图 8 不同浓度乙醇作用下乙醇中间代谢产物乙醛的检测结果 |
3 讨论
流行病学研究表明, 长期饮酒不仅会使患癌症的风险增大, 也会使包括结直肠癌在内的多种癌症的病死率增大, 严重危害人类健康[12]。中度饮酒和重度饮酒后, 人体内的乙醇浓度在10~100 mmol/L之间, 相关研究表明, 乙醇的生物相关浓度为43.4 mmol/L[13]。本研究发现, 乙醇对两株结直肠癌细胞系作用的IC50平均值约为430 mmol/L, 其1/10倍接近于乙醇的生物相关浓度。结合人饮酒后体内的乙醇浓度及乙醇的生物相关浓度, 并参考其他文献, 本实验采用43 mmol/L为最低染毒剂量, 86 mmol/L和172 mmol/L为中、高染毒剂量, 构建结直肠癌细胞低浓度乙醇染毒模型, 探索乙醇对结直肠癌细胞侵袭迁移能力的影响及相关的分子机制。
细胞划痕实验及Transwell实验结果显示, 乙醇作用后两种细胞株的侵袭迁移能力随着乙醇浓度的增大而增强, 证实乙醇能增加结直肠癌细胞的侵袭迁移能力。虽然目前尚缺乏遗传对结直肠癌细胞迁移侵袭能力影响的直接研究, 但有研究提示乙醇可影响其他类型肿瘤细胞的侵袭迁移能力, 如WEI等[14]发现, 乙醇作用于鼻咽癌细胞后在不影响细胞的正常活性下, 乙醇能通过激活细胞的氯离子通道促进细胞的侵袭迁移; 还有研究表明, 乙醇能够促进乳腺癌细胞的增殖能力并且影响肿瘤细胞的血管生成, 从而增加乳腺癌细胞的侵袭能力[15]。结合以往的实验研究结果, 提示乙醇可能具有增强多种肿瘤细胞侵袭迁移的能力。
在乙醇的代谢过程中能产生大量ROS, 在酒精相关癌症中, ROS被证明是除乙醛(乙醇的次级代谢产物)外与结直肠癌发生有关的另一重要因素[16]。CERNIGLIARO等[17]的研究发现乙醇能通过ROS诱导结直肠癌细胞抗氧化通路Nrf2 / HO-1轴的激活, 从而为癌症细胞创造良好的生存环境, 进而促进结直肠癌进展。在乳腺癌的研究中观察到在加入抗氧化剂后, 乙醇的促侵袭迁移作用得到抑制[18-20]。ROS可通过多种机制影响癌症细胞的侵袭迁移能力, 除促血管生成、破坏内皮完整性等之外, ROS促进癌症细胞发生EMT也是影响癌症细胞侵袭迁移能力的重要机制之一[21]。ROS被普遍认为是EMT的诱导剂[22], ROS的积累能通过NF-κB依赖性的Snail激活[23], 激活EGFR的表达[24], 与TGF-β之间相互影响并引起EMT相关分子的变化[25]等机制参与肿瘤的侵袭转移。此外, 既往也有研究表明, 作为乙醇的代谢产物, 乙醛能破坏结肠上皮的紧密连接和粘附连接, 结肠癌细胞Caco2暴露于乙醛后会诱导细胞发生氧化应激[26], 后续的研究表明乙醛暴露后能通过激活Snail通路等诱导细胞发生EMT[27]。在本研究中, 不同剂量乙醇作用于结直肠癌细胞后, 我们观察到细胞内ROS水平和乙醛浓度均表现为随乙醇浓度的增加而显著升高, 特别是乙醛的含量, 以43、86 mmol/L和172 mmol/L乙醇浓度作用后, 细胞内乙醛含量分别约是对照组的3、4倍和9倍; 同时也观察到随乙醇剂量增加, 结直肠癌细胞中上皮相关基因如E-cadherin的表达明显抑制, 而间质相关基因如N-cadherin、vimentin等的表达明显增强, 提示乙醇可能因代谢产生大量乙醛, 导致ROS累积和氧化还原异常激活, 促进结直肠癌细胞发生EMT, 从而表现为对CRC细胞的侵袭和迁移有明显促进作用。
本研究虽然在细胞水平初步证实了乙醇暴露可增加乙醛和ROS水平, 并表现为通过激活EMT而促进结直肠癌细胞的侵袭转移能力, 但是对乙醇代谢诱导的乙醛和ROS积累到底通过哪些具体相关信号通路激活EMT、是否与其他环境刺激导致的ROS对EMT的影响机制有所不同等还缺乏深入的研究; 此外, 乙醇在体内代谢的条件下对结直肠癌侵袭转移是否也存在类似的剂量-效应影响等也还需要在后续的研究中加以证实。
综上, 本研究结果提示了乙醇代谢可导致细胞内ROS的增高和蓄积, 并可能通过对EMT的促进增强结直肠癌细胞的侵袭迁移能力。但乙醇诱导的ROS促进EMT的确切机制, 以及在模拟真实人体乙醇摄入情况下对结直肠侵袭转移的影响程度等还需后续的深入研究和更多的人群流行病学证据进一步证实。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
GUSTAVSSON B, CARLSSON G, MACHOVER D, et al. A review of the evolution of systemic chemotherapy in the management of colorectal cancer[J]. Clin Colorectal Cancer, 2015, 14(1): 1-10. DOI:10.1016/j.clcc.2014.11.002 |
| [3] |
ALATTAS M, ROSS C S, HENEHAN E R, et al. Alcohol policies and alcohol-attributable cancer mortality in US states[J]. Chem Biol Interact, 2020, 315: 108885. DOI:10.1016/j.cbi.2019.108885 |
| [4] |
禚昌龙, 陈维艳, 龙琦, 等. 同源重组修复通路基因遗传变异与结直肠癌易感性的关联研究[J]. 第三军医大学学报, 2019, 41(18): 1769-1775. ZHUO C L, CHEN W Y, LONG Q, et al. Association between polymorphisms of homologous recombination repair pathway genes and the risk of colorectal cancer[J]. J Third Mil Med Univ, 2019, 41(18): 1769-1775. DOI:10.16016/j.1000-5404.201905200 |
| [5] |
WILLIAMS E D, GAO D C, REDFERN A, et al. Controversies around epithelial-mesenchymal plasticity in cancer metastasis[J]. Nat Rev Cancer, 2019, 19(12): 716-732. DOI:10.1038/s41568-019-0213-x |
| [6] |
JIANG J W, WANG K, CHEN Y, et al. Redox regulation in tumor cell epithelial-mesenchymal transition: molecular basis and therapeutic strategy[J]. Signal Transduct Target Ther, 2017, 2: 17036. DOI:10.1038/sigtrans.2017.36 |
| [7] |
GELFAND R, VERNET D, BRUHN K W, et al. Long-term exposure of MCF-7 breast cancer cells to ethanol stimulates oncogenic features[J]. Int J Oncol, 2017, 50(1): 49-65. DOI:10.3892/ijo.2016.3800 |
| [8] |
HOEK J B, CAHILL A, PASTORINO J G. Alcohol and mitochondria: a dysfunctional relationship[J]. Gastroenterology, 2002, 122(7): 2049-2063. DOI:10.1053/gast.2002.33613 |
| [9] |
CHEN D L, YU D D, WANG X Y, et al. Epithelial to mesenchymal transition is involved in ethanol promoted hepatocellular carcinoma cells metastasis and stemness[J]. Mol Carcinog, 2018, 57(10): 1358-1370. DOI:10.1002/mc.22850 |
| [10] |
XU M, BOWER K A, WANG S Y, et al. Cyanidin-3-glucoside inhibits ethanol-induced invasion of breast cancer cells overexpressing ErbB2[J]. Mol Cancer, 2010, 9: 285. DOI:10.1186/1476-4598-9-285 |
| [11] |
BAAN R, STRAIF K, GROSSE Y, et al. Carcinogenicity of alcoholic beverages[J]. Lancet Oncol, 2007, 8(4): 292-293. DOI:10.1016/s1470-2045(07)70099-2 |
| [12] |
WANG F, YANG J L, YU K K, et al. Activation of the NF-κB pathway as a mechanism of alcohol enhanced progression and metastasis of human hepatocellular carcinoma[J]. Mol Cancer, 2015, 14: 10. DOI:10.1186/s12943-014-0274-0 |
| [13] |
XU M, LUO J. Alcohol and cancer stem cells[J]. Cancers, 2017, 9(12): 158. DOI:10.3390/cancers9110158 |
| [14] |
WEI Y, LIN N, ZUO W H, et al. Ethanol promotes cell migration via activation of chloride channels in nasopharyngeal carcinoma cells[J]. Alcohol Clin Exp Res, 2015, 39(8): 1341-1351. DOI:10.1111/acer.12782 |
| [15] |
WANG S Y, XU M, LI F F, et al. Ethanol promotes mammary tumor growth and angiogenesis: the involvement of chemoattractant factor MCP-1[J]. Breast Cancer Res Treat, 2012, 133(3): 1037-1048. DOI:10.1007/s10549-011-1902-7 |
| [16] |
BISHEHSARI F, MAHDAVINIA M, VACCA M, et al. Epidemiological transition of colorectal cancer in developing countries: environmental factors, molecular pathways, and opportunities for prevention[J]. World J Gastroenterol, 2014, 20(20): 6055-6072. DOI:10.3748/wjg.v20.i20.6055 |
| [17] |
CERNIGLIARO C, D'ANNEO A, CARLISI D, et al. Ethanol-mediated stress promotes autophagic survival and aggressiveness of colon cancer cells via activation of Nrf2/HO-1 pathway[J]. Cancers (Basel), 2019, 11(4): E505. DOI:10.3390/cancers11040505 |
| [18] |
XU M, BOWER K A, WANG S Y, et al. Cyanidin-3-glucoside inhibits ethanol-induced invasion of breast cancer cells overexpressing ErbB2[J]. Mol Cancer, 2010, 9: 285. DOI:10.1186/1476-4598-9-285 |
| [19] |
XU M, REN Z H, WANG X, et al. ErbB2 and p38γ MAPK mediate alcohol-induced increase in breast cancer stem cells and metastasis[J]. Mol Cancer, 2016, 15(1): 52. DOI:10.1186/s12943-016-0532-4 |
| [20] |
FLORIS A, LUO J, FRANK J, et al. Star-related lipid transfer protein 10 (STARD10): a novel key player in alcohol-induced breast cancer progression[J]. J Exp Clin Cancer Res, 2019, 38(1): 4. DOI:10.1186/s13046-018-1013-y |
| [21] |
WANG Y C, XU M, KE Z J, et al. Cellular and molecular mechanisms underlying alcohol-induced aggressiveness of breast cancer[J]. Pharmacol Res, 2017, 115: 299-308. DOI:10.1016/j.phrs.2016.12.005 |
| [22] |
MITTAL V. Epithelial mesenchymal transition in tumor metastasis[J]. Annu Rev Pathol, 2018, 13: 395-412. DOI:10.1146/annurev-pathol-020117-043854 |
| [23] |
CICHON M A, RADISKY D C. ROS-induced epithelial-mesenchymal transition in mammary epithelial cells is mediated by NF-kB-dependent activation of Snail[J]. Oncotarget, 2014, 5(9): 2827-2838. DOI:10.18632/oncotarget.1940 |
| [24] |
LEÓN-BUITIMEA A, RODRÍGUEZ-FRAGOSO L, LAUER F T, et al. Ethanol-induced oxidative stress is associated with EGF receptor phosphorylation in MCF-10A cells overexpressing CYP2E1[J]. Toxicol Lett, 2012, 209(2): 161-165. DOI:10.1016/j.toxlet.2011.12.009 |
| [25] |
RYOO I G, HA H, KWAK M K. Inhibitory role of the KEAP1-NRF2 pathway in TGFβ1-stimulated renal epithelial transition to fibroblastic cells: a modulatory effect on SMAD signaling[J]. PLoS ONE, 2014, 9(4): e93265. DOI:10.1371/journal.pone.0093265 |
| [26] |
RAO R K. Commentary: acetaldehyde and epithelial-to-mesenchymal transition in colon[J]. Alcohol Clin Exp Res, 2014, 38(2): 309-311. DOI:10.1111/acer.12295 |
| [27] |
FORSYTH C B, TANG Y M, SHAIKH M, et al. Role of snail activation in alcohol-induced iNOS-mediated disruption of intestinal epithelial cell permeability[J]. Alcohol Clin Exp Res, 2011, 35(9): 1635-1643. DOI:10.1111/j.1530-0277.2011.01510.x |



