2. 400016 重庆,重庆医科大学基础医学院:生物信息学教研室
2. Department of Bioinformatics, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
糖尿病肾病(diabetic nephropathy,DN)作为糖尿病的主要微血管并发症之一,是终末期肾脏疾病的主要原因,它的典型特征是肾脏增生、基底膜增厚、间质纤维化和细胞外基质大量积累[1]。DN一旦发展为终末期肾病,其病死率显著高于其他非DN的终末期肾病患者,严重影响糖尿病患者的健康[2]。因此,早期预防及治疗DN对于病情的发展具有重大意义。肾小球系膜病变是DN最突出的病理改变之一[3],在其病程的早期就存在肾小球系膜细胞(mesangial cells,MCs)增殖,细胞外基质合成增多[4]。但这种高增殖状态的具体形成机制目前还无定论,其具体机制仍不清楚。
半乳糖凝集素3(galectin-3, Gal-3)又名Lgals3,是半乳糖结合素家族的一员,相比其他成员,Gal-3特殊的N-结构域允许Gal-3不与碳水化合物靶标结合形成多聚体复合物[5]。Gal-3在多种细胞和组织中表达,广泛存在于细胞核、细胞质、细胞表面及细胞外基质[6]。人Gal-3基因定位于14q21~22,由6个外显子和5个内含子组成,其蛋白相对分子质量为31×103,参与多种生物学活动,包括细胞生长、细胞凋亡、mRNA前剪接、血管生成、炎症、和纤维化等[7-8]。研究表明,Gal-3作为肾脏疾病、神经退行性疾病和肿瘤形成的诊断或预后生物标志物起着重要作用[9]。特别在糖尿病肾病中,KIKUCHI等[10]发现Gal-3在DN患者中显著高表达;HODEIB等[11]发现血清Gal-3是2型糖尿病患者DN进展的重要预测因子,可作为糖尿病肾病的预后生物标志物;德国研究者在糖尿病透析患者中通过随访发现基线血清Gal-3水平随肾功能下降而增加,并且与肾功能受损患者的临床终点、感染和全因病死率独立相关[12]。然而,在DN中表达异常的Gal-3是否参与MCs增殖呢?目前尚不清楚。
本研究通过二代测序发现Gal-3在DN中显著上调,进一步通过构建Gal-3过表达质粒和siRNA,研究Gal-3对高糖下MCs增殖的作用及机制。以期为探索DN中MCs增殖的具体机制提供实验依据,为后续DN的早期诊断和治疗提供新的分子靶点。
1 材料与方法 1.1 实验动物及试剂4周龄雄性2型糖尿病模型小鼠(db/db小鼠)(BKS.Cg- +Leprdb/ +Leprdb/J)购自南京大学模式动物研究所,作为DN组(n=10)。正常对照C57BL/6J小鼠为重庆医科大学实验动物中心提供,周龄、性别与DN组小鼠同质,为正常组(n=10)。小鼠饲养于重庆医科大学实验动物中心,12周龄时检测血糖和尿白蛋白后处死,取肾脏皮质保存于液氮用于后续实验。所有操作经重庆医科大学伦理委员会同意。
小鼠MCs(SV40-MES14)由本实验室保存。转染试剂Lipofectamine®2000购自美国Invitrogen公司;TB Green® Premix Ex TaqTMⅡ、逆转录试剂盒、TRIzol试剂购自日本TaKaRa公司;DMEM高糖和低糖培养基购自美国Gibco公司;山羊抗鼠Gal-3,Mek,p-Mek和二抗山羊抗鼠IgG购自英国Abcam公司;EdU试剂盒购自中国Thermofisher公司;胎牛血清、青霉素-链霉素溶液,SDS-PAGE相关试剂及细胞裂解液、蛋白定量试剂盒购自中国碧云天生物技术有限公司;PVDF膜购自美国Millipore公司。
1.2 二代测序12周龄DN组小鼠(n=3)和正常组小鼠(n=3)肾脏组织送华大基因公司进行二代测序检测。组织提取总RNA后,将其打断成短片段后为模板,用六碱基随机引物合成cDNA第1链,并加入缓冲液、dNTPs、RNase H和DNA polymerase I,合成cDNA第2链,经过QiaQuick PCR试剂盒纯化后,通过UNG(Uracil-N-Glycosylase)酶降解第2条链。然后用琼脂糖凝胶电泳进行片段大小选择,进行PCR扩增。建好的测序文库用Illumina HiSeqTM 2000进行测序,对其结果进行信息分析。
1.3 Gal-3过表达质粒构建及siRNA合成Gal-3过表达质粒由吉玛基因合成。根据Ensembl数据库小鼠Gal-3的基因序列,用Primer Premier 6.0设计引物,并根据EX-Mm03620-M98载体多克隆位点,分别在Gal-3上下游引物加入BsrGI和Sa1Ⅰ位点,BLAST在线分析引物特异性,PCR扩增Gal-3。其上游引物:5′-AGAGTGGCAAACCATTCA-3′,下游引物:5′-TCACGAGCAGTCCTAAGA-3′。PCR产物纯化后,BsrGI和Sa1Ⅰ酶切1 h, T4连接酶4 ℃过夜连接入EX-Mm03620-M98表达载体,连接产物转化E. coli DH5α感受态细胞,将200 μL已转化的感受态细胞转移到含有Ampicillin固体LB琼脂糖培养基上,挑取阳性单克隆在恒温摇床中37 ℃、250 r/min振荡过夜后,提取质粒进行PCR、酶切、测序鉴定。
同时,根据Ensembl数据库中公布的小鼠Gal-3 mRNA序列,通过Oligo软件设计3条siRNA靶序列, 具体如下:siRNA-1:5′-GCUUAACGAUGCCUUAGCU-3′(sense), 5′-AGCUAAGGCAUCGUUAAGC-3′(antisense);siRNA-2:5′-CCUCCGGGAAAUCAGCCAA-3′(sense), 5′-UUGGCUGAUUUCCCGGAGG-3′(antisense);siRNA-3:5′-UCAUUGUGUGUAACACGAATT-3′(sense), 5′- UUCGUGUUACACACAAUGATT-3′(antisense)。上述引物由生工生物工程(上海)股份有限公司合成。
1.4 细胞培养及转染小鼠MCs分别用含有15%灭活的胎牛血清的DMEM高糖(25 mmol/L)和低糖(5 mmol/L)培养基,在含5%CO2、37 ℃的培养箱中培养,分别命名为高糖组和低糖组。MCs接种于6孔板中,每组设3个平行孔,待细胞生长到70%~80%时,运用Lipofectamine 2000将质粒及siRNA等转染入细胞,具体操作按操作手册进行,24~48 h后收获细胞,准备后续实验。根据转染物的不同,将高糖组细胞分为未处理组(转染时仅加入脂质体Lipofectamine 2000)、对照组(转染siRNA的阴性对照)以及siRNA组(转染Gal-3 siRNA);低糖组细胞分为未处理组(转染时仅加入脂质体Lipofectamine 2000)、空载组(转染空载质粒)以及Gal-3组(转染Gal-3过表达质粒)。
1.5 实时定量PCR (qRT-PCR)检测Gal-3的表达运用TRIzol提取小鼠肾脏组织RNA和MCs总RNA,通过逆转录试剂盒将总RNA逆转录为cDNA后,使用TB Green® Premix Ex TaqTM Ⅱ进行扩增检测,体系为10 μL,每组设置3个复孔。反应条件为:95 ℃预变性3 min,95 ℃ 5 s,55 ℃ 34 s,72 ℃ 60 s,40个循环。实验结果以内参基因β-actin为参考, 用2-ΔΔCt公式对Gal-3基因表达进行相对定量分析。
1.6 Western blot检测Gal-3、Mek、磷酸化Mek的表达在低糖和高糖培养的MCs中分别转染Gal-3过表达质粒及siRNA,48 h后PBS洗3次,收集细胞,根据细胞量加入RIPA裂解液,测定细胞蛋白浓度。SDS-PAGE凝胶电泳,切胶,转膜,封闭,加入一抗抗体(Gal-3,1 :1 000;β-actin,1 :1 000;Mek,1 :3 000;p-Mek1 :3 000;GAPDH,1 :3 000),4℃摇床过夜,加入二抗(山羊抗鼠,1 :5 000)常温摇床2 h后显影。
1.7 5-乙基-2′-脱氧尿嘧啶核苷(5-Ethynyl-2′-deoxyuridine, EdU)检测MCs的增殖能力将不同组的MCs接种于24孔板内。待每孔内细胞生长至70%进行转染,转染24 h后,根据EdU实验试剂盒说明书进行操作。EdU实验主要包括:EdU标记、细胞固定、Apollo染色、DAPI染色等,最后用共聚焦显微镜获取图像,使用Image pro软件进行活细胞计数分析。
1.8 统计学分析采用SPSS 21.0统计软件,实验数据以x±s表示。两组数据比较采用非配对t检验,多组间数据比较采用单因素方差分析,P < 0.05被认为差异具有统计学意义。
2 结果 2.1 Gal-3在DN小鼠和MCs中高表达运用二代测序检测DN组及正常组小鼠肾脏组织基因表达情况,结果显示:4 654个基因呈差异表达(校正P值q < 0.01),其中2 756个基因呈上调,1 898个基因呈下调(图 1A)。采用qRT-PCR检测正常组和DN组小鼠肾组织,以及高低糖培养的MCs中Gal-3的表达,结果显示:Gal-3表达在DN组显著高于正常组(P < 0.01,图 1B);高糖培养条件下的MCs中Gal-3表达显著高于低糖培养条件下的MCs(P < 0.01,图 1C)。提示Gal-3可能参与高糖下MCs的病理生理改变。
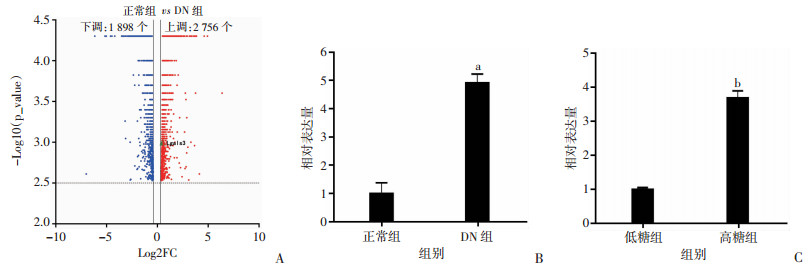
|
| A:二代测序检测DN及正常小鼠肾脏组织基因表达情况;B:qRT-PCR检测DN组及正常小组鼠肾脏组织中Gal-3水平 a: P < 0.01, 与正常组比较;C:qRT-PCR检测低糖和高糖培养的小鼠MCs中Gal-3水平 b: P < 0.01, 与低糖组比较 图 1 Gal-3在DN小鼠肾脏组织和MCs中的表达 |
2.2 过表达质粒和siRNA的转染效率
运用qRT-PCR检测转染了过表达质粒的低糖组MCs中Gal-3的表达,结果显示:表达质粒组可显著高表达Gal-3(图 2A,P < 0.01)。同时,转染Gal-3的siRNA-1、siRNA-2和siRNA-3入高糖培养的MCs中,qRT-PCR检测结果显示:siRNA-3可显著沉默Gal-3的表达(图 2B,P < 0.01)。采用Western blot检测转染过表达质粒和siRNA-3后MCs的Gal-3的表达,结果显示:转染过表达质粒显著增加Gal-3蛋白水平,转染Gal-3 siRNA-3可明显沉默Gal-3蛋白水平(图 2C、D)。提示Gal-3过表达质粒和siRNA-3(后称其为Gal-3 siRNA)是可用于后续高低表达Gal-3的良好工具。
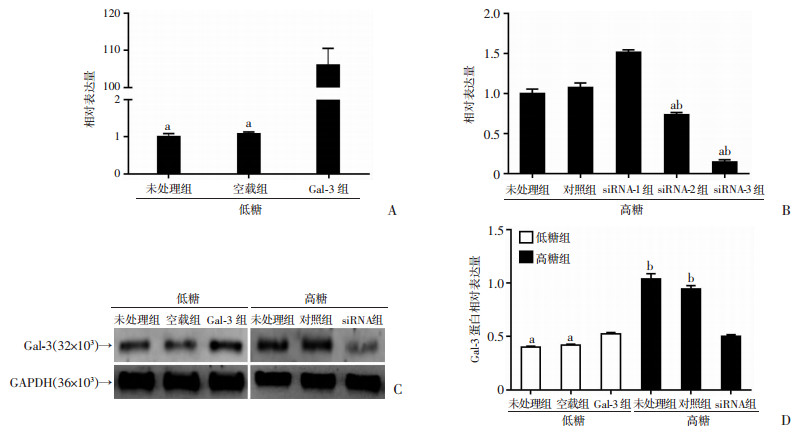
|
| A:qRT-PCR检测低糖培养的MCs中Gal-3过表达效率 a: P < 0.01, 与Gal-3组比较;B:qRT-PCR检测高糖培养的MCs中Gal-3-siRNA敲低效率 a:P < 0.01, 与未处理组比较;b:P < 0.01, 与对照组比较;C:Western blot检测转染过表达质粒和siRNAs后Gal-3蛋白的表达;D:半定量分析结果 a:P < 0.001, 与Gal-3组比较;b:P < 0.001, 与siRNA组比较 图 2 qRT- PCR和Western blot检测转染过表达质粒和siRNAs后MCs中Gal-3的表达 |
2.3 Gal-3促进MCs增殖
EdU检测结果显示:低糖培养的MCs的增殖能力低于高糖培养的MCs,但转染过表达质粒后,其细胞增殖能力较空载组及未处理组显著提高;同时,在转染Gal-3 siRNA的高糖MCs中,其增殖能力较对照组及未处理组均显著明显下降(P < 0.01, 图 3)。表明过表达Gal-3可促进MCs增殖,而沉默Gal-3后可抑制MCs增殖,表明Gal-3可能对MCs的增殖存在调控作用。
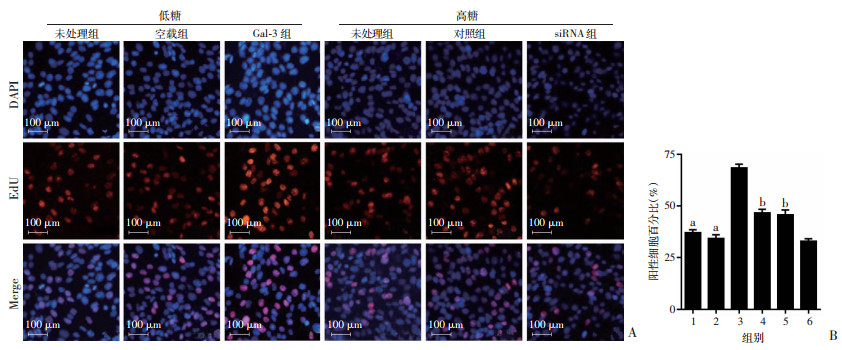
|
| A:EdU检测转染Gal-3过表达质粒和siRNA后MCs增殖; B:定量分析转染Gal-3过表达质粒和siRNA后MCs增殖 1:低糖未处理组;2:低糖空载组;3:低糖Gal-3组;4:高糖未处理组;5:高糖对照组;6:高糖siRNA组;a: P < 0.01, 与低糖Gal-3组比较;b: P < 0.01, 与siRNA组比较 图 3 EdU检测在低高糖条件下的MCs中转染Gal-3过表达质粒和siRNAs后MCs的增殖能力 |
2.4 Gal-3调控DN的Mek信号途径
运用Western blot检测转染Gal-3过表达质粒入低糖培养的MCs和转染Gal-3 siRNA入高糖培养的MCs后Mek和磷酸化Mek的表达。结果显示:低糖培养的MCs的Mek磷酸化水平低于高糖培养的MCs,但在低糖组MCs中转染过表达质粒后,磷酸化Mek较空载组及未处理组显著上调(P < 0.01);同时,在高糖MCs中转染siRNA后,磷酸化Mek较对照组及未处理组显著明显下降(P < 0.001)(图 4)。提示Gal-3可能通过调控Mek磷酸化进而影响MCs的增殖。
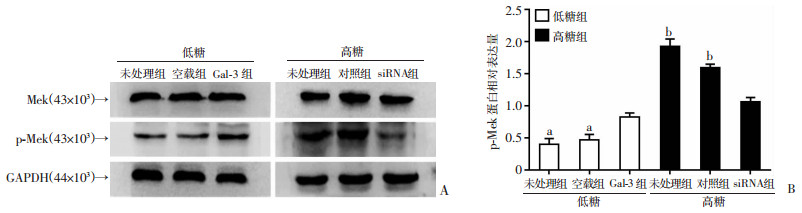
|
| A:Western blot检测转染Gal-3过表达质粒和siRNA后Mek和p-Mek的表达; B:半定量分析转染Gal-3过表达质粒和siRNA后p-Mek的表达 a: P < 0.01, 与Gal-3组比较;b: P < 0.001, 与siRNA组比较 图 4 Western blot检测转染Gal-3过表达质粒和siRNA后Mek和p-Mek的表达 |
3 讨论
DN是继发于糖尿病的进展性肾脏疾病,在我国已成为慢性肾脏疾病的主要疾病类型,并诱发患者终末期肾功能衰竭,严重影响人类健康[13]。近年来,Gal-3在DN发展中的作用引起了广泛关注。新近研究表明,Gal-3在成人正常肾脏中一般呈现低表达水平,但在DN患者中的平均表达水平要显著高于其他非DN的糖尿病患者[11];TAN等[14]报道通过对DN患者与其他肾病患者进行肾活检,发现DN患者肾脏内Gal-3的表达显著高于其他肾脏疾病患者。随着新测序技术的改进,二代测序已越来越多地应用于癌症和代谢性疾病的基因组和转录组学研究领域[15]。在DN研究领域,已经广泛运用二代测序研究分析其基因组和转录组表达以识别与DN相关的罕见或常见遗传变异[16]。有意思的是,本研究应用二代测序检测DN相关基因表达情况,结果发现4 654个基因呈差异表达(q < 0.01),其中2 756个基因呈上调,1 898个基因呈下调。在上调基因中,发现了Gal-3的身影,引起了我们的关注。进一步运用qRT-PCR在体内外验证Gal-3的表达,结果显示Gal-3不仅在DN小鼠的肾脏组织中高表达,在高糖培养的MCs中也呈现表达增高。以上结果提示Gal-3确实在DN中具有重要意义。众所周知,系膜增生是DN进展的重要病理变化之一,Gal-3是否参与DN中MCs增殖?其具体制如何?需进一步探索。
为了研究Gal-3对MCs增殖的影响,本研究采用过表达质粒高表达Gal-3和siRNA沉默Gal-3, 应用qRT-PCR和Western blot检验其表达效率以保证后续实验。结果显示Gal-3过表达及沉默效率良好,为后续研究Gal-3在MCs内的功能奠定了良好基础。进一步应用EdU细胞增殖实验检测高低表达Gal-3后MCs增殖能力的变化。结果表明:在高糖培养的MCs中,其增殖能力显著高于低糖组细胞,然而在高糖组沉默Gal-3后,其增殖能力较未处理组和空载组显著降低;反之,在低糖组过表达Gal-3后,其增殖能力较未处理组和对照组显著提高。结合相关研究报道:Gal-3基因敲除后可明显抑制肾癌细胞的增殖[17],Gal-3可促进急性肾脏疾病中的细胞增殖[18],并可导致DN患者体内肾纤维化等[19]。由此提示:Gal-3参与调节DNMCs增殖,可能在DN发展中起重要作用。
为了深入研究Gal-3调控MCs增殖的机制,本研究运用Western blot检测了高低表达Gal-3后MCs中的Mek和p-Mek的表达。结果显示:在MCs中高表达Gal-3后p-Mek的表达增高,而沉默Gal-3后,p-Mek的表达降低,提示Gal-3可能通过Mek信号传导调控MCs增殖。以往的研究报道:Gal-3的下调导致Mek/Erk信号通路活性显著降低,并抑制肝癌细胞的增殖、迁移和侵袭[20]。Mek信号通路是DN的经典信号通路,已有研究报道关键基因可通过调控Mek信号通路影响DN中肾纤维化[21]、MCs的增殖[22]、肾小球血管内皮细胞的内皮-间质转化[23]。以上结果提示:Gal-3可能通过提高Mek磷酸化水平,激活Mek,从而调控高糖下MCs的增殖,进而影响DN的发生、发展。
综上所述,本研究发现Gal-3在DN小鼠肾脏组织及高糖培养的MCs中表达显著上调;高低表达Gal-3后可调控MCs的增殖能力;且其机制可能与Gal-3调控Mek的磷酸化有关。因此,Gal-3可能通过激活Mek途径,刺激MCs增殖,影响DN的发生、发展,为DN病因的阐述和临床疾病诊治的分子试剂开发提供了新的实验室依据,为进一步理解DN发病机制和找到潜在分子治疗靶点奠定了理论基础。本研究仅探索了Gal-3通过Mek参与MCs的增殖,但Gal-3调控Mek活性后如何参与DN病情发展,其下游分子机制如何仍有待深入研究,并且Gal-3是否参与DN的炎症、纤维化等病理过程也有待于进一步研究。
| [1] |
LI A L, PENG R, SUN Y, et al. LincRNA 1700020I14Rik alleviates cell proliferation and fibrosis in diabetic nephropathy via miR-34a-5p/Sirt1/HIF-1α signaling[J]. Cell Death Dis, 2018, 9(5): 461. DOI:10.1038/s41419-018-0527-8 |
| [2] |
GIORDA C B, CARNÀ P, SALOMONE M, et al. Ten-year comparative analysis of incidence, prognosis, and associated factors for dialysis and renal transplantation in type 1 and type 2 diabetes versus non-diabetes[J]. Acta Diabetol, 2018, 55(7): 733-740. DOI:10.1007/s00592-018-1142-y |
| [3] |
NAJAFIAN B, ALPERS C E, FOGO A B. Pathology of human diabetic nephropathy[J]. Contrib Nephrol, 2011, 170: 36-47. DOI:10.1159/000324942 |
| [4] |
BU X, ZHOU Y, ZHANG H, et al. Systemic administration of naked plasmid encoding HGF attenuates puromycin aminonucleoside-induced damage of murine glomerular podocytes[J]. Am J Physiol Renal Physiol, 2011, 301(4): F784-F792. DOI:10.1152/ajprenal.00210.2011 |
| [5] |
CHAUDOIN T R, BONASERA S J. Mice lacking galectin-3 (Lgals3) function have decreased home cage movement[J]. BMC Neurosci, 2018, 19(1): 27. DOI:10.1186/s12868-018-0428-x |
| [6] |
MENDONÇA BELMONT T F, DO Ó K P, SOARES DA SILVA A, et al. Single nucleotide polymorphisms at +191 and +292 of galectin-3 gene (LGALS3) related to lower GAL-3 serum levels are associated with frequent respiratory tract infection and vaso-occlusive crisis in children with sickle cell Anemia[J]. PLoS ONE, 2016, 11(9): e0162297. DOI:10.1371/journal.pone.0162297 |
| [7] |
KNIGHTS A J, YIK J J, MAT JUSOH H, et al. Krüppel-like factor 3 (KLF3/BKLF) is required for widespread repression of the inflammatory modulator galectin-3 (Lgals3)[J]. J Biol Chem, 2016, 291(31): 16048-16058. DOI:10.1074/jbc.M116.715748 |
| [8] |
HU C Y, CHANG S K, WU C S, et al. Galectin-3 gene (LGALS3) +292C allele is a genetic predisposition factor for rheumatoid arthritis in Taiwan[J]. Clin Rheumatol, 2011, 30(9): 1227-1233. DOI:10.1007/s10067-011-1741-2 |
| [9] |
HARA A, NIWA M, NOGUCHI K, et al. Galectin-3 as a next-generation biomarker for detecting early stage of various diseases[J]. Biomolecules, 2020, 10(3): E389. DOI:10.3390/biom10030389 |
| [10] |
KIKUCHI Y, KOBAYASHI S, HEMMI N, et al. Galectin-3-positive cell infiltration in human diabetic nephropathy[J]. Nephrol Dial Transplant, 2004, 19(3): 602-607. DOI:10.1093/ndt/gfg603 |
| [11] |
HODEIB H, HAGRAS M M, ABDELHAI D, et al. Galectin-3 as a prognostic biomarker for diabetic nephropathy[J]. Diabetes Metab Syndr Obes, 2019, 12: 325-331. DOI:10.2147/DMSO.S194410 |
| [12] |
DRECHSLER C, DELGADO G, WANNER C, et al. Galectin-3, renal function, and clinical outcomes: results from the LURIC and 4D studies[J]. J Am Soc Nephrol, 2015, 26(9): 2213-2221. DOI:10.1681/ASN.2014010093 |
| [13] |
WEI T T, SHU Q, NING J, et al. The protective effect of basic fibroblast growth factor on diabetic nephropathy through remodeling metabolic phenotype and suppressing oxidative stress in mice[J]. Front Pharmacol, 2020, 11: 66. DOI:10.3389/fphar.2020.00066 |
| [14] |
TAN K C B, CHEUNG C L, LEE A C H, et al. Galectin-3 is independently associated with progression of nephropathy in type 2 diabetes mellitus[J]. Diabetologia, 2018, 61(5): 1212-1219. DOI:10.1007/s00125-018-4552-z |
| [15] |
SABOUR L, SABOUR M, GHORBIAN S. Clinical applications of next-generation sequencing in cancer diagnosis[J]. Pathol Oncol Res, 2017, 23(2): 225-234. DOI:10.1007/s12253-016-0124-z |
| [16] |
TSAI Y C, KUO M C, HUNG W W, et al. High glucose induces mesangial cell apoptosis through miR-15b-5p and promotes diabetic nephropathy by extracellular vesicle delivery[J]. Mol Ther, 2020, 28(3): 963-974. DOI:10.1016/j.ymthe.2020.01.014 |
| [17] |
XU Y Y, LI C F, SUN J H, et al. Antitumor effects of galectin-3 inhibition in human renal carcinoma cells[J]. Exp Biol Med (Maywood), 2016, 241(13): 1365-1373. DOI:10.1177/1535370216630839 |
| [18] |
GHORBANI A, BHAMBHANI V, CHRISTENSON R H, et al. Longitudinal change in galectin-3 and incident cardiovascular outcomes[J]. J Am Coll Cardiol, 2018, 72(25): 3246-3254. DOI:10.1016/j.jacc.2018.09.076 |
| [19] |
RAVANI P, BARRETT B J. Galectin-3 and new-onset CKD: marker or mediator?[J]. J Am Soc Nephrol, 2013, 24(9): 1342-1344. DOI:10.1681/ASN.2013050552 |
| [20] |
ZHENG D T, HU Z Z, HE F, et al. Downregulation of galectin-3 causes a decrease in uPAR levels and inhibits the proliferation, migration and invasion of hepatocellular carcinoma cells[J]. Oncol Rep, 2014, 32(1): 411-418. DOI:10.3892/or.2014.3170 |
| [21] |
HUANG H, NI H, MA K, et al. ANGPTL2 regulates autophagy through the MEK/ERK/Nrf-1 pathway and affects the progression of renal fibrosis in diabetic nephropathy[J]. Am J Transl Res, 2019, 11(9): 5472-5486. |
| [22] |
CHEN W Y, PENG R, SUN Y, et al. The topological key lncRNA H2k2 from the CeRNA network promotes mesangial cell proliferation in diabetic nephropathy via the miR-449a/b/Trim11/Mek signaling pathway[J]. FASEB J, 2019, 33(10): 11492-11506. DOI:10.1096/fj.201900522r |
| [23] |
SHANG J, ZHANG Y, JIANG Y M, et al. NOD2 promotes endothelial-to-mesenchymal transition of glomerular endothelial cells via MEK/ERK signaling pathway in diabetic nephropathy[J]. Biochem Biophys Res Commun, 2017, 484(2): 435-441. DOI:10.1016/j.bbrc.2017.01.155 |



