随着经皮冠状动脉支架植入术(percutaneous coronary intervention,PCI)的普及,冠心病心肌梗死患者病死率显著降低,但不少患者在PCI术后出现心律失常、心力衰竭等。研究表明,心肌梗死患者PCI术后,缺血缺氧的心肌细胞恢复血流供氧,在氧自由基的爆发、钙超载、炎症及线粒体活性氧的释放等因素相互作用下,引起心肌细胞凋亡的增加,导致心肌组织结构及功能损害,即心肌缺血再灌注损伤[1]。
长链非编码RNA(long noncoding RNA,LncRNA)作为长度大于200个核苷酸分子的非编码RNA,在冠心病[2]、高血压[3]、糖尿病心肌病[4]、心力衰竭[5]等多种心血管疾病中起重要调控作用。但LncRNA在心肌缺血再灌注损伤中对心肌细胞凋亡的影响及调控机制仍不明确。本课题组前期通过对缺氧24 h复氧6 h与常氧状态的大鼠H9c2心肌细胞进行LncRNA芯片分析,发现LOC100360491在缺氧复氧组的心肌细胞中表达显著下调(未发表),提示其可能参与缺氧复氧心肌细胞的生物学行为,同时采用编码-非编码RNA共表达网络、GO/pathway、KEGG分析得出在转录水平与其相邻且差异性表达明显的mRNA为PAK3与CNNM2。这表明LOC100360491/PAK3/CNNM2信号轴可能参与缺氧复氧诱导的大鼠H9c2心肌细胞凋亡的调控。本研究以慢病毒为载体构建过表达/抑制LOC100360491的大鼠H9c2心肌细胞系[6],探讨LOC100360491对缺氧复氧诱导大鼠H9c2心肌细胞凋亡的影响及其可能调控机制,为阐明LOC100360491在心肌缺血再灌注损伤中的作用及其分子机制奠定基础。
1 材料与方法 1.1 实验材料大鼠H9c2心肌细胞株购自上海中国科学院细胞库;慢病毒购自汉恒生物公司;Annexin V-FITC/PI凋亡试剂盒、Dichlorofluorescin diacetate(DCFH-DC)试剂盒购自Sigma公司;procaspase3、cleaved-caspase3、Bax及Bcl-2等兔来源抗大鼠的一抗均购自博士德生物公司;PAK3、CNNM2相关逆转录及扩增试剂盒均购自TaKaRa生物公司;流式细胞仪购自美国Beckman Coulter公司;倒置荧光显微镜购自德国Olympus公司;酶标仪购自美国Thermo公司;电泳槽、配胶架、Western bolt转膜仪、图像分析系统、PCR仪均购自美国Bio-Rad公司。
1.2 实验方法 1.2.1 过表达/抑制LOC100360491的大鼠H9c2心肌细胞系的构建大鼠H9c2心肌细胞采用含10%胎牛血清、1%青-链霉素、1%谷氨酰胺的DMEM高糖培养基,置于37 ℃、5% CO2培养箱中培养,细胞生长至80%以上时进行后续实验,选取生长状态良好的细胞,分为4组:空白对照组(不做处理)、过表达LOC100360491组(转染过表达LOC100360491慢病毒)、抑制LOC100360491组(转染抑制LOC100360491慢病毒)、空载体组(转染空载体)。参照慢病毒转染说明书转染慢病毒,按300感染复数(nultiplicity of infection, MOI)转染大鼠H9c2心肌细胞24 h后通过倒置显微镜观察荧光变化,RT-PCR检测LOC1003 60491的表达以验证转染效率。实验重复3次。
1.2.2 qRT-PCR检测转染效率转染慢病毒48 h后,按照RNA抽提试剂盒提取各组细胞中总RNA。以GAPDH为内参,采用RT-PCR试剂盒对LOC100360491进行逆转录及扩增,使用20 μL体系,反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环检测LOC100360491表达量。LOC100360491引物序列上游:5′-CAAGAAAATGGCACGCACC-3′,下游:5′-TCTTCAGCAGA-ACTGTCTCCCT-3′。采用2-ΔΔCt法进行分析,计算实验组、对照组的ΔCt后即可计算2-ΔΔCt (ΔCt=Ct靶基因-Ct内参基因,ΔΔCt=ΔCt实验组-ΔCt对照组)。实验重复3次。
1.2.3 建立H9c2心肌细胞缺氧复氧模型将转染过表达/抑制LOC100360491慢病毒的大鼠H9c2心肌细胞进行缺氧复氧处理用于后续实验。分为5组:空白对照组、缺氧复氧组(缺氧24 h复氧6 h)、过表达LOC100360491组(过表达LOC100360491后对大鼠H9c2心肌细胞进行缺氧复氧处理)、抑制LOC100360491组(抑制LOC100360491后对大鼠H9c2心肌细胞进行缺氧复氧处理)、空载体组(转染空载体慢病毒后对大鼠H9c2心肌细胞进行缺氧复氧处理)。采用37 ℃、5% CO2、94% N2、1% O2不含胎牛血清的DMEM低糖完全培养基培养大鼠H9c2心肌细胞24 h作为缺氧培养条件;37 ℃、5% CO2、95%空气,含10%胎牛血清DMEM高糖培养基培养6 h作为复氧培养条件。
1.2.4 Annexin V-FITC/PI检测各组细胞早期凋亡缺氧复氧后,收集细胞培养液并用不含EDTA的胰酶消化细胞,均移至50 mL离心管中,以获取缺氧复氧后的细胞。1 000 r/min,离心5 min,弃上清,PBS重悬细胞,再次离心,弃上清。用1× Binding Buffer重悬细胞,调整细胞数为1×106个/mL。将调整好的细胞每管100 μL加入空白对照管、Annexin V-FITC单染管、PI单染管、Annexin V-FITC+PI双染管。其中,Annexin V-FITC+PI双染管中,Annexin V-FITC阳性+PI阴性即FITC(+)+PE(-)表示凋亡早期磷脂酰丝氨酸外翻细胞所在象限。按分组分别加入5 μL Annexin V-FITC,避光孵育10 min,5 μL PI,避光室温孵育5 min。PBS补足至500 μL,混匀后立即上机检测。
1.2.5 2′, 7′-二氯荧光素二乙酸酯2′,7′-Dichlordihydroofluorescein diacetate(DCFH-DA)检测线粒体活性氧的释放情况根据说明书用无血清高糖DMEM培养基配制10 μmol/L DCFH-DA工作液。缺氧复氧后,弃培养基,PBS清洗3次,加入2 mL DCFH-DA工作液,37 ℃ 5% CO2培养箱培养30 min。PBS清洗3次,去除未进入细胞的DCFH-DA探针。胰酶消化细胞,收集细胞悬液,PBS调整细胞浓度为1×106/mL后取100 μL单细胞悬液加入到2 mL EP管中。PBS补足至500 μL,混匀后流式细胞仪上机检测。
1.2.6 Western blot检测凋亡相关蛋白表达按照分组处理细胞后收集细胞沉淀,RAPI裂解液裂解细胞,裂解30 min后,将裂解液移至1.5 mL离心管中,12 000 r/min离心20 min,取上清,BCA法定量后,SDS-PAGE电泳分离,转膜,5%脱脂奶粉溶液中室温封闭1 h,加入procaspase3(1 :500)、cleaved-caspase3(1 :500)、Bcl-2(1 :1 000)、Bax(1 :2 000)等蛋白的兔抗大鼠一抗,4 ℃过夜;TBST洗膜4次,每次10 min;加入羊抗兔HRP标记的二抗(1 : 2 000),室温孵育1 h。TBST洗膜4次,每次10 min。ECL化学发光试剂盒检测,用凝胶成像系统拍照,Image J软件分析条带的灰度,以GAPDH为内参,测定procaspase3、cleaved-caspase3、Bcl-2、Bax蛋白相对表达量。
1.2.7 qRT-PCR检测PAK3、CNNM2基因表达转染慢病毒48 h后,按照RNA抽提试剂盒提取各组总RNA。以GAPDH为内参,逆转录及扩增PAK3、CNNM2。使用20 μL体系,反应条件:95 ℃ 30 s,95℃ 5 s,60 ℃ 30 s,40个循环检测空白对照组、过表达LOC100360491组、抑制LOC100360491组及空载体组中PAK3、CNNM2的表达量。PAK3引物序列上游:5′-CGTGAAGCGAGAGAGCCAGT-3′,下游:5′-GGGTAAG-GGATTTTGAAAGAGGTT-3′;CNNM2引物序列上游:5′-GCCCGTAGACTACTTCGTCC-3′,下游:5′-AACAAAGGTGCGAGACAGGG-3′。采用2-ΔΔCt法进行分析,计算实验组、对照组的ΔCt,然后即可计算2-ΔΔCt(ΔCt=Ct靶基因-Ct内参基因,ΔΔCt =ΔCt实验组-ΔCt对照组)。实验重复3次。
1.3 统计学分析采用SPSS 22.0统计软件包进行分析。数据以x±s表示,多组间比较采用完全随机设计的单因素方差分析,组间两两比较用q检验,相关分析采用直线相关分析。
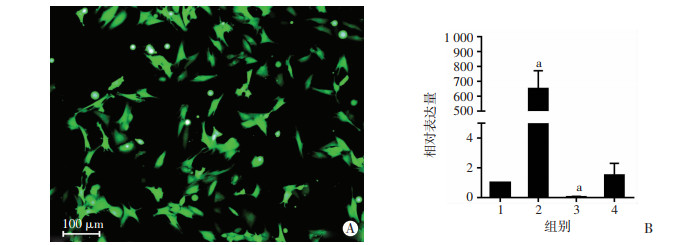
2 结果 2.1 慢病毒转染大鼠H9c2心肌细胞后LOC100360491的表达将携带有绿色荧光且过表达/抑制LOC100360491的慢病毒及空载体按照300 MOI转染大鼠H9c2心肌细胞,24 h后即可在荧光显微镜下观察到被转染慢病毒的H9c2心肌细胞呈现绿色荧光(图 1A)。慢病毒转染大鼠H9c2心肌细胞48 h后,采用qRT-PCR检测细胞中LOC100360491的表达,结果显示:与空载体组相比,过表达LOC100360491组中LOC100360491表达显著上调(P < 0.05),抑制LOC100360491组中LOC100360491表达显著下调(P < 0.05,图 1B)。提示慢病毒转染大鼠H9c2心肌细胞48 h后成功构建过表达/抑制LOC100360491的心肌细胞系。在48~72 h后,细胞融合至80%以上后传代,传至P2~3代后用于后续试验。
|
| A:荧光显微镜观察慢病毒转染大鼠H9c2心肌细胞24 h后的荧光表达;B:RT-PCR检测各组细胞处理48 h后LOC100360491的相对表达量(n=3) 1:空白对照组;2:过表达LOC100360491组;3抑制LOC100360491组;4:空载体组;a:P < 0.05,与空载体组比较 图 1 慢病毒转染大鼠H9c2心肌细胞荧光表达及qRT-PCR验证转染效率 |
2.2 过表达LOC100360491抑制缺氧复氧后大鼠H9c2心肌细胞的早期凋亡
缺氧复氧组H9c2心肌细胞凋亡率达(61.32±1.07)%,较空白对照组显著升高(P < 0.05,图 2)。与缺氧复氧组相比,过表达LOC100360491组H9c2心肌细胞凋亡率[(34.24±0.71)%]显著降低(P < 0.05,图 2),抑制LOC100360491组凋亡率[(65.16±0.69)%]显著升高(P < 0.05,图 2),而空载体组无明显变化(P>0.05)。因此,过表达LOC100360491可显著抑制缺氧复氧后H9c2心肌细胞的早期凋亡。

|
| A:流式细胞术检测结果;B:各组H9c2心肌细胞凋亡率(n=3) 1:空白对照组;2:缺氧复氧组;3:过表达LOC100360491组;4:抑制LOC100360491组;5:空载体组;a:P < 0.05,与缺氧复氧组比较 图 2 流式细胞术检测各组H9c2心肌细胞凋亡变化情况 |
2.3 过表达LOC100360491抑制缺氧复氧后大鼠H9c2心肌细胞线粒体活性氧的释放
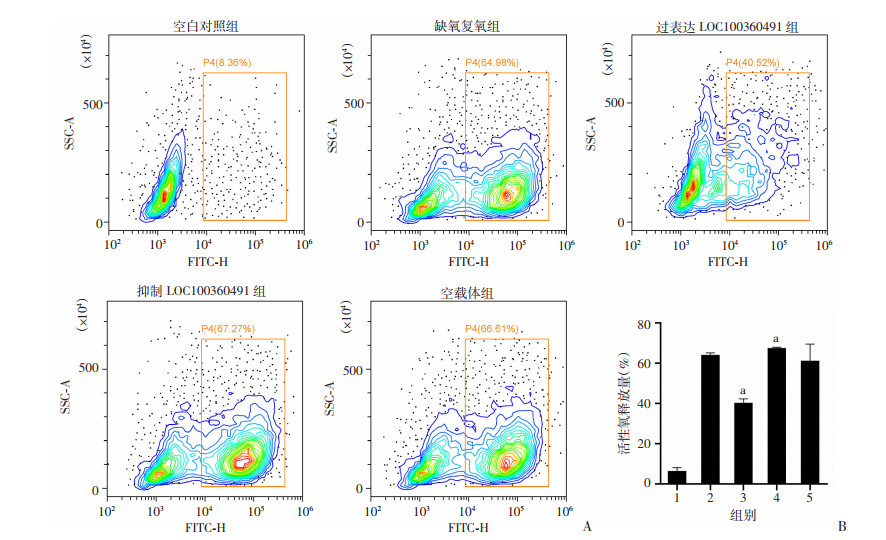
流式细胞术检测各组大鼠H9c2心肌细胞凋亡中期线粒体活性氧的释放情况见图 3。与缺氧复氧组[(60.97±0.47)%]相比,过表达LOC100360491组H9c2心肌细胞内活性氧释放量[(38.49±0.58)%]显著下降(P < 0.05),而抑制LOC100360491组H9c2心肌细胞内活性氧释放量[(64.13±0.54)%]则显著上升(P < 0.05);空载体组无明显变化(P>0.05)。表明过表达LOC100360491可降低缺氧复氧后H9c2心肌细胞凋亡中期粒体活性氧的释放。
|
| A:流式细胞术检测结果;B:各组H9c2心肌细胞活性氧释放量(n=3) 1:空白对照组;2:缺氧复氧组;3:过表达LOC100360491组;4:抑制LOC100360491组;5:空载体组;a:P < 0.05,与缺氧复氧组比较 图 3 流式细胞术检测各组H9c2心肌细胞线粒体活性氧的释放 |
2.4 过表达LOC100360491调控缺氧复氧后大鼠H9c2心肌细胞凋亡相关蛋白的表达
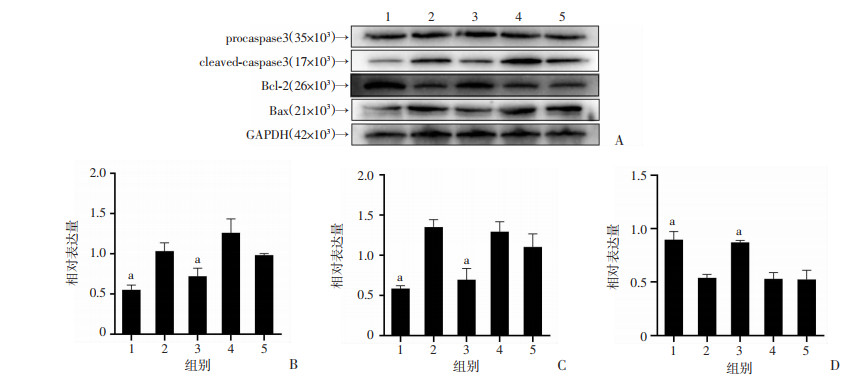
Western blot检测结果见图 4。与空白对照组相比,缺氧复氧组cleaved-caspase3/procaspase3比值与Bax均显著上调,Bcl-2显著下调(P < 0.05);与缺氧复氧组相比,过表达LOC100360491组cleaved- caspase3/procaspase3比值、Bax显著下调,Bcl-2显著上调(P < 0.05)。而抑制LOC100360491组和空载体组上述蛋白表达与缺氧复氧组比较差异均无统计学意义(P>0.05)。
|
|
A:Western blot检测结果;B:cleaved-caspase3/procaspase3相对表达量;C:Bax相对表达量;D:Bcl-2相对表达量 1:空白对照组;2:缺氧复氧组;3:过表达LOC100360491组;4:抑制LOC100360491组;5:空载体组;a:P < 0.05,与缺氧复氧组比较 图 4 Western blot检测各分组H9c2心肌细胞中凋亡蛋白的表达情况 |
2.5 qRT-PCR检测过表达/抑制LOC100360491后,大鼠H9c2心肌细胞中PAK3、CNNM2的表达
为进一步探索LOC100360491/PAK3/CNNM2之间是否存在潜在调控关系,在大鼠H9c2心肌细胞中过表达/抑制LOC100360491后,采用qRT-PCR检测PAK3、CNNM2的含量变化,结果见图 5。与空白对照组相比,抑制LOC100360491组PAK3及CNNM2表达均显著下降(P < 0.05)。而过表达LOC100360491组PAK3表达显著上升(P < 0.05),CNNM2无明显变化(P>0.05)。提示大鼠H9c2心肌细胞中LOC100360491可能调控PAK3的表达,从而参与细胞凋亡的调节。

|
| a:P < 0.05,与空白对照组比较 图 5 qRT-PCR检测各组细胞中PAK3、CNNM2的表达 |
3 讨论
细胞凋亡是机体应对外界的有害刺激而启动的主动性程序性死亡途径。依据不同的启动途径,可分为死亡受体等介导的外源性细胞凋亡,缺氧、DNA损伤等介导的内源性细胞凋亡。内源性细胞以线粒体外膜通透性(mitochondrialoute membrane permeabilisation, MOMP)和线粒体损伤为主要调控途径,启动caspase3蛋白家族发挥凋亡效应。心脏缺血再灌注损伤时[7],由于炎症因子的激活、钙超载等多种因素引起心肌细胞的死亡。细胞凋亡作为程序性细胞死亡形式之一,在缺血再灌注损伤的各个阶段均发挥一定的作用[8-9],其中内源性凋亡占据更为重要的地位[10]。本研究结果显示,在缺氧复氧处理大鼠H9c2心肌细胞后,线粒体释放的活性氧显著增加,内源性凋亡效应分子cleaved-caspase3、促凋亡蛋白Bax的表达显著上调,抗凋亡蛋白Bcl-2表达下调,证实细胞凋亡在大鼠H9c2心肌细胞缺氧复氧模型中具有重要作用。
LncRNA是细胞体内广泛存在的一种非编码RNA,可在转录前水平、转录后水平及转录水平[11]调控其靶基因、靶蛋白的表达,从而发挥生物学作用。研究表明,LncRNA在肿瘤[12]、神经退行性变[13]、代谢性疾病[14]、心血管疾病[15]中均发挥重要作用,但LncRNA在心脏缺血再灌注损伤中的具体作用及其调控机制尚不明确。本课题组前期通过生物信息学方法检测结果显示LOC100360491/PAK3/CNNM2信号轴可能参与缺氧复氧后大鼠H9c2心肌细胞凋亡的调控。为此本课题组通过慢病毒转染大鼠H9c2心肌细胞构建过表达/抑制LOC100360491的心肌细胞系,RT-PCR检测各组LOC100360491含量的变化,结果显示采用300 MOI的过表达/抑制LncRNA的慢病毒转染大鼠H9c2心肌细胞48 h可显著上调/下调LOC100360491的表达水平。此外,与空载体组相比,过表达LOC100360491组的表达明显高于抑制LOC100360491组,提示相同MOI值的慢病毒转染H9c2心肌细胞48 h,过表达LOC100360491组转染效率显著高于抑制LOC100360491组。
为探索LOC100360491在H9c2心肌细胞凋亡中的作用,本研究采用缺氧24 h复氧6 h模拟心肌细胞缺血再灌注微环境。在细胞凋亡早期,膜内侧的磷脂酰丝氨酸外翻,可与Ca2+依赖的磷脂结合蛋白(Annexin V)结合;凋亡中期,线粒体膜电位发生改变,细胞色素C大量释放进入细胞质中,引发活性氧的爆发。研究表明,线粒体可通过释放的活性氧促进procaspase3切割成为具有活性的cleaved-caspase3,调控细胞凋亡的发生、发展[10]。本研究结果显示:过表达LOC100360491显著降低缺氧复氧诱导的H9c2心肌细胞早期凋亡的变化及凋亡中期活性氧的释放,提示LOC100360491可能通过线粒体活性氧途径参与大鼠H9c2心肌细胞凋亡的调控。在线粒体活性氧参与的细胞凋亡途径中,Bcl-2家族发挥重要作用[16]。Bcl-2家族据其结构不同,在细胞凋亡中发挥不同的作用,其中Bcl-2、Bcl-XL、Bcl-W等发挥抗凋亡作用;Bax、Bak、Bok及Bik、Bid等发挥促凋亡作用。抗凋亡蛋白Bcl-2可通过与家族内部成员之间的相互作用,平衡促凋亡蛋白与抗凋亡蛋白,最终影响细胞的存活与死亡[17]。线粒体释放的活性氧亦可通过抑制Bcl-2,促进Bax的表达,从而调控细胞凋亡的发生、发展[18]。本研究结果显示,过表达LOC100360491可抑制线粒体活性氧的释放,下调凋亡效应蛋白cleaved-caspase3及促凋亡蛋白Bax的表达,同时上调抗凋亡蛋白Bcl-2的表达。提示LOC100360491调控缺氧复氧后H9c2心肌细胞凋亡的机制可能是通过抑制线粒体活性氧的释放,上调Bax同时下调Bcl-2,抑制procaspase3切割为其活性形式cleaved-caspase3,最终减少细胞凋亡的发生。此外,考虑到Bcl-2/Beclin1复合物在凋亡和自噬的调控中起到开关的作用[19],LOC100360491是否在自噬方面发挥作用,亦值得进一步研究。
P21激活激酶(PAKs)是小G蛋白家族成员,在细胞骨架重构、细胞增殖等生理过程中发挥作用。近来研究表明,PAKs在心血管的正常发育、心脏不良重塑中发挥重要作用[20]。在细胞凋亡方面,PAK可通过激活NF-κB信号通路调控凋亡的发生、发展[21-22]。MAO等[23]研究发现,过表达PAK1后,可激活Akt信号通路,从而抑制心肌细胞凋亡。我们前期的芯片结果亦显示PAK3可能参与细胞凋亡的调控(未发表)。本研究结果显示,在缺氧复氧的大鼠H9c2心肌细胞中过表达LOC100360491,其PAK3的表达亦显著上调;同时抑制LOC100360491后,PAK3表达下调。提示在缺氧复氧的大鼠H9c2心肌细胞中,LOC100360491可能参与PAK3的调控,而PAK家族位于细胞质中,本身是活性氧的经典下游调控分子[24]。表明LOC100360491可能通过抑制线粒体活性氧的释放,上调PAK3的表达,从而起到抑制心肌细胞凋亡的保护作用。
综上,本研究通过体外实验证实,在大鼠H9c2心肌细胞中过表达LOC100360491可显著降低缺氧复氧诱导的大鼠H9c2心肌细胞早期凋亡及凋亡中期线粒体活性氧的释放。LOC100360491/PAK3/Bcl-2/caspase3为其可能的调节信号轴。本研究亦有局限之处,首先,LncRNA可通过诱饵作用、支架分子、引导作用及信号分子参与靶基因及蛋白的调控。我们发现LOC100360491可能调控PAK3的表达,但二者间是否具有直接或间接的结合位点,具体通过何种方式进行调控尚不明确,可进一步行染色质免疫共沉淀技术对其探索研究。其次,本实验均在体外细胞模型中进行,而LOC100360491在体内心肌缺血再灌注损伤模型中是否具有抗凋亡的作用尚不清楚,有待进一步验证。
| [1] |
SÁNCHEZHERNÁNDEZ C D, TORRESALARCN L A, GONZÁLEZCORTÉS A, et al. Ischemia/reperfusion injury: pathophysiology, current clinical management, and potential preventive approaches[J]. Mediat Inflamm, 2020, 2020: 1-13. DOI:10.1155/2020/8405370 |
| [2] |
GUO Y, LUO F, LIU Q, et al. Regulatory non-coding RNAs in acute myocardial infarction[J]. J Cell Mol Med, 2017, 21(5): 1013-1023. DOI:10.1111/jcmm.13032 |
| [3] |
ZHANG H N, XU Q Q, THAKUR A, et al. Endothelial dysfunction in diabetes and hypertension: Role of microRNAs and long non-coding RNAs[J]. Life Sci, 2018, 213: 258-268. DOI:10.1016/j.lfs.2018.10.028 |
| [4] |
PANT T, DHANASEKARAN A, FANG J, et al. Current status and strategies of long noncoding RNA research for diabetic cardiomyopathy[J]. BMC Cardiovasc Disord, 2018, 18(1): 1-10. DOI:10.1186/s12872-018-0939-5 |
| [5] |
MCKINSEY T A, VONDRISKA T M, WANG Y B. Epigenomic regulation of heart failure: integrating histone marks, long noncoding RNAs, and chromatin architecture[J]. F1000 Research, 2018, 7: 1713. DOI:10.12688/f1000research.15797.1 |
| [6] |
SAHA A, NANAVATYV P, LI B B. Telomere and sub-telomere R-loops and antigenic variation in trypanosomes[J]. J Mol Biol, 2019.[Epub ahead of print]. DOI: 10.1016/j.jmb.2019.10.025.
|
| [7] |
ZHU H, SUN A J. Programmed necrosis in heart disease: Molecular mechanisms and clinical implications[J]. J Mol Cell Cardiol, 2018, 116: 125-134. DOI:10.1016/j.yjmcc.2018.01.018 |
| [8] |
XU W P, ZHANG L, ZHANG Y, et al. TRAF1 exacerbates myocardial ischemia reperfusion injury via ASK1-JNK/p38 signaling[J]. J Am Heart Assoc, 2019, 8(21): e012575. DOI:10.1161/JAHA.119.012575 |
| [9] |
FAN Q, TAO R, ZHANG H, et al. Dectin-1 contributes to myocardial ischemia/reperfusion injury by regulating macrophage polarization and neutrophil infiltration[J]. Circulation, 2019, 139(5): 663-678. DOI:10.1161/CIRCULATIONAHA.118.036044 |
| [10] |
CHEN L D, ZHU W T, CHENG Y Y, et al. T-cell death-associated gene 8 accelerates atherosclerosis by promoting vascular smooth muscle cell proliferation and migration[J]. Atherosclerosis, 2020, 297: 64-73. DOI:10.1016/j.atherosclerosis.2020.01.017 |
| [11] |
FERRÈ F, COLANTONI A, HELMER-CITTERICH M. Revealing protein-lncRNA interaction[J]. Brief Bioinform, 2016, 17(1): 106-116. DOI:10.1093/bib/bbv031 |
| [12] |
JIANG M C, NI J J, CUI W, et al. Emerging roles of lncRNA in cancer and therapeutic opportunities[J]. Am J Cancer Res, 2019, 9(7): 1354-1366. |
| [13] |
PEREIRA FERNANDES D, BITAR M, JACOBS F, et al. Long non-coding RNAs in neuronal aging[J]. NcRNA, 2018, 4(2): 12. DOI:10.3390/ncrna4020012 |
| [14] |
KONG Y H, HSIEH C H, ALONSO L C. ANRIL: a lncRNA at the CDKN2A/B locus with roles in cancer and metabolic disease[J]. Front Endocrinol, 2018, 9: 405. DOI:10.3389/fendo.2018.00405 |
| [15] |
HUANG Y. The novel regulatory role of lnc RNA-miRNA-mRNA axis in cardiovascular diseases[J]. J Cell Mol Med, 2018, 22(12): 5768-5775. DOI:10.1111/jcmm.13866 |
| [16] |
MORTEZAEE K, SALEHI E, MIRTAVOOS-MAHYARI H, et al. Mechanisms of apoptosis modulation by curcumin: Implications for cancer therapy[J]. J Cell Physiol, 2019, 234(8): 12537-12550. DOI:10.1002/jcp.28122 |
| [17] |
CZABOTAR P E, LESSENE G, STRASSER A, et al. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy[J]. Nat Rev Mol Cell Biol, 2014, 15(1): 49-63. DOI:10.1038/nrm3722 |
| [18] |
POHL S Ö G, AGOSTINO M, DHARMARAJAN A, et al. Cross talk between cellular redox state and the antiapoptotic protein bcl-2[J]. Antioxid Redox Signal, 2018, 29(13): 1215-1236. DOI:10.1089/ars.2017.7414 |
| [19] |
FAIRLIE W D, TRAN S, LEE E F. Crosstalk between apoptosis and autophagy signaling pathways[M]//International review of cell and molecular biology. Amsterdam: Elsevier, 2020: 115-158. DOI: 10.1016/bs.ircmb.2020.01.003.
|
| [20] |
KUMAR R, SANAWAR R, LI X D, et al. Structure, biochemistry, and biology of PAK kinases[J]. Gene, 2017, 605: 20-31. DOI:10.1016/j.gene.2016.12.014 |
| [21] |
FAN S J, GAO M, MENG Q H, et al. Role of NF-kappaB signaling in hepatocyte growth factor/scatter factor-mediated cell protection[J]. Oncogene, 2005, 24(10): 1749-1766. DOI:10.1038/sj.onc.1208327 |
| [22] |
HUANG J, HUANG A, POPLAWSKI A, et al. PAK2 activated by Cdc42 and caspase 3 mediates different cellular responses to oxidative stress-induced apoptosis[J]. BBA Mol Cell Res, 2020, 1867(4): 118645. DOI:10.1016/j.bbamcr.2020.118645 |
| [23] |
MAO K, KOBAYASHI S, JAFFER Z M, et al. Regulation of Akt/PKB activity by P21-activated kinase in cardiomyocytes[J]. J Mol Cell Cardiol, 2008, 44(2): 429-434. DOI:10.1016/j.yjmcc.2007.10.016 |
| [24] |
WU W S. The signaling mechanism of ROS in tumor progression[J]. Cancer Metastasis Rev, 2006, 25(4): 695-705. DOI:10.1007/s10555-006-9037-8 |



