2. 200433 上海,复旦大学药学院
2. College of Pharmacy, Fudan University, Shanghai, 200433, China
缺血性中风是导致人类死亡和瘫痪的重要原因之一[1]。临床上大多采用溶栓法治疗缺血性中风,而溶栓法有严格的时间窗限制,并且溶栓后的血液再灌注过程也有可能加重损伤。缺血性中风溶栓后再灌注,体内发生严重炎症反应,若不能有效控制炎症反应程度,则有可能因为过于严重的炎症反应,造成进一步的损伤。因此,减少炎性因子表达、减轻炎症反应,成为治疗缺血性中风的关键思路之一。
β-石竹烯(β-caryophyllene, BCP)是一种提取自香料的天然化合物,具有很强的抗炎活性[2]。研究报道在缺血性中风模型中,BCP能抑制炎性因子的释放,减轻炎症反应,发挥神经保护作用,并且安全性较高[3]。因此BCP具有巨大的研究价值和药用潜力。微小RNA(microRNA, miR)是一种重要的生物信号分子[4-7]。NF-κB作为一种关键的炎症信号分子,在缺血性中风炎症发生过程中发挥重要作用[8]。通过基因芯片筛查,发现miR-183在小鼠缺血性中风前后表达变化显著。根据生物信息学分析预测,NF-κB是miR-183潜在的作用靶点[9]。在此基础上,我们试图探讨BCP在小鼠缺血性中风模型中发挥保护作用,是否与其影响miR-183和NF-κB的表达,并进一步作用于炎症通路有关,为促进BCP脑保护机制研究奠定基础。
1 材料与方法 1.1 实验材料β-石竹烯(BCP)、2, 3, 5-三苯基四氮唑(TTC)、胞嘧啶阿拉伯糖苷(Ara-C)、L-谷氨酰胺和聚L-赖氨酸(0.1%)购自Sigma-Aldrich(St. Louis, MO, USA)。所有细胞培养基和胎牛血清(FBS)均购自GIBCO(Life Technologies, Grand Island, NY, USA)。IL-1β、IL-6、NF-κB的ELISA试剂盒购自Life Science Inc.(Harrington Oakland, CA, USA)。
1.2 实验动物从重庆医科大学实验动物中心购得24 h内新生的C57BL/6小鼠和特定无病原体(SPF)等级的成年雄性小鼠C57BL/6(20~25 g)。所有动物程序均经重庆医科大学实验伦理委员会批准(2015027),并按照国家实验室动物护理和使用卫生指南执行。所有手术都在麻醉下进行,以尽量减少动物的痛苦。
1.3 原代细胞培养皮层原代神经元由新生小鼠(24 h内)提取,在D-Hank’ s平衡盐溶液(HBSS)中切碎并解剖小鼠皮层。然后用胰酶消化后离心,最后铺板接种。平板提前用多聚赖氨酸包被一夜。在平板中培养神经元时,先用含10%FBS的普通培养基接种4 h,之后替换成添加2% B27和1%谷氨酰胺的神经基A的维持培养基,每3天半换液。微管相关蛋白-2(microtubule associated protoin-2, MAP2)是神经元的特异性标记物,通过免疫荧光鉴定原代神经元的纯度。原代神经元纯度在95%以上为合格,神经元培养7 d后继续进行下一步实验。
1.4 建立缺血性中风动物模型雄性小鼠通过右脑中动脉闭塞(middle cerebral artery occlusion, MCAO)引起短暂的局灶性脑缺血。用异氟醚(3%诱导,1.0%~1.5%维持)与氧气和氮气混合使用面罩麻醉小鼠。在手术显微镜下仔细分离右颈总动脉(CCA)、颈内动脉(ICA)和颈外动脉(ECA)。栓线(广州佳灵生物技术有限公司)从ECA插入ICA,最终进入大脑中动脉,直到感觉到有阻力(8~12 mm)。在缺血1 h后,取出栓线开始再灌注。假手术组小鼠接受了相同的手术,但没有插入栓线。在手术过程中,使用恒温控制红外灯让直肠温度保持在(37±5)℃。在再灌注24 h后,对神经功能进行评分,并选择从1~4评分的动物进行进一步的实验。实际实验共计120只小鼠,30只进行假手术实验,考虑到死亡率和模型失败率,共90只参与模型的构建,死亡3只,死亡率为3%。另有显示脑出血或没有缺血的小鼠共计27只被排除在研究之外。因此共计90只小鼠纳入研究,根据随机数字法分为3组(n=30):假手术组、模型组、BCP(72 mg/kg)预处理组。
1.5 建立缺血性中风神经元模型用氧糖剥夺和复氧(oxygen-glucose, OGD/R)法建立缺血型中风的神经元模型。在神经元培养第7天,用无葡萄糖培养基洗涤神经元并孵育,然后转移到三汽培养箱中,在37 ℃,94%N2、5%CO2和1%O2培养DFB1 h,然后将加入之前的维持培养基,在常规培养箱中培养24 h。正常组神经元一并拿出放回,但不做任何处理。
1.6 实验方法神经元的提取共分3批进行,每批取30只乳鼠,提取9组细胞,每批细胞全部混匀后再分瓶培养分为3组:正常组、糖氧剥夺损伤组、BCP(10 μmol/L)预处理组。体内用含1%DMSO生理盐水制备BCP预处理液,体外用无菌PBS配置BCP预处理液。动物BCP给药浓度为72 mg/kg,神经元给药浓度为10 μmol/L,本课题组前期证实72 mg/kg和10 μmol/L为最佳给BCP浓度[1, 8]。给予小鼠连续5 d BCP(72 mg/kg),每天记录一次体质量变化。给药第6天建立缺血模型,缺血1 h,再灌注24 h后进行下一步实验。第6天换液时,对原代神经细胞进行BCP(10 μmol/L)预处理。给药后24 h,OGD 1 h,再正常培养24 h后,继续下一步实验。
1.7 脑缺血损伤程度评价在缺血后24 h,对小鼠进行神经功能评分。0分:无神经功能缺损症状,两前肢均显示正常力量,可伸直。1分:未能完全伸出左前爪。2分:向左转圈,但在休息时保持正常姿势。3分:走路时靠左边。4分:无自发行走,意识水平低。
用TTC染色法测量脑梗死的体积。处死小鼠后,迅速取出大脑,冷冻,切成5个冠状切片,厚度为2 mm。切片在2%TTC染液中37 ℃孵育15 min,在4%多聚甲醛中固定过夜。用Image Pro软件定量测定梗死体积,并以对侧半球的百分比表示。
1.8 HE染色和Nissl染色小鼠大脑注入4%的中性缓冲甲醛,固定24 h。脱水脑组织后嵌入石蜡。石蜡切片用HE与甲苯蓝分别染色。在显微镜下观察不同组同一区域形态学变化和尼氏细胞数差异。
1.9 蛋白印迹法检测小鼠取脑后于冰上分离出皮层部位。用裂解缓冲液(Beyotime生物技术,中国)从皮层组织中提取总蛋白,并用蛋白测定试剂盒(P0012S, Beyotime,中国)测定蛋白质浓度。用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(P0012A, Beyotime, 中国)分离蛋白质并转移到聚偏氟乙烯膜上。5%牛血清白蛋白在室温封闭2 h,并在4 ℃下一抗孵育过夜:抗NF-κB的兔多克隆抗体(10745-1-AP,武汉Proteintech, 1 :1 000)和β-actin(10829-1-AP, Prote Intech,武汉,1 :2 000)。随后膜被洗涤3次,并与辣根过氧化物酶,次级山羊抗兔或抗小鼠抗体,稀释1 :3 000,在室温下孵育1 h。通过增强的化学发光液显示免疫反应活性,用凝胶成像仪(Bio-Rad, Hercules, CA)显影,并使用ImageLab(Bio-Rad)软件分析条带。
1.10 定量实时聚合酶链反应(qRT-PCR)用Trizol试剂盒(Sangon Biotech, 上海)提取脑皮层总RNA。用加尾法试剂盒(Sangon Biotech, 上海)反转录miR-183。采用SYBR预混料(Bimake),在10 μL体积内进行实时定量聚合酶链反应。采用以下循环条件:在95 ℃下循环30 s,然后在95 ℃下循环50 s,60 ℃下循环30 s。miR-183上游:5′-CGCTATGGCACTGGTAGAATTCACT-3′,下游:加尾法(B542451 Sangon Biotech,上海)。
1.11 双荧光素酶报告构建野生型NF-κB WT和突变型NF-κB MUT的NF-κB 3’ UTR双荧光报告质粒,每组实验设置5个重复。参照双荧光素酶报告基因检测试剂盒步骤检测,以萤火虫荧光强度与海肾荧光强度的比值表示各组细胞的荧光素酶活性。
1.12 ELISA检测用ELISA试剂盒(江苏酶标生物科技公司)检测组织匀浆中的NF-κB、IL-1β、IL-6水平。该试剂盒采用双抗体一步夹心法酶联免疫吸附实验(ELISA)。往预先包被捕获抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中呈正相关。用酶标仪在450 nm波长下测定光密度值,计算样品浓度。
1.13 统计学分析神经行为学评分数据采用M计数,其余数据均采用x±s计数。采用GraphPad统计软件,两组间数据比较采用t检验,多组间数据比较采用单因素方差分析。检验水准α=0.05。
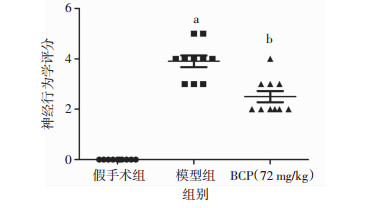
2 结果 2.1 BCP对小鼠缺血性中风损伤的保护作用为了确定BCP能否保护小鼠缺血性中风所引起的一系列损伤,在小鼠脑缺血1 h,再灌注24 h后进行神经行为学评分。结果发现,与假手术组(0.00±0.00)相比,模型组小鼠(3.90±0.74)出现严重的神经功能障碍,小鼠表现为不能持久站立,行走时左偏严重,甚至无法自主行走。而BCP(72 mg/kg)预处理(2.50±0.71)后,小鼠瘫痪情况明显减轻,组间比较差异有统计学意义(P < 0.05,图 1),表现为不行走时自主向左转圈但可保持站立。表明BCP预处理可以改善缺血性中风损伤后的神经行为学损伤。TTC染色测小鼠缺血性中风后脑梗死体积,白色为梗死区域,红色为正常区域。结果显示,造模后小鼠出现明显的脑梗死,与模型组(41.67±1.53)相比,BCP(72 mg/kg)预处理(30.67±20.08)减少了脑梗死体积,组间比较差异有统计学意义(P < 0.05, 图 2),表明BCP可以保护I/R损伤引起的脑缺血区域梗死。
|
| a: P < 0.05,与假手术组比较;b: P < 0.05,与模型组比较 图 1 各组小鼠神经行为学评分(n=10) |
|
| 图 2 TTC法测小鼠造模及给药预处理后脑梗体积 |
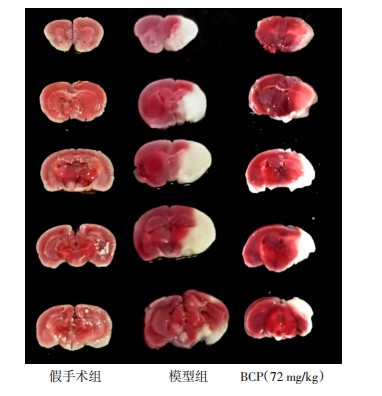
HE染色观察小鼠大脑切片,假手术组神经细胞(0.98±0.03)排列趋势紧密,神经元形态规则,无组织水肿现象,散见少量的凋亡小体和炎性细胞,血管无充血。模型组小鼠大脑神经细胞(0.44±0.02)排列趋势稀疏且紊乱,神经元形态不甚规则,细胞数量显著增加,可见大量炎性细胞和凋亡小体,毛细血管肿胀。而BCP(72 mg/kg)预处理组(0.60±0.02)小鼠大脑病理改变较模型组有明显好转,小鼠大脑神经细胞排布更加规则、分布趋势相对紧密,神经元细胞核固缩数目及炎性细胞数目显著增加,组间比较差异有统计学意义(P < 0.05, 图 3),毛细血管肿胀情况也有所改善,表明BCP对缺血性中风小鼠具有脑保护作用。

|
| 图 3 HE染色观察小鼠造模及给药预处理后组织细胞形态及损伤程度 |
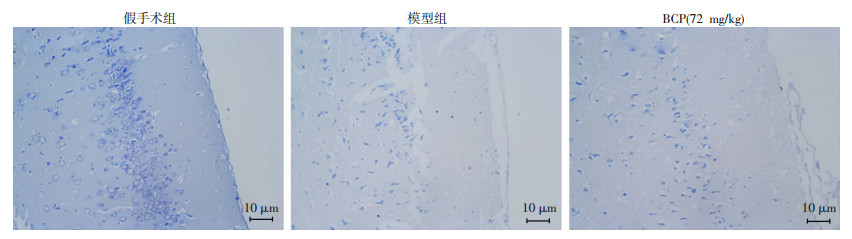
Nissl染色结果同样显示,假手术组神经细胞(79.00±3.61)和尼氏体数量丰富,细胞规整、排列整齐,未见坏死细胞;与假手术组相比,模型组神经细胞(25.33±2.52)出现变形,细胞排列混乱,尼氏体数量明显减少;与模型组相比,BCP(72 mg/kg)预处理组(40.00±1.00)细胞状态得到改善,尼氏体数量增多,组间比较差异有统计学意义(P < 0.05),细胞排列较为整齐,细胞形状趋于规整(图 4)。以上结果表明,BCP可以减少缺血性中风引起的小鼠脑损伤。
|
| 图 4 Nissl染色观察小鼠造模及给药预处理后尼氏小体形态及阳性细胞数 |
2.2 BCP对OGD模型原代神经元的保护作用
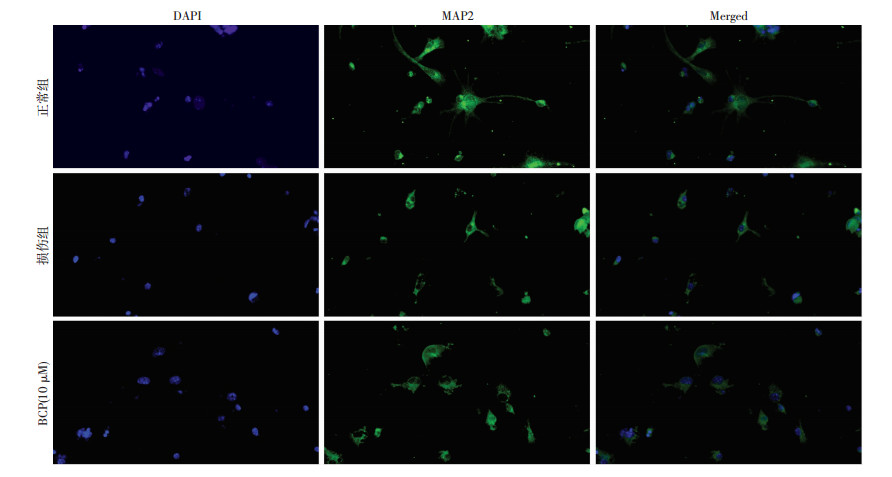
免疫荧光染色观察细胞形态,DAPI蓝色特异性染色细胞核,MAP-2绿色为神经元的标志物。与正常组相比,OGD损伤组细胞数更少,细胞形态不饱满,突触也更短。给药后细胞数增加,形态更饱满,突触也有所增长(图 5)。为了研究脑缺血后缺血神经元的死亡是否发生,测定原代神经元的LDH释放。在OGD损伤组(52.67±3.06)中,神经元的LDH释放量与正常组(17.33±2.08)相比显著增加,但BCP(10 μmol)预处理(40.00±2.00)逆转了这一现象,组间比较差异有统计学意义(P < 0.05)。说明BCP可以一定程度逆转OGD造成的神经元形态损伤,降低神经元的死亡率。
|
| 图 5 免疫荧光染色观察小鼠原代神经元形态与数量(×400) |
2.3 BCP通过上调miR-183和降低p-NF-κB表达来保护缺血性中风损伤
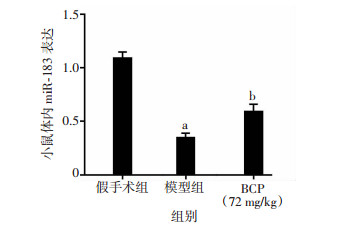
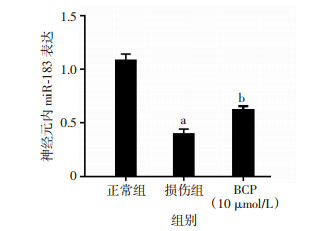
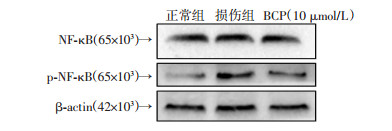
为了探讨BCP的抗炎作用是否与miR-183和NF-κB表达变化有关,通过qRT-PCR法检测小鼠脑内miR-183的表达,蛋白印迹法检测NF-κB的磷酸化激活程度。动物实验表明,与假手术组(miR-183:1.09±0.13;p-NF-κB:1.01±0.04)相比,模型组miR-183的表达(0.35±0.09)减少,p-NF-κB(3.03±0.13)增多。给药后miR-183的表达(0.59±0.15)有所回升,而p-NF-κB的表达量(1.98±0.21)也相应减少,组间比较差异有统计学意义(P < 0.05, 图 6、7)。在细胞实验,同样采用qRT-PCR检测神经元内miR-183的表达,采用Western blot法测定不同组神经元NF-κB和p-NF-κB的表达。与正常组[miR-183:(1.08±0.13);p-NF-κB:(1.02±0.04)]相比,OGD损伤组miR-183表达(0.40±0.10)明显下降,NF-κB通路被显著激活,p-NF-κB水平(3.02±0.11)显著升高。但与模型组相比,BCP则提高了miR-183的表达(0.62±0.08)并显著降低了p-NF-κB的含量(1.72±0.56),抑制NF-κB的激活,组间比较差异有统计学意义(P < 0.05, 图 8、9)。表明BCP可能通过上调miR-183抑制p-NF-κB的增加。
|
| a: P < 0.05,与假手术组比较;b: P < 0.05,与模型组比较 图 6 qRT-PCR法检测miR-183在不同组小鼠体内表达(n=5, x±s) |

|
| 图 7 Western blot检测p-NF-κB在不同组小鼠体内表达 |
|
| a:P < 0.05,与正常组比较;b: P < 0.05,与损伤组比较 图 8 qRT-PCR检测miR-183在神经元内表达(n=5,x±s) |
|
| 图 9 Western blot检测p-NF-κB在不同组原代神经元内表达 |
2.4 miR-183与NF-κB的靶向关系
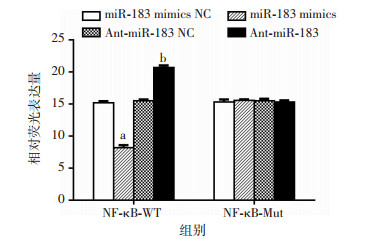
采用Target Scan生物学信息学预测发现,NF-κB 3′ UTR存在能够与miR-183互补的核苷酸序列,结果见图 10(下划线内容为碱基互补位点)。双荧光素酶报告基因实验结果显示,miR183过表达可显著降低野生型NF-κB 3′ UTR质粒转染的细胞荧光素酶活性,而抑制miR183表达则显著升高其荧光素酶活性,组间比较差异有统计学意义(P < 0.05, 图 11)。
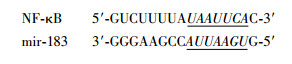
|
| NF-κB 5′-GUCUUUUA UAAUUCA C-3′ mir-183 3′-GGGAAGCC AUUAAGU G-5′ 图 10 miR-183与NF-κB的结合位点 |
|
| a: P < 0.05,与miR-183 mimics NC比较;b: P < 0.05,与Ant-miR-183 NC比较 图 11 各组细胞荧光素酶活性(n=5,x±s) |
2.5 BCP通过上调miR-183和降低p-NF-κB表达进一步抑制炎性因子表达
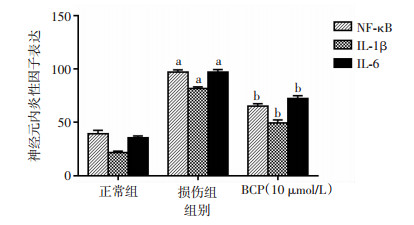
为了进一步探讨BCP在缺血性中风模型中的保护作用与炎症反应的关系,采用ELISA试剂盒检测炎性因子的表达。损伤后,在小鼠体内,关键炎性因子IL-1β、IL-6和NF-κB表达增加,提示炎症反应加重,BCP(72 mg/kg)预处理则使表达显著降低,组间比较差异有统计学意义(P < 0.05, 图 12)。检测神经元内炎性因子IL-1β、IL-6和NF-κB表达情况,与正常组相比,OGD后神经元内的炎性因子表达升高,炎症反应加重,而BCP(10 μmol/L)预处理组的炎性因子表达则明显低于OGD损伤组,组间比较差异有统计学意义(P < 0.05, 图 13)。提示BCP可以通过上调miR-183和降低p-NF-κB表达抑制炎性因子在该模型中的表达。

|
| a: P < 0.05,与假手术组比较;b: P < 0.05,与模型组比较 图 12 ELISA检测不同组小鼠体内炎性因子表达变化(n=5,x±s) |
|
| a: P < 0.05,与正常组比较;b: P < 0.05,与损伤组比较 图 13 ELISA检测不同组神经元内炎性因子表达变化(n=5,x±s) |
3 讨论
缺血性中风后,大脑遭受多处损伤[10-12]。本研究从行为和形态上探讨脑损伤程度。研究证实,缺血性中风发生后,小鼠神经行为受损,脑梗死面积增大,脑组织结构变薄变稀松,脑内细胞皱缩严重,而BCP可以在一定程度上减少这些损伤。在动物实验中,BCP减轻神经行为的障碍,减少脑部梗死体积以及保护脑组织的形态完整和保持正常脑细胞的数量。此外,我们对原代神经元的研究也证明了BCP对神经元的保护作用。从形态上看,BCP(10 μmol /L)预处理过的细胞在造模后的形态更加完整,突触更长;从数量上,BCP(10 μmol/L)预处理后,神经元数目明显较OGD损伤组增多,证明BCP减少了神经元的死亡。
生物信息学分析表明,NF-κB可能是miR-183的潜在靶点。预实验发现,中风后小鼠皮质区miR-183的表达有明显变化,而海马区则无明显变化。有学者已经进行了研究[13-14],发现miR-183可以通过NF-κB发挥抗炎作用,而本研究通过双荧光素酶标记报告检测,证实NF-κB与miR-183可以直接结合而产生相互作用。本课题组的前期研究以及大量文献报道都发现了BCP的抗炎作用[15]。因此,本研究提出了科学假设,BCP的抗炎作用可能与通过miR-183调控NF-κB的表达有关。
本研究发现缺血性中风前后miR-183和NF-κB的表达变化较大。这些结果提示miR-183和NF-κB可能是缺血性中风的关键指标之一。本研究首先探讨BCP给药是否会影响缺血性中风后miR-183的表达,发现BCP逆转了缺血性中风后miR-183的下降,证实了BCP、miR-183与缺血性中风模型的关联性。同时发现BCP可以降低模型中p-NF-κB的表达[16-17]。双荧光素酶实验发现miR-183和NF-κB可以通过直接结合而产生相互作用。研究结果证实了BCP的抗炎作用可能与通过miR-183调控NF-κB表达有关。
随后,我们探讨炎性因子与BCP的关系。已经证实,NF-κB是调控炎症的关键分子之一,缺血性中风后发生的一系列炎症级联反应都与它有关[18]。实验发现,损伤后炎性因子的表达明显增加,但BCP预处理后,炎性因子增加趋势有所下降。这提示BCP很有可能通过作用于miR-183进一步减少p-NF-κB表达,从而降低炎性因子的水平,减轻炎症反应。
综上,本研究发现在缺血性中风小鼠模型中BCP可以上调miR-183的表达,发现miR-183可与NF-κB直接结合产生相互作用。初步验证BCP的抗炎作用与miR-183/NF-κB信号通路有关。在本研究中,发现BCP与miR-183之间存在一定的关系,BCP可能通过促进miR-183表达抑制NF-κB的活化从而抑制下游炎性因子的释放,以达到抗炎和神经保护的目的。然而从BCP上调miR-183进而减少p-NF-κB表达,最终达到炎症抑制作用的整个过程中是否有其他因子参与调控,还有待进一步研究。
| [1] |
TIAN X C, AN R D, LUO Y J, et al. Tamibarotene improves hippocampus injury induced by focal cerebral ischemia-reperfusion via modulating PI3K/akt pathway in rats[J]. J Stroke Cerebrovasc Dis, 2019, 28(7): 1832-1840. DOI:10.1016/j.jstrokecerebrovasdis.2019.04.017 |
| [2] |
ZHANG Q, AN R D, TIAN X C, et al. B-caryophyllene pretreatment alleviates focal cerebral ischemia-reperfusion injury by activating PI3K/akt signaling pathway[J]. Neurochem Res, 2017, 42(5): 1459-1469. DOI:10.1007/s11064-017-2202-3 |
| [3] |
杨梅. β-石竹烯对缺血再灌注损伤诱导的坏死性凋亡和炎症的影响[D].重庆: 重庆医科大学, 2017. YANG M. Neuroprotective effect of β-caryophyllene on cerebral ischemia-reperfusion injury via regulation of necroptotic neuronal death and HMGB1/TLR4 pathway[D]. Chongqing: Chongqing Medical University, 2017. |
| [4] |
FU C Y, CHEN S J, CAI N H, et al. Potential neuroprotective effect of miR-451 against cerebral ischemia/reperfusion injury in stroke patients and a mouse model[J]. World Neurosurg, 2019, 130: e54-e61. DOI:10.1016/j.wneu.2019.05.194 |
| [5] |
SAWANT D V, YAO W G, WRIGHT Z, et al. Serum MicroRNA-21 as a biomarker for allergic inflammatory disease in children[J]. Microrna, 2015, 4(1): 36-40. DOI:10.2174/2211536604666150220232507 |
| [6] |
EOM S, KIM Y, KIM M, et al. Transglutaminase Ⅱ/microRNA-218/-181a loop regulates positive feedback relationship between allergic inflammation and tumor metastasis[J]. J Biol Chem, 2014, 289(43): 29483-29505. DOI:10.1074/jbc.M114.603480 |
| [7] |
LIANG Z H, XU J H, MA Z C, et al. MiR-187 suppresses non-small-cell lung cancer cell proliferation by targeting FGF9[J]. Bioengineered, 2020, 11(1): 70-80. DOI:10.1080/21655979.2019.1706287 |
| [8] |
杨梅, 安瑞娣, 李明航, 等. β-石竹烯通过作用于HMGB1/TLR4/NF-κB通路减轻小鼠局灶性脑缺血再灌注损伤[J]. 中国免疫学杂志, 2017, 33(7): 1009-1013. YANG M, AN R D, LI M H, et al. Β-caryophyllene mitigates cerebral ischemia reperfusion injury in mice by inhibiting HMGB1/TLR4/NF-κB pathway[J]. Chin J Immunol, 2017, 33(7): 1009-1013. DOI:10.3969/j.issn.1000-484X.2017.07.011 |
| [9] |
SHA F S, WU S X, ZHANG H, et al. MiR-183 potentially inhibits NF-κB1 expression by directly targeting its 3'-untranslated region[J]. Acta Biochim Et Biophys Sin, 2014, 46(11): 991-996. DOI:10.1093/abbs/gmu088 |
| [10] |
SUGO N, HURN P D, MORAHAN M B, et al. Social stress exacerbates focal cerebral ischemia in mice[J]. Stroke, 2002, 33(6): 1660-1664. DOI:10.1161/01.str.0000016967.76805.bf |
| [11] |
HAWKINS L J, STOREY K B. Advances and applications of environmental stress adaptation research[J]. Comp Biochem Physiol, Part A Mol Integr Physiol, 2020, 240: 110623. DOI:10.1016/j.cbpa.2019.110623 |
| [12] |
YAO X Q, LI X L, DU X Z, et al. Effect of scalp acupuncture stimulation on expression of pentraxin 3 in striatum in acute ische-mic cerebrovascular disease rats[J]. Acupunct Res, 2019, 44(11): 793-798. DOI:10.13702/j.1000-0607.180899 |
| [13] |
RIVERA-REYES A, YE S, E MARINO G, et al. YAP1 enhances NF-κB-dependent and independent effects on clock-mediated unfolded protein responses and autophagy in sarcoma[J]. Cell Death Dis, 2018, 9(11): 1108. DOI:10.1038/s41419-018-1142-4 |
| [14] |
蔡林奕, 孔祥丽, 谢强, 等. NF-κB通路在TNF-α调控软骨细胞MMPs/TIMPs比例中的作用研究[J]. 四川大学学报(医学版), 2016, 47(5): 642-648. CAI L Y, KONG X L, XIE Q, et al. The effects of NF-kappaB signalling on the TNF-α induced ratios of MMPs to TIMPs in chondrocytes[J]. J Sichuan Univ (Med Sci Ed), 2016, 47(5): 642-648. |
| [15] |
CHOI I Y, JU C, ANTHONY JALIN A M, et al. Activation of cannabinoid CB2 receptor-mediated AMPK/CREB pathway reduces cerebral ischemic injury[J]. Am J Pathol, 2013, 182(3): 928-939. DOI:10.1016/j.ajpath.2012.11.024 |
| [16] |
SUI X. Inhibition of the NF-κB signaling pathway on endothelial cell function and angiogenesis in mice with acute cerebral infarction[J]. J Biol Regul Homeost Agents, 2019, 33(2): 375-384. |
| [17] |
KALANTARY-CHARVADEH A, SANAJOU D, HEMMATI-DINARVAND M, et al. Micheliolide protects against doxorubicin-induced cardiotoxicity in mice by regulating PI3K/akt/NF-kB signaling pathway[J]. Cardiovasc Toxicol, 2019, 19(4): 297-305. DOI:10.1007/s12012-019-09511-2 |
| [18] |
TILIOUA S, MEZIOUG D, AMIR-TIDADINI Z C, et al. Potential role of NF-κB pathway in the immuno-inflammatory responses during human cystic echinococcosis[J]. Acta Trop, 2020, 203: 105306. DOI:10.1016/j.actatropica.2019.105306 |



