视网膜母细胞瘤(retinoblastoma, RB)是儿童最常见的眼部恶性肿瘤,发病率为1/20 000~1/15 000[1-2]。KNUDSON[3]提出的“二次突变假说”,认为RB家系已携带了1个胚系突变,体细胞内发生二次突变则会导致RB1基因失活,影响细胞分化,从而导致RB的发生。RB可分为遗传性RB以及非遗传性RB,其中遗传性RB约占40%,多有家族史,以双眼发病为主,大部分患者携带RB1基因胚系突变,非遗传性RB约占60%,多为散发病例,以单眼发病为主,大部分患者携带RB1基因体细胞突变,但有约17%的患者携带RB1基因胚系突变[4]。RB治疗方式的选择取决于肿瘤的分期、基因状态和疾病的偏侧性。从20世纪70年代开始,RB治疗经历了眼球摘除术、外粒子束放射疗法、全身系统化疗以及眼动脉介入疗法等历程[5]。目前一线治疗方式包括手术(眼球摘除术、玻璃体切除术)、化疗减容(全身化疗、眼动脉介入化疗、玻璃体内注射化疗)、局部治疗(激光治疗、冷冻治疗、温热疗法)以及放射治疗等。近年来逐步开展的基因治疗,致力于寻找针对RB的特异性靶点,与传统细胞毒药物相比,基于治疗相关基因的靶向抗肿瘤药物疗效确切、不良反应较少,是极富前景的治疗方式。
临床上主要通过对摘除眼球进行病理或基因检测来实现RB的最终确诊。一方面,随着治疗方式进步,临床上选择保眼球治疗患者明显增加,大量RB患儿无法获取肿瘤组织分子遗传学检测结果;另一方面,大部分散发病例缺乏阳性家族史,对基因检测缺乏重视,因此常导致散发性RB临床漏诊。为了进一步提高临床上散发性RB的诊断率,以及实现RB患者的早期诊断,本课题结合全外显子测序以及甲基化检测技术对收集的23例无家族史RB病例进行分子遗传学筛查,结合其临床资料及基因检测结果进行分析与总结,以了解患者遗传特性,研究散发性RB患者临床表型与基因型的特点。
1 资料与方法 1.1 临床资料收集2010-2019年于重庆医科大学附属第二医院及其他三级甲等医院确诊,2018-2019年于我院门诊复诊RB患儿共23例(双眼4例,单眼19例;男性12例,女性11例,发病年龄14 d至5岁)。采集所有患儿外周静脉血标本4 mL分别用于全外显子测序以及BSP甲基化测序,同时收集检测异常患儿一级亲属的外周静脉血标本2 mL用于Sanger测序或荧光定量PCR验证。收集2018-2019年于我科门诊体检,并符合以下标准的23例正常人作为对照组,进行全外显子测序以及BSP甲基化测序:①年龄18~60岁;②眼科查体双眼无明显结构及功能异常;③无遗传性疾病家族史。本研究通过了重庆医科大学附属第二医院伦理委员会批准[科伦第2019(270)号],所有实验组患儿监护人均签署知情同意书。
1.2 方法 1.2.1 临床资料收集记录23例视网膜母细胞瘤患者姓名、性别、年龄、发病年龄、就诊时间、临床表现、疾病分期、治疗方式、家族史、随访及预后情况等资料。眼内期分期根据国际眼内期视网膜母细胞瘤分期(international intraocular retinoblastoma classification, IIRC)[6]。
1.2.2 基因组DNA提取对先证者抽取静脉血4 mL,其父母和/或兄弟姐妹各抽取静脉血2 mL,采用乙二胺四乙酸抗凝,使用血液基因组DNA提取试剂盒(QIAamp DNA Blood Mini Kit,Qiagen),提取基因组DNA,后续分子遗传学检测由北京凯昂医学诊断技术有限公司完成。
1.2.3 分子遗传学检测 1.2.3.1 全外显子基因测序取患儿基因组DNA 2 μg,酶切法构建文库,利用IDT全外显子捕获探针进行全外显子区域捕获富集,对富集后的文库使用Hiseq X10进行高通量测序。使用BWA软件对全外显子测序结果与参考基因组序列进行比对,再通过GATK软件识别变异位点,并用Annovar软件对变异位点进行注释。对原始变异数据进行正常人群频率、变异功能筛选,筛选出与患儿临床症状相关性的潜在致病性变异位点,并对全外显子数据进行基于外显子捕获测序深度的拷贝数变异(copy number variation,CNV)分析,筛选致病性CNV。
1.2.3.2 Sanger验证对于先证者检测到的疑似致病或致病性突变位点,对患儿父母进行Sanger测序验证来源。针对变异位点设计PCR引物,PCR扩增后测序。反应条件为:95 ℃预变性5 min,95 ℃变性30 s,64 ℃退火30 s,72 ℃链延伸40 s,扩增30个循环;最后72 ℃延伸10 min,PCR的体系均为50 μL。
1.2.3.3 荧光定量PCR验证以2例正常对照及患儿4家系(RB1基因内5~17号外显子杂合缺失)作为检测样本,针对RB1基因9、12号外显子以及内参基因ABL1,分别设计荧光定量PCR引物,5′→3′序列为RB1(exon9):上游GGGGATTGACACCTCTAACTTACC,下游TCCATTAGATGTTACAAGTCCAAGA;RB1(exon12):上游AGGCAGTGTATTTGAAGAT,下游TCA-TAACAGTCCTAGAGGG;ABL1:上游CTAAAGGTGAA-AAGCTCCG,下游GACTGTTGACTGGCGTGAT。使用ABI QuantStudioTM 6 Flex荧光定量仪,进行荧光定量PCR验证。
2例正常对照及患儿5家系(chr13:39540961-53624906杂合缺失,包括RB1基因全长)作为检测样本,针对ATP7B、COG6和RB1基因内一个外显子以及内参基因ABL1,分别设计荧光定量PCR引物,5′→3′序列为ATP7B:上游TCACCAAGGGTCACAACGG,下游GGGTTTGGACAGGTCTGCTT;COG6:上游CAAGAAG-TTGTTGGGCATA,下游GATTGTATTTGAGCTGGTA;RB1:上游TCAGGAAGAAGAACGATTATCCA,下游GC- GCACGCCAATAAAGACA;ABL1:上游CTAAAGGTGAAAAGCTCCG,下游GACTGTTGACTGGCGTGAT。使用ABI QuantStudioTM 6 Flex荧光定量仪,进行荧光定量PCR验证。
1.2.3.4 BSP甲基化测序针对5个RB相关基因RB1、SYK、MSH6、CD44、p16INK4A,设计BSP引物,采用琼脂糖凝胶电泳验证BSP引物特异性。对样本进行Bisulfite处理(EZ DNA Methylation Gold Kit, Zymo Research),对Bisulfite处理的模版进行BSP扩增,连接illumina测序接头,构建BSP甲基化测序文库,使用Hiseq X10进行高通量测序。
1.2.3.5 GO和KEGG信号通路富集分析使用clusterProfiler软件对23例患者的差异基因集进行GO功能富集分析、KEGG通路富集分析。GO功能富集、KEGG通路富集均以矫正P < 0.05作为显著性富集的阈值。
1.2.3.6 共有分析采用共有突变分析方法筛选潜在的新致病基因。对23例RB患者以及23例正常对照的WES数据分别进行罕见变异位点基因计数,统计其显著性。罕见变异位点筛选标准:①正常人群频率≤0.1%;②非同义突变;③编码区及剪切位点;④突变reads数≥5。
1.2.3.7 数据分析使用SPSS 24.0统计软件进行数据分析,将基因突变与患者发病年龄进行Spearman相关性分析,基因突变与累及眼别行卡方检验,检验水准α=0.05。
2 结果 2.1 一般资料23例儿童视网膜母细胞瘤,均为散发病例,否认阳性家族史。其中男性12例,女性11例,男:女=1.1 :1;双眼发病4例(17.4%),单眼发病19例(82.6%);3岁以内发病比例为91.3%(21/23),发病年龄14 d至5岁,中位年龄17个月。首发症状以白瞳征为主(约90%),治疗方式上9例单眼患儿(1例D期,8例E期)行眼球摘除;8例单眼(1例B期,4例D期,3例E期)和1例双眼(右眼D期,左眼C期)患儿行眼动脉介入化疗,部分复发者联合视网膜激光及玻璃体腔注射马法兰;2例单眼(眼内期D~E期)、1例双眼(右眼B期,左眼D期)患儿行静脉化疗;1例双眼(眼内期D期)患儿行玻璃体切割手术联合静脉化疗;1例双眼(右眼E期,左眼B期)未治疗,最终双眼眼球萎缩。眼部B超提示9例介入治疗患儿眼底均有隆起样回声,1例伴有视网膜脱离及玻璃体积血;3例单纯静脉化疗患儿眼底亦有瘤体残留,1例静脉化疗联合玻璃体切割患儿无瘤体残留;9例眼球摘除患儿对侧眼结构及功能良好。随访时间1个月至9年,无眼外转移及死亡病例(表 1、2,图 1、2)。
| 临床表型 | 数值 | 百分比(%) |
| 平均发病年龄/月 | 17.0 | - |
| 单眼 | 21.0 | - |
| 双眼 | 3.0 | - |
| 性别/例 | ||
| 男 | 12 | 52.1 |
| 女 | 11 | 47.9 |
| 单眼IIRC分期/只 | ||
| B | 1 | 5.3 |
| D | 6 | 31.6 |
| E | 12 | 63.1 |
| 双眼IIRC分期/只 | ||
| B | 2 | 25 |
| C | 1 | 12.5 |
| D | 4 | 50 |
| E | 1 | 12.5 |
| 治疗方式/例 | ||
| 眼摘 | 9 | 39.1 |
| 单眼保眼 | 10 | 43.5 |
| 双眼保眼 | 3 | 13.0 |
| 未治疗 | 1 | 4.4 |
| 预后/只 | ||
| 无视力 | 15 | 55.6 |
| 有视力 | 12 | 44.4 |
| 编号 | 性别 | 首诊年龄 | 眼别 | 表型 | 治疗方式 | 家族史 |
| 1 | 女 | 10个月 | OU | 斜视 | 双眼动脉化疗 | - |
| 2 | 男 | 1个月 | OU | 白瞳征 | 静脉化疗 | - |
| 3 | 女 | 9个月 | OD | 白瞳征 | 眼球摘除 | - |
| 4 | 女 | 5个月 | OU | 白瞳征 | 双眼玻切联合静脉化疗 | - |
| 5 | 女 | 2个月 | OD | 白瞳征 | 眼球摘除 | - |
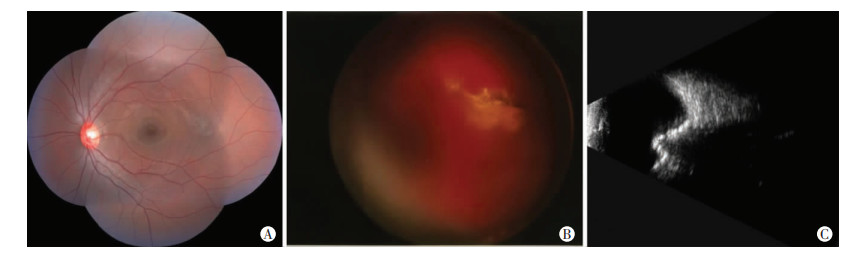
|
| A:患儿7,眼摘术后,对侧眼底照相未见明显异常;B:患儿23,右眼动脉介入化疗后眼底照相显示眼底出血;C:患儿9,右眼动脉介入化疗后B超提示眼底残留无活性钙化灶 图 1 患儿随访眼底照相及眼部B超结果 |
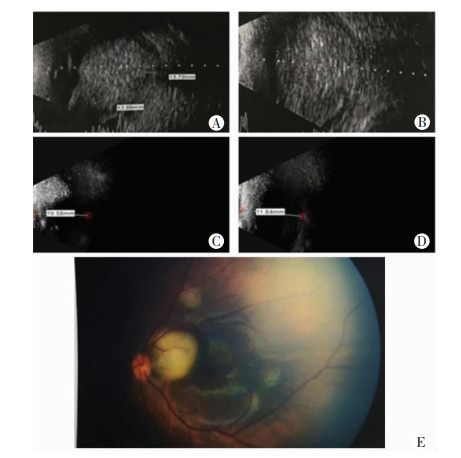
|
| A、B:生后14 d发病,1个月龄眼部B超提示右眼玻璃体腔内巨大占位性病变,左眼球壁局限性隆起;C、D:2岁随访,双眼球萎缩,B超眼内未探及瘤体,肿瘤自行退变;E:发病时左眼底照相可见视盘颞侧边缘约4PD黄白色圆形病灶,视盘颞上方约1PD黄白色圆形病灶(双眼RB,右眼E期、左眼B期,未治疗) 图 2 患儿15发病及随访眼科检查结果 |
2.2 分子遗传学筛查 2.2.1 WES+CNV测序结果
对23例散发RB病例外周血样本进行全外显子测序,5例样本(5/23,21.7%)检测到致病性变异(表 3)。其中3例患儿携带RB1基因点突变,包括c.1333C>T无义突变1例、c.380G>A错义突变1例以及c.1940delT移码突变1例,经Sanger家系验证,均为新发变异(图 3A~C)。其中2例患儿携带拷贝数变异,包括1例RB1基因内5~17号外显子杂合缺失以及1例RB1基因及邻近序列约14 Mb片段杂合缺失,经荧光定量PCR检测,均为新发变异(图 3D、E)。3处RB1基因点突变为已报道变异位点,2处RB1基因拷贝数异常系本研究报道的变异(表 3)。本次检测23例RB,双眼4例,其中3例存在基因突变,单眼19例,其中2例存在基因突变。分析显示基因突变与累及眼别具有显著差异(χ2=8.074, P < 0.01)。进一步将基因突变与发病年龄行Spearman相关性分析,结果显示两者具有相关性(r=0.592,P < 0.01),基因突变导致RB发病时间提前(表 4)。
| 编号 | 性别 | 首诊年龄 | 眼别 | 基因变异信息 | 文献报道 |
| 1 | 女 | 10个月 | OU | c.1333C>T p.R445X | 有 |
| 2 | 男 | 1个月 | OU | c.380G>A p.S127N | 有 |
| 3 | 女 | 9个月 | OD | c.1940delT p.L647fs | 有 |
| 4 | 女 | 5个月 | OU | exon5-17 del | 无 |
| 5 | 女 | 2个月 | OD | chr13:39540961-53624906*1 | 无 |
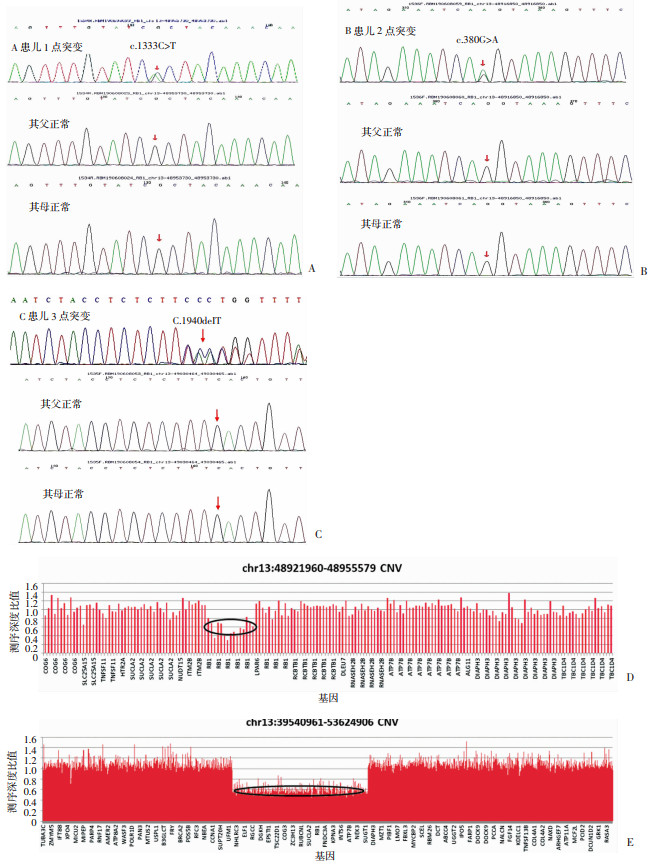
|
| A~C:3个RB1基因点突变家系测序结果(红色箭头所指为变异位点);D~E:2例患儿拷贝数异常测序结果(圆圈所示为杂合缺失基因片段) 图 3 5例RB1基因突变结果 |
| 基因状态 | 病例数 | 平均发病年龄/月 | 统计值 | 单/双眼 | 统计值 | |
| 双眼 | 单眼 | |||||
| 有基因变异 | 5 | 5.4 | P < 0.001 | 3 | 2 | P < 0.001 |
| 无基因变异 | 18 | 20.2 | r=0.592 | 1 | 17 | χ2=8.074 |
| 总计 | 23 | - | 4 | 19 | ||
2.2.2 BSP甲基化测序结果
23例RB外周血样本采用BSP甲基化测序,对RB相关5个基因RB1、SYK、MSH6、CD44、p16INK4A进行甲基化水平检测,对比对照组23例正常人数据,结果未见显著性甲基化异常。
2.2.3 生物信息分析对23例患者以及23例正常对照的WES数据进行KEGG(Kyoto Encyclopedia of Gene and Genomes)富集、GO(Gene Ontology)富集及共有分析,未发现与视网膜母细胞瘤相关的显著信号通路(矫正P < 0.05)。我们筛选出一条与视网膜母细胞瘤有相关趋势的信号通路(P < 0.05,矫正P>0.05),即磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路(图 4)。
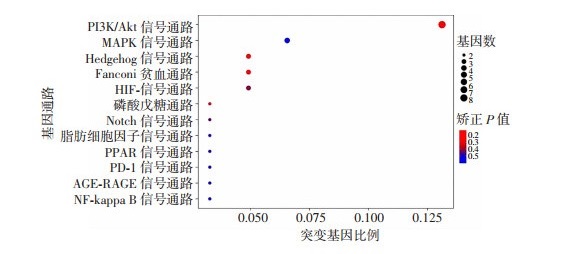
|
| 图 4 KEGG分析结果 |
3 讨论
视网膜母细胞瘤是起源于原始神经外胚层的中枢神经系统恶性肿瘤,高发于3岁以下儿童,临床症状多样,多以白瞳征及斜视为首发症状,如果未经及时有效的治疗,肿瘤可能通过视神经至大脑,或通过血液,扩散到全身各部位,最终导致死亡[7]。本研究中23例患儿以白瞳征为主要首发症状(约90%),个别出现类似于眼眶蜂窝组织炎的无菌性眼眶炎反应;从发病到确诊间隔时间3 d至6个月,延迟确诊中位时间为1个月;部分患儿初诊时误诊为结膜炎、斜视从而延误病情,临床确诊时多为眼内型RB国际分期(international intraocular retinoblastoma classification,IIRC)的D期和E期。晚期RB治疗上既往多行眼球摘除,近年来患者家属倾向于选择保眼球治疗,眼动脉介入化疗是热门选择,治疗过程中可出现眼睑肿胀、眼睑下垂、视网膜下出血、玻璃体出血、眼球萎缩、一过性骨髓抑制等并发症。介入治疗仅起到肿瘤减容作用,治疗后肿瘤不同程度缩小,最后残留无活性钙化灶或者瘢痕[8],因此眼部B超可显示眼底隆起样强回声。若肿瘤未侵犯黄斑,未合并严重并发症,预后多有残留视力。
目前研究表明RB1基因突变是RB发生的主要病因。RB1基因,位于13号染色体长臂,由27个外显子组成,基因全长183 kb。目前已有1 800多个RB1基因致病变异被报道,RB1基因变异类型多样,其中以无义突变、移码突变、剪接位点突变较为常见,错义突变及拷贝数变异相对较为少见。RB1基因作为抑癌基因,通过与E2F转录因子结合,抑制E2F转录因子活性,从而对细胞周期进行调控。RB1基因致病性突变则会使RB蛋白功能丧失,无法与E2F正常结合,导致其转录抑制功能受影响,细胞周期调控紊乱,正常细胞转化为肿瘤细胞,最终形成肿瘤。
RB按照遗传性分为遗传型和非遗传型,可以通过基因检测确诊。国内钱江等[9]应用多重PCR测序技术对35例RB患儿(双眼14例,单眼19例)进行RB1基因胚系变异分析,检测出RB1突变14例(40%),其中双眼患者检出率78.57%,单眼患者检出率15.8%。国外RUSHLOW等[10]通过多中心合作收集1 020例RB患者血液及肿瘤样本,利用多重定量PCR(QM-PCR)及高灵敏的等位基因特异性PCR(AS-PCR)技术检测,其中500例患者检测到RB1基因变异,总检出率为50%,双眼患者检出率为94.8%(不明确是否有家族史),但在没有家族史的单眼患者中,检出率为13.3%。本研究中采用全外显子测序技术,对23例无家族史视网膜母细胞瘤患者(双眼4例,单眼19例)采集外周静脉血进行分子遗传学检测,发现5例RB1基因变异,总检出率为21.7%,4例双眼患者有3例检出突变,19例单眼患者有2例检出突变。对比国内外研究数据,本实验中RB1突变阳性检出率偏低,分析有如下原因:①样本量小,双眼发病患者所占比例较低,且均无阳性家族史,散发患者多为非遗传性视网膜母细胞瘤;②仅收集到外周静脉血标本,未采集到肿瘤病理标本,非遗传性视网膜母细胞瘤RB1基因变异发生在视网膜细胞中,外周血中难以检测;③实验方法采用全外显子测序,受检测灵敏度所限,无法覆盖内含子突变、嵌合突变及肿瘤低频突变[11-12]等情况。
在23例散发性RB中,5例存在基因突变,其中双眼受累3例,单眼受累2例,卡方检验发现基因突变与累及眼别具有显著差异(χ2=8.074,P < 0.01),双眼患病占比更高。5例基因突变患儿的平均发病年龄为5.4个月,显著早于未突变患儿的平均发病年龄20.2个月,且基因突变与发病年龄之间具有相关性(r=0.592,P < 0.01)。确定2例新发现的RB1基因胚系拷贝数变异,包括1例RB1基因内5~17号外显子杂合缺失以及1例RB1基因及邻近序列约14 Mb片段杂合缺失,该2例父母均未检测到突变。患儿5,女,7岁,检测到包括RB1在内约14 Mb的大片段基因缺失,其生后2个月发病,确诊为右眼RB眼内E期后随即行眼球摘除术,病理检查确诊。随访7年无对侧眼受累及第二肿瘤发生,家属诉其发育迟缓,7岁6个月,身高110 cm,体质量23 kg,智力检测 < 50分,社交能力差,查体可见:右眼义眼,左眼球上翻,间歇性面部肌肉抽搐,表现为左眼轮匝肌收缩闭眼,同时张嘴,情绪激动或紧张时明显,伴有右侧嘴角震颤。发生于13号染色体长臂的大片段杂合缺失,该区域包含RB1、STOML3、HTR2A等93个基因,患儿神经系统发育异常考虑与多基因缺失相关。另证实3例已报道基因突变位点:包括RB1基因第14外显子c.1333C>T的杂合无义突变,第3外显子c.380G>A错义突变p.S127N,造成丝氨酸变为天冬氨酸,以及第19外显子c.1940delT移码突变。由此可见,散发病例也有可能存在胚系突变,进而增加子代发病风险。对于此类患者,应加强眼科随访频率,警惕第二肿瘤的发生。同时,早期的基因诊断还可用于指导患者家系的遗传咨询及产前诊断[13],减少视网膜母细胞瘤患儿的出生,具有重要社会意义。
患儿15,女,2岁,生后14 d发病,首发症状为右眼红肿,眼部B超提示双眼玻璃体腔占位,确诊为双眼RB(右眼E期,左眼B期),未行特殊治疗,后双眼球逐渐萎缩,外周血基因检测无异常,复查眼部B超右眼前后径10.58 mm,左眼前后径11.84 mm,球内未见实质性病变,考虑为肿瘤自发完全退变。RB自发退化发生率在1%~2%,是人类其他肿瘤的1 000倍;国内北京同仁眼科中心报道在579例摘除眼球中发现52例(9.0%)视网膜母细胞瘤的自行退变,8例完全退变(1.4%)。RB自行退变后多数眼球体积明显萎缩变小或为眼球痨改变,病理检查眼球内肿瘤细胞全部或绝大多数发生凝固性坏死, 仅见残存的肿瘤细胞残骸,部分已表现为典型的自发退行改变的肿瘤仍可在球后视神经内或脉络膜内发现活性肿瘤细胞, 具有肿瘤向远处扩散、转移的风险。因此,对少数具有高危组织病理学因素的自发退行病例,术后应给予化学治疗等全身辅助治疗并密切随访观察[14]。RB自发退变的机制目前尚不清楚,以往针对RB自发退行机制提出的假说——RB基因的表现度不同、肿瘤血管栓塞、局部因素的钙毒作用、免疫机制、环境因素等均有待进一步验证[15]。
随着对视网膜母细胞瘤深入认识,人们发现此病不仅与基因组学相关,还与表观基因组学有联系。早在1989年就有研究者发现RB1基因启动子区域CpG岛的异常甲基化[16]。PRICE等[17]对497例RB患者进行RB1基因甲基化水平检测,发现其中11.4%的患者存在RB1基因启动子区高度甲基化。RB1基因甲基化会导致RB1转录失活。除RB1甲基化异常会导致RB外,研究显示多种抑癌基因(如MGMT、hMLH1、RASSF1A等)启动子的高甲基化也与RB的发生、发展有关[18]。INDOVINA等[19]通过对23例散发RB患者和6个家系的研究发现55%的患者存在p16INK4A基因下调,进一步分析发现p16INK4A的启动子区存在高甲基化现象。后续研究陆续发现不同基因的高甲基化,常见的包括RB1、MGMT、MSH6、CD44、p16INK4A、PAX5、RASSFIA、GATA5等基因[20-21]。本研究对5个RB相关基因RB1、SYK、MSH6、CD44、p16INK4A进行BSP甲基化测序,与正常对照组相比,均未见显著差异的甲基化水平异常(P>0.05)。本研究中甲基化检出率较低,可能与RB相关基因甲基化水平异常导致RB患者占比较少、人群差异以及检测样本类型为外周血有关。
在生物体内,不同基因相互协调行使其生物学功能,通过通路显著性富集能分析患病个体高频突变基因参与的最主要生化代谢途径和信号转导途径。细胞内信号转导是一个复杂的网络,疾病的发生是不同通路相互作用所致,因此探讨与视网膜母细胞瘤相关信号通路以及不同通路间的关系,对明确RB发病机制及精准治疗具有积极意义。本研究对23例RB患者进行KEGG富集、GO富集及共有分析,拟从不同发病机制解释疾病的产生。虽未发现与视网膜母细胞瘤显著相关的信号通路,但筛选出一条与RB有相关趋势的信号通路,即PI3K/Akt信号通路。既往已有研究报道该信号通路在RB中可呈现高表达[22]。PI3K/Akt信号通路在多种细胞和生理过程中发挥重要作用,包括细胞周期、细胞生长、分化、存活、凋亡、代谢、血管生成和迁移[23-24]。该通路异常激活后可能诱发上皮-间质转化,增强细胞的移动性和侵袭性,在卵巢癌、乳腺癌等多种疾病均有报道[25]。有研究证明RB中PI3K/Akt通路与Hedgehog通路具有明显的相互作用,抑制PI3K/Akt是抑制Hedgehog的先决条件,揭示了其在疾病治疗中的潜在作用[22]。本实验通过生物信息分析预测了PI3K/Akt信号通路具有与RB相关趋势(矫正P值差异无统计学意义),可能是因为样本量小的原因,后续需扩大样本量明确该通路与疾病相关性以及进一步功能验证实验。
与发达国家相比,我国视网膜母细胞瘤患者存在确诊晚、病情重、生存率低等情况。故RB强调早发现、早治疗,以提高保眼球率及生存率。基因筛查能降低RB患儿的出生率、提高人口素质,并能减轻RB患者家庭沉重的心理负担和经济负担,节省大量的医疗资源[22]。RB具有一定遗传倾向性,确诊依靠分子遗传学检测,临床上无家族史患者往往容易忽视该项检查。随着基因检测技术的成熟,在缺乏肿瘤病理组织的情况下,外周血基因检测亦可明确RB1基因的胚系突变,联合应用全外显子测序以及甲基化检测技术能够更为全面的检测RB各种变异类型,有利于对遗传型RB患者的早期诊断及遗传咨询,推荐成为RB患者除病理诊断外的常规诊断方法。同时,本研究发现2例新型RB1基因胚系拷贝数变异,其中1例导致神经系统发育障碍及眼部肿瘤同时发生,进一步补充了RB1基因变异谱。RB1基因胚系突变易导致RB患儿双眼患病,且发病更早。本研究结果对散发性视网膜母细胞瘤患者临床早期诊断具有较大价值。
| [1] |
BISHOP J O, MADSON E C. Retinoblastoma. Review of the current status[J]. Surv Ophthalmol, 1975, 19(6): 342-366. |
| [2] |
LUO C, DENG Y P. Retinoblastoma: concerning its initiation and treatment[J]. Int J Ophthalmol, 2013, 6(3): 397-401. DOI:10.3980/j.issn.2222-3959.2013.03.26 |
| [3] |
KNUDSON A G. Mutation and cancer: statistical study of retinoblastoma[J]. Proc Natl Acad Sci USA, 1971, 68(4): 820-823. DOI:10.1073/pnas.68.4.820 |
| [4] |
GANGULY A, NICHOLS K E, GRANT G, et al. Molecular karyotype of sporadic unilateral retinoblastoma tumors[J]. Retina, 2009, 29(7): 1002-1012. DOI:10.1097/iae.0b013e3181a0be05 |
| [5] |
宋文凭, 邵荣光, 李亮. 视网膜母细胞瘤的治疗、基因组学和表观基因组学研究进展[J]. 中国生化药物杂志, 2016, 36(6): 1-5. SONG W P, SHAO R G, LI L. Therapeutics, genomics and epigenomics of retinoblastoma[J]. Chin J Biochem Pharm, 2016, 36(6): 1-5. DOI:10.3969/j.issn.1005-1678.2016.06.01 |
| [6] |
LINNMURPHREE A. Intraocular retinoblastoma: the case for a new group classification[J]. Ophthalmol Clin N Am, 2005, 18(1): 41-53. DOI:10.1016/j.ohc.2004.11.003 |
| [7] |
SOLIMAN S E, RACHER H, ZHANG C Y, et al. Genetics and molecular diagnostics in retinoblastoma: an update[J]. Asia Pac J Ophthalmol(Phila), 2017, 6(2): 197-207. DOI:10.22608/APO.201711 |
| [8] |
张靖, 姜华, 申刚, 等. 经眼动脉灌注化疗治疗视网膜母细胞瘤临床疗效多因素分析[J]. 介入放射学杂志, 2015, 24(12): 1062-1066. ZHANG J, JIANG H, SHEN G, et al. Percutaneous transcatheter chemotherapy via ophthalmic artery for retinoblastoma: a multivariate analysis of clinical curative effect[J]. J Interv Radiol, 2015, 24(12): 1062-1066. DOI:10.3969/j.issn.1008-794X.2015.12.009 |
| [9] |
何明燕, 安宇, 李刚, 等. 儿童视网膜母细胞瘤患者RB1基因胚系突变的特征分析[J]. 中华医学遗传学杂志, 2013, 30(5): 509-512. HE M Y, AN Y, LI G, et al. Characteristics of RB1 gene mutations in Chinese patients with retinoblastoma[J]. Chin J Med Genet, 2013, 30(5): 509-512. DOI:10.3760/cma.j.issn.1003-9406.2013.05.001 |
| [10] |
RUSHLOW D E, MOL B M, KENNETT J Y, et al. Characterisation of retinoblastomas without RB1 mutations: genomic, gene expression, and clinical studies[J]. Lancet Oncol, 2013, 14(4): 327-334. DOI:10.1016/S1470-2045(13)70045-7 |
| [11] |
CHEN Z, MORAN K, RICHARDS-YUTZ J, et al. Enhanced sensitivity for detection of low-level germline mosaic RB1 mutations in sporadic retinoblastoma cases using deep semiconductor sequencing[J]. Hum Mutat, 2014, 35(3): 384-391. DOI:10.1002/humu.22488 |
| [12] |
GROTTA S, D'ELIA G, SCAVELLI R, et al. Advantages of a next generation sequencing targeted approach for the molecular diagnosis of retinoblastoma[J]. BMC Cancer, 2015, 15(1): 1-9. DOI:10.1186/s12885-015-1854-0 |
| [13] |
YAHALOM C, MACAROV M, LAZERDERBEKO G, et al. Preimplantation genetic diagnosis as a strategy to prevent having a child born with an heritable eye disease[J]. Ophthalmic Genet, 2018, 39(4): 450-456. DOI:10.1080/13816810.2018.1474368 |
| [14] |
顼晓琳, 李彬, 王怡琛, 等. 视网膜母细胞瘤自发退行的临床组织病理学分析[J]. 中华眼科杂志, 2014, 50(10): 729-732. XU X L, LI B, WANG Y C, et al. Retinoblastoma spontaneous regression: clinical and histopathologic analysis[J]. Chin J Ophthalmol, 2014, 50(10): 729-732. DOI:10.3760/cma.j.issn.0412-4081.2014.10.004 |
| [15] |
孙为荣. 眼科病理学[M]. 北京: 人民卫生出版社, 1997: 397-400. SUN W R. Ophthalmology pathology[M]. Beijing: People's Health Press, 1997: 397-400. |
| [16] |
GREGER V, PASSARGE E, HÖPPING W, et al. Epi-genetic changes may contribute to the formation and spontaneous regression of retinoblastoma[J]. Hum Genet, 1989, 83(2): 155-158. DOI:10.1007/BF00286709 |
| [17] |
PRICE E A, KOLKIEWICZ K, PATEL R, et al. Detection and reporting of RB1 promoter hypermethylation in diagnostic screening[J]. Ophthalmic Genet, 2018, 39(4): 526-531. DOI:10.1080/13816810.2018.1479432 |
| [18] |
刘茹, 高玲, 卢光琇, 等. RAS相关区域家族1A和死亡相关蛋白激酶基因启动子在视网膜母细胞瘤中的甲基化状态[J]. 中华眼科杂志, 2009, 45(7): 631-635. LIU R, GAO L, LU G X, et al. Methylation status of RASSFIA and DAPK promoter in retinoblastoma[J]. Chin J Ophthalmol, 2009, 45(7): 631-635. DOI:10.3760/cma.j.issn.0412-4081.2009.07.011 |
| [19] |
INDOVINA P, ACQUAVIVA A, DE FALCO G, et al. Downregulation and aberrant promoter methylation of p16INK4A: a possible novel heritable susceptibility marker to retinoblastoma[J]. J Cell Physiol, 2009, 223(1): 143-150. DOI:10.1002/jcp.22019 |
| [20] |
ZHANG J H, BENAVENTE C A, MCEVOY J, et al. A novel retinoblastoma therapy from genomic and epigenetic analyses[J]. Nature, 2012, 481(7381): 329-334. DOI:10.1038/nature10733 |
| [21] |
LIVIDE G, EPISTOLATO M C, AMENDUNI M, et al. Epigenetic and copy number variation analysis in retinoblastoma by MS-MLPA[J]. Pathol Oncol Res, 2012, 18(3): 703-712. DOI:10.1007/s12253-012-9498-8 |
| [22] |
SONG Z D, DU Y Y, TAO Y. Blockade of sonic hedgehog signaling decreases viability and induces apoptosis in retinoblastoma cells: The key role of the PI3K/Akt pathway[J]. Oncol Lett, 2017, 14(4): 4099-4105. DOI:10.3892/ol.2017.6701 |
| [23] |
VANHAESEBROECK B, STEPHENS L, HAWKINS P. PI3K signalling: the path to discovery and understanding[J]. Nat Rev Mol Cell Biol, 2012, 13(3): 195-203. DOI:10.1038/nrm3290 |
| [24] |
XU W T, YANG Z, LU N H. A new role for the PI3K/Akt signaling pathway in the epithelial-mesenchymal transition[J]. Cell Adhesion Migr, 2015, 9(4): 317-324. DOI:10.1080/19336918.2015.1016686 |
| [25] |
YE B, JIANG L L, XU H T, et al. Expression and PI3K/AKT pathway in gastric cancer and its blockade suppresses tumor growth and metastasis[J]. Int J Immunopathol Pharmacol, 2012, 25(3): 627-636. DOI:10.1177/039463201202500309 |
| [26] |
陈长征, 郁想想. 重视开展视网膜母细胞瘤的基因诊断工作[J]. 中华实验眼科杂志, 2013, 31(7): 617-620. CHEN C Z, YU X X. The importance of carrying out the gene diagnosis for retinoblastoma[J]. Chin J Exp Ophthalmol, 2013, 31(7): 617-620. DOI:10.3760/cma.j.issn.2095-0160.2013.07.001 |



