2. 361004 福建 厦门,厦门大学附属中山医院
2. Zhongshan Hospital of Xiamen University, Xiamen, Fujian Province, 361004, China
自体动静脉内瘘(arteriovenous fistula,AVF)是血液透析患者的首选透析通路[1]。AVF失功多表现为吻合口静脉流出道的狭窄,病理学上主要表现为吻合口静脉端内膜增生(intimal hyperplasia, IH)[2]。如何有效地抑制血管内膜增生,提高AVF的通畅率是目前亟须解决的一个棘手问题。
光动力疗法(photodynamic therapy,PDT)是一种新兴的无创治疗方式,其主要原理是光敏剂(photosensitizer,PS)被病变区域内增生异常活跃的细胞选择性吸收、聚集,经过特定波长的光照射,产生大量单态氧及自由基,从而使病变区域的细胞发生凋亡和坏死[3], 且当光动力疗法处于合适剂量时,其主要死亡路径表现为凋亡。血卟啉单甲醚(hematoporphyrinmonomethyl ether,HMME)是第2代卟啉衍生物类光敏剂[4],HMME-PDT已被证明会导致线粒体内氧自由基的积累,提示HMME-PDT可能导致线粒体损伤,诱导细胞凋亡[5]。
我们既往的研究发现光动力治疗可以促进血管平滑肌细胞凋亡,抑制血管内膜增生[6],然而具体机制并不清楚,本研究进一步探索血卟啉单甲醚光动力疗法预防兔颈动静脉内瘘静脉内膜增生的机制,研究血卟啉单甲醚光动力疗法对兔颈动静脉内瘘血管内膜增生的影响,以及对血管平滑肌细胞增殖、凋亡的影响。
1 材料与方法 1.1 材料 1.1.1 实验动物由重庆医科大学实验动物中心提供的32只健康新西兰兔,体质量2.0~2.5 kg,3~4月龄,雌雄不限。按照重庆医科大学实验动物伦理委员会批准进行动物实验(2016-054)。所有实验动物给予同质饮食饲养,温度适宜。
1.1.2 试剂3%异戊巴比妥钠,HMME(H124003, 纯度>95%, 上海笛柏化学品有限公司)经兔耳缘静脉给药(5 mg/kg)。光动力治疗仪购自武汉亚格光电技术有限公司。增殖细胞核抗原PCNA抗体、ɑ-SMA抗体和Caspase3抗体购自美国Novus公司;Bax、Bcl-2和Lamin-B抗体购自中国沈阳万类生物公司;Caspase9购自中国北京博奥森生物公司。显微器械包购自上海医疗器械(集团)有限公司手术器械厂; Masson染色试剂盒购自武汉博士德生物工程有限公司; 免疫组化试剂盒、免疫组化二抗购自北京中杉金桥生物技术有限公司; BCA蛋白质浓度测定试剂盒、SDS-PAGE凝胶配制胶试剂盒、β-actin一抗、山羊抗小鼠二抗购自上海碧云天生物技术有限公司; Axio Imager A2倒置显微镜购置德国Carl Zeiss公司。
1.2 研究方法 1.2.1 动物AVF模型的建立具体见文献[6]报道的实验方法。麻醉后将动物固定于手术台,暴露兔右侧颈部,沿下颌角和锁骨中点连线处做3 cm切口,暴露并分离右颈静脉和颈总动脉,止血钳阻断血流,在右颈静脉和颈总动脉沿长轴进行切口,长度相当于颈静脉直径。之后用缝线行颈总动脉-颈静脉侧侧吻合,将颈静脉远心端结扎。当颈静脉表现出稳定的震颤、搏动和充血时认为AVF模型建立成功。之后关闭皮肤切口,术后3 d皮下注射青霉素(400 000单位/d)防止感染。
1.2.2 实验分组动物按随机数字表法[7]分为4组,每组8只。对照组:术后不做干预;单纯光敏剂组(HMME组):术中沿未结扎的颈外静脉远心端将稀释后的HMME溶液(5 mg/kg)缓慢注入,避光;单纯光照组(Light组):手术完成后、切口关闭前,以(633±10) nm波长的光动力治疗仪透过遮光板直接照射(光照强度:80 mW/cm2,光照时间:15 min,光照距离25 cm);光动力治疗组(PDT组):结扎颈外静脉远心端前注入稀释后的HMME溶液(5 mg/kg),而后以(633± 10)nm的光动力治疗仪照射,照射参数同单纯光照组。所有治疗干预只进行1次。
1.2.3 彩色多普勒超声监测吻合口解剖情况及血流频谱术后利用彩色多普勒超声检测吻合口解剖情况以及血流频谱,以4.8~11.0 MHz高频探头检测颈静脉与颈总动脉吻合口解剖结构,并以频谱多普勒彩超检测吻合口血流频谱,得出超声视角下的吻合口解剖图以及血流频谱图。
1.2.4 HE染色术后第30天,在3%异戊巴比妥钠麻醉下处死,经原切口切取距吻合口静脉端2 cm血管,经固定(4%多聚甲醛12~24 h)、脱水、包埋(石蜡)、切片(厚度约5 μm)。HE染色切片在Axio Imager A2显微镜下观察,从×200放大倍数下每个切片选5个不同的位置。用Image Profession Plus 6.0软件分析图片,测量静脉内中膜厚度(VNH),即为内膜管腔侧距中膜外弹力膜之间的长度,并取平均值[8]。
1.2.5 Masson染色石蜡切片经Mayer苏木精染色液滴染2 min,水洗;丽春红品红染液染色5 min,水洗;磷钼酸溶液处理5 min, 镜下观察其分化, 胶原纤维呈淡红色时倒掉磷钼酸; 苯胺蓝染液复染3 min, 倒掉染液; 1%冰醋酸冲洗切片, 至蓝色不再分化为止; 梯度乙醇快速脱水, 透明, 封片。Axio Imager A2显微镜下观察静脉管壁中红染的平滑肌细胞,蓝染的胶原纤维。用Image Profession Plus 6.0软件分析图片,从×200放大倍数下每个切片选5个不同的位置进行分析测量管腔面积,并取平均值。
1.2.6 免疫组织化学染色石蜡切片首先加热进行抗原修复,之后在37 ℃浸泡3%过氧化氢15 min,接着用山羊血清在37 ℃下孵育20 min。分别滴加一抗孵育,其中PCNA、Caspase3、ɑ-SMA浓度分别为1 :1 000、1 :400、1 :300,4 ℃过夜。之后用相应二抗孵育37 ℃ 20 min,DAB显色,中性树胶封片。PCNA的免疫组化染色用于评估静脉内中膜细胞增殖情况;Caspase3的免疫组化染色用于评估动静脉内瘘处细胞凋亡情况;α-SMA的免疫组化染色用于评估静脉管壁平滑肌细胞的排列形态和数量情况。由Axio Imager A2显微镜获取图像。用Image Profession Plus 6.0软件分析图片。棕色染色表示阳性表达,在×400放大倍数下,随机选取10个视野根据PCNA增殖指数=阳性细胞数/(阳性细胞数+阴性细胞数)×100%,计算PCNA阳性细胞百分率。利用图像分析软件测定每个图像的积分光密度(IOD)值,并计算平均值[9]。以对照组IOD值作为参照,计算相对平均积分光密度(relative average IOD)值。
1.2.7 Western blot检测新鲜静脉血管样本经磷酸盐缓冲液洗净后,迅速放入液氮,之后在冰上操作加入RIPA裂解液裂解后提取总蛋白,用BCA蛋白分析试剂盒测定蛋白浓度。以30 μg为上样量,进行聚丙烯酰胺凝胶电泳,0.45 μm PDVF转膜(恒压100 V,100 min),随后用含有5%(0.05 μg/mL)脱脂牛奶室温摇床封闭90 min,TBST洗膜后孵育一抗4 ℃过夜,其中PCNA、Caspase3、ɑ-SMA、Bcl-2、Bax、Lamin-B、β-actin的抗体稀释浓度分别是1 :2 000、1 :2 000、1 :3 000、1 :500、1 :750、1 :750、1 :1 500。次日用TBST漂洗膜3次后加对应的二抗(1 :7 500)室温摇床孵育2 h。采用ECL底物发光法获取结果。使用β-actin抗体与lamin-B抗体为内参对照。通过Fusion-Capt software (Vilber, France)软件定量蛋白质条带的灰度值。
1.3 统计学分析应用SPSS 22.0统计分析软件,数据以x±s表示。组间比较采用单因素方差分析,组内两两比较采用SNK-q检验,所有实验至少重复3次。
2 结果 2.1 AVF模型建立与验证AVF术后,吻合口见明显的“三头”充盈(颈总动脉近心端、颈总动脉远心端、颈静脉近心端)现象(图 1A),触诊可扪及明显的震颤。血管彩色多普勒超声显示颈静脉与颈总动脉间有一血管解剖通道(图 1B),加彩后见“花色”血流(图 1C);频谱多普勒彩超检查提示吻合口血流频谱呈现类动脉血流频谱(图 1D),符合动静脉内瘘的血流频谱。
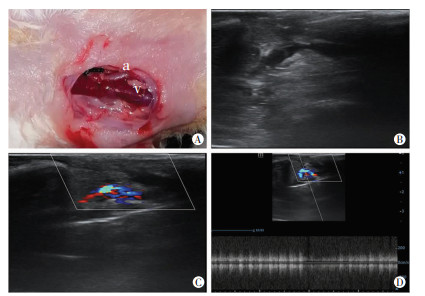
|
| A:兔改良端侧吻合颈动静脉内瘘 a:颈总动脉;v:颈静脉;B、C:彩色多普勒显示颈静脉与颈总动脉直接相连且呈现“花色”血流;D:脉冲多普勒频谱分析颈静脉中出现类动脉频谱 图 1 兔改良端侧吻合颈动静脉内瘘模型 |
2.2 HMME-PDT光动力疗法抑制兔颈动静脉内瘘血管内膜增生
结果见图 2,HE染色测得各组静脉内中膜厚度分别为:对照组(83.01±15.27) μm;单纯光敏剂组(78.19±12.22)μm;单纯光照组(61.75±12.22)μm;光动力治疗组(41.05±11.36)μm,统计分析表明4组静脉内中膜厚度差异具有统计学意义(P < 0.05)。组间比较结果显示对照组和单纯光敏剂组静脉内中膜厚度差异无统计学意义(P>0.05),其余各组组间两两比较差异均有统计学意义(P < 0.05),提示光动力疗法抑制静脉内中膜增生。Masson染色结果测得各组血管管腔面积分别为:对照组(11.14±0.61)mm2;单纯光敏剂组(11.37±0.98)mm2;单纯光照组(14.13±0.59)mm2;光动力治疗组(18.34±0.48)mm2,光动力治疗组管腔面积较其余3组明显增加。光动力治疗组内中膜细胞增殖受抑制,厚度显著低于其余3组,其Masson染色结果与正常静脉相似(结果未显示)。另外,光动力治疗组内中膜细胞受抑制,在Masson染色结果中也表现为PDT组血管的内皮细胞衬层红色减少,蓝染的胶原纤维增多,胶原纤维与VSMCs的比例增加。以上结果显示HMME-PDT光动力疗法能够明显增加兔颈AVF吻合口血管管腔面积,减轻其内膜增生。
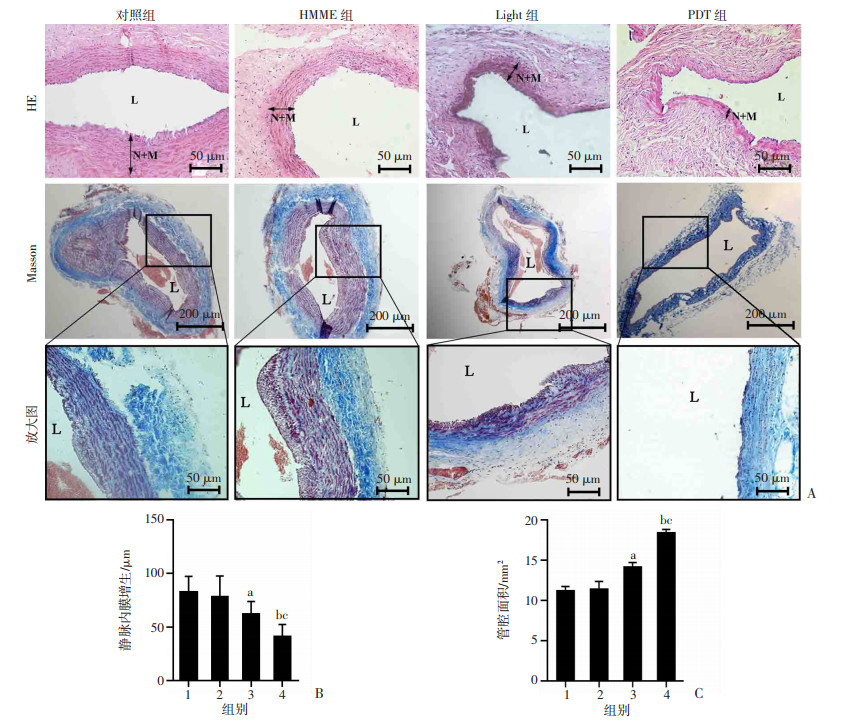
|
| A:HE染色与Massson染色检测各组静脉内中膜增生;红色为静脉管壁中的平滑肌细胞,蓝色为胶原纤维;N+M:静脉内中膜;L:血管腔;1:对照组;2:HMME组;3:Light组;4:PDT组;B:各组静脉内中膜厚度统计分析 a: P < 0.05, 与HMME组比较;b: P < 0.05,与Light组比较;c: P < 0.01,与对照组和HMME组比较;C:各组静脉管腔面积统计分析a: P < 0.05, 与对照组比较;b: P < 0.05,与Light组比较;c: P < 0.01,与对照组比较 图 2 光动力疗法抑制动静脉内瘘内膜增生,增加瘘口管腔面积 |
2.3 HMME-PDT抑制兔颈动静脉内瘘血管平滑肌细胞增殖
α-SMA免疫组化结果(图 3)显示对照组和单纯光敏剂组α-SMA表达较单纯光照组和光动力治疗组明显增加,且α-SMA在对照组、单纯光敏剂组排列紊乱,统计结果(图 3C)显示光动力治疗组较其余3组α-SMA的表达明显下降,差异具有统计学意义(P < 0.05)。Western blot检测结果与其免疫组织化学染色结果相吻合。以上结果显示光动力疗法可抑制AVF吻合口静脉VSMC增殖。
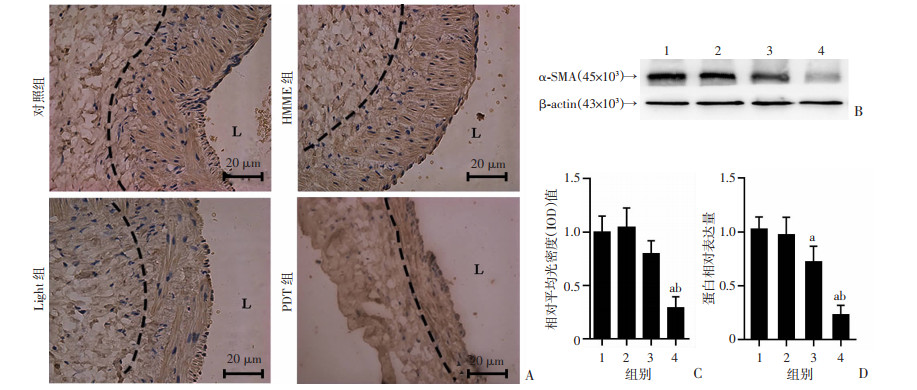
|
| 1:对照组;2:HMME组;3:Light组;4:PDT组A:各组静脉中ɑ-SMA的免疫组化染色情况棕色为阳性;L:血管腔;黑色虚线与血管腔之间部分为内中膜;B、D:Western blot检测各组静脉中ɑ-SMA的表达及半定量分析 a:P < 0.05,与HMME组、Light组比较;b: P < 0.01,与对照组比较;C:各组相对平均积分光密度值的统计分析 a: P < 0.05,与Light组、HMME组比较;b:P < 0.01,与对照组比较 图 3 光动力疗法抑制动静脉内瘘ɑ-SMA的表达水平 |
2.4 HMME-PDT光动力疗法抑制兔颈动静脉内瘘血管内膜PCNA的表达
免疫组化各组PCNA增殖指数统计结果分别为:对照组43.96%;单纯光敏剂组45.67%;单纯光照组33.21%;光动力治疗组17.07%。光动力组PCNA增殖指数较其余3组明显减轻(P < 0.05,图 4A、C)。Western blot结果显示光动力组血管内中膜的PCNA蛋白表达较对照组、单纯光敏剂组、单纯光照组明显下降(P < 0.05,图 4B、D),Western blot结果与免疫组化结果相吻合,提示HMME-PDT可以抑制颈动静脉内瘘术后PCNA的表达。
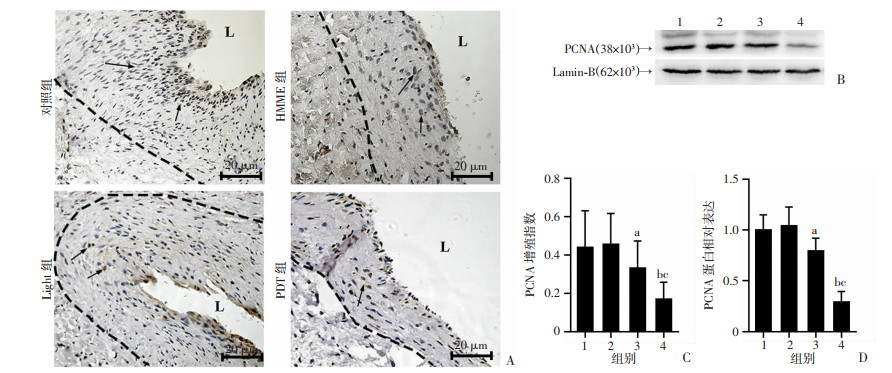
|
| 1:对照组;2:HMME组;3:Light组;4:PDT组A:各组静脉中PCNA的免疫组化染色情况棕色为阳性染色; L:血管腔;黑色虚线与血管腔之间部分为内中膜;↑:示指阳性表达;B、D:Western blot检测各组静脉中PCNA的表达及半定量分析;C:PCNA增殖指数分析 a: P < 0.05,与HMME组比较;b: P < 0.05,与Light组比较;c: P < 0.01,与对照组比较 图 4 光动力疗法抑制动静脉内瘘PCNA的表达水平 |
2.5 HMME-PDT通过Bcl-2/Bax凋亡途径促进血管平滑肌细胞凋亡
血管内中膜Caspase3免疫组织化学染色结果显示,对照组与单纯光敏剂组血管内中膜可见少量棕色凋亡细胞,单纯光照组和光动力治疗组凋亡细胞增多,其中光动力治疗组更明显(图 5A),统计分析显示光动力治疗组Caspase3表达较对照组、单纯光敏剂组、单纯光照组明显增加(图 5B),差异具有统计学意义(P < 0.05)。Western blot结果显示对照组与单纯光敏剂组血管内中膜Caspase3蛋白表达差异无统计学意义(P>0.05,图 6B、D), 单纯光照组和光动力治疗组Caspase3蛋白表达较对照组和单纯光敏剂组明显增加,差异具有统计学意义(P < 0.05),并且光动力治疗组Caspase3蛋白表达水平较其余3组明显增高,差异具有统计学意义(P < 0.05)。
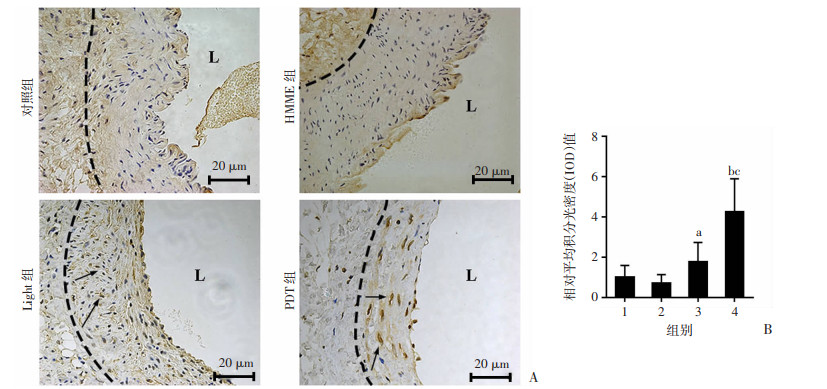
|
| A:各组静脉中Caspase3的免疫组化染色情况棕色为阳性染色;L:血管腔;黑色虚线与血管腔之间部分为内中膜;↑:示指阳性表达;B:各组相对平均积分光密度(IOD)值的统计分析 1:对照组;2:HMME组;3:Light组;4:PDT组;a: P < 0.05,与HMME组比较;b: P < 0.05,与Light组比较;c: P < 0.01,与对照组比较 图 5 光动力疗法促进动静脉内瘘Caspase3的表达水平 |

|
| A:Western blot检测各组静脉中Bax、Bcl-2的表达;B:Western blot检测各组静脉中Cleaved Caspase3、Cleaved Caspase9的表达;C:Bax、Bcl-2蛋白表达的半定量分析 a: P < 0.05, d: P < 0.01,与对照组比较;b: P < 0.05, 与HMME组比较;c: P < 0.05, 与Light组比较;D:Cleaved Caspase3、Cleaved Caspase9蛋白表达的半定量分析 a: P < 0.05, 与对照组比较;b: P < 0.05, 与HMME组比较;c: P < 0.05, 与Light组比较; d:P < 0.01,与对照组和HMME组比较 图 6 光动力疗法促进Bax、Bcl-2、Cleaved Caspase3、Cleaved Caspase9蛋白的表达,抑制Bcl-2蛋白的表达 |
Western blot结果(图 6A、C)显示光动力治疗组和单纯光照组Bcl-2蛋白表达较对照组和单纯光敏剂组明显降低,差异具有统计学意义(P < 0.05)。Western blot(图 6A~D)结果显示,光动力治疗组Bax、Caspase9蛋白表达较其余3组明显增加,差异具有统计学意义(P < 0.05),并且光动力治疗组Bcl-2/Bax比率较对照组、单纯光敏剂组、单纯光照组显著性降低(P < 0.05,图 6A)。以上结果显示HMME-PDT光动力治疗可通过Bcl-2/Bax凋亡途径促进AVF吻合口静脉VSMC凋亡。
3 讨论AVF仍有成熟率低、失功率高的缺点,研究表明吻合口静脉端IH引起的吻合口狭窄在AVF失功中起着至关重要的作用[2]。本研究采用兔颈部AVF模型,病理染色结果显示4组兔AVF模型在吻合口静脉端均有不同程度的IH。彩色多普勒超声显示AVF术后颈静脉与颈总动脉之间有直接解剖通道连接颈静脉与颈总动脉,频谱多普勒超声显示吻合口呈现“花色”血流,其血流频谱表现为类动脉血流频谱,同临床动静脉内瘘血流频谱信号。
本研究以第2代HMME作为光敏剂,并以(633±10)nm的红光照射AVF吻合口。结果显示,与对照组和单纯光敏剂组相比,单纯光照组静脉内中膜厚度明显减轻。
组织病理学上,由内膜增生引起的静脉狭窄是AVF失败的最常见原因[2]。在本研究中,我们发现PDT组的静脉内中膜厚度[(41.05±11.36)μm]仅为对照组[(83.01±15.27)μm]的50%,且PDT组血管管腔面积较其余3组明显增加。提示光动力疗法可明显增加兔AVF吻合口血管管腔面积,减轻AVF吻合口静脉端IH。
PCNA是一种与增殖密切相关的细胞周期调节蛋白, PCNA的表达能准确反映细胞增殖状态[10]。AVF狭窄是由VSMC、成纤维细胞和炎症细胞(主要是巨噬细胞)增殖引起的IH导致管腔狭窄所致,其中VSMC增殖在IH所致AVF狭窄中起着关键作用[11]。本研究采用免疫组化SABC法检测细胞核增殖蛋白(PCNA)指数,统计结果显示光动力治疗组PCNA指数(17.07%)仅为对照组(43.96%)的38.83%。Western blot结果显示光动力治疗组PCNA蛋白表达较其余3组明显下调,Western blot结果与免疫组织化学染色结果相符。正常情况下,α-SMA阳性细胞仅表达于血管中膜层。WANG等[12]的研究发现AVF增生的内膜中也出现了α-SMA(间充质细胞标记物)的表达。研究表明,内膜和中膜的成纤维细胞可以转化成肌成纤维细胞(α-SMA阳性细胞),从而导致IH[13]。α-SMA阳性细胞在IH中起着不可代替的重要作用。我们的研究发现,PDT组α-SMA蛋白表达较其余3组明显减少,据此,我们可以推论:HMME-PDT可明显抑制AVF吻合口VSMC增殖。
线粒体在细胞程序性死亡(凋亡)中起着至关重要的作用。LI等[14]的研究发现HMME-PDT通过破坏线粒体结构和引起线粒体功能紊乱而导致犬乳腺癌细胞死亡。LI等[15]的研究发现,PpIX光动力疗法可引起线粒体膜电位的丧失并导致平滑肌细胞(smooth muscle cells, SMCs)凋亡。许多基因都参与了细胞凋亡的调控,以往的研究表明Bcl-2家族在线粒体凋亡调控中起着至关重要的作用[16],在这个家族的成员中,一些是凋亡增强因子(促凋亡),另一些是凋亡抑制因子(抗凋亡)。Bcl-2、Bcl-x、Bcl-xl、Bcl-xs、Bcl-w和Back是常见的抗凋亡基因, 其中Bcl-2的抗凋亡作用最强;Bcl-2表达下调可诱导线粒体凋亡[17]。Bcl-10、Bax、Bak、Bid、Bad、Bim、Bik和Blk是常见的促凋亡基因,Bax是最重要的促凋亡基因,多项研究表明Bax上调可诱导线粒体凋亡[18]。LI等[17]的研究发现线粒体凋亡途径是HMME-PDT光动力疗法诱导犬乳腺肿瘤细胞死亡的主要细胞死亡途径。此外,他们还证实了HMME-PDT能诱导Bcl-2的下调和Bax的上调,降低Bcl-2/Bax的比值,进而诱导CHMm细胞引起线粒体介导的凋亡。Caspase3是细胞凋亡过程中执行凋亡最重要的酶类,研究表明Caspase3参与了细胞凋亡的绝大部分生化和病理生理事件,Caspase3的激活将导致持续的DNA损伤[19]。既往研究表明,在细胞层面PDT具有诱导VSMC凋亡的作用[15];在体内PDT也能诱导VSMC凋亡。在本实验研究中,免疫组织化学染色结果显示,光动力治疗组Caspase3的表达明显高于其余3组。Western blot结果显示光动力组Bax、Caspase9、Caspase3蛋白表达较其余3组均明显增加,而Bcl-2表达明显减少。我们的研究发现HMME-PDT光动力疗法可明显降低Bcl-2/Bax的比率,从而通过Bcl-2/Bax凋亡途径诱导VSMC凋亡。
综上,本实验使用兔颈部AVF模型,实验结果证明HMME-PDT能够明显减轻兔AVF内中膜增生;HMME-PDT通过Bcl-2/Bax凋亡途径促进VSMC凋亡,抑制VSMC增殖,从而达到抑制动静脉内瘘静脉内膜增生的效果。
| [1] |
VAZQUEZ-PADRON R I, ALLON M. New insights into dia-lysis vascular access: impact of preexisting arterial and venous pathology on AVF and AVG outcomes[J]. Clin J Am Soc Nephrol, 2016, 11(8): 1495-1503. DOI:10.2215/CJN.01860216 |
| [2] |
CHEUNG A K, IMREY P B, ALPERS C E, et al. Intimal hyperplasia, stenosis, and arteriovenous fistula maturation failure in the hemodialysis fistula maturation study[J]. J Am Soc Nephrol, 2017, 28(10): 3005-3013. DOI:10.1681/ASN.2016121355 |
| [3] |
KWIATKOWSKI S, KNAP B, PRZYSTUPSKI D, et al. Photodynamic therapy—mechanisms, photosensitizers and combinations[J]. Biomed Pharmacother, 2018, 106: 1098-1107. DOI:10.1016/j.biopha.2018.07.049 |
| [4] |
MA J W, LAI G Y, LU Z. Effect of 410 nm photodynamic therapy with hemoporfin on the expression of vascular endothelial growth factor (VEGF) in cultured human vascular endothelial cells[J]. Lasers Med Sci, 2019, 34(1): 149-155. DOI:10.1007/s10103-018-2649-8 |
| [5] |
LI D H, LI L, LI P X, et al. Apoptosis of HeLa cells induced by a new targeting photosensitizer-based PDT via a mitochondrial pathway and ER stress[J]. Oncotargets Ther, 2015, 8: 703-711. DOI:10.2147/OTT.S76370 |
| [6] |
郭鹏, 刘杨东, 涂波, 等. 光动力疗法在预防动静脉内瘘再狭窄中的作用[J]. 第三军医大学学报, 2017, 39(7): 635-640. GUO P, LIU Y D, TU B, et al. Role of photodynamic therapy in prevention of arteriovenous fistula restenosis in rabbits[J]. J Third Mil Med Univ, 2017, 39(7): 635-640. DOI:10.16016/j.1000-5404.201611144 |
| [7] |
林斌, 董兴有, 赵江, 等. 二甲基亚砜通过降低炎症和氧化应激改善鱼精蛋白诱导的大鼠膀胱炎[J]. 第三军医大学学报, 2015, 37(6): 505-509. LIN B, DONG X Y, ZHAO J, et al. Dimethyl sulfoxide alleviates protamine sulfate-induced rat cystitis by reducing inflammation and oxidative stress[J]. J Third Mil Med Univ, 2015, 37(6): 505-509. DOI:10.16016/j.1000-5404.201410047 |
| [8] |
DUQUE J C, MARTINEZ L, MESA A, et al. CD4(+) lymphocytes improve venous blood flow in experimental arteriovenous fistulae[J]. Surgery, 2015, 158(2): 529-536. DOI:10.1016/j.surg.2015.02.018 |
| [9] |
CHEN S H, QIN S Y, WANG M H, et al. Expression and significance of NELIN and SM22α in varicose vein tissue[J]. Exp Ther Med, 2015, 9(3): 845-849. DOI:10.3892/etm.2015.2170 |
| [10] |
BOEHM E M, GILDENBERG M S, WASHINGTON M T. The many roles of PCNA in eukaryotic DNAreplication[J]. Enzym, 2016, 39: 231-254. DOI:10.1016/bs.enz.2016.03.003 |
| [11] |
BRAHMBHATT A, MISRA S. The biology of hemodialysis vascular accessfailure[J]. Semin Interv Radiol, 2016, 33(1): 15-20. DOI:10.1055/s-0036-1572355 |
| [12] |
WANG Y, LIANG A L, LUO J L, et al. Blocking Notch in endothelial cells prevents arteriovenous fistula failure despite CKD[J]. J Am Soc Nephrol, 2014, 25(4): 773-783. DOI:10.1681/ASN.2013050490 |
| [13] |
GOLDSTONE R N, MCCORMACK M C, KHAN S I, et al. Photochemical tissue passivation reduces vein graft intimal hyperplasia in a swine model of arteriovenous bypass grafting[J]. J Am Heart Assoc, 2016, 5(8): e003856. DOI:10.1161/jaha.116.003856 |
| [14] |
LI H T, SONG X Y, YANG C, et al. Effect of hematoporphyrin monomethyl ether-mediated PDT on the mitochondria of canine breast cancer cells[J]. Photodiagn Photodyn Ther, 2013, 10(4): 414-421. DOI:10.1016/j.pdpdt.2013.03.005 |
| [15] |
LI Q S, CHENG J L, PENG C H, et al. Apoptosis of vascular smooth muscle cells induced by photodynamic therapy with protoporphyrin IX[J]. Biochem Biophys Res Commun, 2010, 391(1): 69-72. DOI:10.1016/j.bbrc.2009.11.003 |
| [16] |
HUSKA J D, LAMB H M, HARDWICK J M. Overview of BCL-2 family proteins and therapeuticpotentials[J]. Methods Mol Biol Clifton N J, 2019, 1877: 1-21. DOI:10.1007/978-1-4939-8861-7_1 |
| [17] |
LI H T, TONG JJ, BAO J, et al. Hematoporphyrin monomethyl ether combined with He-Ne laser irradiation-induced apoptosis in canine breast cancer cells through the mitochondrial pathway[J]. J Vet Sci, 2016, 17(2): 235-242. DOI:10.4142/jvs.2016.17.2.235 |
| [18] |
PEÑA-BLANCO A, GARCÍA-SÁEZ A J. Bax, Bak and beyond-mitochondrial performance in apoptosis[J]. FEBS J, 2018, 285(3): 416-431. DOI:10.1111/febs.14186 |
| [19] |
LIU X J, HE Y J, LI F, et al. Caspase3 promotes genetic instability and carcinogenesis[J]. Mol Cell, 2015, 58(2): 284-296. DOI:10.1016/j.molcel.2015.03.003 |



