在过去几十年中, 多药耐药菌迅速蔓延, 导致医院感染和住院死亡率增加, 对全球健康构成威胁。随着抗生素耐药性的上升, 寻找替代性抗生素已成为治疗耐药菌的首要任务。抗菌肽(antimicrobial peptides, AMPs)存在于从细菌到植物、脊椎动物和无脊椎动物的所有生命形式中, 是其固有免疫防御的普遍组成部分, 已经被广泛研究。由于抗菌谱广、热稳定性好、对宿主毒性小等特征, 抗菌肽具有作为抗菌药物使用的潜力[1-3]; 此外, 大多数抗菌药物通常作用于特定蛋白质, 而抗菌肽大多作用于细菌膜或其他广义靶点, 使得细菌通过基因突变获得耐药性的可能性变得很小[4]。
抗菌肽是病原微生物入侵有机体后, 有机体产生的一种具有抗菌作用的小分子多肽。从来源上分类, 可分为内源性抗菌肽和人工合成抗菌肽两类。内源性抗菌肽是从有机体中直接提取的, 具有广谱抗菌能力[5]。人工合成的抗菌肽主要是为了解决内源性抗菌肽产量小、技术难度高、新陈代谢稳定率和生物药效率低等问题而设计和改造的[6]。我们根据粪肠球菌产生的肠毒素中的一段氨基酸序列[7], 在保证有较好抗菌活性的基础上, 尽可能减小分子量, 设计出3条具有9~12个氨基酸的多肽, 经前期实验比较发现含有12个氨基酸残基的抗菌肽ET12对革兰阳性菌、特别是表皮葡萄球菌抗菌效果较好。因此, 本研究拟通过调查其抗菌活性、抗生物膜形成能力、细胞毒性、溶血性, 从而确定ET12是一种可应用的、效果良好的抗革兰阳性菌活性肽; 并在此基础上, 通过透射电子显微镜和激光共聚焦显微镜观察抗菌肽处理前后细菌形态和细胞膜通透性的变化, 初步探究抗菌肽ET12的抗菌机制, 以期为开发新抗菌药物提供实验研究依据。
1 材料与方法 1.1 菌株为了检测抗菌肽ET12的抗菌活性, 本实验共选择6种30株常见菌, 其中包括2种革兰阳性菌(金黄色葡萄球菌、表皮葡萄球菌)和4种革兰阴性菌(鲍曼不动杆菌、铜绿假单胞菌、大肠埃希氏菌、肺炎克雷伯菌)。所有的标准菌株(ATCC25923、N315、ATCC12228、ATCC35984、ATCC27853、ATCC25922)均购自美国菌种保藏中心, 其余临床菌株均为陆军军医大学第一附属医院临床分离所得。实验所用菌株信息见表 1。
| 菌株名 | 菌株号 | ET12 MIC/μg·mL-1 |
| 金黄色葡萄球菌 | ATCC25923 | 64 |
| N315 | 32 | |
| S26 | 32 | |
| S28 | 64 | |
| S29 | 8 | |
| 表皮葡萄球菌 | ATCC12228 | 8 |
| ATCC35984 | 16 | |
| 48 | 16 | |
| 49 | 16 | |
| 50 | 8 | |
| 鲍曼不动杆菌 | aba658 | 256 |
| aba659 | 32 | |
| aba660 | 64 | |
| aba661 | 128 | |
| aba662 | 128 | |
| 铜绿假单胞菌 | ATCC27853 | >256 |
| P544 | >256 | |
| P630 | >256 | |
| P669 | >256 | |
| P670 | >256 | |
| 大肠埃希氏菌 | ATCC25922 | >256 |
| E260 | >256 | |
| E270 | >256 | |
| E282 | 256 | |
| E388 | 256 | |
| 肺炎克雷伯菌 | 1206 | >256 |
| 1220 | >256 | |
| 1240 | >256 | |
| 1248 | >256 | |
| 1314 | >256 |
1.2 材料、试剂与仪器
小鼠单核巨噬细胞白血病细胞(RAW264.7)购自中国科学院上海细胞生物研究所。试剂:DMEM细胞培养基(HyClone, SH30243.01);胎牛血清(HyClone, SV30087.03);哥伦比亚血琼脂平板(庞通医疗, PB1101);M-H肉汤(北京路桥, CM901);TSB培养基(索莱宝, LA0110);异硫氰酸荧光标记的伴刀豆球蛋白A(FITC-ConA; Sigma, C7642);碘化丙啶(PI; Simga, P4170);脱纤维绵羊血(索莱宝, TX0030);增强型CCK-8试剂盒(碧云天, C0017);Triton X-100(碧云天, ST795);二甲亚砜(DMSO; 碧云天, ST038);戊二醛溶液(阿拉丁, G105907)。仪器:玻底培养皿(NEST, 801002);3111型CO2培养箱(美国Thermo公司); Muhiskan Spectrum型酶标仪(美国Thermo公司); MAXQ 481R型摇床(美国Thermo公司); JEM-1400型透射电子显微镜(日本电子株式会社); LSM 780型激光共聚焦显微镜(德国ZEISS公司)。
1.3 抗菌肽ET12的合成抗菌肽ET12含有12个氨基酸残基, 序列为苯丙氨酸-赖氨酸-赖氨酸-缬氨酸-异亮氨酸-缬氨酸-异亮氨酸-精氨酸-精氨酸-色氨酸-苯丙氨酸-异亮氨酸。通过芴甲氧羰基(Fmoc)固相化学方法合成多肽ET12(批号:P15064-2-20171220), 利用高效液相色谱法进行纯化, 并进行质谱鉴定。用自动氨基酸测序仪测定氨基酸序列结构。上述均由上海生工生物工程股份有限公司完成。
1.4 最低抑菌浓度(MIC)测定采用微量肉汤稀释法检测抗菌肽ET12对革兰阴性菌和革兰阳性菌的MIC。各菌株分别接种至哥伦比亚血琼脂平板上, 37 ℃培养20 h后, 取单菌落, 并用生理盐水稀释至0.5个麦氏比浊单位, 用M-H肉汤进一步稀释1 000倍备用。少量DMSO溶解抗菌肽ET12, 按倍比稀释法用M-H肉汤将其稀释成512~1 μg/mL的浓度梯度。取100 μL各浓度的抗菌肽ET12溶液分别与100 μL稀释菌液一起加入96孔板中; 取100 μL稀释菌液和100 μL M-H肉汤作为生长对照孔。37 ℃培养20 h后, 读取MIC结果。
1.5 抗菌肽ET12对细菌生物膜形成的影响用TSB培养基将过夜培养的表皮葡萄球菌比浊稀释至1.0×108 CFU/L; 无菌6孔板中放入无菌盖玻片, 加入2.5 mL菌液和2.5 mL的抗菌肽ET12溶液, 使得抗菌肽ET12的最终浓度为1/4 MIC, 以TSB培养基为阴性对照。37 ℃培养24 h。取出盖玻片, 用PBS溶液轻柔冲洗, 去除未粘附细菌, 并用吸水纸吸去多余水分, 加入2.5%的戊二醛溶液, 固定1.5 h。PBS溶液冲洗后, 加入50 mg/mL的FITC-ConA溶液, 4 ℃避光染色30 min。PBS溶液冲洗后, 加入5 mg/L的PI溶液, 4 ℃避光染色15 min。PBS再次清洗后, 晾半干, 50%甘油封片。激光共聚焦显微镜定性观察标记为绿色荧光的多糖和标记为红色荧光的细菌细胞核。
1.6 抗菌肽ET12对细菌形态的影响参照文献[8]描述的方法利用透射电子显微镜观察细菌形态。取对数生长期的表皮葡萄球菌与MIC浓度的ET12, 37 ℃、180 r/min摇床培养30 min。菌液与PBS共培养作为空白对照。1 000 r/min离心10 min, 弃上清, 无菌生理盐水洗涤3次后, 用2.5%戊二醛固定2 h后, 送至电镜室进行样品固定、脱水、包埋、切片和染色, 最后用透射电子显微镜观察。
1.7 抗菌肽ET12对细菌细胞膜通透性的影响通过PI染色观察ET12对细菌细胞膜通透性的影响[9]。取对数生长期的表皮葡萄球菌与MIC浓度的抗菌肽ET12(PBS作为空白对照)共培养30 min后, 用PBS清洗细菌3次。100 μg/mL的PI溶液染色15 min后, 加入玻底培养皿中。激光共聚焦显微镜定性观察标记为红色荧光的膜破细菌。
1.8 抗菌肽ET12体外溶血性的测定取脱纤维绵羊血1 000 r/min离心10 min。弃上清, 用PBS反复多次洗涤红细胞, 直至上清透亮。用10倍体积的PBS重悬红细胞, 制备红细胞悬液。用PBS按照倍比稀释法将抗菌肽ET12稀释为5 120、2 560、1 280、640、320、160、80、40 μg/mL的浓度, 分别取10 μL肽液加入96孔板中, 作为实验组, 另取10 μL PBS和10%的Triton X-100分别作为阴性对照组和阳性对照组。每孔加入1×105个红细胞悬液, 每组5个复孔。5% CO2、37 ℃孵育30 min, 1 500 r/min离心10 min, 取上清至新的96孔板中, 于450 nm处测光密度值[D(450)], 并计算溶血率。溶血率=[实验组D(450)-阴性对照组D(450)]/[阳性对照组D(450)-阴性对照组D(450)]×100%。
1.9 抗菌肽ET12细胞毒性测定小鼠单核巨噬细胞白血病细胞(RAW264.7)按照1×105个/孔接种至96孔板中, 在含5% CO2的恒温细胞培养箱中37 ℃培养24 h。弃上清, 并用PBS清洗2次。用含10%胎牛血清的DMEM培养基按照倍比稀释法将抗菌肽ET12稀释为512、256、128、64、32、16、8、4 μg/mL, 分别取100 μL加入清洗好的96孔板细胞中, 作为实验组, 并设置对照组(含有细胞和培养基)和空白组(只含有培养基), 每组3个复孔。37 ℃、5% CO2条件下孵育24 h。每孔加入10 μL CCK-8溶液, 细胞培养箱中孵育30 min后, 在450 nm处测光密度值[D(450)], 并计算细胞存活率。细胞存活率= [实验组D(450)-空白组D(450)]/[对照组D(450)-空白组D(450)]×100%。
2 结果 2.1 抗菌肽ET12的合成ET12是一种小分子多肽, 由12个氨基酸残基组成, 相对分子量为1605.05, 其中包括4个正电荷残基(精氨酸+赖氨酸)。高效液相色谱法鉴定其纯度为98.0%(图 1A), 质谱结果显示ESI-MS(m/z):803.45[M+2H]2+、1605.15[M+H]+, ET12的分子离子峰与合成预期结果一致(图 1B)。ET12全序列为FKKVIVIRRWFI, 通过NCBInr蛋白质数据库检索, 未发现有与之序列相匹配的蛋白质。
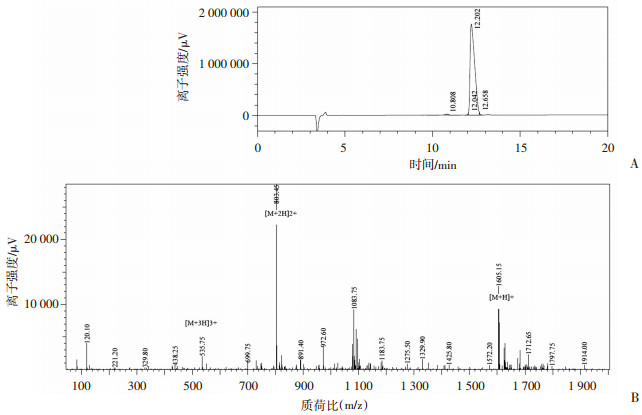
|
| A:ET12的高效液相色谱图; B:电喷雾电离(ESI)质谱图 图 1 抗菌肽ET12的表征 |
2.2 MIC测定结果
抗菌肽ET12对革兰阳性菌和革兰阴性菌的MIC结果如表 1所示。抗菌肽ET12对革兰阴性菌几乎没有抗菌效果, MIC值大部分均大于256 μg/mL。相对而言, ET12对革兰阳性菌的抗菌活性良好, 其中对表皮葡萄球菌的抗菌活性最好, MIC值均在16 μg/mL及以下。由于ET12对表皮葡萄球菌临床菌株50的抗菌活性最好, 因此将其作为后续生物膜、细胞形态及细胞膜通透性实验的菌株。
2.3 抗菌肽ET12对细菌生物膜形成的影响激光共聚焦显微镜观察亚-MIC ET12对表皮葡萄球菌生物膜形成的影响, 结果如图 2所示。未经抗菌肽ET12处理的空白对照组, 其表皮葡萄球菌密集, 所形成的生物膜结构紧密。相对而言, 1/4 MIC ET12处理表皮葡萄球菌24 h后, 细菌数量明显减少, 细菌生物膜的形成疏散。
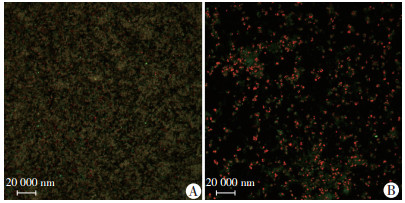
|
| A:空白对照组; B:ET12处理组 图 2 抗菌肽ET12对细菌生物膜形成的影响 |
2.4 抗菌肽ET12对细菌形态的影响
通过透射电镜观察ET12对表皮葡萄球菌细胞形态的影响, 结果如图 3所示。空白对照组表皮葡萄球菌细胞轮廓平滑完整, 胞质密度均匀; 而抗菌肽ET12处理组细胞溶胀破裂, 细胞质向外渗漏。
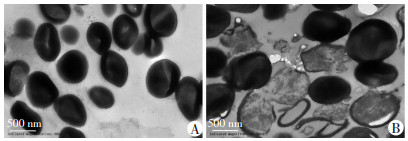
|
| A:空白对照组; B:ET12处理组 图 3 透射电镜观察抗菌肽ET12对细菌细胞形态的影响 |
2.5 抗菌肽ET12对细菌细胞膜通透性影响
激光共聚焦显微镜观察结果(图 4)显示, 相比空白对照组, ET12在37 ℃与表皮葡萄球菌孵育30 min后, PI穿透细胞膜, 产生大量对照组极少存在的红色荧光。
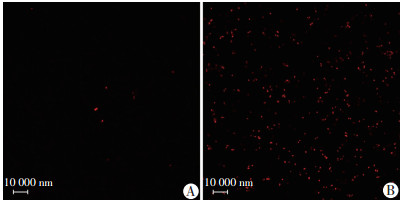
|
| A:空白对照组; B:ET12处理组 图 4 菌肽ET12对细菌细胞膜通透性的影响 |
2.6 抗菌肽ET12的溶血率
利用脱纤维绵羊血红细胞测定ET12的溶血活性, 结果如图 5所示。抗菌肽ET12的溶血率随浓度的升高而升高。虽然在512 μg/mL时对红细胞的溶血率为6.85%, 但在8~64 μg/mL时其溶血率在0.62%~2.29%范围内, 溶血活性较低。
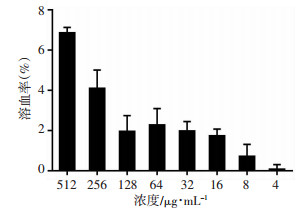
|
| 图 5 抗菌肽ET12对脱纤维绵羊红细胞的溶血率 |
2.7 抗菌肽ET12的细胞毒性
抗菌肽ET12的细胞毒性如图 6所示。随着抗菌肽ET12浓度的增加, RAW264.7细胞的存活率呈下降趋势。在512 μg/mL的浓度下, 细胞存活率最低, 为47.82%。在抗菌肽ET12对革兰阳性菌的MIC范围内(MIC≤64 μg/mL), RAW264.7细胞的存活率都大于80%。结果表明, 抗菌肽ET12的细胞毒性较小。
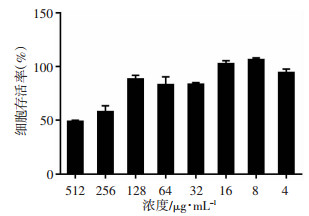
|
| 图 6 不同浓度抗菌肽ET12处理后RAW264.7细胞的存活率 |
3 讨论
由于抗菌药物的大量及不合理使用, 多重耐药菌不断增加, 给临床治疗带来了巨大挑战。目前抗菌药物的研发速度远低于耐药菌的出现, 因此寻找新的抗菌药物成为亟待解决的问题。近年来, 越来越多的人工抗菌肽被设计合成并发现具有广谱的抗菌活性[10-12]。本研究设计合成了一种抗菌肽ET12, 通过MIC测定发现其对革兰阳性菌, 特别是表皮葡萄球菌具有较强的抗菌效果。ET12对表皮葡萄球菌的MIC均≤16 μg/mL, 与临床常用抗菌药物的MIC值相当。抗菌肽ET12由12个氨基酸残基组成, 含有4个正电荷氨基酸和66.67%的疏水氨基酸, 是一种分子量小的阳离子疏水肽。抗菌肽ET12较好的抗革兰阳性菌活性效果可能是由于革兰阳性菌细胞壁表面存在的大量磷壁酸和糖醛酸磷壁酸使其对带正电的抗菌肽ET12更加敏感[1, 13]。然而, ET12对革兰阴性菌几乎没有抗菌活性。导致这种差异的原因可能是由于革兰阴性菌细胞壁外具有额外的一层外膜, 比革兰阳性菌更能抵抗外来抗菌药物的入侵[14]。本研究中ET12对表皮葡萄球菌具有最强的抗菌活性, 因此以表皮葡萄球菌为研究对象进行后续的生物膜、细菌形态及细胞膜通透性实验。
临床上80%的感染都与生物膜相关。表皮葡萄球菌是生物膜相关感染的重要病原菌之一。表皮葡萄球菌能够粘附到外科植入材料上形成生物膜, 生物膜中的细菌能够抵抗抗菌药物和宿主免疫系统的攻击, 比浮游菌的耐药性高1 000倍[15]。本研究通过激光共聚焦显微镜观察生物膜, 结果显示亚-MIC ET12能够有效抑制表皮葡萄球菌的生物膜形成, 提示抗菌肽ET12可能作为一种预防生物膜相关感染的治疗药物。
为了探讨ET12的抗菌作用机制, 我们首先通过透射电镜观察表皮葡萄球菌细胞形态变化, 结果显示ET12会导致表皮葡萄球菌的细胞破裂, 细胞质向外渗漏。由于PI只穿透受损的膜, 将DNA染成红色, 因此通过测定细菌对PI的摄取量研究ET12对细菌细胞膜的通透性。实验结果显示ET12会造成表皮葡萄球菌细胞膜破裂, 通透性增加。据此我们推测, 阳离子抗菌肽ET12可能在穿过细胞壁后, 通过作用于细胞膜, 造成细胞膜破裂而表现出抗菌活性[16-18]。然而具体的作用方式, 仍需更加深入的研究。
溶血活性和细胞毒性是衡量抗菌肽安全性的重要评价指标。本研究中, 抗菌肽ET12虽然在高浓度中具有一定的溶血活性和细胞毒性, 但在≤128 μg/mL浓度范围内溶血性和细胞毒性较低。研究结果表明抗菌肽ET12在保证对革兰阳性菌具有良好的抗菌活性和抗生物膜形成活性的同时, 还具有溶血率低, 对正常细胞无毒性的特征, 有作为抗生素替代药物的潜力。
| [1] |
MORAVEJ H, MORAVEJ Z, YAZDANPARAST M, et al. Antimicrobial peptides: features, action, and their resistance mechanisms in bacteria[J]. Microb Drug Resist, 2018, 24(6): 747-767. DOI:10.1089/mdr.2017.0392 |
| [2] |
李冠楠, 夏雪娟, 隆耀航, 等. 抗菌肽的研究进展及其应用[J]. 动物营养学报, 2014, 26(1): 17-25. LI G N, XIA X J, LONG Y H, et al. Research progress and application of antimicrobial peptides[J]. Chin J Animal Nutrit, 2014, 26(1): 17-25. DOI:10.3969/j.issn.1006-267x.2014.01.003 |
| [3] |
KOCZULLA A R, BALS R. Antimicrobial peptides: current status and therapeutic potential[J]. Drugs, 2003, 63(4): 389-406. DOI:10.2165/00003495-200363040-00005 |
| [4] |
NGUYEN L T, HANEY E F, VOGEL H J. The expanding scope of antimicrobial peptide structures and their modes of action[J]. Trends Biotechnol, 2011, 29(9): 464-472. DOI:10.1016/j.tibtech.2011.05.001 |
| [5] |
BASTOS P, TRINDADE F, DA COSTA J, et al. Human antimicrobial peptides in bodily fluids: current knowledge and therapeutic perspectives in the postantibiotic era[J]. Med Res Rev, 2018, 38(1): 101-146. DOI:10.1002/med.21435 |
| [6] |
彭博, 郭中敏, 陆家海. 人工合成抗菌肽的常用方法及应用前景[J]. 中国抗生素杂志, 2012, 37(3): 176-183. PENG B, GUO Z M, LU J H. The common methods and application prospect of the artificial synthetic antibacterial peptide[J]. Chin J Antibiot, 2012, 37(3): 176-183. DOI:10.13461/j.cnki.cja.004954 |
| [7] |
CHEN Z H, CHANG D, ZOU Y Q, et al. Genome sequence of Enterococcus faecium clinical isolate LCT-EF128[J]. J Bacteriol, 2012, 194(17): 4765. DOI:10.1128/JB.00996-12 |
| [8] |
OUYANG J, SUN F J, FENG W, et al. Antimicrobial activity of galangin and its effects on murein hydrolases of vancomycin-intermediate Staphylococcus aureus (VISA) strain Mu50[J]. Chemotherapy, 2018, 63(1): 20-28. DOI:10.1159/000481658 |
| [9] |
WANG Q, XU Y Z, DONG M M, et al. HJH-1, a broad-spectrum antimicrobial activity and low cytotoxicity antimicrobial peptide[J]. Molecules, 2018, 23(8): E2026. DOI:10.3390/molecules23082026 |
| [10] |
JIA F J, ZHANG Y, WANG J Y, et al. The effect of halogenation on the antimicrobial activity, antibiofilm activity, cytotoxicity and proteolytic stability of the antimicrobial peptide Jelleine-I[J]. Peptides, 2019, 112: 56-66. DOI:10.1016/j.peptides.2018.11.006 |
| [11] |
VOGEL H J, SCHIBLI D J, JING W G, et al. Towards a structure-function analysis of bovine lactoferricin and related tryptophan- and arginine-containing peptides[J]. Biochimie Et Biol Cell, 2002, 80(1): 49-63. DOI:10.1139/o01-213 |
| [12] |
李国栋, 钱承军, 陆敏, 等. 一组人工合成抗菌肽的研究[J]. 微生物学报, 2006, 46(3): 496-499. LI G D, QIAN C J, LU M, et al. A group of synthetic antimicrobial peptides[J]. Acta Microbiol Sin, 2006, 46(3): 496-499. DOI:10.13343/j.cnki.wsxb.2006.03.033 |
| [13] |
OMARDIEN S, BRUL S, ZAAT S A J. Antimicrobial activity of cationic antimicrobial peptides against gram-positives: current progress made in understanding the mode of action and the response of bacteria[J]. Front Cell Dev Biol, 2016, 4: 111. DOI:10.3389/fcell.2016.00111 |
| [14] |
GRUENHEID S, LE MOUAL H. Resistance to antimicrobial peptides in Gram-negative bacteria[J]. FEMS Microbiol Lett, 2012, 330(2): 81-89. DOI:10.1111/j.1574-6968.2012.02528.x |
| [15] |
SUN F J, QU F, LING Y, et al. Biofilm-associated infections: antibiotic resistance and novel therapeutic strategies[J]. Future Microbiol, 2013, 8(7): 877-886. DOI:10.2217/fmb.13.58 |
| [16] |
BOLINTINEANU D, HAZRATI E, DAVIS H T, et al. Antimicrobial mechanism of pore-forming protegrin peptides: 100 pores to kill E. coli[J]. Peptides, 2010, 31(1): 1-8. DOI:10.1016/j.peptides.2009.11.010 |
| [17] |
MATSUZAKI K, NAKAMURA A, MURASE O, et al. Modulation of Magainin 2-lipid bilayer interactions by peptide charge[J]. Biochemistry, 1997, 36(8): 2104-2111. DOI:10.1021/bi961870p |
| [18] |
WANG K, DANG W, YAN J, et al. Membrane perturbation action mode and structure-activity relationships of protonectin, a novel antimicrobial peptide from the venom of the neotropical social wasp agelaia pallipes pallipes[J]. Antimicrob Agents Chemother, 2013, 57(10): 4632-4639. DOI:10.1128/AAC.02311-12 |



