2. 400030 重庆,重庆大学附属肿瘤医院血液肿瘤科;
3. 401420 重庆,重庆市綦江区人民医院血液内科
2. Department of Hematologic Oncology, Chongqing University Cancer Hospital, Chongqing, 400030;
3. Department of Hematology, Qijiang People’s Hospital, Chongqing, 401420, China
多发性骨髓瘤(multiple myeloma,MM)是一种单克隆浆细胞来源的恶性肿瘤,准确的危险度分层对指导个体化治疗至关重要[1]。细胞遗传学异常被认为是其最重要的预后因素,荧光原位杂交(fluorescence in situ hybridization, FISH)在MM的细胞遗传学检测中广泛应用,但骨髓瘤患者的肿瘤浆细胞在骨髓中呈灶性分布,直接进行FISH检测假阴性率高。未经分选直接进行FISH检测,其阳性率与抽取骨髓液中的浆细胞比例呈显著正相关[2]。CD138磁珠分选(magneticactivated cell sorting, MACS)可以有效地筛选和富集浆细胞[3],但需要磁珠分选仪(分选架及配套分选柱或全自动磁珠分选仪)和相应的MACS磁珠(CD138-Beads),且该方法对人员的技术要求相对较高,在国内大部分医院难以开展。浆细胞作为B淋巴效应细胞,从记忆B→活化B→浆母细胞→成熟浆细胞4个分化发育阶段中,CD19、CD20、CD27、CD45、CD38、CD138、CD269、MHCⅡ、CXCR4均发生不同的变化。浆母细胞和成熟浆细胞之间存在一些差异,浆母细胞表型为CD45int/highCD19+CD20-CD38highCD27highCD269+CD138-MHCⅡ+,而成熟浆细胞表型为CD45int/highCD19lowCD20- CD38highCD27+CD269+CD138+MHCⅡ-CXCR4+。针对CD138这一成熟浆细胞的标志进行磁珠分选能够富集所有的成熟浆细胞,但是对于CD138阴性或弱表达的浆母细胞富集效果欠佳。
CD45是白细胞共同抗原,在造血系统所有白细胞表面均有不同程度表达,CD45阴性细胞主要包括非造血系统来源的细胞,如实体瘤细胞和造血系统中的幼稚红细胞等。在实体瘤循环肿瘤细胞的研究中CD45阴性细胞分选的方法被广泛应用[4-6],主要原理是通过去除外周血中CD45阳性的白细胞,反向富集获得CD45阴性的肿瘤细胞群。骨髓液中正常成熟浆细胞的CD45呈中等强度表达,然而多发性骨髓瘤是一种恶性克隆性浆细胞疾病,骨髓瘤细胞为肿瘤浆细胞并非正常分化发育的浆细胞,起源于较早期的B细胞,病变发生在B细胞到成熟浆细胞各个发育阶段,故可表达高度异质性的B细胞系抗原和浆细胞抗原。肿瘤浆细胞表型与正常浆细胞是有差异的,如约80%多发性骨髓瘤患者的肿瘤浆细胞CD45表达为阴性,60%~70%的肿瘤浆细胞CD56表达为阳性。那么我们是否可以利用这一表型特点进行浆细胞的筛选和富集呢?因此,本研究探讨新型CD45阴性细胞分选技术在筛选和富集浆细胞中的作用。
1 资料与方法 1.1 研究对象纳入2018年7月至2019年12月陆军军医大学第二附属医院、重庆大学附属肿瘤医院、重庆市綦江区人民医院初诊骨髓瘤患者共60例。每个患者抽取骨髓液3~4 mL,平均分为2份,一份直接进行流式细胞仪浆细胞含量鉴定和细胞遗传学FISH检测(直接检测组),另一份先进行新型CD45阴性细胞分选,之后进行流式细胞仪和FISH检测(CD45分选组)。本研究经中国注册临床试验伦理审查委员会审查通过(ChiECRCT-20160046)。
1.2 试剂RosetteSep人CD45四聚抗体购自美国Stemcell公司,Ficoll-Paque Plus购自美国GE Healthcare公司,抗人CD38-APC、CD138-PE荧光抗体购自美国BD公司,IgH重排、13q14缺失、1q21扩增和17p缺失等FISH探针购自北京金菩嘉医疗科技有限公司。
1.3 方法 1.3.1 新型CD45阴性细胞分选取EDTA抗凝的患者骨髓液1 mL,估算有核细胞浓度,每107个有核细胞加入RosetteSep CD45抗体500 μL,充分混匀后 室温孵育30 min,加入等体积PBS稀释,后将标本小心沿离心管壁加入等体积Ficoll液上。4 ℃,1 200 r/min 离心15 min。将血浆与Ficoll之间的白膜层吸出,放入一试管中,另将红细胞层吸出放入另一试管。两份样本分别加入PBS,然后低速低温离心,弃去上清液。分别加入荧光抗体CD38和CD138各150 μL,混匀后室温避光孵育15 min。
1.3.2 流式细胞仪检测取白膜层细胞和红细胞层细胞各50 μL,分别加入荧光抗体CD38和CD138各20 μL,混匀后室温避光孵育15 min。BD FACS CANTOII上机检测,获取有核细胞至少105个,CD45/CD38/CD138鉴定浆细胞群。
1.3.3 流式细胞仪检测取白膜层细胞和红细胞层细胞各50 μL,分别加入荧光抗体CD38和CD138各20 μL,混匀后室温避光孵育15 min。BD FACS CANTOII上机检测,获取有核细胞至少105个,CD45/CD38/CD138鉴定浆细胞群。
1.3.4 FISH检测按照常规方法制片、配制探针、变性杂交过夜后,检测IgH重排、13q14缺失、1q21扩增和17p缺失的表达,若IgH重排阳性,则进一步完善 t(6;14)、t(11;14)、t(4;14)、t(14;16)、t(14;20)的检测。
1.4 统计学分析21.0统计软件进行分析。骨髓液中浆细胞比例通过单样本K-S检验分析符合正态分布,采用配对样本t检验;FISH检测结果采用配对样本卡方检验。检测水准α=0.05。
2 结果 2.1 患者基本情况60例初诊的骨髓瘤患者中,男性较多,占71.7%,年龄35~81岁,中位年龄61岁,IgG型最多占53.3%,其次为轻链型和IgA型分别占21.7%和16.7%;初诊时Ⅱ~Ⅲ期患者占80%(表 1)。
| 基本情况 | 例(%) |
| 性别 | |
| 男 | 43(71.7) |
| 女 | 17(28.3) |
| 疾病分型 | |
| IgG型 | 32(53.3) |
| IgA型 | 10(16.7) |
| IgD型 | 3(5.0) |
| 轻链型 | 13(21.7) |
| 不分泌型 | 2(3.3) |
| ISS分期 | |
| Ⅰ期 | 12(20.0) |
| Ⅱ期 | 21(35.0) |
| Ⅲ期 | 27(45.0) |
2.2 流式细胞仪检测浆细胞比例
流式细胞仪直接检测(分选前)骨髓液中浆细胞的比例为0.2%~60.2%(14.5%±13.8%),而采用新型CD45细胞阴性分选技术处理后(分选后)浆细胞比例明显增高,为0.5%~97.8%(51.5%±30.3%),差异有统计学意义(P<0.01,图 1、2),其中49例患者分选后浆细胞比例大于20%,仅有7例患者分选后浆细胞比例小于10%。分选后浆细胞比例平均为分选前的7.69倍,最高达68.4倍;但其中有4例患者分选后浆细胞比例较前下降,为分选前的30%~90%。从临床特征分析,这4例患者均为男性、IgG型,其中3例为ISS分期Ⅲ期,1例为ISS分期Ⅰ期,均有不同程度的骨质破坏。显微镜观察4例患者的骨髓涂片形态,发现浆细胞为胞体小、染色质粗的成熟浆细胞,而瘤样变原幼浆细胞少见;流式细胞仪检测显示上述患者的肿瘤浆细胞CD45表达阳性或弱阳性。同时,对分选后红细胞中的浆细胞也采用流式细胞仪检测,结果显示浆细胞比例平均为4.63%(0.0%~40.4%),其中接近80%的患者在分选后红细胞层中的浆细胞小于5%,仅有3例患者红细胞层中的浆细胞比例高于白膜层中的骨髓瘤细胞比例,其中2例大于20%,这3例均为分选后浆细胞比例下降的患者。
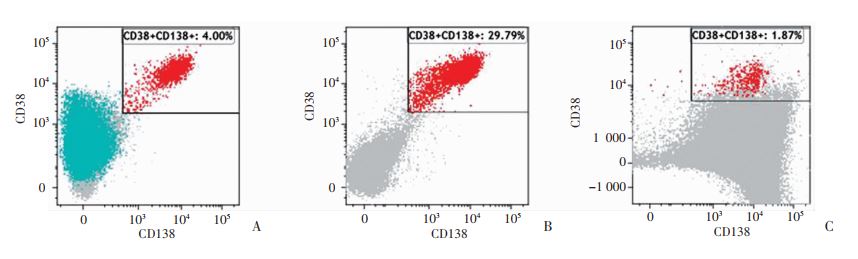
|
| A:直接检测组浆细胞比例;B:CD45分选组分选后白膜层中浆细胞比例;C:CD45分选组分选后红细胞层浆细胞比例 图 1 两种方式检测患者浆细胞比例 |

|
| a:P<0.01,与分选前比较 图 2 流式细胞仪检测60例患者分选前后浆细胞比例 |
2.3 FISH的检测结果
直接检测组(分选前)60例患者有17例(28.3%)检测出细胞遗传学异常,其中IgH重排12例、13q14缺失12例、1q21扩增15例和17p缺失5例;CD45分选组(分选后)60例患者共39例检测出细胞遗传学异常,检出率为65.0%,较直接检测组显著增高(P<0.001),其中IgH重排27例、13q14缺失25例、1q21扩增27例和17p缺失14例,其阳性率均明显高于直接检测组(P<0.05,表 2)。但分选后浆细胞比例下降的患者中有3例因骨髓液中细胞较少无法进行FISH检测。
| 组别 | IgH重排 | 13q14缺失 | 1q21扩增 | 17p缺失 |
| 直接检测组 | 12(20.0) | 12(20.0) | 15(25.0) | 5(8.3) |
| CD45分选组 | 27(45.0) | 25(41.7) | 27(45.0) | 14(23.3) |
| P值 | 0.006 | 0.017 | 0.035 | 0.043 |
2.4 危险度分层结果
根据mSMRAT3.0骨髓瘤危险度分层标准(www.msmart.org),直接检测组标危患者占大多数,为43例(71.7%),高危患者17例(28.3%);而CD45分选组,标危患者减少为25例(41.7%),高危患者增加至32例(53.3%),两组患者的危险度分层差异有统计学意义(P=0.002,表 3),但CD45分选组有3例患者细胞较少不能进行FISH检测,故无法进行危险度分层。
| 组别 | 标危 | 高危 | 无法分类 |
| 直接检测组 | 43(71.7) | 17(28.3) | 0(0.0) |
| CD45分选组 | 25(41.7) | 32(53.3) | 3(5.0) |
| P值 | 0.002 |
3 讨论
多发性骨髓瘤(MM)来源于单克隆浆细胞,目前仍是一种不可治愈的恶性肿瘤,危险度分层的差异导致了预后显著不同,故准确的危险度分层对治疗方案的选择至关重要[7-9]。细胞遗传学异常目前仍是MM最重要的预后因素,FISH被广泛用于骨髓瘤患者细胞遗传学的检测,但由于肿瘤浆细胞为灶性分布,骨髓液直接检测阳性率低,因此需要先对浆细胞进行富集分选。目前经典的方法是CD138磁珠分选,但国内大部分医院不具备磁珠分选的仪器设备,检测时间较长、成本也较高,因此需要探索适合我国医疗条件的新的浆细胞分选技术方法。
细胞分选的方法包括阳性细胞分选和阴性细胞分选,近年来实体肿瘤外周血中循环肿瘤细胞的分选采用的是CD45阴性细胞分选,主要利用RosetteSepTM Human CD45这种新型的双特异性抗体四聚体复合物(tetrameric antibody complexes,TAC),一端结合白细胞表面的CD45,另一端结合成熟红细胞表面的血型糖蛋白A(CD235a)并相互交联使红细胞在白细胞周围形成花环样结构,其密度较大,而不表达CD45的循环肿瘤细胞不与红细胞交联故而密度较小,因此经过密度梯度离心后循环肿瘤细胞得以和其他细胞分离。
在正常骨髓中只有幼稚红细胞CD45表达阴性,包括正常成熟浆细胞在内的所有白细胞CD45表达均为阳性。但骨髓瘤患者的肿瘤浆细胞常出现抗原漂移,比如CD45、CD19的丢失,CD38、CD28的异常减弱等,绝大部分多发性骨髓瘤患者的肿瘤浆细胞 CD45为阴性表达。基于此,本研究利用RosetteSepTM Human CD45抗体去除CD45阳性细胞,从而富集和分选获得CD45阴性的肿瘤浆细胞,建立一种新型的CD45阴性细胞分选技术。
本结果显示,骨髓液经新型CD45阴性细胞分选技术处理后,流式细胞仪检测浆细胞的比例明显增高,从直接检测组的14.5%增加到51.5%,分选后浆细胞比例平均为直接检测组的7.69倍,提示新型CD45阴性细胞分选技术能够分选和富集浆细胞;而且80%的患者红细胞层中的浆细胞比例小于5%,显示新型CD45阴性细胞分选技术处理后残留在红细胞层中的浆细胞是极少的。但有4例患者分选后浆细胞比例较前下降,其中3例患者红细胞层中浆细胞比例高于分选后白膜层中浆细胞的比例。进一步研究结果显示采用新型CD45阴性细胞分选技术后,患者细胞遗传学异常的检出率明显提高,IgH重排、13q14缺失、1q21扩增和17p缺失的阳性率均明显高于直接检测组,因此也改变了患者的危险度分层。但3例分选后浆细胞比例下降的患者因骨髓中浆细胞过少无法进行FISH检测。这4例患者分选结果不理想的原因主要和其肿瘤浆细胞CD45弱阳性或阳性表达相关,虽然典型的肿瘤浆细胞CD45表达为阴性,但有10%~20%的骨髓瘤患者肿瘤浆细胞CD45的表达为弱阳性或阳性[10]。因此,采用CD45阴性细胞分选技术处理后CD45阳性的肿瘤浆细胞被红细胞交联、沉积,导致极少部分患者红细胞层中富集较多的浆细胞,分选后的浆细胞比例反而低于直接检测组从而影响分选的效果。另外,我们从形态上发现这4例患者骨髓中主要为成熟浆细胞,瘤样变原幼浆细胞少见,提示CD45阴性细胞分选可能对肿瘤样原幼浆细胞的富集更有优势,但仍需要进一步累积病例以明确二者相关性。
CD138免疫磁珠阳性分选后浆细胞比例理论上可达90%以上,虽然新型CD45阴性细胞分选技术达不到该效果,但有研究表明当骨髓标本中浆细胞比例超过10%~20%时, 直接FISH检测和CD138免疫磁珠分选后检测的结果无统计学差异[2],有研究认为20%可能是FISH出现假阴性结果的分界点[11-12]。本研究中超过80%的患者分选后骨髓标本中浆细胞比例大于20%,很大程度降低了假阴性结果的出现。本研究分选后FISH总检出率达到65.0%,接近研究报道的CD138免疫磁珠分选后FISH异常检出率80.0%左右的水平[11-13]。虽然新型CD45阴性细胞分选技术不可避免地去除了CD45阳性的异常浆细胞,但这部分细胞在患者中的比例较低,有研究显示CD45阴性异常浆细胞在骨髓瘤晚期患者中比例更高,与骨病和高密度血管新生相关,而且CD45阴性异常浆细胞占主导的患者总体生存率低于CD45阳性异常浆细胞为主的患者。因此,新型CD45阴性细胞分选技术可能对高危的多发性骨髓瘤患者的识别有一定的意义,而本研究也显示分选后高危患者的比例从28.3%增加到53.3%,对于危险度分层改变的患者根据指南可给予更积极的治疗方案,有利于改善患者的预后。
免疫磁珠分选的方法分离细胞纯度高,但对样本量要求较高至少4mL以上,需要专门的设备、耗材,分选时间约数小时,成本较高;而新型CD45阴性细胞分选技术虽然分离细胞纯度中等,但样本量仅需1~2 mL,分选时间仅30 min且成本较低,操作简单,适合在我国基层医院推广。
综上,新型CD45阴性细胞分选技术简单易行,提高骨髓瘤细胞遗传学异常检出率,准确进行危险度分层以指导治疗,可以推广至基层医院。但因为骨髓中幼稚红细胞CD45的表达也为阴性,所以未来该技术还可以考虑通过加入其他RosetteSepTM抗体等方法进一步优化。
| [1] |
SONNEVELD P, AVET-LOISEAU H, LONIAL S, et al. Treatment of multiple myeloma with high-risk cytogenetics: a consensus of the International Myeloma Working Group[J]. Blood, 2016, 127(24): 2955-2962. DOI:10.1182/blood-2016-01-631200 |
| [2] |
安刚, 李承文, 李倩, 等. 免疫磁珠分选对荧光原位杂交检测多发性骨髓瘤细胞遗传学异常的影响[J]. 中国实验血液学杂志, 2011, 19(1): 54-58. AN G, LI C W, LI Q, et al. Influence of immunomagnetic sorting on detecting genetic aberration of multiple myeloma cells by interphase fluorescence in situ hybridization[J]. J Exp Hematol, 2011, 19(1): 54-58. |
| [3] |
FONSECA R, BERGSAGEL P L, DRACH J, et al. International Myeloma Working Group molecular classification of multiple myeloma: spotlight review[J]. Leukemia, 2009, 23(12): 2210-2221. DOI:10.1038/leu.2009.174 |
| [4] |
GONSALVES W I, TIMM M M, RAJKUMAR S V, et al. Influence of immunomagnetic sorting on detecting genetic aberration of multiple myeloma cells by interphase fluorescence in situ hybridization[J]. J Exp Hematol, 2016, 44: 32-39. DOI:10.1016/j.leukres.2016.03.003. |
| [5] |
KALLERGI G, POLITAKI E, ALKAHTANI S, et al. Evaluation of isolation methods for circulating tumor cells (CTCs)[J]. Cell Physiol Biochem, 2016, 40(3/4): 411-419. DOI:10.1159/000452556 |
| [6] |
WANG G K, BENASUTTI H, JONES J F, et al. Isolation of Breast cancer CTCs with multitargeted buoyant immunomicrobubbles[J]. Colloids Surf B Biointerfaces, 2018, 161: 200-209. DOI:10.1016/j.colsurfb.2017.10.060 |
| [7] |
D’AGOSTINO M, BERTAMINI L, OLIVA S, et al. Pursuing a curative approach in multiple myeloma: a review of new therapeutic strategies[J]. Cancers (Basel), 2019, 11(12). DOI:10.3390/cancers11122015 |
| [8] |
MINA R, BONELLO F, PETRUCCI M T, et al. Carfilzomib, cyclophosphamide and dexamethasone for newly diagnosed, high-risk myeloma patients not eligible for transplant: a pooled analysis of two studies[J]. Haematologica, 2020. DOI:10.3324/haematol.2019.243428 |
| [9] |
LI X Z, CHEN W M, WU Y, et al. 1q21 gain combined with high-risk factors is a heterogeneous prognostic factor in newly diagnosed multiple myeloma: a multicenter study in China[J]. Oncologist, 2019, 24(11). DOI:10.1634/theoncologist.2019-0132 |
| [10] |
FLORES-MONTERO J, DE TUTE R, PAIVA B, et al. Immunophenotype of normal vs[J]. Toward antibody panel specifications for MRD detection in multiple myeloma, 2016, 90(1): 61-72. DOI:10.1002/cyto.b.21265 |
| [11] |
高露, 刘清, 师岩, 等. 应用 CD138 免疫磁珠分选结合荧光原位杂交技术检测多发性骨髓瘤细胞遗传学异常[J]. 中国实验血液学杂志, 2017, 25(3): 807-812. GAO L, LIU Q, SHI Y, et al. Immunophenotype of normal vs[J]. Toward antibody panel specifications for MRD detection in multiple myeloma, 2017, 25(3): 807-812. DOI:10.7534/j.issn.1009-2137.2017.03.031. |
| [12] |
LAI Y Y, HUANG X J, CAI Z, et al. Prognostic power of abnormal cytogenetics for multiple myeloma: a multicenter study in China[J]. Chin Med J, 2012, 125(15): 2663-2670. |
| [13] |
吴昊, 张慧, 何海燕, 等. 532 例多发性骨髓瘤患者细胞遗传学异常及对预后的影响[J]. 中华血液学杂志, 2005, 19(9): 739-743. WU H, ZHANG H, HE H Y, et al. Immunophenotype of normal vs[J]. Toward antibody panel specifications for MRD detection in multiple myeloma, 2005, 19(8): 1466-1470. DOI:10.3760/cma.j.issn.0253-2727.2017.09.002. |
| [14] |
KUMAR S, RAJKUMAR S V, KIMLINGER T, 等. CD45 expression by bone marrow plasma cells in multiple myeloma: clinical and biological correlations[J]. Leukemia, 2005, 19(8): 1466-1470. DOI:10.1038/sj.leu.2403823. |



