宫颈癌是目前严重威胁妇女健康的恶性肿瘤。高危型人乳头瘤病毒感染(high risk human papillomavirus infection, HR-HPV)持续感染是宫颈癌及癌前病变的致病因素[1]。理想的宫颈癌筛查需权衡利弊, 准确检出并干预具有发展潜能的癌前病变, 同时最大化减少筛查带来的危害。癌症预防中心负责人CUZICK等[2]建议增加HPV基因分型进行宫颈筛查, 并在增加更精细的基因分型基础上, 将病毒载量作为分子标记物引入HPV检测分流管理中。2017年的欧洲生殖道感染和肿瘤研究协会(EUROGIN)会议上也提出把病毒载量作为一个重要的因素, 对筛查方案进行补充。
HPV型别和感染持续时间是宫颈病变发生、发展的两个关键因素, 然而HPV病毒载量对疾病转归的影响存在争议[3]。以往HPV载量的研究在未甄别HPV型别的情况下, 对HR-HPV的总载量进行测定, 不能将标本中的宫颈脱落细胞进行标准化计数, 其病毒载量缺乏准确性。
目前HPV标准化定量与宫颈病变的相关性成为新的研究热点[4]。在HPV分型基础上进行定量检测对宫颈病变的预测价值得以实现[5]。但病毒载量和宫颈病变的相关性研究主要集中在HPV16型和HPV18型, 其他型别HPV病毒载量与宫颈病变的风险关系尚不肯定[6-7]。
本研究采用同步HPV分型及标准化定量检测, 对13种HR-HPV病毒进行标准化定量, 明确13种HR-HPV标准化定量与感染转归的关系, 建立特异型别HR-HPV标准化定量预测感染转归的最佳阈值, 为宫颈癌筛查方案的进一步完善提供依据。
1 资料与方法 1.1 研究对象收集2017年1月至2018年1月在重庆市妇幼保健院妇科门诊接受宫颈癌筛查的21~65岁女性共15 840例, 单一型别HR-HPV初次阳性、液基细胞学(thinprep cytologic test, TCT)阴性, 阴道镜评估无异常, 共2 870例, 失访86例, 实际符合要求2 784例, 年龄(36.76±10.20)岁。纳入标准:①21~65岁有性生活的妇女; ②初次单一型别HR-HPV阳性; ③有完整的子宫颈; ④HPV感染未予药物干预; ⑤目前处于非妊娠期; ⑥2年内无妊娠计划。排除标准:①有宫颈手术史; ②有宫颈癌或癌前病变史; ③有生殖道感染; ④有全子宫切除史; ⑤有自身免疫性疾病及口服免疫抑制剂史; ⑥有吸烟史; ⑦有恶性肿瘤病史。采取封闭式问卷建档信息资料:包括基本信息、月经史、婚育史、避孕史、既往史、家族史、性行为等。本研究遵循的程序符合重庆市妇幼保健院医学伦理委员会制定的伦理学标准, 并得到该伦理委员会审查(伦理审查编号:L2017055), 与调查对象均签署临床研究知情同意书。
1.2 方法 1.2.1 同步HPV分型及标准化定量检测我院检验科采用中国国家食品药品监督管理总局(CFDA)2015年批准的硕世诊断公司的HPV检测试剂盒, 该检测方法率先实现了同步HPV分型及标准化定量检测的突破。使用特制取样器于宫颈鳞、柱交界部位刷取宫颈脱落细胞。采用多重荧光PCR定量技术, 可在2.5 h内快速、准确地区分检验标本中21种HPV基因亚型, 包括13种HR-HPV16、18、31、33、35、39、45、51、52、56、58、59、68型, 5种中危型HPV36、53、66、73、82型和3种低危型HPV6、11、81型, 并同步对21种HPV亚型病毒载量进行标准化定量。采用定量扩增检测宫颈脱落细胞内含的单拷贝基因(TOP3), 测算宫颈脱落细胞的数量, 并报告同等宫颈脱落细胞数量(10 000个细胞)中的HPV病毒载量, 从而实现标准化定量[8]。
1.2.2 宫颈细胞学检查由我院病理科医师采用液基超薄细胞学技术(TCT)制片、阅片及诊断。诊断标准采用2001版TBS细胞学诊断标准。
1.2.3 阴道镜检查由我院宫颈疾病诊治中心的阴道镜医师对女性下生殖道病变进行阴道镜检查、全面评估、规范化诊治。阴道镜检查的标准程序及要求按照2017年美国阴道镜检查和宫颈病理学会(American Society for Colposcopy and Cervical Pathology, ASCCP)阴道镜标准[9-10], 阴道镜报告采用2011年最新阴道镜术语[11]。
1.2.4 组织病理检查有宫颈活检指征者进行组织病理学检查。由我院病理科医师诊断。病理学结果分为宫颈炎症、宫颈上皮内瘤变(cervical intraepithelial neoplasia, CIN)、阴道上皮内瘤变(vaginal intraepithelial neoplasia, VAIN)、外阴上皮内瘤变(vulvar intraepithelial neoplasia, VIN)、宫颈原位腺癌(adenocarcinoms in situ of the cervical, AIS)、宫颈浸润癌(cervical cancer, CC)。
1.3 随访质控 1.3.1 诊断误差诊断和处理采用规范统一标准; 阴道镜检查、细胞学、病理学及实验室报告要求定期高级职称医师复核, 定期质控。
1.3.2 研究对象失访指定专职随访监控人员, 定期追踪研究对象, 严格控制失访率。本研究入组共2 870例, 失访86例, 失访率仅为3.00%。
1.3.3 研究资料收集指定专人定期及时录入随访资料及实验室数据, 定期监测质控。
1.4 随访方案对单一型别HR-HPV初次阳性、TCT阴性女性进行跟踪随访, 随访间隔半年, 随访期间不予药物治疗, 共随访2年。若随访过程中细胞学、阴道镜及组织学异常按子宫颈癌综合防控指南及专家共识进行规范化处理[12-14]。
1.5 HR-HPV感染转归判断标准自然清除:HR-HPV连续2次阴性; 持续感染:同一型别HR-HPV阳性持续1年以上, 细胞学及阴道镜结果无异常; 进展:同一型别HR-HPV阳性, 宫颈活检异常。共收集完整病例2 784例。具体随访流程见图 1。
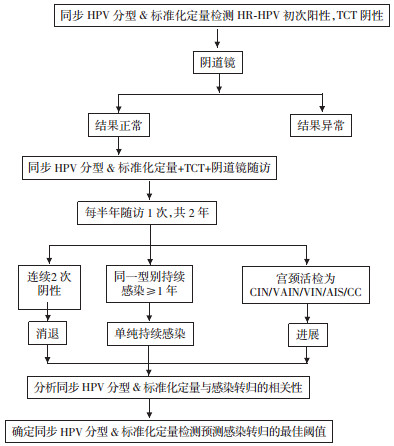
|
| 图 1 同步HPV分型 & 标准化定量检测随访流程图 |
1.6 统计学分析
采用SPSS 18.0统计软件进行分析。Log10转化的每10 000个细胞中的HPV病毒拷贝数认定为特定型别HR-HPV的病毒标准化定量。HR-HPV标准化定量呈非正态分布, 采用中位数M(P25, P75)描述, 组间比较采用Kruskal-Wallis秩和检验。通过受试者工作特征(ROC)曲线计算出不同型别HR-HPV的标准化定量预测HR-HPV感染转归的最佳阈值, 并计算灵敏度和特异性。检验水准α=0.05。
2 结果 2.1 随访对象的基线基本特征2 784例单一型HR-HPV感染女性跟踪随访2年, 随访对象的基线基本特征见表 1。
| 基线基本特征 | 例数 | 构成比(%) |
| 年龄/岁 | ||
| <40 | 1 832 | 65.80 |
| ≥40 | 952 | 34.20 |
| 孕次/次 | ||
| <3 | 1 492 | 53.59 |
| ≥3 | 1 292 | 46.41 |
| 初次性生活年龄/岁 | ||
| <20 | 467 | 16.77 |
| ≥20 | 2 317 | 83.23 |
| 性伴数量/个 | ||
| <3 | 1 915 | 68.79 |
| ≥3 | 869 | 31.21 |
| 使用避孕套 | ||
| 是 | 733 | 26.33 |
| 否 | 2 051 | 73.67 |
2.2 不同型别HR-HPV感染的自然转归规律
2 784例单一型HR-HPV感染女性在为期2年的随访中, 自然消退为73.71%, 持续感染率为20.26%, 进展率为6.03%, 进展率由高到低依次为HPV16、58、18、52、33、51、31、59、39、68、56、45、35型。2年的随访中共168例进展, 其中CIN 145例, VAIN 4例, VIN 3例, AIS 1例, CC 14例, CIN+VAIN 1例, CIN+VIN 1例, 见表 2。
| 型别 | 例数 | 自然消退 | 持续感染 | 进展 |
| 16型 | 534 | 366(68.54) | 124(23.22) | 44(8.24) |
| 18型 | 195 | 145(74.36) | 37(18.97) | 13(6.67) |
| 31型 | 129 | 94(72.87) | 28(21.71) | 7(5.43) |
| 33型 | 174 | 132(75.86) | 31(17.82) | 11(6.32) |
| 35型 | 40 | 33(82.50) | 7(17.50) | 0(0.00) |
| 39型 | 163 | 133(81.60) | 24(14.72) | 6(3.68) |
| 45型 | 41 | 32(78.05) | 8(19.51) | 1(2.44) |
| 51型 | 146 | 123(84.25) | 15(10.27) | 8(5.48) |
| 52型 | 687 | 472(68.70) | 170(24.75) | 45(6.55) |
| 56型 | 105 | 89(84.76) | 13(12.38) | 3(2.86) |
| 58型 | 304 | 207(68.09) | 76(25.00) | 21(6.90) |
| 59型 | 132 | 109(82.58) | 18(13.64) | 5(3.79) |
| 68型 | 134 | 117(87.31) | 13(9.70) | 4(2.99) |
| 合计 | 2 784 | 2 052(73.71) | 564(20.26) | 168(6.03) |
2.3 HR-HPV标准化定量与感染转归的关系
根据感染转归结果分为自然消退组2 052例、持续感染组564例、进展组168例, 选择首次调查时初始HR-HPV标准化定量在HPV自然消退、持续感染、进展中进行比较。除45型外, 不同型别HR-HPV标准化定量在3组间比较差异均有统计学意义(P<0.05), 多数型别中持续感染组与自然消退组比较有差异, 进展组与自然消退组比较有差异, 但进展组与持续感染组比较差异无统计学意义(P>0.05, 表 3)。
| 型别 | Log10转化的每10 000个细胞中的HPV病毒拷贝数[M(P25, P75)] | H | P | ||
| 自然消退 | 持续感染 | 进展 | |||
| HPV16型 | 3.00(2.00, 4.00) | 4.00(4.00, 5.00)a | 5.00(4.00, 5.00)a | 206.712 | <0.001 |
| HPV18型 | 3.00(2.00, 4.00) | 5.00(4.00, 5.00)a | 4.00(2.50, 6.00)a | 31.605 | <0.001 |
| HPV31型 | 4.00(3.00, 4.00) | 5.00(3.00, 6.00)a | 5.00(4.00, 7.00)a | 16.764 | <0.001 |
| HPV33型 | 3.00(2.00, 4.00) | 4.00(4.00, 5.00)a | 5.00(5.00, 6.00)a | 28.187 | <0.001 |
| HPV35型 | 4.00(2.00, 4.00) | 5.00(4.00, 6.00)a | - | 7.935 | 0.005 |
| HPV39型 | 3.00(2.00, 4.00) | 5.00(4.00, 6.00)a | 5.50(4.00, 6.00)a | 39.345 | <0.001 |
| HPV45型 | 2.50(2.00, 3.75) | 2.50(2.00, 3.75) | 3.00(3.00, 3.00) | 0.224 | 0.894 |
| HPV51型 | 4.00(3.00, 4.00) | 5.00(4.00, 6.00)a | 5.50(5.00, 6.00)a | 28.087 | <0.001 |
| HPV52型 | 3.00(2.00, 4.00) | 5.00(4.00, 5.00)a | 5.00(4.00, 6.00)a | 215.611 | <0.001 |
| HPV56型 | 3.00(2.00, 4.00) | 5.00(4.00, 6.00)a | 6.00(6.00, -)a | 23.682 | <0.001 |
| HPV58型 | 3.00(2.00, 4.00) | 5.00(4.00, 5.75)a | 5.00(4.00, 6.00)a | 123.340 | <0.001 |
| HPV59型 | 4.00(3.00, 5.00) | 4.50(4.00, 5.25) | 6.00(5.00, 7.00)a | 11.674 | 0.003 |
| HPV68型 | 3.00(2.00, 4.00) | 4.00(3.00, 4.00) | 5.00(5.00, 5.75)a | 12.189 | 0.002 |
| 13种HR-HPV | 3.00(2.00, 4.00) | 5.00(4.00, 5.00)a | 5.00(4.00, 6.00)ab | 673.943 | <0.001 |
| a:P<0.05, 与自然消退组比较; b:P<0.05, 与持续感染组比较 | |||||
2.4 不同型别HR-HPV标准化定量预测HPV持续感染最佳阈值的确立
多数型别中持续感染组与自然消退组, 进展组与自然消退组比较差异有统计学意义, 但进展组与持续感染组比较差异无统计学意义。以自然消退组为阴性, 以持续感染组与进展组合并为阳性, 绘制不同型别初始HR-HPV标准化定量预测HPV持续感染的ROC曲线, 其中HPV35、45型检出总例数 < 100, 未纳入计算。根据ROC曲线分析预测HPV16、18、33、52、58、59、68型持续感染的最佳阈值为3.00拷贝数/10 000个细胞(Log10转化); 预测HPV31、39、51、56型持续感染最佳阈值为4.00拷贝数/10 000个细胞(Log10转化); 预测13种HR-HPV持续感染的最佳阈值为3.00拷贝数/10 000个细胞(Log10转化), 见表 4。
| 型别 | Log10转化的每10 000个细胞中的HPV病毒拷贝数 | P | ||||
| Cutoff值 | 敏感度(%) | 特异度(%) | AUC | 95%CI | ||
| HPV16型 | 3.00 | 92.26 | 65.57 | 0.874 | 0.844~0.904 | <0.001 |
| HPV18型 | 3.00 | 78.00 | 60.00 | 0.758 | 0.677~0.838 | <0.001 |
| HPV31型 | 4.00 | 57.14 | 79.79 | 0.712 | 0.601~0.823 | <0.001 |
| HPV33型 | 3.00 | 90.48 | 59.09 | 0.751 | 0.679~0.822 | <0.001 |
| HPV39型 | 4.00 | 70.00 | 83.46 | 0.859 | 0.791~0.926 | <0.001 |
| HPV51型 | 4.00 | 73.91 | 82.93 | 0.826 | 0.728~0.923 | <0.001 |
| HPV52型 | 3.00 | 92.09 | 62.71 | 0.839 | 0.810~0.868 | <0.001 |
| HPV56型 | 4.00 | 75.00 | 82.02 | 0.867 | 0.760~0.975 | <0.001 |
| HPV58型 | 3.00 | 93.81 | 66.67 | 0.884 | 0.847~0.921 | <0.001 |
| HPV59型 | 3.00 | 86.96 | 39.45 | 0.689 | 0.578~0.801 | 0.004 |
| HPV68型 | 3.00 | 75.00 | 63.10 | 0.738 | 0.636~0.841 | 0.002 |
| 13种HR-HPV | 3.00 | 88.66 | 59.36 | 0.812 | 0.792~0.827 | <0.001 |
3 讨论
HPV载量在筛查风险分层、预测病情变化及治疗后随访监测判断预后有着重要的应用前景。为准确解释不同型别载量与感染转归的相关性, 避免多重感染交叉影响, 本研究只把单一型别感染纳入研究对象, 在HPV分型检测的基础上进行不同型别的标准化定量, 根据初始病毒载量绘制ROC曲线确立同步HPV分型及标准化定量预测HR-HPV持续感染的最佳阈值。
本研究对2 784例单一型别HR-HPV感染女性进行了2年的跟踪随访, 总体人群自然消退为73.71%(2 052/2 784), 持续感染率为20.26%(564/2 784), 进展率为6.03%(168/2 784), 宫颈癌进展率为0.50%(14/2 784)。张倩等[15]研究760例西安女性HR-HPV自然清除率为71.58%, 持续感染率为22.63%, 进展率为5.79%, 宫颈癌进展率为0.79%。本研究与国内学者的报道相似。本研究中HPV进展率由高到低依次为16、58、18、52、33、51、31、59、39、68、56、45、35型。由此可见, 除16型和18型以外, 其他型别也在宫颈病变的发生、发展中发挥着重要作用。未来的筛查模式应该增加更精细的基因分型, 并且在基因分型水平上, 将病毒载量作为分子标记物引入分流管理中。
为明确HPV载量与感染转归的关系, 本研究采用多重荧光PCR定量技术, 通过测定宫颈脱落细胞内独特的单拷贝基因, 可采集细胞总数量, 通过计算单位数量宫颈脱落细胞中HPV-DNA拷贝数, 最终获得同等细胞数量中不同HPV型别的病毒载量, 实现同步HPV分型及标准化定量, 避免了取样标本中细胞数量多寡造成的偏差。本研究逐一分析了不同型别HR-HPV初始载量与感染转归的关系。HPV16型高载量已有大量数据支撑, 认为是持续感染的重要标志。TREVISAN等[16]研究HPV16型感染清除情况与载量的关系, 结果显示在随访7年中HPV16型病毒初始载量越高, 病毒感染持续时间越长。CARCOPINO等[17]的研究发现, HPV16型病毒载量在病毒清除组与病毒持续感染组差异有统计学意义(P=0.006)。本研究发现除HPV16型以外, 病毒载量在HPV18、31、33、39、51、52、56、58型持续感染组同样明显高于自然消退组(P<0.001)。以上研究显示了病毒载量作为一项特异性生物学指标用于预测疾病转归的前景[18-19]。
本研究中不同HR-HPV型别在病变进展中呈现出不同的相关趋势。HPV45型是易于导致宫颈腺上皮病变的型别, 其载量与感染转归差异无统计学意义(P=0.894)。HPV18型与宫颈腺上皮病变关系密切, 其载量与腺上皮病变级别的相关性也存在争议[20]。SUN等[8]的研究提示HPVl6、31、33、52型的病毒载量与宫颈癌前病变风险呈正相关; 文献[21]报道病毒载量与宫颈癌前病变的风险在HPVA9组中(HPV31、33、35、52、58型)呈正相关, 而在HPVA7组中(HPV39、45、59型)则无相关性。一项横断面研究也提示HPV16型及HPV16协同其他型别的混合感染病毒载量与宫颈病变等级呈线性相关, 而HPV18型病毒载量在癌前病变组与正常组比较呈下降趋势, 在宫颈癌组中又上升[22]。HPV病毒载量是具有型别依耐性的风险标记物[23]。
本研究绘制了不同型别HPV标准化定量预测HPV持续感染的ROC曲线, 通过曲线分析确立HPV标准化定量预测HR-HPV持续感染的最佳阈值。本研究中病毒标准化定量预测HPV16、18、33、52、58、59、68型持续感染的最佳阈值为3.00拷贝数/10 000个细胞(Log10转化); 预测HPV31、39、51、56型持续感染最佳阈值为4.00拷贝数/10 000个细胞(Log10转化); 预测13种HR-HPV持续感染的最佳阈值为3.00拷贝数/10 000个细胞(Log10转化), 敏感度为88.66%, 特异度为59.36%。本研究发现初始病毒载量最佳分界点为3.00~4.00拷贝数/10 000个细胞, 即病毒载量低于3.00拷贝数/10 000个细胞, HPV感染易于自然消退, 而病毒载量高于4.00拷贝数/10 000个细胞, HPV感染易于持续感染或进展。根据本研究结果, 除HPV16型和18型直接转诊阴道镜, 其他常见高危型转诊阴道镜需结合病毒载量, 建议把病毒载量≥4.00拷贝数/10 000个细胞作为转诊阴道镜的界值, 根据不同型别的差异, 可设立不同的界值。DONG等[24]的研究发现HPV16、31、33、52、58型的病毒载量在识别≥高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion, HSIL)的最佳阈值分别为4.24、4.46、4.48、4.36、4.26拷贝数/10 000个细胞。北大深圳医院的研究[25]使用第2代杂交捕获实验(hybrid capture2, HC2)测定HPV病毒载量, 确定病毒载量与宫颈病变程度呈正相关, 以载量≥10RLU/CO为转诊阴道镜的界值。本研究采用的精准HPV分型及标准化定量方法弥补了以往未分型定量的不足, 发挥其最大临床价值。
本研究在HPV分型检测的基础上进行不同型别的标准化定量, 确定了预测HR-HPV感染转归的最佳阈值, 为建立更完备精准的基于HPV分型及定量检测的宫颈癌筛查分诊方案提供数据支持及理论依据。宫颈癌筛查分诊方案中依据最佳阈值的建立, 设定转诊阴道镜的界值, 可提高宫颈癌前病变的筛查效率, 同时避免过度检查和处理带来的潜在危害和卫生资源的浪费, 优化宫颈癌筛查策略。
本研究为精确计算特异型别HR-HPV病毒载量的预测阈值, 未把多重感染纳入研究计划, 多重感染与宫颈癌前病变关系密切, HPV多重感染占比可高达55.92%[26]。下生殖道多重HPV基因型之间存在协同作用[27], 多个型别间的相互影响使得HPV多重感染的病毒载量与宫颈病变的相关性成为研究的难点, 这将是我们下一步攻克的方向。
| [1] |
MOODY C A, LAIMINS L A. Human papillomavirus oncoproteins: pathways to transformation[J]. Nat Rev Cancer, 2010, 10(8): 550-560. DOI:10.1038/nrc2886 |
| [2] |
CUZICK J, WHEELER C. Need for expanded HPV genotyping for cervical screening[J]. Papillomavirus Res, 2016, 2: 112-115. DOI:10.1016/j.pvr.2016.05.004 |
| [3] |
US Preventive Services Task Force, CURRY S J, KRIST A H, et al. Screening for cervical cancer: US preventive services task force recommendation statement[J]. JAMA, 2018, 320(7): 674-686. DOI:10.1001/jama.2018.10897 |
| [4] |
王轶英, 王悦, 孔北华, 等. HPV定量检测的临床意义与研究进展[J]. 中华妇产科杂志, 2017, 52(8): 569-572. WANG Y Y, WANG Y, KONG B H, et al. Clinical significance and research progress of quantitative detection of HPV[J]. Chin J Obstet Gynecol, 2017, 52(8): 569-572. DOI:10.3760/cma.j.issn.0529-567x.2017.08.015 |
| [5] |
王晴, 张蓓, 印泽远, 等. HPV分型定量检测对宫颈病变的预测价值[J]. 现代妇产科进展, 2018, 27(5): 351-354, 358. WANG Q, ZHANG B, YIN Z Y, et al. The value of HPV genotyping and quantitative PCR testing in the prediction of cervical lesions[J]. Curr Adv Obstet Gynecol, 2018, 27(5): 351-354, 358. |
| [6] |
SEGONDY M, NGOU J, KELLY H, et al. Diagnostic value of human papillomavirus (HPV) 16 and HPV18 viral loads for the detection of high-grade cervical intraepithelial neoplasia (CIN2+) in a cohort of African women living with HIV[J]. J Clin Virol, 2018, 99/100: 79-83. DOI:10.1016/j.jcv.2018.01.006 |
| [7] |
MANAWAPAT-KLOPFER A, WANG L, HAEDICKE-JARBOUI J, et al. HPV16 viral load and physical state measurement as a potential immediate triage strategy for HR-HPV-infected women: a study in 644 women with single HPV16 infections[J]. Am J Cancer Res, 2018, 8(4): 715-722. |
| [8] |
SUN Z, ZHANG R, LIU Z, et al. Development of a fluorescence-based multiplex genotyping method for simultaneous determination of human papillomavirus infections and viral loads[J]. BMC Cancer, 2015, 15: 860. DOI:10.1186/s12885-015-1874-9 |
| [9] |
WRIGHT T C Jr. The new ASCCP colposcopy standards[J]. J Low Genit Tract Dis, 2017, 21(4): 215. DOI:10.1097/LGT.0000000000000337 |
| [10] |
WENTZENSEN N, MASSAD L S, MAYEAUX E J Jr, et al. Evidence-Based consensus recommendations for colposcopy practice for cervical cancer prevention in the united states[J]. J Low Genit Tract Dis, 2017, 21(4): 216-222. DOI:10.1097/LGT.0000000000000322 |
| [11] |
BORNSTEIN J, BENTLEY J, BÖSZE P, et al. 2011 colposcopic terminology of the international federation for cervical pathology and colposcopy[J]. Obstet Gynecol, 2012, 120(1): 166-172. |
| [12] |
中华预防医学会妇女保健分会. 子宫颈癌综合防控指南[M]. 北京: 人民卫生出版社, 2017: 8. Chinese Preventive Medicine Association. Guidelines for comprehensive prevention and control of cervical cancer[M]. Beijing: People's Medical Publishing House, 2017: 8. |
| [13] |
魏丽惠, 赵昀, 沈丹华, 等. 中国子宫颈癌筛查及异常管理相关问题专家共识(一)[J]. 中国妇产科临床杂志, 2017, 18(2): 190-192. WEI L H, ZHAO Y, SHEN D H, et al. Expert consensus on cervical cancer screening and abnormal management in China(1)[J]. Chin J Clin Obstet Gynecol, 2017, 18(2): 190-192. DOI:10.13390/j.issn.1672-1861.2017.02.032 |
| [14] |
魏丽惠, 沈丹华, 赵方辉, 等. 中国子宫颈癌筛查及异常管理相关问题专家共识(二)[J]. 中国妇产科临床杂志, 2017, 18(3): 286-288. WEI L H, SHEN D H, ZHAO F H, et al. Expert consensus on cervical cancer screening and abnormal management in China(2)[J]. Chin J Clin Obstet Gynecol, 2017, 18(3): 286-288. DOI:10.13390/j.issn.1672-1861.2017.03.041 |
| [15] |
张倩, 曹頔, 马茜, 等. 760名女性生殖道高危型人乳头瘤病毒感染自然转归规律及影响因素[J]. 中国医学科学院学报, 2015, 37(5): 534-540. ZHANG Q, CAO D, MA Q, et al. Natural outcome of genital tract high-risk human papillomavirus infection and associated factors among 760 women[J]. Acta Acad Med Sin, 2015, 37(5): 534-540. DOI:10.3881/j.issn.1000-503X.2015.05.008 |
| [16] |
TREVISAN A, SCHLECHT N F, RAMANAKUMAR A V, et al. Human papillomavirus type 16 viral load measurement as a predictor of infection clearance[J]. J Gen Virol, 2013, 94(Pt 8): 1850-1857. DOI:10.1099/vir.0.051722-0 |
| [17] |
CARCOPINO X, HENRY M, MANCINI J, et al. Two years outcome of women infected with high risk HPV having normal colposcopy following low-grade or equivocal cytological abnormalities: are HPV16 and 18 viral load clinically useful predictive markers?[J]. J Med Virol, 2012, 84(6): 964-972. DOI:10.1002/jmv.23276 |
| [18] |
DEL RÍO-OSPINA L, SOTO-DE LEÓN S C, CAMARGO M, et al. The DNA load of six high-risk human papillomavirus types and its association with cervical lesions[J]. BMC Cancer, 2015, 15: 100. DOI:10.1186/s12885-015-1126-z |
| [19] |
SOTO-DE LEÓN S C, DEL RÍO-OSPINA L, CAMARGO M, et al. Persistence, clearance and reinfection regarding six high risk human papillomavirus types in Colombian women: a follow-up study[J]. BMC Infect Dis, 2014, 14: 395. DOI:10.1186/1471-2334-14-395 |
| [20] |
SHEN G Q, CHENG J X, WANG Y, et al. Viral DNA load of high-risk human papilloma virus is closely associated with the grade of cervical lesions[J]. Int J Clin Exp Med, 2014, 7(12): 5826-5831. |
| [21] |
XI L F, SCHIFFMAN M, KE Y, et al. Type-dependent association between risk of cervical intraepithelial neoplasia and viral load of oncogenic human papillomavirus types other than types 16 and 18[J]. Int J Cancer, 2017, 140(8): 1747-1756. DOI:10.1002/ijc.30594 |
| [22] |
WU Z N, QIN Y, YU L L, et al. Association between human papillomavirus (HPV) 16, HPV18, and other HR-HPV viral load and the histological classification of cervical lesions: Results from a large-scale cross-sectional study[J]. J Med Virol, 2017, 89(3): 535-541. DOI:10.1002/jmv.24645 |
| [23] |
BROCCOLO F, CHIARI S, PIANA A, et al. Prevalence and viral load of oncogenic human papillomavirus types associated with cervical carcinoma in a population of North Italy[J]. J Med Virol, 2009, 81(2): 278-287. DOI:10.1002/jmv.21395 |
| [24] |
DONG B H, SUN P M, RUAN G Y, et al. Type-specific high-risk human papillomavirus viral load as a viable triage Indicator for high-grade squamous intraepithelial lesion: a nested case- control study[J]. Cancer Manag Res, 2018, 10: 4839-4851. DOI:10.2147/CMAR.S179724 |
| [25] |
LUO H X, BELINSON J L, DU H, et al. Evaluation of viral load as a triage strategy with primary high-risk human papillomavirus cervical cancer screening[J]. J Low Genit Tract Dis, 2017, 21(1): 12-16. DOI:10.1097/LGT.0000000000000277 |
| [26] |
龙馨, 周德平, 杨君, 等. 重庆地区29580例女性人乳头瘤病毒感染分布特点分析[J]. 实用妇产科杂志, 2016, 32(6): 464-467. LONG X, ZHOU D P, YANG J, et al. Analysis of the distribution characteristics of human papilloma virus infection among 29580 females in Chongqing area[J]. J Pract Obstet Gynecol, 2016, 32(6): 464-467. |
| [27] |
HAJIA M, SOHRABI A. Possible synergistic interactions among multiple HPV genotypes in women suffering from genital neoplasia[J]. Asian Pac J Cancer Prev, 2018, 19(3): 785-789. DOI:10.22034/APJCP.2018.19.3.785 |



