2. 400016 重庆,重庆医科大学基础医学院人体解剖学教研室
2. Department of Human Anatomy, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
脑出血(intracerebral hemorrhage,ICH)是指脑组织的自发性出血,占所有脑血管意外的15%~20%,具有较高的发病率和死亡率[1]。越来越多的证据表明,氧化应激和神经元凋亡在ICH后继发性脑损伤(secondary brain injury, SBI)的病理生理过程中起着关键作用,尽管促成SBI的确切机制仍然不明[2]。因此,抑制氧化应激和细胞凋亡可能是减轻SBI的有效方法。
Nle4-D-Phe7-α-MSH(NDP-MSH)作为与天然α-MSH分子发挥相似作用的非特异性黑皮质素受体激动剂,对局部和全身宿主反应发挥调节作用,包括抗凋亡和保护神经功能[3-4]。NDP-MSH通过结合不同的黑皮质素受体(Mc1r~Mc5r)在中枢神经系统中发挥抗炎、抗凋亡等神经保护作用[5]。黑色素3受体(Mc3r)是一种G蛋白偶联受体,研究表明NDP-MSH对Mc3r具有高特异性亲和力[6]。蛛网膜下腔出血后,NDP-MSH治疗可以起到抗凋亡和抗氧化应激的作用。此外,在成人多发性硬化症中,NDP-MSH被证实能通过激活Mc3r和Mc4r保护星形胶质细胞并减少细胞凋亡[7]。迄今为止,已经确定NDP-MSH可以减轻小鼠ICH后的神经炎症和血脑屏障(blood brain barrier, BBB)破坏并改善神经功能[8]。但是,关于NDP-MSH和Mc3r对ICH后氧化应激反应和神经元凋亡的影响知之甚少。先前的研究表明,Mc3r与HEK293细胞中的PKC途径相互作用[8]。在大鼠局灶性脑出血中,证据表明PKC途径通过激活ERK 1/2信号通路参与了对神经元的神经保护作用[9-11]。此外,越来越多的证据表明,PKC可以调节ERK 1/2的转录活性从而减少细胞凋亡[12-13]。
本研究假设NDP-MSH激活Mc3r可以减少小鼠脑出血后的氧化应激反应和神经元细胞凋亡,通过自体血注射法建立小鼠ICH模型,探讨NDP-MSH的神经保护作用及其可能的机制,旨在为脑出血临床研究寻找新的治疗方法。
1 材料与方法 1.1 实验动物与材料从重庆医科大学动物中心购买170只C57BL/6小鼠(雄性,25~30 g)。本研究中实验方案均得到重庆医科大学动物伦理委员会的批准,操作过程和处死方案均基于国际通用实验动物使用指南。Mc3r抗体、Neun抗体购自英国Abcam公司,PKC抗体、p-PKC抗体、ERK抗体、p-ERK1/2抗体、Bcl-2抗体、caspase-3抗体c-caspase-3抗体购自美国Cell signaling公司,PKC抑制剂Staurosporine购自美国Selleck公司,总蛋白提取试剂盒、BCA蛋白浓度测定试剂盒购自中国碧云天生物技术有限公司。
1.2 方法 1.2.1 小鼠脑出血模型建立和分组小鼠经戊巴比妥(40 mg/kg,腹膜内注射)深度麻醉后,取中央尾动脉中提取30 μL未抗凝的自体动脉血备用,俯卧位固定小鼠于脑立体定位仪,前卤右侧2 mm处钻1个直径约1 mm的孔。然后将自体血注入基底神经节(立体位置坐标:前部0.2 mm,前部右侧2.3 mm,深度3.5 mm)。首先,在2.8 mm的深度注入5 μL血液。5 min后,剩余的25 μL血液以3.5 mm的深度输送。注射后将针头再固定10 min,然后缓慢拔出,缝合头皮。170只小鼠按随机数字表法分为3组:Sham组、ICH组、ICH+NDP-MSH组。其中Sham组28只,在出血模型的相同部位注射等量无菌盐水;ICH组52只,按上述方法建立小鼠脑出血模型;ICH+NDP-MSH组90只,于ICH建模后1 h腹腔给予NDP-MSH治疗。Sham组和ICH组,每组4只小鼠后用于免疫染色,每张切片取同侧血肿周围脑组织显微镜观察(×400倍)。另外,每组6只小鼠用于神经功能评分和脑水肿检测,6只用于Western blot检测,其余每组6只用于酶联免疫吸附测定试剂盒检测。
1.2.2 侧脑室注射用戊巴比妥(40 mg/kg,腹膜内注射)深度麻醉小鼠,将其置于俯卧位的立体定向头架中。沿中心线作纵向切口并在前卤右侧1 mm处钻孔。根据制造商的说明,将Mc3r siRNA或Staurosporine溶解在无菌无核糖核酸的水中。将Mc3r siRNA或Staurosporine混合物(100 pmol/2 μL)以2.5 mm的深度送入同侧脑室。注射后将针头再留5 min后缓慢拔出。用骨蜡密封毛刺孔,用缝合线缝合切口。
1.2.3 神经学评分改良的Garcia评分和Beam balance评分用于评估ICH后24 h的神经行为功能。改良的Garcia评分包括6个子项:自发运动(0~3分),肢体对称(0~3分)、向前伸展(0~3分)、攀爬(1~3分)、身体本体感受(1~3分)和对触须的响应(1~3分),评分越低损伤越重。在Beam balance评分中,将小鼠放在木板上,测量小鼠在上面行走的时间(0~4分),评分越低损伤越重。
1.2.4 脑水含量的测定在深度麻醉下处死小鼠。立即将大脑切除,并迅速分为5个部分:同侧和对侧基底神经节,同侧和对侧皮质以及小脑。保留小脑作为内部对照。立即在电子分析天平上称量样品的质量以确定湿质量(wet weight,WW),然后在105 ℃下干燥72 h以确定干质量(dry weight,DW)。脑含水量=[(WW-DW)/WW]×100%。
1.2.5 组织学分析ICH后24 h,对小鼠进行深度麻醉并向体内灌注20 mL冷磷酸盐缓冲液(PBS,0.01 mol/L,pH=7.4),然后注射20 mL 4%多聚甲醛。快速收集整个大脑,然后在4%多聚甲醛中于4 ℃固定24 h。分别在10%、20%、30%的蔗糖溶液中固定24 h至大脑完全沉底。OCT化合物包埋并使用低温恒温器在-25 ℃切成10 μm厚的冠状切片,以进行双重免疫荧光分析。
1.2.6 免疫荧光染色将样本用0.01 mol/L PBS洗涤3次,每次10 min。然后在室温下免疫荧光封闭液孵育1 h后将样本以用抗NeuN和抗Mc3r共标,在4 ℃孵育过夜。第2天将样本用0.01 mol/L PBS洗涤3次,与荧光二抗在37 ℃温育1 h,DAPI染色5 min后封片。
1.2.7 氧化应激检测根据ELISA测试试剂盒的说明,将ICH后24 h小鼠脑血肿(基底神经节)周围的组织匀浆。检测丙二醛(MDA),过氧化氢酶(CAT)和超氧化物歧化酶(SOD)的表达。
1.2.8 Western blot分析断头取脑,收集血肿周围组织,提取总蛋白进行Western blot分析。将等量蛋白上样于10%SDS聚丙烯酰胺凝胶行,通过80 V恒压电泳分离蛋白质。250 mA恒定电流转膜至PVDF膜上,将膜在WB封闭液中于37 ℃封闭2 h,然后在4 ℃条件下一抗稀释液孵育过夜。一抗是抗Mc3r,抗PKC,抗磷酸化PKC,抗ERK1/2,抗磷酸化ERK1/2,抗Bcl-2,抗caspase-3,抗c-caspase-3,抗β-Tubulin。第2天在室温下用PBST洗涤PVDF膜,二抗37 ℃孵育1 h。ECL显影液曝光,用凝胶成像仪曝光分析条带。
1.3 统计学分析实验数据以x±s表示,并使用SigmaPlot 11.0和GraphPad Prism 6进行统计分析。多组均数比较采取单因素方差分析(one-way ANOVA), 两组均数比较采取t检验。检验水准:α=0.05。
2 结果 2.1 ICH后Mc3r表达增加与假手术组相比,Mc3r的表达增加,并在术后24 h达到高峰(P < 0.05, 图 1A、B)。与假手术组相比,ICH组的Mc3r(绿色)表达显著增加;同时,在假手术组和ICH组中,Mc3r在神经元中表达(图 1C)。
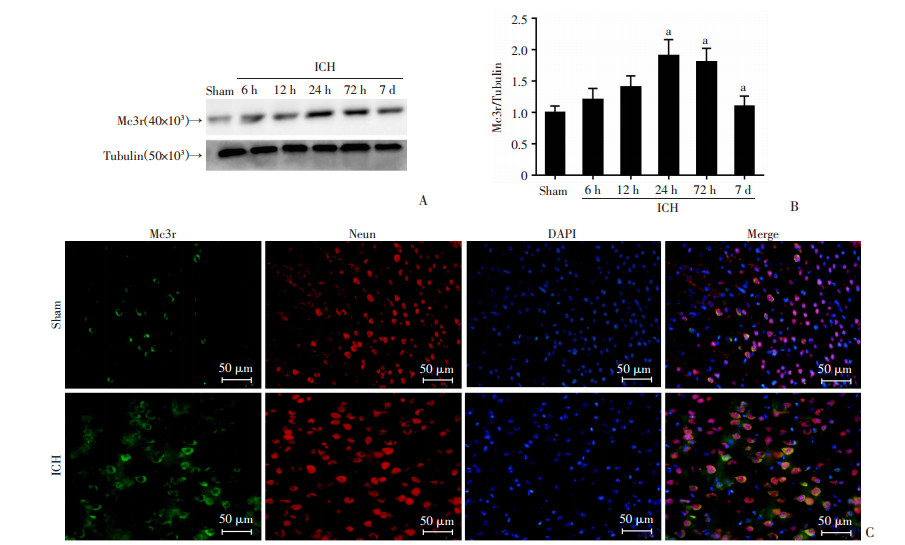
|
| A:Western blot检测ICH后不通时间点血肿组织中Mc3r表达;B:定量分析(x±s, n=6) a: P < 0.05, 与Sham组比较;C:双重免疫荧光染色观察ICH后24 h Mc3r与神经元(Neun)在小鼠脑血肿周围组织中共定位 图 1 小鼠脑出血后血肿周围组织中的Mc1r的表达 |
2.2 NDP-MSH可改善ICH后神经功能并减轻脑水肿和氧化应激反应
与Sham组相比,ICH组和ICH+1.5 μgNDP-MSH组在ICH后24 h的神经功能缺损和脑水肿明显恶化。然而,ICH+5 μgNDP-MSH和ICH +15 μgNDP-MSH的给药显著改善了神经功能障碍(P < 0.05,图 2A、B),减少了同侧基底神经节的脑水肿(P < 0.05,图 2C)。根据以上实验结果,NDP-MSH的最佳剂量为5 μg,用于后续的实验。ICH后24 h,与Sham组相比,ICH组MDA水平显著升高,CAT和SOD水平下降(P < 0.05,图 3A~C)。然而,与ICH组相比,使用NDP-MSH治疗显著降低了MDA水平,提高了CAT和SOD水平。
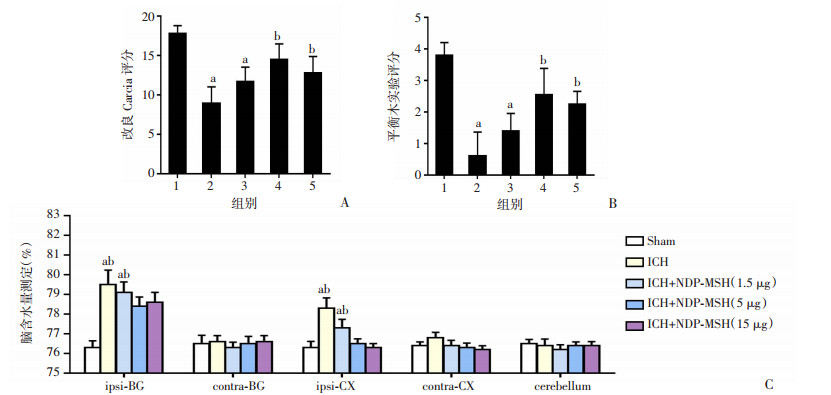
|
| 1: Sham; 2: ICH; 3: ICH+NDP-MSH(1.5 μg); 4: ICH+NDP-MSH(5 μg); 5: ICH+NDP-MSH(15 μg) A:小鼠ICH后24 h各组改良Garcia评分;B:ICH后24 h各组Beam balance评分;C: ICH后24 h各组脑水含量a: P < 0.05, 与Sham组比较; b: P < 0.05,与ICH+NDP-MSH (5 μg)组比较 图 2 NDP-MSH治疗后各组小鼠神经功能评分和脑含水量(x±s, n=6) |
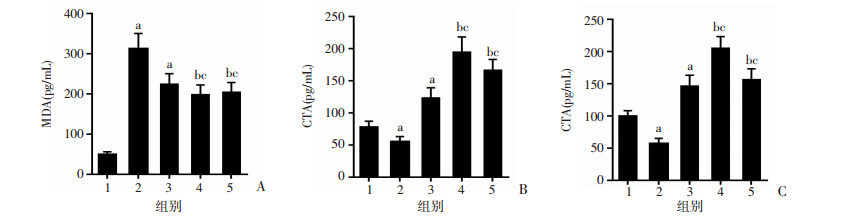
|
| 1: Sham; 2: ICH; 3: ICH+NDP-MSH(1.5 μg); 4: ICH+NDP-MSH(5 μg); 5: ICH+NDP-MSH(15 μg) A:小鼠ICH后24 h各组MDA含量;B:小鼠ICH后24 h各组CAT含量;C:小鼠ICH后24 h各组SOD含量a: P < 0.05, 与sham组比较; b: P < 0.05与ICH组比较; C: P < 0.05,与ICH+NDP-MSH(1.5 μg)组比较 图 3 小鼠脑出血后24 h各组血肿周围脑组织中氧化应激相关因子水平(n=6, x±s) |
2.3 Mc3r敲低对ICH后氧化应激反应和下游分子表达的影响
为了进一步研究NDP-MSH的保护作用,经侧脑室注射了Mc3r siRNA以抑制内源性Mc3r的表达。敲除Mc3r消除了NDP-MSH对ICH后氧化应激反应的保护作用(P < 0.05,表 1)。NDP-MSH治疗组与ICH组相比,p-PKC、p-ERK1/2、Bcl-2表达降低,c-caspase-3表达增加(P < 0.05)。相反,与ICH+NDP-MSH组相比,使用特异性siRNA敲除Mc3r后,下游信号分子PKC、ERK1/2、Bcl-2、caspase-3表达发生了相反的变化(P < 0.05, 图 4)。
| 指标 | Sham | ICH | ICH+NDP-MSH | ICH+NDP-MSH+Scr siRNA | ICH+NDP-MSH+Mc3r siRNA |
| MDA | 75.5±6.1 | 53.2±8.3a | 212.3±22.7bc | 185.2±18.5bc | 110.1±12.5 |
| CAT | 73.3±8.4 | 294.1±30.5a | 135.4±22.2bc | 143.8±19.1bc | 286.3±27.3 |
| SOD | 101.7±9.1 | 52.3±7.5a | 248.0±23.5bc | 187.4±20.6bc | 110.5±16.3 |
| Mc3r | 1.03±0.12 | 1.87±0.36a | 2.56±0.58bc | 2.48±0.54bc | 2.43±0.46 |
| p-PKC | 1.08±0.21 | 0.53±0.13a | 1.21±0.27bc | 1.17±0.23bc | 0.49±0.18 |
| p-ERK1/2 | 0.97±0.18 | 0.43±0.17a | 1.13±0.32bc | 1.22±0.27bc | 0.47±0.18 |
| Bcl-2 | 1.14±0.24 | 0.37±0.16a | 1.04±0.31bc | 0.97±0.28bc | 0.41±0.13 |
| c-caspase-3 | 0.98±0.13 | 2.01±0.32a | 1.14±0.20bc | 1.08±0.24bc | 1.83±0.47 |
| a: P < 0.05与Sham组比较; b: P < 0.05, 与ICH组比较; c: P < 0.05,与ICH+NDP-MSH+Mc3r siRNA组比较 | |||||
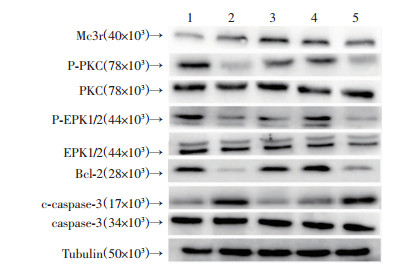
|
| 1: Sham; 2: ICH; 3: ICH+NDP-MSH; 4: ICH+NDP-MSH+Scr siRNA; 5: ICH+NDP-MSH+Mc3r siRNA 图 4 Mc3r敲低后Weston blot检测Mc3r、PKC、ERK、Bcl-2、caspase-3在小鼠脑组织中的表达 |
2.4 PKC特异性抑制剂Staurosporine减轻ICH后NDP-MSH的保护作用
为了进一步确定NDP-MSH的神经保护作用是否通过PKC信号通路调节,在ICH诱导前48 h通过侧脑室注射施用PKC特异性抑制剂Staurosporine,并在ICH后24 h用NDP-MSH治疗。在ICH后24 h,抑制PKC会加剧氧化应激反应(P < 0.05, 表 2)。此外,PKC的抑制增加了血肿周围组织中c-caspase-3的表达,并且降低了p-PKC,p-ERK1/2和Bcl-2的表达(P < 0.05, 图 5)。
| 指标 | Sham | ICH | ICH+NDP-MSH | ICH+NDP-MSH+Vihecle | ICH+NDP-MSH+Staurosporin |
| MDA | 99.8±8.2 | 50.4±6.3a | 210.6±26.7bc | 195.2±22.3bc | 118.1±13.6 |
| CAT | 60.4±6.2 | 330.7±35.1a | 175.1±20.4bc | 185.9±20.1bc | 286.2±29.8 |
| SOD | 101.2±8.1 | 49.3±6.5a | 250.7±30.3bc | 226.2±28.6bc | 125.4±16.9 |
| Mc3r | 1.00±0.15 | 1.80±0.24a | 2.73±0.52bc | 2.63±0.45bc | 1.90±0.32 |
| p-PKC | 0.98±0.13 | 0.52±0.16a | 0.95±0.47bc | 1.13±0.44bc | 0.54±0.28 |
| p-ERK1/2 | 1.25±0.26 | 0.53±0.11a | 1.10±0.36bc | 1.12±0.41bc | 0.48±0.16 |
| Bcl-2 | 1.14±0.31 | 0.48±0.14a | 1.32±0.41bc | 1.19±0.39bc | 0.44±0.14 |
| c-caspase-3 | 1.05±0.23 | 1.86±0.48a | 0.97±0.32bc | 1.12±0.27bc | 1.92±0.38 |
| a: P < 0.05,与Sham组比较; b: P < 0.05, 与ICH组比较; c: P < 0.05,与ICH+NDP-MSH+Staurosporin组比较 | |||||
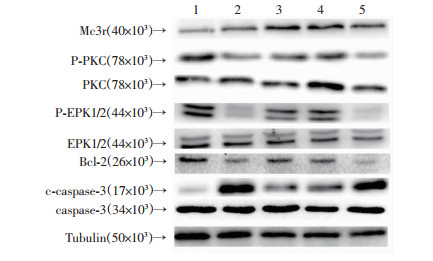
|
| 1: Sham; 2: ICH; 3: ICH+NDP-MSH; 4: ICH+NDP-MSH+Vihecle; 5: ICH+NDP-MSH+Staurosporin 图 5 PKC抑制后Weston blot检测Mc3r、PKC、ERK、Bcl-2、caspase-3在小鼠脑组织中的表达 |
3 讨论
氧化应激反应和神经元凋亡是由ICH后SBI引起的重要的病理事件,其形成的机制非常复杂。研究表明,ICH后由氧化剂(ROS / RNS)和抗氧化剂之间的不平衡引起的氧化应激和多种因素诱导的神经元细胞凋亡起着重要的作用[14-15]。ICH后,大量自由基被释放,ROS导致膜脂质过氧化、蛋白质和DNA的氧化损伤[16]。此外,自由基级联,炎症,细胞因子刺激,凝血酶,血液成分和许多调节神经元凋亡的基因,例如促进凋亡的Bcl-x和caspase-3,是ICH诱导神经元凋亡的主要因素。本研究首先确定了NDP-MSH对ICH后氧化应激和神经元凋亡的神经保护作用,同时观察到以下结果:①小鼠ICH早期,血肿周围的Mc3r表达水平升高,广泛表达于神经元中; ②腹腔给予NDP-MSH可以在ICH后24 h显著降低氧化应激和脑水肿,并伴有神经功能障碍的改善; ③NDP-MSH治疗与p-PKC,p-ERK1/2和Bcl-2的上调以及c-caspase-3的下调有关; ④通过特异性siRNA抑制Mc3r或通过Staurosporine抑制PKC途径抵消了NDP-MSH对氧化应激和神经元凋亡的作用。
研究表明,NDP-MSH可以通过刺激迷走神经背侧或软骨下的Mc3/Mc4受体来激活迷走神经介导的胆碱能抗炎途径并参与神经保护作用[17]。蛛网膜下腔出血后,通过减少细胞外信号调节激酶(ERK1/2)的磷酸化,NDP-MSH阻断了SAH诱导的基底动脉基因表达谱的变化,抑制了涉及炎症,氧化应激反应,细胞凋亡和血管重塑[18]。此外,在神经元中,NDP-MSH通过与Mc3r结合来激活ERK1/2信号传导途径,从而诱导细胞增殖[19]。它也可以增加细胞内Ca2+水平,并与PKC途径相互作用以改善神经功能[20]。与以前的发现一致,本研究结果表明NDP-MSH的治疗可促进p-PKC、p-ERK1/2、Bcl-2的上调和caspase-3的下调,从而减少氧化应激和神经元凋亡。
目前,已证明NDP-MSH通过结合不同的黑皮质素受体(Mc1r至Mc5r)在中枢神经系统中发挥有效的抗炎和神经保护作用[21-22]。然而,Mc3r是中枢神经系统中黑色素皮质受体最丰富的亚型,在下丘脑和边缘系统中含量丰富,并且与能量稳态的中枢调节密切相关[7]。本研究观察到Mc3r在小鼠的大脑神经元细胞中表达。此外,用Mc3r siRNA敲低Mc3r可以通过增加凋亡相关分子caspase-3的表达和降低Bcl-2的表达从而显著消除NDP-MSH的神经保护作用。ELISA结果显示,敲除Mc3r后氧化应激反应升高。因此,有理由推测,Mc3r的激活介导了ICH后NDP-MSH诱导的神经保护作用。尽管发现与以前的观察结果不同,这表明用NDP-MSH或RO27-3225激活Mc4r可以改善ICH动物模型的神经功能。我们建议这种差异可能是由于动物模型和组织类型的差异。
PKC已显示出通过调节ERK1/2的转录活性来减轻氧化应激和细胞凋亡的作用。越来越多的证据表明,ERK1/2或PKC活性的增强导致多种信号传导机制的激活,例如活性氧(ROS)/NO,Bcl家族,从而在中风后介导氧化应激和神经元凋亡的调节[23-24]。在当前的研究中,PKC活性的敲低降低了p-ERK1/2, Bcl-2的表达,升高了caspase-3的表达,并导致氧化应激反应加重和神经元凋亡。因此,敲低PKC逆转了NDP-α-MSH的神经保护作用。
据报道NDP-α-MSH在中枢神经系统疾病中通过多种途径(CREB, MAPK等)发挥其神经保护作用[25-26]。但本研究仅研究了Mc3r通过PKC/ERK1/2途径的作用,而未进一步研究其他途径;其次,仅研究了NDP-α-MSH对ICH后氧化应激和神经元凋亡的神经保护作用,而未进一步研究其在抗自噬等方面的作用;第三,尽管本研究结果验证了NDP-α-MSH的新机制,通过上调Mc3r,激活ERK1/2信号通路介导的神经保护作用,但是NDP-α-MSH同时对Mc1r、Mc4r也有一定的作用,是否在这一过程中发挥作用仍需进一步探讨。此外,进一步的研究还应集中在探索Mc3r的更详细作用以及Mc3r如何增加ERK1/2水平的潜在机制上。
| [1] |
HEMPHILL J C 3rd, ADEOYE O M, ALEXANDER D N, et al. Clinical performance measures for adults hospitalized with intracerebral hemorrhage: performance measures for healthcare professionals from the American heart association/American stroke association[J]. Stroke, 2018, 49(7): e243-e261. DOI:10.1161/STR.0000000000000171 |
| [2] |
DELCOURT C, SATO S, ZHANG S H, et al. Intracerebral hemorrhage location and outcome among INTERACT2 participants[J]. Neurology, 2017, 88(15): 1408-1414. DOI:10.1212/WNL.0000000000003771 |
| [3] |
SABA J, CARNIGLIA L, RAMÍREZD, et al. Melanocortin 4 receptor activation protects striatal neurons and glial cells from 3-nitropropionic acid toxicity[J]. Mol Cell Neurosci, 2019, 94: 41-51. DOI:10.1016/j.mcn.2018.12.002 |
| [4] |
PATEL C A, ACHARYA S R. Energy homeostasis and obesity: the therapeutic role ofanorexigenic and orexigenic peptide[J]. Int J Pept Res Ther, 2019, 25(3): 919-932. DOI:10.1007/s10989-018-9740-7 |
| [5] |
CATANIA A. Neuroprotective actions ofmelanocortins: a therapeutic opportunity[J]. Trends Neurosci, 2008, 31(7): 353-360. DOI:10.1016/j.tins.2008.04.002 |
| [6] |
YAMADA-GOTO N, OCHI Y, KATSUURA G, et al. Neuronal cells derived from human induced pluripotent stem cells as a functional tool ofmelanocortin system[J]. Neuropeptides, 2017, 65: 10-20. DOI:10.1016/j.npep.2017.04.004 |
| [7] |
BENJAMINS J A, NEDELKOSKA L, LISAK R P. Melanocortin receptor subtypes are expressed on cells in the oligodendroglial lineage and signal ACTH protection[J]. J Neurosci Res, 2018, 96(3): 427-435. DOI:10.1002/jnr.24141 |
| [8] |
RODRIGUES A R, ALMEIDA H, GOUVEIA A M. Intracellular signaling mechanisms of themelanocortin receptors: current state of the art[J]. Cell Mol Life Sci, 2015, 72(7): 1331-1345. DOI:10.1007/s00018-014-1800-3 |
| [9] |
MA K, YANG Z H, YANG L M, et al. Activation of M1mAChRs by lesatropane rescues glutamate neurotoxicity in PC12 cells via PKC-mediated phosphorylation of ERK1/2[J]. Bosn J Basic Med Sci, 2013, 13(3): 146-152. DOI:10.17305/bjbms.2013.2346 |
| [10] |
ZHAO G C, YANG L J, WANG S Q, et al. TREK-2 mediates the neuroprotective effect of isoflurane preconditioning against acute cerebral ischemia in the rat[J]. Rejuvenation Res, 2019, 22(4): 325-334. DOI:10.1089/rej.2017.2039 |
| [11] |
LIU C, DU Q M, ZHANG X, et al. Clematichinenoside serves as a neuroprotective agent against ischemic stroke: the synergistic action of ERK1/2 and cPKC pathways[J]. Front Cell Neurosci, 2015, 9: 517. DOI:10.3389/fncel.2015.00517 |
| [12] |
KIM J E, KANG T C. PKC, AKT and ERK1/2-mediated modulations of PARP1, NF-κB and PEA15 activities distinctly regulate regional specific astroglial responses following status epilepticus[J]. Front Mol Neurosci, 2019, 12: 180. DOI:10.3389/fnmol.2019.00180 |
| [13] |
JIANG S F, LI X Z, JIN W, et al. Ketamine-induced neurotoxicity blocked by N-Methyl-d-aspartate is mediated through activation of PKC/ERK pathway in developing hippocampal neurons[J]. Neurosci Lett, 2018, 673: 122-131. DOI:10.1016/j.neulet.2018.02.051 |
| [14] |
HU X, TAO C Y, GAN Q, et al. Oxidative stress in intracerebral hemorrhage: sources, mechanisms, and therapeutic targets[J]. Oxid Med Cell Longev, 2016, 2016: 3215391. DOI:10.1155/2016/3215391 |
| [15] |
XIE R X, LI D W, LIU X C, et al. Carnosine attenuates brain oxidative stress and apoptosis after intracerebral hemorrhage in rats[J]. Neurochem Res, 2017, 42(2): 541-551. DOI:10.1007/s11064-016-2104-9 |
| [16] |
WANG Z, ZHOU F, DOU Y, et al. Melatonin alleviates intracerebral hemorrhage-induced secondary brain injury in rats via suppressing apoptosis, inflammation, oxidative stress, DNA damage, and mitochondria injury[J]. Transl Stroke Res, 2018, 9(1): 74-91. DOI:10.1007/s12975-017-0559-x |
| [17] |
GIULIANI D, OTTANI A, NERI L, et al. Multiple beneficial effects ofmelanocortin MC4 receptor agonists in experimental neurodegenerative disorders: Therapeutic perspectives[J]. Prog Neurobiol, 2017, 148: 40-56. DOI:10.1016/j.pneurobio.2016.11.004 |
| [18] |
HOLLOWAY P M, SMITH H K, RENSHAW D, et al. Targeting themelanocortin receptor system for anti-stroke therapy[J]. Trends Pharmacol Sci, 2011, 32(2): 90-98. DOI:10.1016/j.tips.2010.11.010.[PubMed |
| [19] |
KONDA Y, GANTZ I, DELVALLE J, et al. Interaction of dual intracellular signaling pathways activated by the melanocortin-3 receptor[J]. J Biol Chem, 1994, 269(18): 13162-13166. |
| [20] |
WACHIRA S J, HUGHES-DARDEN C A, TAYLOR C V, et al. Evidence for the interaction of protein kinase C andmelanocortin 3-receptor signaling pathways[J]. Neuropeptides, 2003, 37(4): 201-210. DOI:10.1016/s0143-4179(03)00026-x |
| [21] |
SABA J, CARNIGLIA L, RAMÍREZ D, et al. Melanocortin 4 receptor activation protects striatal neurons and glial cells from 3-nitropropionic acid toxicity[J]. Mol Cell Neurosci, 2019, 94: 41-51. DOI:10.1016/j.mcn.2018.12.002 |
| [22] |
CATANIA A, LONATI C, SORDI A, et al. The peptide NDP-MSH induces phenotype changes in the heart that resemble ischemic preconditioning[J]. Peptides, 2010, 31(1): 116-122. DOI:10.1016/j.peptides.2009.09.030 |
| [23] |
SHU Q, ZHANG J H, MA W, et al. Orexin-A promotesGlu uptake by OX1R/PKCα/ERK1/2/GLT-1 pathway in astrocytes and protects co-cultured astrocytes and neurons against apoptosis in Anoxia/hypoglycemic injury in vitro[J]. Mol Cell Biochem, 2017, 425(1/2): 103-112. DOI:10.1007/s11010-016-2866-z |
| [24] |
LEE B K, JUNG Y S. Alliumcepa extract and quercetin protect neuronal cells from oxidative stress via PKC-ε inactivation/ERK1/2 activation[J]. Oxid Med Cell Longev, 2016, 2016: 2495624. DOI:10.1155/2016/2495624 |
| [25] |
RAMÍREZ D, SABA J, CARNIGLIA L, et al. Melanocortin 4 receptor activates ERK-cFos pathway to increase brain-derived neurotrophic factor expression in rat astrocytes and hypothalamus[J]. Mol Cell Endocrinol, 2015, 411: 28-37. DOI:10.1016/j.mce.2015.04.008 |
| [26] |
MYKICKI N, HERRMANN A M, SCHWAB N, et al. Melanocortin-1 receptor activation is neuroprotective in mouse models ofneuroinflammatory disease[J]. Sci Transl Med, 2016, 8(362): 362ra146. DOI:10.1126/scitranslmed.aaf8732 |



