2. 100084 北京, 北京体育大学:运动人体科学学院;
3. 200030 上海, 上海体育科学研究所
2. Sport Science College, Beijing Sport University, Beijing, 100084;
3. Shanghai Research Institute of Sport Sciences, Shanghai, 200030, China
高海拔地区具有高寒缺氧特征, 大气中氧含量低, 人体暴露在高原低氧环境中易诱发心、脑、肺等多种脏器损伤, 也诱发骨骼肌萎缩[1]。随着社会发展进步, 进入高原旅游和工作的人越来越多, 高原低氧对人体的损害逐步受到重视。其中低氧暴露后机体中骨骼肌丢失, 运动能力下降, 不仅困扰高原训练的运动员和教练员[2], 还影响高原地区生活和工作人群的生产、生活。近来研究发现, 低氧下骨骼肌蛋白质合成分解失衡可能是骨骼肌丢失的主要原因[1]。
叉头状转录因子O1(forkhead transcription factor O1, FoxO1)作为核转录因子, 参与调节细胞增殖、凋亡以及代谢等多种生理病理过程[3]。FoxO1在骨骼肌蛋白质合成分解调控中发挥着关键作用。FoxO1结合肌肉环状指基因1(muscle ring finger 1, MuRF1)和肌肉萎缩盒F基因(muscle atrophy F-box, MAFbx, Atrogin-1)两个基因的启动子区域, 增强两者表达[4]; 同时这两个基因是机体主要的降解系统[5]——泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)中重要的限速酶。FoxO1还直接或者间接作用于哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR), 与细胞外调节蛋白激酶1和2(extracellular regulated protein kinases 1 and 2, ERK1/2)以及真核翻译起始因子4E结合蛋白1(e IF4E-binding protein 1, 4E-BP1)等蛋白一起调节骨骼肌蛋白质合成[6-7]。FoxO1活性受到自身磷酸化/去磷酸化水平的调控, 如FoxO1蛋白中3个高度保守的磷酸化位点:Thr24、Ser256和Ser319(其中大鼠为Thr24、Ser250和Ser313位点)[8]。磷酸化FoxO1与14-3-3蛋白相互作用, 使FoxO1被锚定在细胞质中, 阻止其向核内转位, 从而抑制其转录激活作用[9]。
FoxO1是否参与低氧暴露下骨骼肌蛋白质合成分解的调控尚不清楚, 低氧下FoxO1状态的改变是否与其磷酸化/去磷酸状态有关, 哪个磷酸化位点可能发挥更重要的调节作用也不清楚。因此, 本研究通过腺病毒介导FoxO1三种磷酸化位点突变质粒到大鼠骨骼肌细胞中表达, 比较低氧和常氧下骨骼肌蛋白质合成和分解情况, 探讨FoxO1磷酸化位点对低氧诱导的骨骼肌蛋白质合成分解的调节作用。
1 材料与方法 1.1 材料与试剂大鼠L6细胞购于上海中桥新舟生物科技有限公司; 腺病毒由广州云舟生物科技有限公司提供; DMEM培养基、胎牛血清、马血清和puromycin购自Gibco; 抗体信息:puromycin antibody(Thermo Fisher, A1113802)和p-ERK1/2 antibody(Thermo Fisher, 44-680G); ERK1/2 antibody(Abcam, ab47326)、mTOR antibody(Abcam, ab131339)、MuRF1 antibody(Abcam, ab172479)和Atrogin-1 antibody(Abcam, ab168372);p-4E-BP1 antibody(Cell Signaling Technology, 2855)、p-mTOR antibody(Cell Signaling Technology, 5536T); uniquitin antibody(Santa, sc-8017)、FoxO1 antibody(Santa, sc-374427);4E-BP1 antibody(Proteintech, 60246-1-Ig); α-tubulin antibody(Sigma, T6074)。
1.2 方法 1.2.1 质粒构建与腺病毒包装从NCBI数据库中检索大鼠FoxO1基因序列, 构建rFoxO1(FoxO1过表达)、FoxO1T24A、FoxO1 T24D、FoxO1 S250A、FoxO1 S250D、FoxO1 S313A和FoxO1 S313D等质粒(其中位点数字前T表示苏氨酸、S表示丝氨酸, 数字后A表示突变为丙氨酸——使位点丧失磷酸化; 数字后D表示突变为天冬氨酸——使位点保持磷酸化)。质粒转染至HEK293细胞中, 整合重组腺病毒, 收获细胞进行腺病毒扩增、纯化和滴度检测。
1.2.2 细胞分化与分组L6细胞复苏后, 用DMEM完全培养基(含10%胎牛血清), 在5%CO2、37 ℃下培养。数次传代之后, 将L6细胞按照1×105/mL传代到9.5 cm2培养皿, 待细胞生长到80%左右, 更换至DMEM分化培养基(含2%马血清)中, 当细胞逐渐长为梭形, 呈肌管形态时表明分化成功。分化完成后将细胞分为8个转染组:EGFP(空白对照质粒)、rFoxO1、T24A、T24D、S250A、S250D、S313A和S313D组。
1.2.3 腺病毒转染待细胞分化完成后, 根据病毒滴度以及感染复数(multiplicity of infection, MOI), 现配置培养基。弃去培养皿中原有培养基, 向细胞加入1 mL含有病毒的培养基, 轻轻摇匀培养基, 放置培养箱中培养。病毒转染6 h后即刻、12 h和24 h均更换新鲜培养基。
1.2.4 腺病毒转染效果观察使用DAPI工作液对感染腺病毒2 d(目的蛋白表达峰值)后的细胞进行细胞核染色, 并置于激光共聚焦显微镜下观察转染效果。
1.2.5 低氧干预各转染组再分为低氧组(H组, 37 ℃, 1%O2)和常氧组(C组), 培养6 h后收细胞进行检测。
1.2.6 蛋白质合成检测翻译表面感应(surface sensing of translation, SUnSET)手段依靠嘌呤霉素(puromycin)实现快速、准确测定机体蛋白质合成[10]。puromycin具有与tRNA分子末端类似的结构, 能同氨基酸结合, 替代氨酰化tRNA同核糖体A位点结合, 并掺入到生长的肽链中。收细胞30 min前, 向培养基中加入puromycin(终浓度为40 mmol/L), 因为puromycin不参与蛋白质合成的后续反应, 从而导致蛋白质合成中断, 释放出C末端含有puromycin的不成熟多肽。方法是对样本中puromycin进行检测, 能反映出puromycin结合多肽情况, 从而反映出蛋白质的合成情况。
1.2.7 蛋白质分解检测UPS是一个复杂的多步骤反应过程, 蛋白质先被泛素(ubiquitin)标记, 随后被蛋白酶体识别, 从而进一步降解[11-12]。方法是检测标有ubiquitin的蛋白质相对含量, 即反映出蛋白质的分解情况。
1.2.8 Western blot测定蛋白表达含量低氧干预结束后, 使用加入裂解液提取细胞蛋白, 随后用BCA法计算蛋白质浓度。蛋白样品使用SDS聚丙烯酰胺凝胶电泳, 采用干转法转膜后, 进行封闭(封闭液Odyssey Blocking Buffer, LI-COR), 分别孵育相应抗体4 ℃过夜, 然后用TBST洗涤, 再孵育二抗、洗涤, 用近红外光谱检测系统(Odyssey CLX, LI-COR)检测条带信号值, Image Studio进行分析。
1.3 统计学处理采用SPSS 21.0统计软件进行分析, 数据以x±s表示, 采用双因素方差分析对是否低氧干预和腺病毒干预进行主效应和交互效应分析。交互效应显著, 组间多重比较采用简单效应分析; 交互效应不显著, 分别对单独主效应进行分析。对腺病毒干预主效应的组间比较采用单因素方差分析, 方差齐时采用LSD检验, 方差不齐采用Tamhane’s T2检验; 对是否低氧干预主效应的组间比较, 满足正态分布采用独立样本t检验, 非正态分布采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
2 结果 2.1 细胞分化过程L6细胞诱导分化前细胞界限清晰, 可见不规则三角形、多角形等, 立体感较强, 未见肌型结构出现。诱导分化后细胞边界模糊, 以细梭形为主, 细胞生长方向趋于一致, 细胞中有肌型结构出现。见图 1。
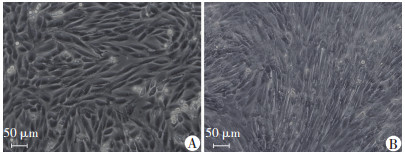
|
| A:分化前; B:分化后 图 1 L6细胞分化过程 |
2.2 腺病毒感染
目的基因表达量与绿色荧光蛋白基因表达量基本一致, 因此通过绿色荧光蛋白(GFP)表达情况来反映目的蛋白表达情况。结果发现所有转染腺病毒的细胞中都有GFP表达, 并且表达丰富(图 2), 说明细胞中目的蛋白表达成功, 腺病毒转染效果好。
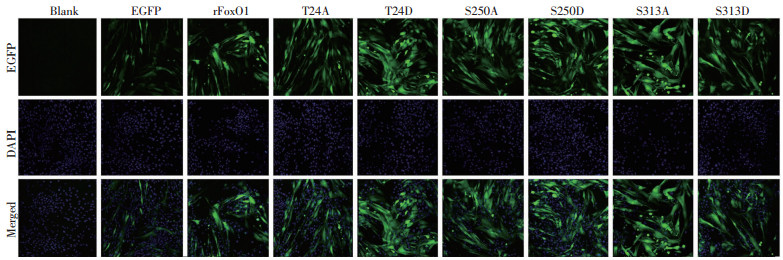
|
| 绿色表示绿色荧光蛋白GFP、蓝色表示DAPI染色后细胞核, Merge表示两张图片重合 图 2 免疫荧光检测L6细胞中绿色荧光蛋白(GFP)表达 |
2.3 FoxO1 Thr24磷酸化位点对骨骼肌细胞蛋白质合成分解影响 2.3.1 FoxO1 Thr24磷酸化位点对骨骼肌细胞蛋白质积累的影响
常氧下, C-rFoxO1组puromycin结合多肽量较C-EGFP组显著上升(P<0.05)。与C-T24A组相比, H-T24A组puromycin结合多肽量显著下降(P<0.05)。与C-EGFP组相比, C-T24D组ubiquitin表达显著升高(P<0.05);与H-EGFP组相比, H-rFoxO1组ubiquitin表达显著上升(P<0.01);与C-T24A组相比, H-T24A组ubiquitin表达显著降低(P<0.05)。与C-EGFP组相比, C-rFoxO1组puromycin/ubiquitin比值显著升高(P<0.05)。见图 3。
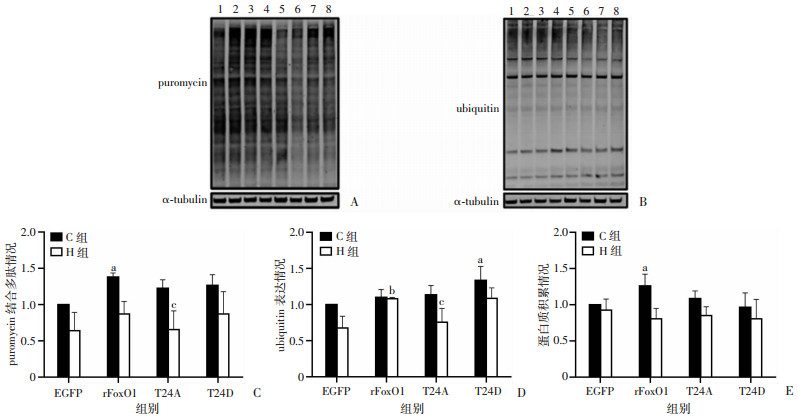
|
| A:Western blot检测puromycin结合多肽情况; B:Western blot检测ubiquitin表达情况; C:puromycin结合多肽情况; D:ubiquitin表达情况; E:蛋白质积累情况; 1:C-EGFP; 2:C-rFoxO1;3:C-T24A;4:C-T24D;5:H-EGFP; 6:H-rFoxO1;7:H-T24A;8:H-T24D;a:P<0.05, 与C-EGFP组比较; b:P<0.01, 与H-EGFP组比较; c:P<0.05, 与C-T24A组比较 图 3 FoxO1 Thr24磷酸化位点对骨骼肌细胞蛋白质积累的影响 |
2.3.2 Thr24磷酸化位点对骨骼肌中FoxO1表达的影响
与C-rFoxO1组相比, C-T24A和C-T24D两组FoxO1表达均显著下降(P<0.01);与H-rFoxO1组相比, H-T24A和H-T24D组FoxO1表达显著下降(P<0.01);与C-T24D组相比, H-T24D组FoxO1表达显著上升(P<0.05)。见图 4。
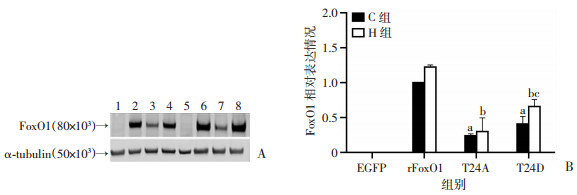
|
| A:Western blot检测FoxO1蛋白表达情况; B:FoxO1表达情况; 1:C-EGFP; 2:C-rFoxO1;3:C-T24A;4:C-T24D;5:H-EGFP; 6:H-rFoxO1;7:H-T24A;8:H-T24D;a:P<0.01, 与C-EGFP组比较; b:P<0.01, 与H-EGFP组比较; c:P<0.05, 与C-T24D组比较 图 4 FoxO1 Thr24磷酸化位点对骨骼肌中FoxO1表达的影响 |
2.3.3 FoxO1 Thr24磷酸化位点对骨骼肌细胞合成相关蛋白质表达的影响
与H-EGFP组和C-T24D组相比, H-T24D组的p-ERK1/2表达显著上升(P<0.01);与C-EGFP组相比, H-EGFP组p-ERK1/2/ERK1/2比值显著升高(P<0.01)。与C-EGFP组相比, H-EGFP组4E-BP1表达显著下降(P<0.01);与C-EGFP组相比, C-rFoxO1组和C-T24D组mTOR表达显著上升(P<0.01);与H-EGFP组相比, H-rFoxO1组mTOR表达显著上升(P<0.01);与C-T24D组相比, H-T24D组mTOR表达显著降低(P<0.01)。见图 5。
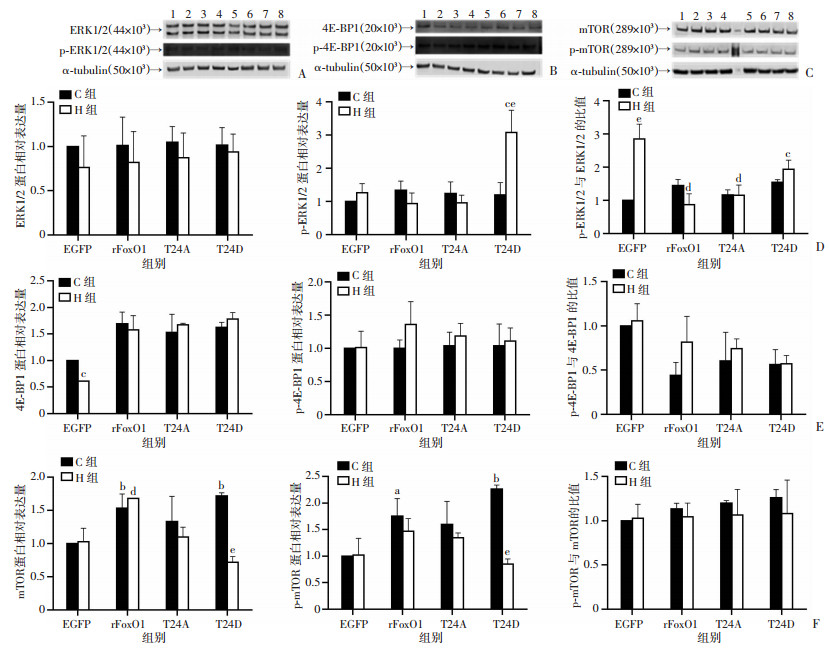
|
| A:Western blot检测ERK1/2和p-ERK1/2蛋白表达; B:Western blot检测4E-BP1和p-4E-BP1蛋白表达; C:Western blot检测mTOR和p-mTOR蛋白表达; D:ERK1/2、p-ERK1/2和p-ERK1/2/ERK1/2表达; E:4E-BP1、p-4E-BP1和p-4E-BP1表达; F:mTOR、p-mTOR和p-mTOR/mTOR表达; 1:C-EGFP; 2:C-rFoxO1;3:C-T24A;4:C-T24D;5:H-EGFP; 6:H-rFoxO1;7:H-T24A;8:H-T24D;a:P<0.05, b:P<0.01, 与C-EGFP组比较; c:P<0.05, d:P<0.01, 与H-EGFP组比较; e:P<0.01, 与相同转染的C组比较 图 5 FoxO1 Thr24磷酸化位点对骨骼肌细胞合成相关蛋白质表达的影响 |
2.3.4 FoxO1 Thr24磷酸化位点对骨骼肌细胞分解相关蛋白质表达的影响
各组间MuRF1表达差异均无统计学意义(P>0.05);与C-EGFP组相比, C-T24A和C-T24D组Atrogin-1表达显著上升(P<0.01);与C-T24A组相比, H-T24A组的Atrogin-1表达显著降低(P<0.01);与C-T24D相比, H-T24D组的Atrogin-1表达显著降低(P<0.01)。见图 6。
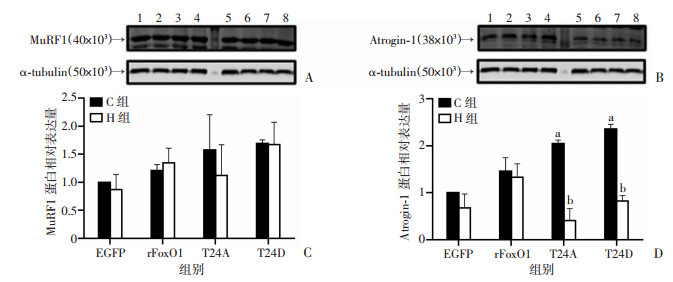
|
| A:Western blot检测MuRF1蛋白表达; B:Western blot检测Atrogin-1蛋白表达; C:MuRF1表达; D:Atrogin-1表达; 1:C-EGFP; 2:C-rFoxO1;3:C-T24A;4:C-T24D;5:H-EGFP; 6:H-rFoxO1;7:H-T24A;8:H-T24D;a:P<0.01, 与C-EGFP组比较; b:P<0.01, 与相同转染的C组比较 图 6 FoxO1 Thr24磷酸化位点对骨骼肌细胞分解相关蛋白质表达的影响 |
2.4 FoxO1 Ser250磷酸化位点对骨骼肌细胞蛋白质合成分解影响 2.4.1 FoxO1 Ser250磷酸化位点对骨骼肌细胞蛋白质积累的影响
与C-EGFP组相比, C-rFoxO1组和C-S250A组puromycin结合多肽量显著上升(P<0.05)。与C-S250A组相比, H-S250A组puromycin结合多肽量显著下降(P<0.01);与C-S250D组相比, H-S250D组puromycin结合多肽量显著下降(P<0.01)。与C-EGFP组相比, C-rFoxO1组的ubiquitin表达显著升高(P<0.01)。与C-EGFP组相比, C-S250A组puromycin/ubiquitin比值显著增加(P<0.01);与C-S250A组相比, H-S250A组puromycin/ubiquitin比值显著减少(P<0.01)。见图 7。

|
| A:Western blot检测puromycin结合多肽情况; B:Western blot检测ubiquitin的表达; C:puromycin结合多肽情况; D:ubiquitin表达; E:puromycin/uniquitin表达; 1:C-EGFP; 2:C-rFoxO1;3:C-T24A;4:C-T24D;5:H-EGFP; 6:H-rFoxO1;7:H-T24A;8:H-T24D;a:P<0.05, b:P<0.01, 与C-EGFP组比较; c:P<0.01, 与相同转染的C组比较 图 7 FoxO1 Ser250磷酸化位点对骨骼肌细胞蛋白质积累的影响 |
2.4.2 Ser250磷酸化位点对低氧下骨骼肌中FoxO1表达的影响
与C-rFoxO1组相比, C-S250A组FoxO1表达显著下降(P<0.05);与C-rFoxO1组相比, H-rFoxO1组FoxO1表达显著下降(P<0.05);与H-rFoxO1组相比, H-S250A组FoxO1表达显著降低(P<0.05);与C-S250A组相比, H-S250A组FoxO1表达显著下降(P<0.05)。见图 8。
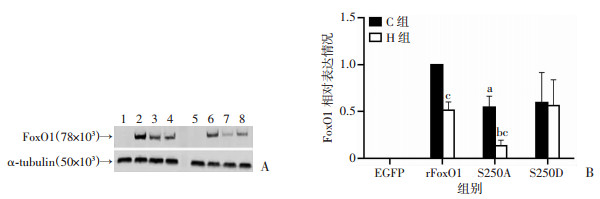
|
| A:Western blot检测FoxO1蛋白表达; B:FoxO1表达情况; 1:C-EGFP; 2:C-rFoxO1;3:C-T24A;4:C-T24D;5:H-EGFP; 6:H-rFoxO1;7:H-T24A;8:H-T24D;a:P<0.05, 与C-EGFP组比较; b:P<0.05, 与H-EGFP组比较; c:P<0.05, 与相同转染的C组比较 图 8 FoxO1 Ser250磷酸化位点对低氧下骨骼肌中FoxO1表达的影响 |
2.4.3 FoxO1 Ser250磷酸化位点对骨骼肌细胞合成相关蛋白质表达的影响
与H-EGFP组相比, H-S250D组ERK1/2表达显著上升(P<0.05);与C-S250D组相比, H-S250D组ERK1/2表达显著上升(P<0.01)。与C-EGFP组相比, C-rFoxO1组p-4E-BP1/4E-BP1比值显著升高(P<0.01);与C-EGFP组相比, H-EGFP组p-4E-BP1/4E-BP1比值显著升高(P<0.05);与H-EGFP组相比, H-rFoxO1组、H-S250A组和H-S250D组p-4E-BP1/4E-BP1比值显著降低(P<0.05);与C-rFoxO1组相比, H-rFoxO1组p-4E-BP1/4E-BP1比值显著降低(P<0.05)。见图 9。
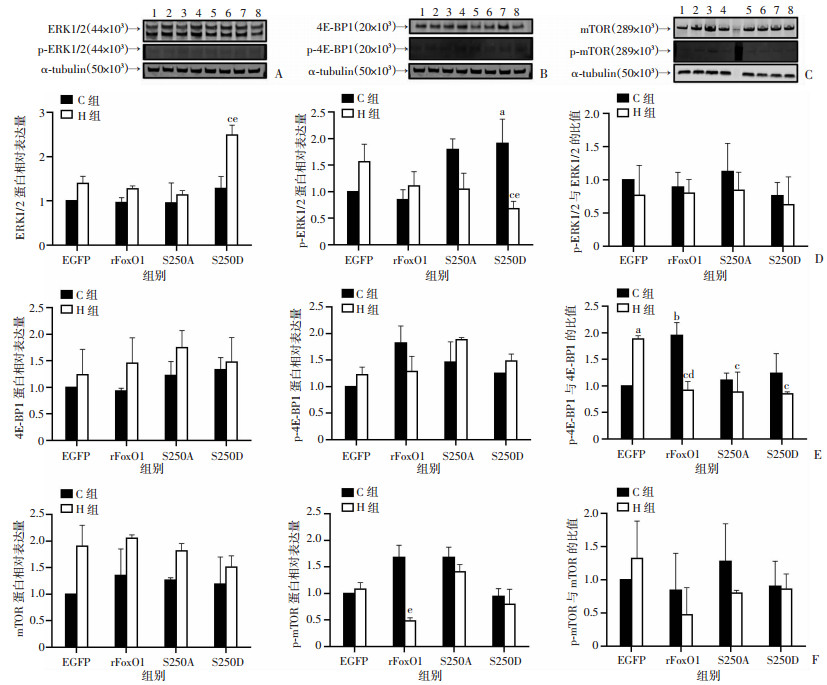
|
| A:Western blot检测ERK1/2和p-ERK1/2蛋白表达; B:Western blot检测4E-BP1和p-4E-BP1蛋白表达; C:Western blot检测mTOR和p-mTOR蛋白表达; D:ERK1/2、p-ERK1/2和p-ERK1/2/ERK1/2表达; E:4E-BP1、p-4E-BP1和p-4E-BP1表达; F:mTOR、p-mTOR和p-mTOR/mTOR表达; 1:C-EGFP; 2:C-rFoxO1;3:C-T24A;4:C-T24D;5:H-EGFP; 6:H-rFoxO1;7:H-T24A;8:H-T24D;a:P<0.05, b:P<0.01, 与C-EGFP组比较; c:P<0.05, 与H-EGFP组比较; d:P<0.05, e:P<0.01, 与相同转染的C组比较 图 9 FoxO1 Ser250磷酸化位点对骨骼肌细胞合成相关蛋白质表达的影响 |
2.4.4 FoxO1 Ser250磷酸化位点对骨骼肌细胞分解相关蛋白质表达的影响
与H-EGFP组相比, H-S250A组MuRF1表达显著增加(P<0.05);与C-S250A组相比, H-S250A组MuRF1表达显著增加(P<0.01)。见图 10。
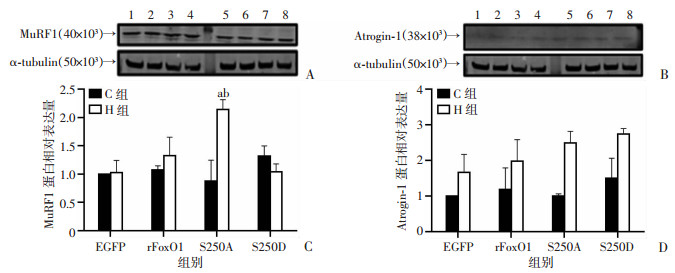
|
| A:Western blot检测MuRF1蛋白表达; B:Western blot检测Atrogin-1蛋白表达; C:MuRF1表达情况; D:Atrogin-1表达情况; 1:C-EGFP; 2:C-rFoxO1;3:C-T24A;4:C-T24D;5:H-EGFP; 6:H-rFoxO1;7:H-T24A;8:H-T24D;a:P<0.05, 与H-EGFP组比较; b:P<0.01, 与相同转染的C组比较 图 10 FoxO1 Ser250磷酸化位点对骨骼肌细胞分解相关蛋白质表达的影响 |
2.5 FoxO1 Ser313磷酸化位点对骨骼肌细胞蛋白质合成分解影响 2.5.1 FoxO1 Ser313磷酸化位点对骨骼肌细胞蛋白质积累的影响
与C-EGFP组相比, C-rFoxO1组、C-S313A组和C-S313D组puromycin结合多肽量显著上升(P<0.05)。各组之间ubiquitin表达均没有统计学差异。各组之间puromycin/ubiquitin比值均无统计学差异, 见图 11。

|
| A:Western blot检测puromycin结合多肽情况; B:Western blot检测ubiquitin的表达; C:puromycin结合多肽情况; D:ubiquitin表达; E:puromycin/uniquitin表达; 1:C-EGFP; 2:C-rFoxO1;3:C-T24A;4:C-T24D;5:H-EGFP; 6:H-rFoxO1;7:H-T24A; 8:H-T24D;a:P<0.05, 与C-EGFP组比较 图 11 FoxO1 Ser313磷酸化位点对骨骼肌细胞蛋白质积累的影响 |
2.5.2 Ser313磷酸化位点对骨骼肌细胞中FoxO1表达的影响
与C-rFoxO1组相比, C-S313A组和C-S313D组FoxO1表达显著降低(P<0.01);与H-rFoxO1组相比, H-S313A组和H-S313D组FoxO1表达显著降低(P<0.01)。见图 12。
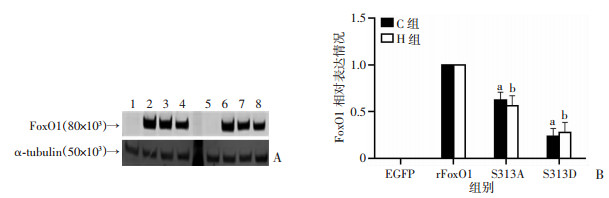
|
| A:Western blot检测FoxO1蛋白表达; B:半定量分析; 1:C-EGFP; 2:C-rFoxO1;3:C-T24A;4:C-T24D;5:H-EGFP; 6:H-rFoxO1;7:H-T24A;8:H-T24D;a:P<0.01, 与C-EGFP组比较; b:P<0.01, 与H-EGFP组比较 图 12 FoxO1 Ser313磷酸化位点对骨骼肌细胞中FoxO1表达的影响 |
2.5.3 FoxO1 Ser313磷酸化位点对骨骼肌细胞合成相关蛋白质表达的影响
与C-EGFP组相比, C-S313A组p-ERK1/2表达显著上升(P<0.01);与C-EGFP组相比, H-EGFP组p-ERK1/2表达显著升高(P<0.01)。与C-EGFP组相比, C-rFoxO1组mTOR表达显著上升(P<0.05);与C-S313D组相比, H-S313D组mTOR表达显著升高; 与C-EGFP组相比, C-rFoxO1 p-mTOR表达显著升高(P<0.05)。见图 13。
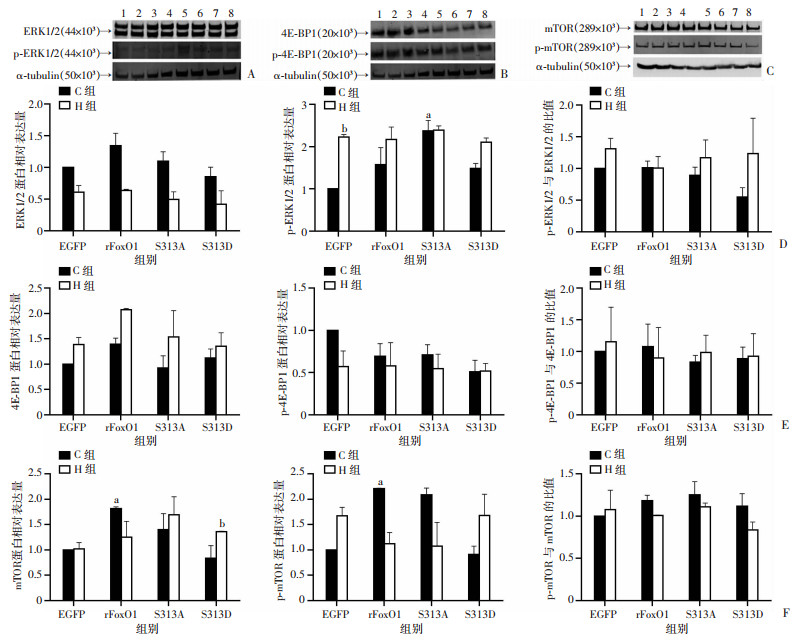
|
| A:Western blot检测ERK1/2和p-ERK1/2蛋白表达; B:Western blot检测4E-BP1和p-4E-BP1蛋白表达; C:Western blot检测mTOR和p-mTOR蛋白表达; D:ERK1/2、p-ERK1/2和p-ERK1/2/ERK1/2表达; E:4E-BP1、p-4E-BP1和p-4E-BP1表达; F:mTOR、p-mTOR和p-mTOR/mTOR表达; 1:C-EGFP; 2:C-rFoxO1;3:C-T24A;4:C-T24D;5:H-EGFP; 6:H-rFoxO1;7:H-T24A;8:H-T24D;a:P<0.05, b:P<0.01, 与C-EGFP组比较 图 13 FoxO1 Ser313磷酸化位点对骨骼肌细胞合成相关蛋白质表达的影响 |
2.5.4 FoxO1 Ser313磷酸化位点对骨骼肌细胞分解相关蛋白质表达的影响
与C-rFoxO1组相比, H-rFoxO1组Atrogin-1表达显著降低(P<0.05)。见图 14。

|
| A:Western blot检测MuRF1蛋白表达; B:Western blot检测Atrogin-1蛋白表达; C:MuRF1表达; D:Atrogin-1表达; 1:C-EGFP; 2:C-rFoxO1;3:C-T24A;4:C-T24D;5:H-EGFP; 6:H-rFoxO1;7:H-T24A;8:H-T24D;a:P<0.05, 与相同转染的C组比较 图 14 FoxO1 Ser313磷酸化位点对骨骼肌细胞分解相关蛋白质表达的影响 |
3 讨论 3.1 FoxO1对低氧下骨骼肌细胞蛋白质合成分解的影响
骨骼肌因其蛋白质占机体蛋白质总量的一半以上, 是机体中重要的蛋白质储备器官。正常生理条件下, 骨骼肌中蛋白质合成和分解处于动态平衡过程, 这种动态平衡对生命活动的正常维持具有重要意义[13]。该平衡被打破, 尤其是向蛋白质分解方向偏移, 大多是由生理病理状态以及外界环境的改变所导致的[14]。
低氧暴露能降低机体中蛋白质合成和分解水平, 而整个平衡过程向分解方向移动, 机体中总蛋白质含量减少, 这在人体和动物实验中都得到了证实[15-16]。本研究发现过表达FoxO1既能使大鼠骨骼肌细胞中蛋白质合成增加, 也能使蛋白质分解增加。这一现象说明过表达FoxO1能加快骨骼肌细胞中蛋白质代谢的速度。从puromycin/ubiquitin比值来看, 无论是常氧还是低氧下过表达FoxO1并不能改变大鼠骨骼肌细胞中蛋白质的积累。那么FoxO1过表达是如何影响大鼠骨骼肌细胞中蛋白质合成和分解的?本研究显示, 常氧下FoxO1过表达能显著增加大鼠骨骼肌细胞中mTOR和p-mTOR表达, 但对p-mTOR/mTOR比值没有影响。p-mTOR上调对骨骼肌合成具有重要的促进作用[17]。FoxO1能通过miR-3188调控mTOR的活性, 从而对蛋白质合成产生影响[18]。过表达FoxO1能激活PI3K/Akt通路活性, 并且FoxO1和Akt在抑制细胞凋亡方面具有协同作用[19]。mTOR作为PI3K/Akt的下游因子, 受到FoxO1的调控。以上现象表明, FoxO1过表达是通过影响mTOR的活性来使骨骼肌细胞中蛋白质合成增加。FoxO1过表达并不能显著增加骨骼肌细胞中MuRF1和Atrogin-1表达。综上FoxO1过表达能显著增加大鼠骨骼肌细胞中蛋白质的合成, 这种促进蛋白质合成的作用是通过上调mTOR和p-mTOR表达来实现的。
3.2 FoxO1磷酸化位点对低氧下骨骼肌细胞蛋白质合成分解的影响Thr24磷酸化位点是影响FoxO1活性的重要磷酸化位点。该位点磷酸化后, FoxO1被14-3-3蛋白结合, 并移位出细胞核, 被锚定在细胞质中等待降解[8, 20]。本研究显示, FoxO1T24A在低氧环境中显著下调骨骼肌细胞中蛋白质合成和分解, 但不影响蛋白质的积累。ERK1/2通路能协同mTOR通路促进蛋白质合成[21]。低氧环境中Thr24T24D能显著增加p-ERK1/2表达, 且低氧环境中FoxO1T24A/D会使骨骼肌细胞中p-ERK1/2/ERK1/2比值降低, 说明p-ERK1/2/ERK1/2比值的降低主要是由低氧干预造成。常氧环境中FoxO1T24D能显著升高骨骼肌细胞中mTOR和p-mTOR表达, 相反在低氧条件下FoxO1T24D显著降低mTOR和p-mTOR表达, 且不论常氧还是低氧, p-mTOR/mTOR比值不变。说明FoxO1 Thr24位点磷酸化对mTOR的调节是通过上调mTOR和p-mTOR表达来实现的, 而非增加mTOR的磷酸化程度。FoxO1T24D对mTOR的调节受低氧干预的影响, 说明低氧能显著抑制FoxO1 Thr24位点的磷酸化作用。常氧下, FoxO1T24A和FoxO1T24D均显著增加Atrogin-1表达, 但在6 h低氧干预环境下Atrogin-1表达显著下降, 推测可能在低氧暴露初期(6 h), 有另外的通路影响Atrogin-1的活性, 需要进一步的证实。
Ser250磷酸化位点是FoxO1主要门控位点, 该位点磷酸化后促进FoxO1其他位点磷酸化, 使整个FoxO1处于磷酸化状态[22-23]。本研究中, 常氧下FoxO1S250A能显著增加大鼠骨骼肌细胞中蛋白质合成; 低氧下FoxO1S250A对蛋白质合成的促进作用消失。因此, 低氧干预能抑制FoxO1 Ser250位点去磷酸化所带来的蛋白质增加效应。进一步研究发现, 低氧干预下FoxO1S250D能显著增加骨骼肌细胞中ERK1/2表达; 低氧干预下FoxO1S250A和FoxO1S250D均能显著降低p-4E- BP1/4E-BP1比值。4E-BP1是mTOR直接作用底物之一, 属翻译抑制蛋白家族。mTOR能直接磷酸化4E-BP1, 阻止其抑制翻译, 促进翻译的起始和蛋白质合成[24]。表明FoxO1 Ser250位点促进骨骼肌蛋白质合成作用受到低氧的严格调控, 且低氧下该位点对骨骼肌细胞蛋白质合成的影响与常氧下截然相反。FoxO1 Ser250位点去磷酸化能在低氧下显著增加MuRF1表达, 这一现象与之前研究FoxO1能增加MuRF1表达相一致[25]。
Ser313是FoxO1典型的磷酸化位点, 该位点磷酸化状态能显著影响FoxO1的活性[26]。Ser313位点的磷酸化状态不仅与FoxO1的转录活性有关, 还与FoxO1的核定位有关。PI3K/Akt催化的Ser313磷酸化令FoxO1的局部结构发生变化, 使Ser316位点被进一步磷酸化。磷酸化的Ser316位点进一步磷酸化Ser319位点。由Ser313、Ser316、Ser319和Ser323磷酸化形成的高酸性补丁能促进FoxO1核输出[27]。S313A能消除该位点PI3K/Akt介导的磷酸化作用, 但不阻止Thr24或Ser250的磷酸化作用。S313A能降低FoxO1的核排斥率, 使FoxO1靶向细胞核并增强反式激活作用[28]。本研究显示, FoxO1S313A和FoxO1S313D均能显著增加大鼠骨骼肌细胞中蛋白质的合成, 但对蛋白质分解没有显著影响; FoxO1S313A能显著增加骨骼肌细胞中p-ERK1/2表达, 但并没有增加p-ERK1/2/ERK1/2比值。FoxO1S313A/D对MuRF1和Atrogin-1表达都没有影响。
综上所述, FoxO1能通过上调mTOR和p-mTOR的活性来增加蛋白质合成, 但是这一现象严格受到低氧环境调控, 低氧下FoxO1能抑制机体中蛋白质合成。FoxO1促进蛋白质合成和/或低氧下FoxO1抑制蛋白质合成主要是通过影响FoxO1 Thr24和Ser250两个磷酸化位点状态来实现的。
| [1] |
唐舒宁, 龚丽景, 赵小雅, 等. 低氧影响蛋白质合成和分解的平衡诱导骨骼肌萎缩[J]. 中国生物化学与分子生物学报, 2019, 35(12): 1352-1360. TANG S N, GONG L J, ZHAO X Y, et al. Hypoxia induces skeletal muscle atrophy by affecting the balance of protein synthesis and decomposition[J]. Chin J Biochem Mol Biol, 2019, 35(12): 1352-1360. DOI:10.13865/j.cnki.cjbmb.2019.10.1292 |
| [2] |
于加倍, 胡扬, 李燕春, 等. 4周爬梯抗阻训练对低氧诱导大鼠骨骼肌萎缩的影响[J]. 中国实验动物学报, 2018, 26(4): 448-453. YU J B, HU Y, LI Y C, et al. Effects of 4-week resistance training on hypoxia-induced skeletal muscle atrophy in rats[J]. Acta Lab Animalis Sci Sin, 2018, 26(4): 448-453. DOI:10.3969/j.issn.1005-4847.2018.04.007 |
| [3] |
O'NEILL B T, BHARDWAJ G, PENNIMAN C M, et al. FoxO transcription factors are critical regulators of diabetes-related muscle atrophy[J]. Diabetes, 2019, 68(3): 556-570. DOI:10.2337/db18-0416 |
| [4] |
HANDAYANINGSIH A E, IGUCHI G, FUKUOKA H, et al. Reactive oxygen species play an essential role in IGF-I signaling and IGF-I-induced myocyte hypertrophy in C2C12 myocytes[J]. Endocrinology, 2011, 152(3): 912-921. DOI:10.1210/en.2010-0981 |
| [5] |
张聪聪, 陈博雅, 程乃萱, 等. AKT/FOXO1信号通路在心力衰竭小鼠骨骼肌萎缩中的作用[J]. 心肺血管病杂志, 2018, 37(1): 60-65. ZHANG C C, CHEN B Y, CHENG N X, et al. Role of AKT/FOXO1 signaling pathway in skeletal muscle atrophy in heart failure mouse[J]. J Cardiovasc Pulm Dis, 2018, 37(1): 60-65. DOI:10.3969/j.issn.1007-5062.2018.01.016 |
| [6] |
CHEN C C, JEON S M, BHASKAR P T, et al. FoxOs inhibit mTORC1 and activate Akt by inducing the expression of Sestrin3 and Rictor[J]. Dev Cell, 2010, 18(4): 592-604. DOI:10.1016/j.devcel.2010.03.008 |
| [7] |
HAY N. Interplay between FOXO, TOR, and akt[J]. Biochim Biophys Acta, 2011, 1813(11): 1965-1970. DOI:10.1016/j.bbamcr.2011.03.013 |
| [8] |
MAO W K, YOU T, YE B, et al. Reactive oxygen species suppress cardiac NaV1.5 expression through Foxo1[J]. PLoS ONE, 2012, 7(2): e32738. DOI:10.1371/journal.pone.0032738 |
| [9] |
WILHELM K, HAPPEL K, EELEN G, et al. FOXO1 couples metabolic activity and growth state in the vascular endothelium[J]. Nature, 2016, 529(7585): 216-220. DOI:10.1038/nature16498 |
| [10] |
SCHMIDT E K, CLAVARINO G, CEPPI M, et al. SUnSET, a nonradioactive method to monitor protein synthesis[J]. Nat Methods, 2009, 6(4): 275-277. DOI:10.1038/nmeth.1314 |
| [11] |
MALYNN B A, MA A. Ubiquitin makes its mark on immune regulation[J]. Immunity, 2010, 33(6): 843-852. DOI:10.1016/j.immuni.2010.12.007 |
| [12] |
ZHAO H, SHU L Y, HUANG W L, et al. Resveratrol affects hepatic gluconeogenesis via histone deacetylase 4[J]. Diabetes Metab Syndr Obes, 2019, 12: 401-411. DOI:10.2147/DMSO.S198830 |
| [13] |
LAMON S, ZACHAREWICZ E, ARENTSON-LANTZ E, et al. Erythropoietin does not enhance skeletal muscle protein synthesis following exercise in young and older adults[J]. Front Physiol, 2016, 7: 292-301. DOI:10.3389/fphys.2016.00292 |
| [14] |
D'HULST G, DELDICQUE L. Human skeletal muscle wasting in hypoxia: a matter of hypoxic dose?[J]. J Appl Physiol, 2017, 122(2): 406-408. DOI:10.1152/japplphysiol.00264.2016 |
| [15] |
DE THEIJE C C, SCHOLS A M W J, LAMERS W H, et al. Hypoxia impairs adaptation of skeletal muscle protein turnover- and AMPK signaling during fasting-induced muscle atrophy[J]. PLoS ONE, 2018, 13(9): e0203630. DOI:10.1371/journal.pone.0203630 |
| [16] |
贾杰, 付鹏宇, 朱镕鑫, 等. 低氧经mTOR/4E-BP1和FoxO1/Atrogin-1通路影响骨骼肌蛋白质积累[J]. 中国生物化学与分子生物学报, 2020, 36(3): 300-309. JIA J, FU P Y, ZHU R X, et al. Hypoxia affects skeletal muscle protein accumulation via mTOR/4E-BP1 and FoxO1/atrogin-1 pathways[J]. Chin J Biochem Mol Biol, 2020, 36(3): 300-309. DOI:10.13865/j.cnki.cjbmb.2020.01.1446 |
| [17] |
YOON M S. mTOR as a key regulator in maintaining skeletal muscle mass[J]. Front Physiol, 2017, 8: 788. DOI:10.3389/fphys.2017.00788 |
| [18] |
ZHAO M Y, LUO R C, LIU Y Y, et al. MiR-3188 regulates nasopharyngeal carcinoma proliferation and chemosensitivity through a FOXO1-modulated positive feedback loop with mTOR-p-PI3K/AKT-c-JUN[J]. Nat Commun, 2016, 7: 11309. DOI:10.1038/ncomms11309 |
| [19] |
PARK J, KO Y S, YOON J, et al. The forkhead transcription factor FOXO1 mediates cisplatin resistance in gastric cancer cells by activating phosphoinositide 3-kinase/Akt pathway[J]. Gastric Cancer, 2014, 17(3): 423-430. DOI:10.1007/s10120-013-0314-2 |
| [20] |
王孝强, 李荀, 曾凡星. 运动骨骼肌ERK1/2与mTOR通路关系的研究[J]. 沈阳体育学院学报, 2016, 35(5): 49-55. WANG X Q, LI X, ZENG F X. Relationship between mTOR and ERK1/2 pathway in rat's skeletal muscle during exercise[J]. J Shenyang Sport Univ, 2016, 35(5): 49-55. DOI:10.3969/j.issn.1004-0560.2016.05.010 |
| [21] |
ZHOU P X, BLAIN A E, NEWMAN A M, et al. Sporadic and endemic Burkitt lymphoma have frequent FOXO1 mutations but distinct hotspots in the AKT recognition motif[J]. Blood Adv, 2019, 3(14): 2118-2127. DOI:10.1182/bloodadvances.2018029546 |
| [22] |
ZHANG K B, GUO X Q, YAN H, et al. Phosphorylation of forkhead protein FoxO1 at S253 regulates glucose homeostasis in mice[J]. Endocrinology, 2019, 160(5): 1333-1347. DOI:10.1210/en.2018-00853 |
| [23] |
JU Y H, XU T J, ZHANG H K, et al. FOXO1-dependent DNA damage repair is regulated by JNK in lung cancer cells[J]. Int J Oncol, 2014, 44(4): 1284-1292. DOI:10.3892/ijo.2014.2269 |
| [24] |
HORI Y, OZEKI M, HIROSE K, et al. Analysis of mTOR pathway expression in lymphatic malformation and related diseases[J]. Pathol Int, 2020. DOI:10.1111/pin.12913 |
| [25] |
付鹏宇, 胡扬, 李燕春, 等. 低氧暴露所致大鼠骨骼肌萎缩的蛋白转化调节机制[J]. 中国实验动物学报, 2019, 27(4): 423-432. FU P Y, HU Y, LI Y C, et al. Protein turnover regulation mechanism of rat skeletal muscle atrophy induced by hypoxia[J]. Acta Lab Animalis Sci Sin, 2019, 27(4): 423-432. DOI:10.3969/j.issn.1005-4847.2019.04.002 |
| [26] |
KANAO T, SAWADA T, DAVIES S A, et al. The nitric oxide-cyclic GMP pathway regulates FoxO and alters dopaminergic neuron survival in Drosophila[J]. PLoS ONE, 2012, 7(2): e30958. DOI:10.1371/journal.pone.0030958 |
| [27] |
RENA G, WOODS Y L, PRESCOTT A R, et al. Two novel phosphorylation sites on FKHR that are critical for its nuclear exclusion[J]. EMBO J, 2002, 21(9): 2263-2271. DOI:10.1093/emboj/21.9.2263 |
| [28] |
ZHANG X H, GAN L X, PAN H Y, et al. Phosphorylation of serine 256 suppresses transactivation by FKHR (FOXO1) by multiple mechanisms. Direct and indirect effects on nuclear/cytoplasmic shuttling and DNA binding[J]. J Biol Chem, 2002, 277(47): 45276-45284. DOI:10.1074/jbc.M208063200 |



