2. 430070 武汉,中国人民解放军中部战区总医院医学实验科
2. Department of Medical Laboratory, General Hospital of Central Theater Command of PLA, Wuhan, Hubei Province, 430070, China
胶质瘤主要来源于脑胶质细胞区,是中枢神经系统恶性程度最高的原发性肿瘤。现阶段,治疗胶质瘤的主要手段是通过手术及联合放化疗,但胶质瘤细胞容易对周围正常组织浸润性侵袭,所以难以根治,容易复发。这直接影响人脑正常的神经功能。患者会产生较大的心理负担,严重降低了他们的生活质量[1-2]。早期诊断是任何肿瘤防治的有力措施之一,但迄今为止人胶质瘤仍较为缺乏诊断和进展的标志物。
作为Rab蛋白家族的成员之一,近些年国内外有研究表明,Rab18表达与多种恶性肿瘤有着密切的关系[3]。Rab18能造成肝癌细胞增殖,引起上皮间质转化(epithelial mesenchymal transition, EMT),使肝癌细胞摆脱细胞间粘附,获得浸润侵袭能力[4]。过表达Rab18能促进胃癌细胞凋亡[5]。Rab18在非小细胞肺癌组织的表达显著高于癌旁正常肺组织[6]。Rab18可作为乳腺癌早期诊断和判断预后的理想型分子标志物[7]。但Rab18对人类胶质瘤的作用并不明确,本研究通过沉默Rab18的方法探讨Rab18对U87胶质瘤细胞增殖和凋亡的影响机制,进而初步验证Rab18表达水平在人胶质瘤诊断和进展的价值,为胶质瘤诊断和进展提供一个理想的生物分子标志物。
1 材料与方法 1.1 细胞和主要试剂人胶质瘤U87细胞购自江苏泽雨;胎牛血清、BCA蛋白定量试剂盒购自北京索莱宝;DMEM培养基、Opti-MEM培养基均购自美国HyClone;siRNA质粒购自上海维三;LipofactamineTM 2000、TRIzol均购自美国Invitrogen;兔抗人Rab18、兔抗人P53、兔抗人Caspase 7、鼠抗人GAPDH均购自武汉三鹰;兔抗人Bim、兔抗人Bax均购自美国CST;PCR引物均购自北京擎科;细胞计数-8(Cell Counting Kit-8, CCK-8)购自日本Dojindo;细胞凋亡检测试剂盒购自美国BD;细胞周期检测试剂盒购自杭州联科。
1.2 细胞培养及转染将人胶质瘤U87细胞接种于含10%胎牛血清的DMEM培养基,并在5% CO2,95%湿度,37 ℃的恒温培养箱中培养。使用含25% EDTA胰蛋白酶消化,以1 :3比例进行传代培养。待人胶质瘤U87细胞贴壁生长至90%融合度时,收集细胞,将细胞浓度调整至1×109/L接种于6孔板,每孔2 mL。培养24 h后,U87细胞分成3组,即空白对照组(WT)、阴性对照组(siNC)和Rab18沉默组(siRab18, 5′-CCAGAAUAAA-GGAGUCAAATT-3′),将siNC组和siRab18组分别转染NC siRNA和Rab18 siRNA,WT组不转染。
1.3 qRT-PCR检测mRNA表达、Western blot检测蛋白表达转染48 h后收集各组细胞,根据逆转录试剂盒说明书,将mRNA逆转录成cDNA后,使用实时荧光PCR仪LightCycle96进行qRT-PCR,靶基因包括Rab18、内参基因GAPDH及凋亡相关蛋白P53、Caspase 7、Bim和Bax。反应条件如下:95 ℃预变性3 min,两步法:在95 ℃ 3 s,在60 ℃ 30 s,共40个循环。内参采用GAPDH,相对定量的表达的计算方法为2-ΔΔCt。
转染48 h后收集各组细胞,用细胞蛋白裂解液提取总蛋白,BCA蛋白定量试剂盒定量蛋白浓度,以15% SDS-PAGE,转至硝酸纤维素(NC)膜,5%脱脂牛奶封闭2 h,分别加入一抗(Rab18、P53、Caspase 7、Bax和Bim,均为1 :1 000),4 ℃孵育过夜后,加入二抗(1 :3 000)室温孵育90 min,ECL反应2 min,暗室曝光,显影、定影处理,采用Image J软件进行灰度分析。
1.4 CCK-8检测细胞增殖转染后分别以浓度为2×104/孔接种在96孔板中,置于37 ℃,5% CO2的培养箱中培养。分别在转染第0、24、48 h和72 h,向每个孔加入10 μL CCK-8溶液,再放回培养箱内孵育2 h,使用酶标分析仪(RT-6500)测量每孔波长450 nm处的光密度值[D(450)]。
1.5 流式细胞术检测细胞周期和细胞凋亡转染48 h后收集各组细胞,用含25% ETDA胰蛋白酶消化成悬浮细胞,预冷的PBS漂洗,收集大约1×106个细胞/mL,分别进行细胞周期和细胞凋亡检测。
细胞周期检测:用70%乙醇在4 ℃下固定过夜。次日1 000 r/min离心10 min,弃乙醇,加入5 mL室温的PBS静置15 min。弃上清,加入碘化丙啶(PI)染色,室温避光孵育30 min后,上流式细胞仪检测,采用Novoexpress软件分析G0/G1期、S期和G2/M期细胞所占的百分比。
细胞凋亡检测:每管加入500 μL Binding Buffer重悬。设置阴性对照:不加染料;单阳对照1 :10 μL Annexin V-FITC;单阳对照2 :5 μL PI,样本管:10 μL Annexin V-FITC和5 μL PI,混匀后室温避光孵育30 min,上流式细胞仪检测,采用Novoexpress软件分析细胞早期凋亡(Annexin V+, PI-)和晚期凋亡(Annexin V+, PI+)细胞所占的百分比。
1.6 HE染色观察组织形态学脑组织用甲醛固定后,依次按脱水、包埋、切片、脱蜡、染色、分化、再染色、封片的步骤制作病理切片,然后置于光学显微镜下观察瘤旁正常脑组织与不同级别胶质瘤组织的组织学形态变化。
1.7 临床标本来源选取2018年1月至2019年1月在中国人民解放军中部战区总医院留存的胶质瘤手术患者瘤组织标本33例(Glioma组)及瘤旁组织标本15例(Normal组),所有患者术前未接受放化疗。基于2016年世界卫生组织(World Health Organization, WHO)中枢神经系统肿瘤分类将胶质瘤组织标本分为低级别组14例(WHOⅠ~Ⅱ, n=14)和高级别组19例(WHO Ⅲ~Ⅳ, n=19),切除后立即编号登记入库,置于-80 ℃保存。均获得患者书面知情同意,并得到中国人民解放军中部战区总医院伦理委员会的批准([2018]010-1)。
1.8 统计学分析使用GraphPad Prism 6.0软件进行统计分析,计量资料以x±s表示,两组间比较采用独立样本t检验,多组间比较采用方差分析。检验水准α=0.05。
2 结果 2.1 转染后人胶质瘤U87细胞Rab18 mRNA和蛋白的表达成功转染合成siRNA的人胶质瘤U87细胞呈亮绿色荧光(图 1A)。转染成功的人胶质瘤U87细胞分为3组:siRab18组(转染Rab18 siRNA),siNC组(转染NC siRNA)和WT组(不转染,作为空白对照)。siRab18组细胞Rab18 mRNA和蛋白的表达显著低于WT组和siNC组(P < 0.01),WT与siNC组间差异无统计学意义(P>0.05,图 1B、C)。

|
| A:人胶质瘤U87细胞siRNA荧光转染结果;B:沉默Rab18后人胶质瘤U87细胞中Rab18 mRNA表达水平;C:沉默Rab18后人胶质瘤U87细胞中Rab18蛋白表达水平 WT:空白对照组;siNC:阴性对照组;siRab18:Rab18沉默组;a:P < 0.01,与WT组和siNC组比较 图 1 沉默Rab18后人胶质瘤U87细胞Rab18 mRNA和蛋白的表达 |
2.2 沉默Rab18可抑制人胶质瘤U87细胞增殖
为了观察沉默Rab18对人胶质瘤U87细胞增殖的影响,进行了CCK-8实验。实验结果显示,siRab18组细胞增殖水平显著低于WT组和siNC组(P < 0.01),WT与siNC组间差异无统计学意义(P>0.05,图 2A)。
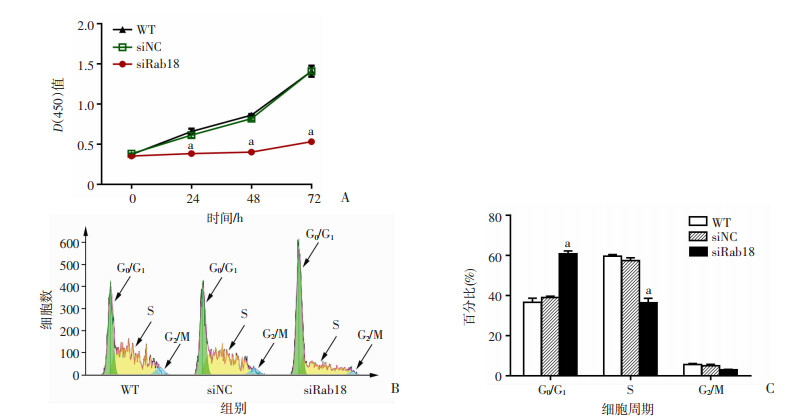
|
|
A:沉默Rab18后人胶质瘤U87细胞增殖情况;B、C:沉默Rab18后人胶质瘤U87各周期细胞分布变化与所占百分比 a:P < 0.01,与WT组和siNC组比较 图 2 沉默Rab18对人胶质瘤U87细胞增殖的影响 |
siRab18组G0/G1期细胞所占百分比显著高于WT组和siNC组,伴随S期细胞所占百分比显著低于WT组和siNC组(P < 0.01),而siNC组和WT组间各期细胞所占百分比差异并无统计学意义(P>0.05,图 2B、C)。说明沉默Rab18后,人胶质瘤U87细胞增殖受到抑制与周期停滞于G0/G1期有关。
2.3 沉默Rab18可诱导人胶质瘤U87细胞凋亡siRab18组细胞凋亡率显著高于WT组和siNC组(P < 0.01,图 3A),WT组与siNC组间差异无统计学意义(P>0.05),表明沉默Rab18对人胶质瘤细胞有促凋亡的作用。另外,siRab18组细胞凋亡相关蛋白P53、Caspase 7、Bax及Bim mRNA和蛋白表达显著高于WT组和siNC组(P < 0.01,图 3B~D),而WT组和siNC组间差异无统计学意义(P>0.05)。这可能是促进胶质瘤细胞凋亡的重要作用机制。
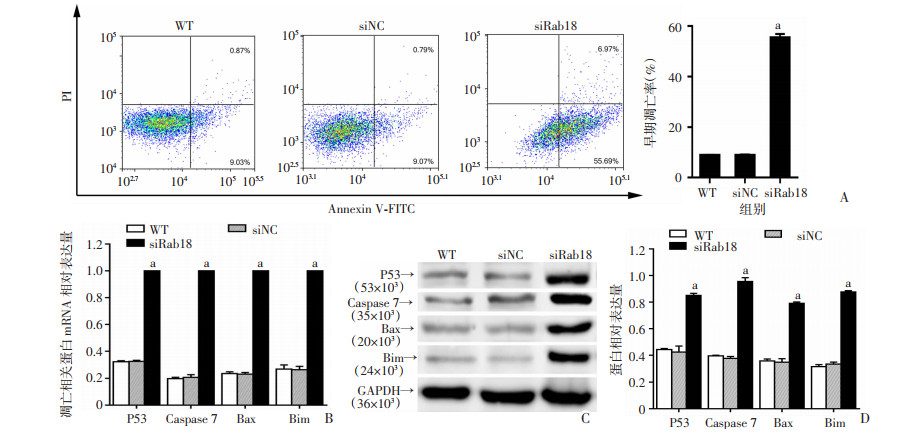
|
|
A:沉默Rab18后人胶质瘤U87细胞凋亡率;B:沉默Rab18后人胶质瘤U87细胞凋亡相关蛋白P53、Caspase 7、Bax和Bim mRNA表达水平;C, D:Westerm blot检测沉默Rab18后人胶质瘤U87细胞凋亡相关蛋白P53、Caspase 7、Bax和Bim蛋白表达水平 a:P < 0.01,与WT组和siNC组比较 图 3 沉默Rab18对人胶质瘤U87细胞凋亡的影响 |
2.4 Rab18在人胶质瘤组织的表达
共纳入33例胶质瘤组织和15例瘤旁正常脑组织其中将14例WHO Ⅰ~Ⅱ级胶质瘤组织作为低级别组,19例WHO Ⅲ~Ⅳ级胶质瘤组织作为高级别组,患者基本信息如表 1所示。HE染色结果显示,瘤旁正常脑组织结构清晰,形态未见明显异常;低级别胶质瘤中,细胞排列稍密集,核大,核仁明显发育不良,轻度异型改变;高级别胶质瘤组织中,细胞密度高,分化差,形态呈梭形,核分裂象多见,可见大片肿瘤性坏死,瘤周细胞呈栅栏状排列(图 4A)。qRT-PCR和Western blot实验结果显示,Rab18 mRNA和蛋白均表达于人胶质瘤组织(n=33)和瘤旁正常脑组织(n=15)中,但在人胶质瘤组织中高表达(P < 0.01,图 4B、C)。并且高级别胶质瘤(WHO Ⅲ~Ⅳ, n=19)比低级别胶质瘤(WHO Ⅰ~Ⅱ, n=14)Rab18的高表达更为显著(P < 0.01,图 4D、E)。
| 级别 | 例数 | 年龄/岁 | 女性比例 | 诊断 |
| WHO Ⅰ~Ⅱ级 | 14 | 31~67 | 35.70% | 节细胞胶质瘤、星形胶质细胞瘤、少突胶质细胞瘤 |
| WHO Ⅲ~Ⅳ级 | 19 | 31~72 | 47.40% | 间变性少突胶质细胞瘤、间变性星形细胞瘤、胶质母细胞瘤 |

|
| A:瘤旁正常脑组织与不同级别胶质瘤组织形态学变化(HE×200);B:人胶质瘤组织和瘤旁正常脑组织Rab18 mRNA表达水平;C:人胶质瘤组织和瘤旁正常脑组织Rab18蛋白表达水平;D:不同级别胶质瘤Rab18 mRNA表达水平;E:不同级别胶质瘤Rab18蛋白表达水平 a:P < 0.01,与Normal组比较;b:P < 0.01,与低级别组比较 图 4 人胶质瘤和瘤旁正常脑组织形态学变化及Rab18的表达水平 |
3 讨论
根据WHO中枢神经系统肿瘤分类,可将胶质瘤分为低级别胶质瘤(WHOⅠ~Ⅱ)和高级别胶质瘤(WHO Ⅲ~Ⅳ),其中胶质母细胞瘤恶性程度最高,患者生存率最低[8]。探索出更多的胶质瘤生物学分子标志物,对胶质瘤的诊断和治疗提供更有效的帮助,是目前胶质瘤科学研究领域研究热点。
本研究为了验证Rab18与胶质瘤的相关性,通过siRNA转染技术特异性沉默人胶质瘤U87细胞Rab18的表达,发现沉默Rab18能显著抑制胶质瘤细胞的增殖,同时诱导细胞凋亡。本研究发现,沉默Rab18能使胶质瘤U87细胞停滞于G0/G1期,从而导致细胞的生长增殖受到抑制。有研究表明Rab18不仅能促进周期蛋白D1(cyclin D1)的表达,还能抑制细胞周期蛋白依赖激酶抑制剂(cyclin-dependent kinase inhibitor, CKI)的表达[4],证实了本研究观点。另外,了解肿瘤细胞凋亡不仅能深入了解肿瘤的发病机制,还能为肿瘤的治疗提供线索。在此,我们探讨了沉默Rab18如何促进胶质瘤U87细胞凋亡的潜在机制。Caspase 7是依赖P53的下游关键效应物之一[9],沉默Rab18能使P53活化,导致下游Caspase 7活化引起胶质瘤细胞凋亡。而Bim和Bax是两种促凋亡蛋白,Bim通过构象变化激活Bak和Bax,导致细胞线粒体通透性转换孔开放从而诱导细胞凋亡[10]。本研究发现,在沉默了Rab18的人胶质瘤细胞中,P53、Caspase 7、Bim和Bax mRNA和蛋白的表达显著增加,说明沉默Rab18能通过促进胶质瘤细胞凋亡相关蛋白P53/Caspase 7和Bax/Bim的表达而发挥抗肿瘤作用。还有部分研究证明,多种Rab蛋白的表达与恶性肿瘤有着密切的关系,其中包括调控胶质瘤的发生、发展[11],本研究发现,Rab18的表达与胶质瘤的分级和进展密切相关,恶性程度越高,Rab18表达水平越高,说明Rab18表达水平对人类胶质瘤的诊断和进展具有重要作用。
本研究通过沉默Rab18的方法探讨Rab18对人类胶质瘤U87细胞增殖和凋亡影响机制,结果显示沉默Rab18不仅能使细胞周期停滞于G0/G1期,抑制肿瘤的增殖,还能促进凋亡蛋白的表达诱导细胞凋亡。本研究还发现Rab18能高表达于人胶质瘤组织中,且表达水平与恶性程度呈正比。目前的研究发现,Rab18可作为人类胶质瘤一个潜在的临床诊断和病程进展及预后判断的生物标志物。
| [1] |
BAHADUR S, SAHU A K, BAGHEL P, et al. Current promising treatment strategy for glioblastoma multiform: a review[J]. Oncol Rev, 2019, 13(2): 417. DOI:10.4081/oncol.2019.417 |
| [2] |
REARDON D A, WEN P Y. Therapeutic advances in the treatment of glioblastoma: rationale and potential role of targeted agents[J]. Oncologist, 2006, 11(2): 152-164. DOI:10.1634/theoncologist.11-2-152 |
| [3] |
MVLLER M P, GOODY R S. Molecular control of rab activity by GEFs, GAPs and GDI[J]. Small GTPases, 2018, 9(1/2): 5-21. DOI:10.1080/21541248.2016.1276999 |
| [4] |
GONG T, ZHOU B X, LIU M Y, et al. RAB18 promotes proliferation and metastasis in hepatocellular carcinoma[J]. Am J Transl Res, 2019, 11(2): 1009-1019. |
| [5] |
LIU J C, ZHANG J K, LI Y S, et al. MiR-455-5p Acts as a novel tumor suppressor in gastric cancer by down-regulating RAB18[J]. Gene, 2016, 592(2): 308-315. DOI:10.1016/j.gene.2016.07.034 |
| [6] |
ZHONG K, CHEN K, HAN L, et al. MicroRNA-30b/c inhibits non-small cell lung cancer cell proliferation by targeting Rab18[J]. BMC Cancer, 2014, 14: 703. DOI:10.1186/1471-2407-14-703 |
| [7] |
YE F, TANG H L, LIU Q, et al. MiR-200b as a prognostic factor in breast cancer targets multiple members of RAB family[J]. J Transl Med, 2014, 12: 17. DOI:10.1186/1479-5876-12-17 |
| [8] |
YAN W, ZHANG W, YOU G, et al. Molecular classification of gliomas based on whole genome gene expression: a systematic report of 225 samples from the Chinese Glioma Cooperative Group[J]. Neuro-oncology, 2012, 14(12): 1432-1440. DOI:10.1093/neuonc/nos263 |
| [9] |
YANG S H, WANG S M, SYU J P, et al. Andrographolide induces apoptosis of C6 glioma cells via the ERK-p53-caspase 7-PARP pathway[J]. Biomed Res Int, 2014, 2014: 312847. DOI:10.1155/2014/312847.DOI:10.1155/2014/312847 |
| [10] |
ZHAO L, FENG Y, SHI A W, et al. Apoptosis induced by microbubble-assisted acoustic cavitation in K562 cells: the predominant role of the cyclosporin A-dependent mitochondrial permeability transition pore[J]. Ultrasound Med Biol, 2015, 41(10): 2755-2764. DOI:10.1016/j.ultrasmedbio.2015.05.021 |
| [11] |
WU Q W, SUN X Q, YUE W H, et al. RAB18, a protein associated with Warburg Micro syndrome, controls neuronal migration in the developing cerebral cortex[J]. Mol Brain, 2016, 9: 19. DOI:10.1186/s13041-016-0198-2 |



