2. 050000 石家庄,河北省儿童医院新生儿科;
3. 400016 重庆,重庆医科大学基础医学院病原生物学教研室;
4. 050000 石家庄,河北省儿童医院重症监护二科
2. Department of Neonatology, Children's Hospital of Hebei Province, Shijiazhuang, Hebei Province, 050000;
3. Department of Pathogenic Biology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China;
4. Second Department of Intensive Care Medicine, Children's Hospital of Hebei Province, Shijiazhuang, Hebei Province, 050000
小儿哮喘的直接原因是支气管上皮细胞损伤和功能障碍;在外界刺激性物质诱导下支气管上皮细胞结构和功能遭到破坏,产生炎症因子和细胞凋亡是哮喘患儿支气管上皮细胞损伤的机制之一[1-2]。研究表明非编码RNA(non-coding RNA)包括miRNA和lncRNA等在重症哮喘患者中多出现异常表达,可能参与哮喘的发病机制,调节支气管上皮细胞凋亡、炎症等过程[3]。也有研究表明lncRNA NKILA在组织和细胞发生炎症时发挥调控作用,例如lncRNA NKILA在骨关节炎软骨组织[4]和缺氧/复氧诱导的心肌细胞损伤中[5]表达下调,上调其表达可抑制细胞凋亡和炎症反应。lncRNA NKILA在支气管上皮细胞损伤中的表达尚不清楚。本研究通过生物信息学预测发现,miR-1236-3p可能与lncRNA NKILA存在结合位点。已知miR-1236-3p与细胞的凋亡有关[6]。基于以上研究结论和预测结果,本研究通过建立人支气管上皮细胞(human bronchial epithelial cells,16HBE)的LPS损伤模型,假设在脂多糖(lipopolysaccharide,LPS)诱导的16HBE细胞中lncRNA NKILA可靶向调控miR-1236-3p的表达影响细胞损伤和凋亡,以期为小儿哮喘的基础研究提供新的思路。
1 材料与方法 1.1 材料永生化人支气管上皮细胞系16HBE购自北京北纳生物;胎牛血清(fetal bovine serum, FBS)、DMEM高糖培养基购自美国Hyclone公司,胰蛋白酶、LPS购自Sigma-Aldrich公司;Total RNA提取试剂盒、反转录试剂盒(RT-PCR)、Real-time PCR试剂盒购自宝生物工程(大连)有限公司;Lipofectamine 2000转染试剂盒购自美国Invitrogen公司;白细胞介素6(interleukin 6, IL-6)、白细胞介素13(interleukin 13, IL-13)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒购自北京索莱宝科技有限公司;双荧光素酶报告系统(Dual-Luciferase Reporter Assay System)购自美国Promega公司;引物、lncRNA NKILA过表达载体(pcDNA-NKILA)、lncRNA NKILA干扰物(si-NKILA)、miR-1236-3p mimics(miR-1236-3p)、miR-1236-3p抑制剂(anti-miR-1236-3p)、空载体和阴性对照(pcDNA、miR-NC、anti-miR-NC和si-NC)及lncRNA NKILA突变型和野生型双荧光素酶载体购自上海吉玛制药技术有限公司;Bcl-2抗体、Bax抗体和抗GAPDH抗体购自英国Abcam公司;流式法细胞凋亡检测试剂盒、BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;流式细胞仪购自BD公司,Real-time PCR仪购自美国Bio-Rad公司。
1.2 方法 1.2.1 细胞培养将16HBE细胞培养于含有10%胎牛血清、100 U/mL青霉素和10 mg/L链霉素的DMEM高糖培养基中,培养条件:饱和湿度、37 ℃ 5% CO2恒温密闭培养箱中培养。当细胞生长至对数生长期,1 :2消化传代。
1.2.2 细胞LPS模型构建和实验分组LPS模型建立:根据文献[7]进行16HBE细胞LPS模型的建立,将对数生长期的16HBE细胞以1×106个细胞/孔接种于6孔板,细胞密度达到80%时每孔加入终浓度50 μg/mL LPS培养24 h,收集细胞进行实验。
实验分组:对照Con组:以正常DMEM高糖培养基培养;LPS组:按照模型建立的方法进行培养24 h;实验组(LPS+转染组):细胞转染48 h后进行LPS模型的建立。
1.2.3 细胞转染常规培养16HBE细胞,当细胞融合度达到70%时根据Lipofectamine 2 000转染试剂盒说明书进行细胞转染。转染分组:pcDNA组和pcDNA-NKILA组,si-NC组和si-NKILA组,miR-NC组和miR-1236-3p组,anti-miR-NC组和anti-miR-1236-3p组;pcDNA-NKILA+miR-NC组和pcDNA-NKILA+miR-1236-3p组。转染48 h,收集细胞,根据1.2.4检测细胞中miR-1236-3p和lncRNA NKILA的含量,验证转染效果。
1.2.4 Real-time PCR检测miR-1236-3p和lncRNA NKILA的表达收集LPS处理和/或转染过的16HBE细胞,用Total RNA提取试剂盒提取细胞总RNA,以反转录试剂盒说明书反转录合成cDNA,测定合成的cDNA的浓度和纯度,以cDNA为模板按照Real-time PCR试剂盒的说明书进行反应合成lncRNA NKILA和miR-1236-3p mRNA。引物如下,lncRNA NKILA上游引物:5′-CTGTCGGGGACTGGTGTATT-3′,下游引物:5′-AATACACCAGTCCCCGACAG-3′;miR-1236-3p上游引物:5′-CCAATCAGCCTCTTCCCCTT-3′,下游引物:5′-TATGGTTGTTCACGACTCCTTCAC-3′;用2-ΔΔCt法进行数据分析。
1.2.5 检测细胞中IL-6、IL-13和TNF-α的含量收集各组16HBE细胞培养上清,离心后按照IL-6、IL-13和TNF-α试剂盒说明书操作,检测培养上清中IL-6、IL-13和TNF-α的含量。
1.2.6 流式细胞术测定细胞凋亡率将各组16HBE细胞接种于6孔板中(1×106个细胞/孔),培养24 h,收集并洗涤细胞2次,将细胞稀释为1×105个/mL,取200 μL 1×Binding buffer重悬细胞,然后加入5 μL Annexin V-FITC和10 μL碘化丙啶(PI),室温避光15 min,再加入300 μL 1×Binding buffer,上流式细胞仪分析细胞凋亡率。
1.2.7 双荧光素酶报告系统实验根据1.2.3进行转染前的16HBE细胞培养,然后按照Dual-Luciferase Reporter Assay System试剂盒说明书进行操作转染,将构建的含有lncRNA NKILA与miR-1236-3p预测结合位点的野生型(WT-NKILA)和突变型(MUT-NKILA)双荧光素酶报告载体,分别与miR-NC或miR-1236-3p共转染16HBE细胞。转染48 h,收集细胞,裂解细胞,离心收集上清,以海肾荧光素酶活性为内参照,检测萤火虫相对荧光素酶活性。
1.2.8 Western blot检测凋亡相关蛋白Bax和Bcl-2收集16HBE细胞,加入细胞裂解液室温裂解细胞,收集细胞总蛋白,检测蛋白浓度,进行SDS-PAGE,转PVDF膜,室温封闭2 h,加入一抗(Bcl-2抗体1 :1 000,Bax抗体1 :1 000,GAPDH抗体1 :5 000),4 ℃过夜孵育,洗膜3次,加入稀释的酶标二抗,室温孵育2 h,显影拍照,分析蛋白灰度。
1.3 统计学处理用SPSS19.0软件进行数据统计分析,所有数据均以x±s表示;两组间比较采用独立样本t检验,多组间比较分别采用单因素方差分析。
2 结果 2.1 lncRNA NKILA靶向调控miR-1236-3p的表达通过LncBase Predicted v.2预测发现,lncRNA NKILA的序列中含有与miR-1236-3p互补的序列(图 1A)。双荧光素酶报告系统结果显示,过表达miR-1236-3p可显著下调野生型WT-NKILA组细胞中萤火虫荧光素酶相对活性(P < 0.05);而突变型MUT-NKILA的萤火虫荧光素酶相对活性没有明显变化(图 1B)。qRT-PCR实验结果显示,过表达lncRNA NKILA可下调miR-1236-3p表达(P < 0.05);抑制lncRNA NKILA表达则上调miR-1236-3p表达(P < 0.05,图 1C)。说明lncRNA NKILA靶向负调控miR-1236-3p的表达。
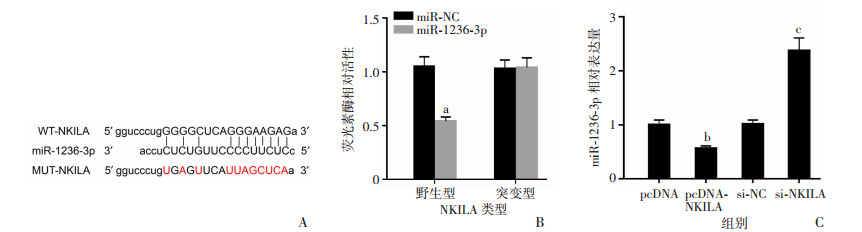
|
| A: lncRNA NKILA序列中含有与miR-1236-3p互补的核苷酸序列;B:双荧光素酶报告实验(n=9, x±s);C: lncRNA NKILA调控miR-1236-3p的表达(n=9, x±s) a:P < 0.05,与miR-NC组比较;b:P < 0.05,与pcDNA组比较;c:P < 0.05,与si-NC组比较 图 1 lncRNA NKILA靶向调控miR-1236-3p的表达 |
2.2 lncRNA NKILA和miR-1236-3p在LPS诱导的支气管上皮细胞16HBE损伤中的表达
经预实验结果显示,50 μg/mL LPS处理16HBE 24 h对细胞的抑制效果最好且不显著影响细胞活性,后续实验采用50 μg/mL LPS处理16HBE 24 h建立细胞损伤模型。与对照Con组相比,LPS组支气管上皮细胞16HBE中lncRNA NKILA含量显著降低(1.00±0.06 vs 0.43±0.04,P < 0.05),miR-1236-3p的含量显著升高(1.00±0.05 vs 3.63±0.33,P < 0.05)。
2.3 lncRNA NKILA过表达对LPS诱导的16HBE细胞炎症因子释放的影响与对照Con组相比,LPS组16HBE细胞中lncRNA NKILA含量下降(P < 0.05),炎症因子IL-6、IL-13和TNF-α含量均显著升高(P < 0.05);过表达lncRNA NKILA的16HBE细胞LPS诱导后结果相反,见表 1。说明LPS可下调lncRNA NKILA表达并促进16HBE产生炎症反应;过表达lncRNA NKILA可减轻LPS诱导的16HBE细胞炎症损伤,提高细胞的抗炎症能力。
| 分组 | NKILA | IL-6/pg·mL-1 | IL-13/pg·mL-1 | TNF-α/pg·mL-1 |
| Con | 1.00±0.07 | 41.25±4.38 | 6.29±0.64 | 53.61±5.33 |
| LPS | 0.46±0.04a | 83.22±8.14a | 37.22±3.51a | 128.33±14.25a |
| LPS+pcDNA | 0.43±0.05 | 85.69±8.57 | 38.69±3.59 | 129.65±12.54 |
| LPS+pcDNA-NKILA | 0.75±0.07b | 50.65±5.37b | 10.42±1.33b | 69.34±6.79b |
| F | 186.993 | 97.794 | 389.135 | 129.234 |
| P | 0.000 | 0.000 | 0.000 | 0.000 |
| a: P < 0.05,与Con组比较;b: P < 0.05,与LPS+pcDNA组比较 | ||||
2.4 lncRNA NKILA过表达对LPS诱导的支气管上皮16HBE细胞凋亡的影响
与对照Con组相比,LPS诱导的16HBE细胞凋亡率明显升高(P < 0.05),抗凋亡蛋白Bcl-2表达降低(P < 0.05),凋亡蛋白Bax表达升高(P < 0.05);过表达lncRNA NKILA组16HBE经LPS诱导后结果相反,见图 2和表 2。说明LPS可诱导16HBE细胞凋亡;过表达lncRNA NKILA可抑制LPS诱导的16HBE细胞凋亡。
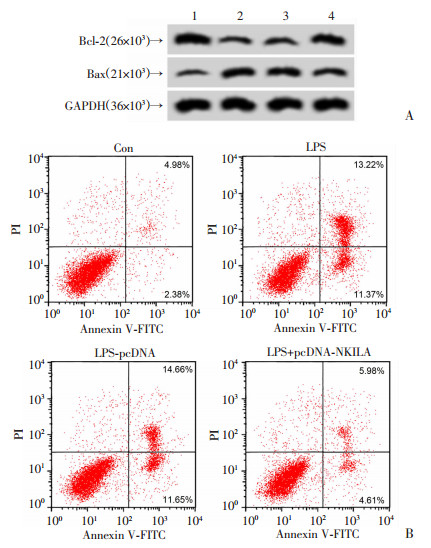
|
| A:凋亡相关蛋白表达1:Con组;2:LPS组;3:LPS+pcDNA组;4:LPS+pcDNA-NKILA组;B:细胞凋亡流式 图 2 lncRNA NKILA过表达对LPS诱导的支气管上皮细胞16HBE凋亡的影响 |
| 分组 | 凋亡率/% | Bcl-2蛋白 | Bax蛋白 |
| Con | 7.36±0.74 | 0.73±0.07 | 0.22±0.02 |
| LPS | 24.59±2.87a | 0.29±0.03a | 0.57±0.05a |
| LPS+pcDNA | 26.31±2.34 | 0.28±0.03 | 0.58±0.06 |
| LPS+pcDNA-NKILA | 10.59±1.08b | 0.64±0.06b | 0.31±0.03b |
| F | 216.346 | 191.184 | 162.486 |
| P | 0.000 | 0.000 | 0.000 |
| a: P < 0.05,与Con组比较;b: P < 0.05,与LPS+si-NC组比较 | |||
2.5 干扰miR-1236-3p表达对LPS诱导的支气管上皮16HBE细胞损伤的影响
与对照Con组相比,LPS诱导的16HBE细胞中miR-1236-3p含量显著升高,IL-6、IL-13和TNF-α含量显著升高,细胞凋亡率升高,Bcl-2表达降低,Bax含量升高,均具有统计学意义(P < 0.05);而干扰miR-1236-3p表达组则结果相反,见图 3和表 3。说明LPS可上调16HBE中miR-1236-3p含量,促进细胞炎症损伤并诱导细胞凋亡;干扰miR-1236-3p表达可减轻LPS诱导的16HBE细胞损伤并抑制细胞凋亡。

|
| A:凋亡相关蛋白表达1: LPS+pcDNA; 2: LPS+pcDNA-NKILA; 3: LPS+pcDNA-NKILA+miR-NC; 4: LPS+pcDNA-NKILA+miR-1236-3P;B:细胞凋亡流式图 图 3 干扰miR-1236-3p表达对LPS诱导的支气管上皮细胞16HBE凋亡的影响 |
| 分组 | miR-1236-3p | IL-6/pg·mL-1 | IL-13/pg·mL-1 | TNF-α/pg·mL-1 | 凋亡率/% | Bcl-2蛋白 | Bax蛋白 |
| Con | 1.00±0.06 | 40.36±4.18 | 7.12±0.71 | 52.36±5.17 | 6.25±0.63 | 0.75±0.07 | 0.21±0.02 |
| LPS | 3.56±0.37a | 84.32±8.14a | 38.14±3.81a | 121.52±11.41a | 23.14±2.31a | 0.31±0.03a | 0.58±0.05a |
| LPS+anti-miR-NC | 3.61±0.36 | 87.33±8.29 | 39.58±3.22 | 124.59±12.37 | 25.96±2.58 | 0.30±0.03 | 0.59±0.06 |
| LPS+anti-miR-1236-3p | 1.68±0.17b | 59.14±5.21b | 16.47±1.65b | 78.22±7.63b | 12.39±1.24b | 0.61±0.06b | 0.36±0.03b |
| F | 211.604 | 99.039 | 331.796 | 119.816 | 219.527 | 175.311 | 164.270 |
| P | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| a: P < 0.05,与Con组比较;b: P < 0.05,与LPS+anti-miR-NC组比较 | |||||||
2.6 miR-1236-3p过表达逆转了lncRNA NKILA过表达对LPS诱导的支气管上皮细胞损伤的作用
在LPS诱导的16HBE细胞中,过表达lncRNA NKILA可抑制miR-1236-3p表达并抑制细胞凋亡,减轻细胞炎症损伤;而在LPS诱导的16HBE细胞中同时过表达lncRNA NKILA和miR-1236-3p则结果相反,miR-1236-3p含量升高,细胞中IL-6、IL-13和TNF-α含量均升高,细胞凋亡率上升,Bcl-2表达降低,Bax表达明显升高,均具有统计学意义(P < 0.05),见图 4、表 4。说明过表达miR-1236-3p可逆转过表达lncRNA NKILA对LPS诱导的16HBE细胞损伤的作用。
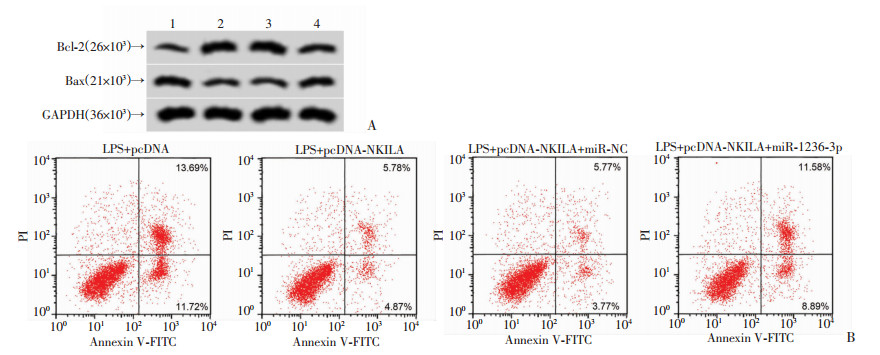
|
| A:凋亡相关蛋白表达1: LPS+pcDNA; 2: LPS+pcDNA-NKILA; 3: LPS+pcDNA-NKILA+miR-NC; 4: LPS+pcDNA-NKILA+miR-1236-3p;B:细胞凋亡流式图 图 4 miR-1236-3p过表达逆转了lncRNA NKILA过表达对LPS诱导的16HBE细胞凋亡 |
| 分组 | miR-1236-3p | IL-6/pg·mL-1 | IL-13/pg·mL-1 | TNF-α/pg·mL-1 | 凋亡率/% | Bcl-2蛋白 | Bax蛋白 |
| LPS+pcDNA | 1.00±0.08 | 86.14±8.22 | 37.54±2.71 | 127.14±11.65 | 25.41±2.51 | 0.27±0.03 | 0.59±0.05 |
| LPS+pcDNA-NKILA | 0.53±0.05a | 53.19±5.32a | 11.42±1.18a | 67.32±6.74a | 10.65±1.08a | 0.65±0.06a | 0.30±0.03a |
| LPS+pcDNA-NKILA+miR-NC | 0.51±0.05 | 50.48±5.12 | 10.65±1.09 | 65.28±6.53 | 9.54±0.96 | 0.66±0.05 | 0.29±0.03 |
| LPS+pcDNA-NKILA+miR-1236-3p | 0.82±0.07b | 71.65±7.19b | 24.31±2.14b | 106.65±10.58b | 20.47±2.06b | 0.38±0.03b | 0.48±0.04b |
| F | 124.049 | 58.066 | 399.960 | 99.075 | 168.920 | 174.684 | 129.559 |
| P | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| a: P < 0.05,与LPS+pcDNA组比较;b: P < 0.05,与LPS+pcDNA-NKILA+miR-NC组比较 | |||||||
3 讨论
LPS是革兰阴性菌细胞壁的重要组成成分,可引起炎症反应,诱导支气管上皮细胞产生炎症[8]。本研究采用LPS诱导的16HBE细胞损伤为模型,研究lncRNA NKILA在支气管上皮细胞损伤中的作用。
NKILA(nuclear factor-κB interacting long non-coding RNA)是一种NF-κB相互作用的lncRNA,通过抑制NF-κB活性调节T细胞对活化诱导细胞死亡(AICD)的敏感性[9],有研究表明,lncRNA NKILA在乳腺癌和舌癌等多种恶性肿瘤中发挥抑制因子的作用[10]。lncRNA-NKILA上调通过抑制NF-κB信号传导介导氧葡萄糖剥夺/复氧诱导的神经元细胞死亡[11]。还有报道表明,lncRNA NKILA能够通过NF-κB介导的DNA甲基化机制,积极介导内皮细胞中抗炎动脉粥样硬化保护调节剂KLF4的表达,NKILA功能失调,就会出现持续的内皮炎症[12]。lncRNA-NKILA的过度表达与糖尿病心肌病(DC)有关,lncRNA-NKILA异位表达和基因敲除分别增强和抑制心肌细胞凋亡[13]。本研究以人支气管上皮细胞16HBE为主要研究对象,通过检测lncRNA NKILA在LPS诱导的16HBE细胞中的表达情况,探究其对支气管上皮细胞损伤的作用。结果发现,lncRNA NKILA在LPS诱导的16HBE细胞中表达下调,过表达lncRNA NKILA可减少16HBE细胞中Bax蛋白及炎症因子(IL-6、IL-13、TNF-α)的含量,提高Bcl-2蛋白含量,降低细胞凋亡率,减轻LPS诱导的16HBE细胞炎症并抑制细胞凋亡,说明lncRNA NKILA在16HBE炎症损伤中发挥调节作用。
此外,本研究通过LncBase Predicted v.2预测发现,miR-1236-3p含有与lncRNA NKILA互补的位点,提示lncRNA NKILA与miR-1236-3p可能存在靶向结合关系,miR-1236-3p可能参与lncRNA NKILA对16HBE炎症损伤的调控过程。双荧光素酶报告系统和qRT-PCR结果也显示,lncRNA NKILA靶向负调控miR-1236-3p的表达。miR-1236-3p在胃癌[14]和肺癌[15]等肿瘤中表达下调,与肿瘤的转移、侵袭有关,但在炎症方面的研究较少。研究表明,miR-1236与溃疡性结肠炎有关[16],miR-1236在炎症性淋巴管生成过程中抑制VEGFR-3的信号传导[17]。本研究发现,miR-1236-3p在LPS诱导后的16HBE细胞中含量显著升高,干扰miR-1236-3p可减轻LPS对16HBE细胞的炎症损伤并抑制细胞凋亡,说明miR-1236-3p在支气管上皮细胞损伤中发挥作用。进一步实验还发现,miR-1236-3p过表达可逆转lncRNA NKILA过表达对LPS诱导的16HBE细胞炎症和凋亡的影响,验证了在16HBE中lncRNA NKILA靶向miR-1236-3p调控支气管上皮细胞损伤。
综上,本研究阐述了在LPS诱导的支气管上皮细胞16HBE中,lncRNA NKILA下调,miR-1236-3p上调,lncRNA NKILA可能通过靶向miR-1236-3p调控16HBE细胞炎症损伤和细胞凋亡。
| [1] |
CARSIN A, MAZENQ J, ILSTAD A, et al. Bronchial epithelium in children: a key player in asthma[J]. Eur Respir Rev, 2016, 25(140): 158-169. DOI:10.1183/16000617.0101-2015 |
| [2] |
周春菊, 赵顺英, 王琳, 等. 哮喘患儿气道炎症重塑表现和上皮细胞的凋亡[J]. 中国实用儿科杂志, 2007, 22(8): 621-623. ZHOU C J, ZHAO S Y, WANG L, et al. Airway inflammation remodeling and epithelial cell apoptosis in children with asthma[J]. Chin J Pract Pediat, 2007, 22(8): 621-623. DOI:10.3969/j.issn.1005-2224.2007.08.018 |
| [3] |
CHEN Y, MAO Z D, SHI Y J, et al. Comprehensive analysis of miRNA-mRNA-lncRNA networks in severe asthma[J]. Epigenomics, 2019, 11(2): 115-131. DOI:10.2217/epi-2018-0132 |
| [4] |
XUE H, YU P, WANG W Z, et al. The reduced lncRNA NKILA inhibited proliferation and promoted apoptosis of chondrocytes via miR-145/SP1/NF-κB signaling in human osteoarthritis[J]. Eur Rev Med Pharmacol Sci, 2020, 24(2): 535-548. DOI:10.26355/eurrev_202001_20030 |
| [5] |
LIU Q, LIU Z, ZHOU L J, et al. The long noncoding RNA NKILA protects against myocardial ischaemic injury by enhancing myocardin expression via suppressing the NF-κB signalling pathway[J]. Exp Cell Res, 2020, 387(2): 111774. DOI:10.1016/j.yexcr.2019.111774 |
| [6] |
MENG TT, SHEN S M, LI C, et al. MicroRNA-1236-3p/translationally controlled tumor protein (TPT1) Axis participates in congenital hypothyroidism progression by regulating neuronal apoptosis[J]. Exp Ther Med, 2020, 19(1): 459-466. DOI:10.3892/etm.2019.8262 |
| [7] |
申光富, 罗长琴, 黄波, 等. 下调TLR4对LPS诱导的支气管上皮16HBE细胞损伤的影响及其机制[J]. 中华细胞与干细胞杂志(电子版), 2019, 9(3): 166-172. SHEN G F, LUO C Q, HUANG B, et al. Effect of TLR4 on LPS-induced bronchial epithelial 16HBE cell injury[J]. Chin J Cell Stem Cell Electron Ed, 2019, 9(3): 166-172. |
| [8] |
SHI L, DONG N, JI D X, et al. Lipopolysaccharide-induced CCN1 production enhances interleukin-6 secretion in bronchial epithelial cells[J]. Cell Biol Toxicol, 2018, 34(1): 39-49. DOI:10.1007/s10565-017-9401-1 |
| [9] |
HUANG D, CHEN J N, YANG L B, et al. NKILA lncRNA promotes tumor immune evasion by sensitizing T cells to activation-induced cell death[J]. Nat Immunol, 2018, 19(10): 1112-1125. DOI:10.1038/s41590-018-0207-y |
| [10] |
KE S, LI R C, MENG F K, et al. NKILA inhibits NF-κB signaling and suppresses tumor metastasis[J]. Aging (Albany NY), 2018, 10(1): 56-71. DOI:10.18632/aging.101359 |
| [11] |
WANG M, JIANG Y M, XIA L Y, et al. LncRNA NKILA upregulation mediates oxygen glucose deprivation/re-oxygenation-induced neuronal cell death by inhibiting NF-κB signaling[J]. Biochem Biophys Res Commun, 2018, 503(4): 2524-2530. DOI:10.1016/j.bbrc.2018.07.010 |
| [12] |
ZHU X X, DU J, YU J J, et al. LncRNA NKILA regulates endothelium inflammation by controlling a NF-κB/KLF4 positive feedback loop[J]. J Mol Cell Cardiol, 2019, 126: 60-69. DOI:10.1016/j.yjmcc.2018.11.001 |
| [13] |
LI Q Y, LI P R, SU J L, et al. LncRNA NKILA was upregulated in diabetic cardiomyopathy with early prediction values[J]. Exp Ther Med, 2019, 18(2): 1221-1225. DOI:10.3892/etm.2019.7671 |
| [14] |
AN J X, MA M H, ZHANG C D, et al. MiR-1236-3p inhibits invasion and metastasis in gastric cancer by targeting MTA2[J]. Cancer Cell Int, 2018, 18: 66. DOI:10.1186/s12935-018-0560-9 |
| [15] |
BIAN T T, JIANG D S, LIU J, et al. MiR-1236-3p suppresses the migration and invasion by targeting KLF8 in lung adenocarcinoma A549 cells[J]. Biochem Biophys Res Commun, 2017, 492(3): 461-467. DOI:10.1016/j.bbrc.2017.08.074 |
| [16] |
ZHANG Y, JIN Y, LIN Y, et al. Adipose-derived mesenchymal stem cells ameliorate ulcerative colitis through miR-1236 negatively regulating the expression of retinoid-related orphan receptor Gamma[J]. DNA Cell Biol, 2015, 34(10): 618-625. DOI:10.1089/dna.2015.2961 |
| [17] |
JONES D, LI Y H, HE Y, et al. Mirtron microRNA-1236 inhibits VEGFR-3 signaling during inflammatory lymphangiogenesis[J]. Arterioscler Thromb Vasc Biol, 2012, 32(3): 633-642. DOI:10.1161/ATVBAHA.111.243576 |



