糖尿病是一种慢性疾病,在全球范围内影响了超过4.15亿人,估计到2040年将影响约6.42亿人[1]。尽管在临床治疗和科学研究中已经取得了重大进展,但对糖尿病的机制仍知之甚少。胰岛β细胞功能障碍已被发现在糖尿病的发生和发展中起重要作用[2]。新兴的证据强调了微小RNA(microRNA, miRNA)在β细胞功能中的关键作用,包括凋亡,胰岛素分泌等[3]。miRNA是进化上保守的单链非编码RNA,由18~24个核苷酸组成。它们通过靶向靶基因的3'-非翻译区(3'-UTR)参与转录后调控[4]。研究显示,miRNA涉及各种生物学过程,包括细胞凋亡、分化、增殖、转移和细胞代谢[5]。此外,一些miRNA在β细胞功能、胰岛素基因表达和胰岛素分泌中发挥重要作用[6-7]。研究表明,高糖导致的糖尿病心肌病患者血清中,miR-186-5p的表达较健康人心肌血清中的表达低[8]。但是,miR-186-5p与高脂高糖诱导的β细胞损伤之间的关系尚未探明。因此,本研究利用高脂高糖诱导胰岛β细胞NIT-1损伤,以期阐明miR-186-5p在细胞增殖和凋亡中的生物学功能和对潜在靶标细胞分裂周期相关因子3 (cell division cycle associated 3 protein,CDCA3)的靶向调控,并评估其在高脂高糖环境中的作用。
1 材料与方法 1.1 材料主要试剂:Roswell Park Memorial Institute(RPMI)-1640培养基购自美国Gibco公司,棕榈酸购自美国Sigma公司,CCK-8购自日本Dojindo公司,Annexin V-FITC细胞凋亡试剂盒购自南京凯基公司,BCA蛋白质检测试剂盒购自美国Pierce公司,双荧光素酶报告系统购自美国Promega公司,PrimeScript RT Master Mix试剂盒、SYBR Premix Ex Taq II试剂盒购自日本Takara公司,抗细胞核相关抗原ki-67(nuclear associated antigen ki67, ki-67)、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2, Bcl-2)、Bcl-2相关X蛋白(Bax)、CDCA3、GAPDH抗体、辣根过氧化物酶标记的二抗购自美国CST公司。
胰岛β细胞NIT-1购自美国典型培养物保藏中心,在10%胎牛血清、100 U/mL青霉素、100 µg/mL链霉素的RPMI-1640培养基中培养。选取对数生长期的细胞NIT-1进行后续实验。
1.2 方法 1.2.1 细胞分组与转染将NIT-1细胞分为LG组(5 mmol/L葡萄糖处理48 h),HG组(0.25 mmol/L棕榈酸和25 mmol/L葡萄糖处理48 h[9]),HG+miR-NC组(转染miR-NC和高脂高糖处理),HG+miR-186-5p组(转染miR-186-5p和高脂高糖处理),HG+anti-NC组(转染anti-NC和高脂高糖处理),HG+anti-miR-186-5p组(转染anti-miR-186-5p和高脂高糖处理),HG+si-NC组(转染si-NC和高脂高糖处理),HG+si-CDCA3组(转染si-CDCA3和高脂高糖处理),HG+miR-186-5p +pcDNA-NC组(共转染miR-186-5p与pcDNA-NC和高脂高糖处理),HG+miR-186-5p + CDCA3组(共转染miR-186-5p与pcDNA-CDCA3和高脂高糖处理)。转染时,NIT-1细胞以1×105个/mL的密度接种于6孔板,当细胞达到50%-70%汇合时,根据制造商的说明,将miR-186-5p、miR-NC、anti-miR-186-5p、anti-NC、si-CDCA3、si-NC、pcDNA-CDCA3、pcDNA-NC(购自广州锐博生物公司)通过Lipofectamine 2000进行转染,转染5 h后,进行高脂高糖处理48 h。
1.2.2 CCK-8法检测细胞增殖将待测NIT-1细胞(每孔1×104)接种到96孔板中,培养48 h后,将细胞用CCK-8溶液处理,并在37℃下孵育2 h。用酶标仪测定450 nm处的光密度值D(450),表示细胞活力。
1.2.3 流式细胞术评估细胞凋亡根据Annexin V-FITC细胞凋亡试剂盒的步骤,细胞转染后,将5 μL Annexin V-FITC和5 μL PI添加到1×105个细胞NIT-1中,并在黑暗中于室温孵育15 min。通过流式细胞仪分析细胞凋亡。
1.2.4 Western blot分析Ki-67、PCNA、Bcl-2、Bax、CDCA3蛋白表达在RIPA缓冲液中裂解待测的细胞NIT-1,并将其转移至1.5 mL管中,在4℃下离心5 min。使用BCA蛋白质检测试剂盒确定每个样品的蛋白浓度。取等量的蛋白进行12%SDS-PAGE凝胶电泳,然后从凝胶转移到硝酸纤维素膜上。在室温下将膜置于封闭缓冲液中90 min,与抗Ki-67、PCNA、Bcl-2、Bax、CDCA3或GAPDH的一抗(1:1 000稀释)在4℃孵育过夜。在Tris-HCl-Tween缓冲盐溶液(TBST)中洗涤膜8 min,然后与辣根过氧化物酶标记的二抗(1:3 000稀释)在室温下孵育1 h。将膜与ECL印迹底物孵育,Quantum One软件分析蛋白条带,条带与对照GAPDH的比值即为Ki-67、PCNA、Bcl-2、Bax、CDCA3蛋白的表达量。
1.2.5 实时定量PCR(quantitative real-time PCR, qRT-PCR)测定miR-186-5p、CDCA3 mRNA表达使用TRIzol试剂从细胞中提取总RNA,并通过NanoDrop 2000分光光度计进行定量。提取的RNA样品通过PrimeScript RT Master Mix试剂盒进行逆转录。qRT-PCR通过SYBR Premix Ex Taq Ⅱ试剂盒在实时PCR系统上进行。U6和GAPDH分别用作miRNA和mRNA的内参照,2-ΔΔCt法分析miR-186-5p、CDCA3 mRNA表达。引物序列, miR-186-5p: 5,-TCAAAGAATTCTCCTTTTGGGCT-3,(F),5,-CGCTTCACGAATTTGCGTGTCAT-3,(R);U6:5,-CGCTTCGGCAGCACATATAC-3,(F),5,-AAAATATGGAACGCTTCACGA-3,(R);CDCA3: 5,-GGACCCTGAGACTCCCAGAT-3,(F),5,-GCCGCTTACCCTGTCGTAG-3,(R);GAPDH :5,-GCACCGTCAAGGCTGAGAAC-3,(F),5,-GGATCTCGCTCCTGGAAGATG-3,(R)。
1.2.6 生物信息学预测和双荧光素酶活性检测miR-186-5p与CDCA3的靶向关系Starbase网站(http://starbase.sysu.edu.cn/)预测出miR-186-5p与CDCA3的3'-UTR存在靶向结合序列。扩增出具有miR-186-5p结合位点的CDCA3野生型(WT)或突变型(MUT)的3'-UTR,并将其克隆到pGL3载体中,以生成质粒CDCA3(WT)或CDCA3(MUT)。使用NIT-1细胞进行荧光素酶报告的测定,并采用Lipofectamine 2000试剂转染miR-186-5p或miR-con和CDCA3(WT)或CDCA3(MUT)质粒。按照制造商的规程,使用双荧光素酶系统分析荧光素酶活性。
1.3 统计学分析采用SPSS 22.0统计软件,结果表示以x±s表示。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。P < 0.05表示差异具有统计学意义。
2 结果 2.1 高脂高糖对NIT-1细胞增殖及凋亡的影响与LG组比较,HG组NIT-1细胞的细胞活力明显降低,Ki-67、PCNA蛋白表达量显著减少,细胞的凋亡率明显增加,Bcl-2蛋白水平显著降低,Bax蛋白水平明显提高(P < 0.05,图 1)。
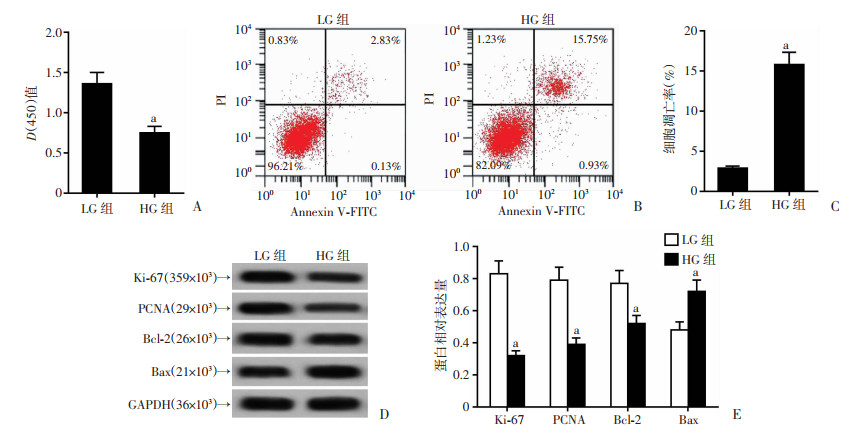
|
|
a:P <
0.05,与LG组比较 A:细胞活力;B、C:流式细胞仪检测细胞凋亡及凋亡率分析;D~E:Western blot检测增殖和凋亡相关蛋白表达及分析 图 1 高脂高糖对NIT-1细胞增殖及凋亡的影响 |
2.2 miR-186-5p和CDCA3在高脂高糖诱导的NIT-1细胞中的表达
与LG组比较,HG组NIT-1细胞中miR-186-5p表达量明显减少,CDCA3 mRNA表达量和CDCA3蛋白表达量显著增加(P < 0.05,图 2)。
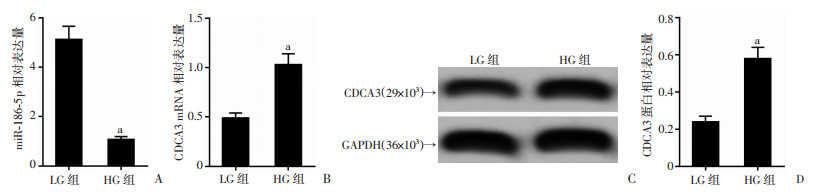
|
| a:P < 0.05与LG组比较;A:qRT-PCR检测miR-186-5p表达;B:qRT-PCR检测CDCA3 mRNA表达;C:Western blot 检测CDCA3 蛋白表达;D:半定量分析 图 2 miR-186-5p和CDCA3在高脂高糖诱导的NIT-1细胞中的表达 |
2.3 miR-186-5p靶向负调控基因CDCA3
CDCA3的序列中含有与miR-186-5p互补的核苷酸序列,研究结果(图 3)显示:与miR-con组比较,miR-186-5p组CDCA3(WT)细胞的荧光素酶活性明显降低(P < 0.05),CDCA3(MUT)细胞的荧光素酶活性无显著变化(P > 0.05);与HG+miR-NC组比较,HG+miR-186-5p组NIT-1细胞的miR-186-5p表达量明显增加,CDCA3 mRNA表达和CDCA3蛋白表达显著减少(P < 0.05)。与HG+anti-NC组比较,HG+anti-miR-186-5p组NIT-1细胞内miR-186-5p表达明显降低,CDCA3 mRNA表达和CDCA3蛋白表达显著提高(P < 0.05)。
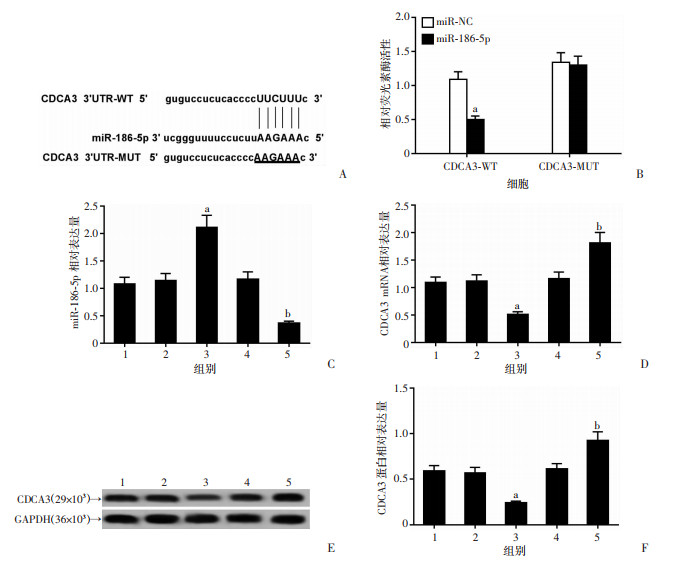
|
| A:Starbase预测miR-186-5p与CDCA3的靶向结合区域a:P < 0.05,与miR-NC组比较; B:双荧光素酶活性检测NIT-1细胞中miR-186-5p与CDCA3的靶向关系; C:qRT-PCR检测miR-186-5p表达量; D:qRT-PCR检测CDCA3 mRNA表达; E、F:Western blot检测CDCA3蛋白的表达a:P < 0.05,与HG+miR-NC组比较;b:P < 0.05,与HG+anti-miR-NC组比较 图 3 miR-186-5p靶向负调控基因CDCA3 |
2.4 过表达miR-186-5p对高脂高糖诱导的NIT-1细胞增殖和凋亡的影响
与HG+miR-NC组比较,HG+miR-186-5p组NIT-1细胞miR-186-5p表达量、细胞活力、Ki-67、PCNA蛋白表达量明显增加,细胞的凋亡率显著减少,Bcl-2蛋白水平明显提高,Bax蛋白水平显著降低(P < 0.05,图 4)。
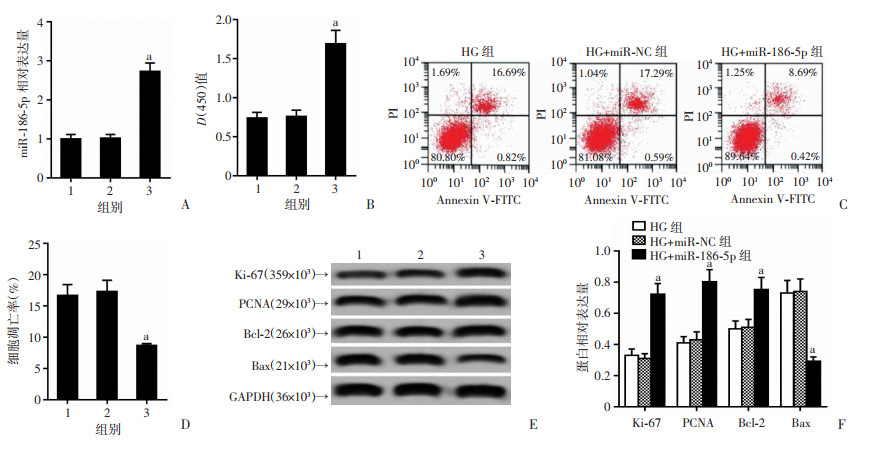
|
| A:qRT-PCR检测miR-186-5p表达;B:细胞活力;C、D:流式细胞仪检测细胞凋亡;E、F:Western blot检测增殖和凋亡相关蛋白表达a:P < 0.05,与HG+ miR-NC组比较 图 4 过表达miR-186-5p对高脂高糖诱导的NIT-1细胞增殖和凋亡的影响 |
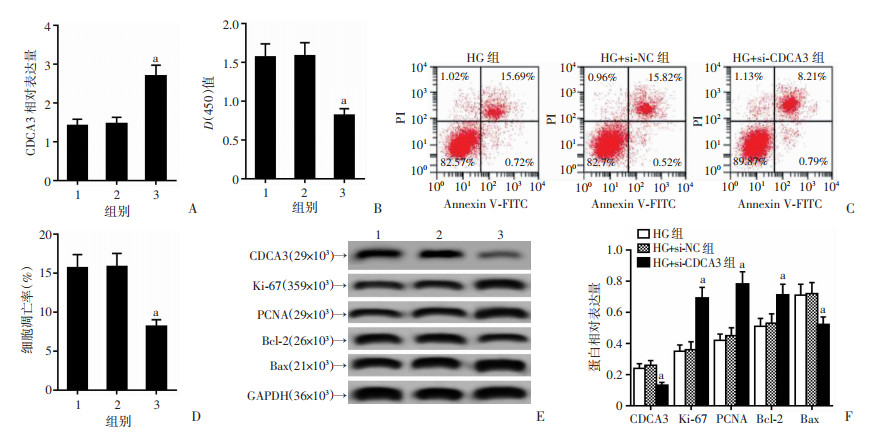
2.5 敲减CDCA3对高脂高糖诱导的NIT-1细胞增殖和凋亡的影响
与HG+si-NC组比较,HG+si-CDCA3组NIT-1细胞中CDCA3 mRNA表达量和CDCA3蛋白表达显著降低,细胞活力和Ki-67、PCNA蛋白表达明显升高,并且细胞的凋亡率显著减少,Bcl-2蛋白表达明显增加,Bax蛋白表达量显著减少(P < 0.05,图 5)
|
| A:qRT-PCR检测CDCA3 mRNA表达;B:细胞活力;C、D:流式细胞仪检测细胞凋亡;E、F:Western blot检测增殖和凋亡相关蛋白表达a:P < 0.05,与HG+ si-NC组比较 图 5 敲减CDCA3对高脂高糖诱导的NIT-1细胞增殖和凋亡的影响 |
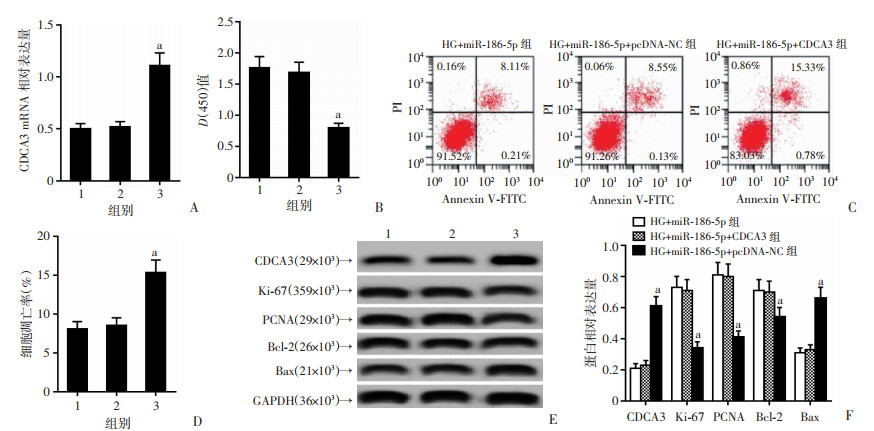
2.6 过表达CDCA3逆转过表达miR-186-5p对高脂高糖诱导的NIT-1细胞增殖和凋亡的影响
与HG+miR-186-5p +pcDNA-NC组比较,HG+miR-186-5p + CDCA3组NIT-1细胞中CDCA3 mRNA和CDCA3蛋白表达明显增加,细胞活力和Ki-67、PCNA蛋白表达显著升高,细胞的凋亡率明显增加,Bcl-2蛋白水平显著降低,Bax蛋白水平明显提高(P < 0.05,图 6)。
|
| A:qRT-PCR检测CDCA3 mRNA表达;B:细胞活力;C、D:流式细胞仪检测细胞凋亡;E、F:Western blot检测增殖和凋亡相关蛋白表达情况a:P < 0.05,与HG + miR-186-5p + pcDNA-NC组比较 图 6 过表达CDCA3逆转过表达miR-186-5p对高脂高糖诱导的NIT-1细胞增殖和凋亡的影响 |
3 讨论
糖尿病已被确定为世界上威胁最大的疾病,其特征是高血糖。糖尿病不仅会产生严重的健康问题,而且会带来沉重的社会经济负担。β细胞功能障碍和β细胞身份丧失会导致胰岛素分泌不足,诱发糖尿病[10]。先前的研究表明,某些转录因子的异常表达与β细胞损伤有关[11]。然而,β细胞损伤的确切机制仍需要进一步探索。本研究采用高脂高糖诱导胰岛β细胞NIT-1损伤,结果显示:高脂高糖处理后,NIT-1细胞的细胞活力、增殖相关蛋白Ki-67、PCNA和抗凋亡蛋白Bcl-2表达明显降低,而细胞的凋亡率和促凋亡蛋白Bax水平则显著提高,与既往研究[12]相符。同时高脂高糖还能引起NIT-1细胞中miR-186-5p表达减少及CDCA3 mRNA表达、蛋白表达增加,提示miR-186-5p和CDCA3参与高脂高糖损伤胰岛β细胞NIT-1过程,研究结果有助于糖尿病的发病机制和进展的分子机制的深入了解,也为糖尿病新的和更有效的治疗方法的开发提供了有前景的治疗选择。
miR-186-5p在许多人类癌症中被认为是一种肿瘤抑制因子,在肿瘤细胞增殖、凋亡、分化和迁移中发挥关键调节剂作用[13-15]。例如,miR-186-5p通过靶向叉头框蛋白K1(forkhead box k1,FOXK1)来减少骨肉瘤体外细胞增殖和体内肿瘤生长[16]。miR-186-5p通过下调Eg5抑制神经母细胞瘤细胞增殖,并促进细胞凋亡[17]。在糖尿病方面,也有研究显示:高糖刺激心肌细胞的糖尿病心肌病模型中,miR-186-5p被下调,miR-186-5p过表达通过调节心肌细胞中的Toll样受体3(toll-like receptor 3,TLR3)减弱了高糖诱导的细胞凋亡[18]。高糖处理的AC16心肌细胞中miR-186-5p的水平显著降低,miR-186-5p模拟物可显著改善高糖诱导AC16细胞活力降低和细胞凋亡率升高的作用,而miR-186-5p抑制剂可降低高糖处理的AC16细胞的生存力,并促进凋亡[19]。但是,miR-186-5p在高脂高糖导致的胰腺β细胞损伤中的意义尚未明确。本研究确定了miR-186-5p的生物学功能,即过表达miR-186-5p使高脂高糖损伤的NIT-1细胞的细胞活力、Ki-67、PCNA、Bcl-2蛋白表达量增加,并引起细胞的凋亡率、Bax蛋白表达量减少。这表明miR-186-5p可以作为糖尿病的潜在生物标记。
CDCA3基因在非小细胞肺癌组织和细胞中显著升高,高水平的CDCA3与患者预后不良相关,CDCA3表达的缺失显著降低了非小细胞肺癌细胞的增殖[20]。与癌旁非肿瘤组织相比,人胃癌组织中CDCA3表达增加,CDCA3是促进胃癌细胞增殖的潜在预后标志物[21]。结直肠癌中CDCA3的表达上调,CDCA3在体外促进了癌细胞的增殖,而其下调则诱导细胞周期阻滞和细胞凋亡[22]。这些研究证明CDCA3在肿瘤细胞中具有促进肿瘤进展的效果,但是,尚不清楚CDCA3在糖尿病β细胞功能中的作用。本研究中,敲减CDCA3明显增强高脂高糖环境中的NIT-1细胞的细胞活力和Ki-67、PCNA、Bcl-2蛋白表达,显著减轻其凋亡和Bax蛋白表达,可以保护高脂高糖损伤的胰岛β细胞。为进一步揭示miR-186-5p的可能机制,本研究进行生物信息学分析以鉴定CDCA3是否作为miR-186-5p的潜在靶标,通过荧光素酶报告基因检测进一步得以证实。同时,在高脂高糖诱导的NIT-1细胞中,上调miR-186-5p显著抑制CDCA3的表达,下调miR-186-5p时则反之,miR-186-5p对CDCA3的表达显示出负调控作用,这表明CDCA3可作为miR-186-5p的直接靶标。
综上所述,本研究阐明了miR-186-5p在高脂高糖损伤的胰岛β细胞中的可能机制。miR-186-5p可以通过靶向CDCA3促进高脂高糖环境诱导的胰岛β细胞NIT-1增殖,并抑制细胞凋亡,证明了其在临床治疗中作为新型诊断生物标志物的潜在应用,为糖尿病的治疗方法提供新的思路。
| [1] |
NG L C, GUPTA M. Transdermal drug delivery systems in diabetes management: a review[J]. Asian J Pharm Sci, 2020, 15(1): 13-25. DOI:10.1016/j.ajps.2019.04.006 |
| [2] |
YE R S, ONODERA T, SCHERER P E. Lipotoxicity and β cell maintenance in obesity and type 2 diabetes[J]. J. Endocr. Soc., 2019, 3(3617): 631. DOI:10.1210/js.2018-00372 |
| [3] |
MARTINEZ-SANCHEZ A, NGUYEN-TU M S, CEBOLA I, et al. MiR-184 expression is regulated by AMPK in pancreatic islets[J]. FASEB J, 2018, 32(5): 2587-2600. DOI:10.1096/fj.201701100R |
| [4] |
WU D H, LIANG H, LU S N, et al. miR-124 suppresses pancreatic ductal adenocarcinoma growth by regulating monocarboxylate transporter 1-mediated cancer lactate metabolism[J]. Cell Physiol Biochem, 2018, 50(3): 924-935. DOI:10.1159/000494477 |
| [5] |
MICHLEWSKI G, CÁCERES J F. Post-transcriptional control of miRNA biogenesis[J]. RNA, 2019, 25(1): 1-16. DOI:10.1261/rna.068692.118 |
| [6] |
NIGI L, GRIECO G E, VENTRIGLIA G, et al. MicroRNAs as regulators of insulin signaling: research updates and potential therapeutic perspectives in type 2 diabetes[J]. Int J Mol Sci, 2018, 19(12): 3705. DOI:10.3390/ijms19123705 |
| [7] |
RAJAN S, PANZADE G, SRIVASTAVA A, et al. miR-876-3p regulates glucose homeostasis and insulin sensitivity by targeting adiponectin[J]. J Endocrinol, 2018, 239(1): 1-17. DOI:10.1530/JOE-17-0387 |
| [8] |
郭润民, 刘畅, 吴子君, 等. 糖尿病心肌病患者血清差异表达microRNA及作用的研究[J]. 中国医药科学, 2016, 6(13): 20-23. GUO R M, LIU C, WU Z J, et al. Serum differentially expression microRNA profile and potential roles in diabetic cardiomyopathy patients[J]. China Med Pharm, 2016, 6(13): 20-23. |
| [9] |
胡朝恩. Exenatide对高糖高脂诱导的NIT-1细胞损伤和炎症因子过表达的影响[D].泸州: 四川医科大学, 2015. HU C E. Effects of Exenatide on high glucose and high fat induced NIT-1 cell damage and overexpression of inflammatory factors[D]. Luzhou: Sichuan Medical University, 2015. |
| [10] |
WANG W Y, WANG J, YAN M L, et al. MiRNA-92a protects pancreatic B-cell function by targeting KLF2 in diabetes mellitus[J]. Biochem Biophys Res Commun, 2018, 500(3): 577-582. DOI:10.1016/j.bbrc.2018.04.097 |
| [11] |
SHEN Z Y, JIANG H M, HSU H T, et al. MicroRNA-127 inhibits cell proliferation via targeting Kif3b in pancreatic β cells[J]. Aging, 2019, 11(5): 1342-1355. DOI:10.18632/aging.101835 |
| [12] |
张萌, 欧阳礼辰, 龙漫. 桑白皮含药血清抑制高脂高糖诱导的胰岛β细胞凋亡的分子机制[J]. 湖北中医药大学学报, 2018, 20(4): 15-17. ZHANG M, OUYANG L C, LONG M. Molecular mechanism of cortex mori radicis serum inhibiting apoptosis of islet β cells induced by palmitic acid and high glucose[J]. J Hubei Univ Chin Med, 2018, 20(4): 15-17. DOI:10.3969/j.issn.1008-987x.2018.04.03 |
| [13] |
TAN H Y, ZHAO L. lncRNA nuclear-enriched abundant transcript 1 promotes cell proliferation and invasion by targeting miR-186-5p/HIF-1α in osteosarcoma[J]. J Cell Biochem, 2019, 120(4): 6502-6514. DOI:10.1002/jcb.27941 |
| [14] |
LIU X, ZHOU X, CHEN Y, et al. miR-186-5p targeting SIX1 inhibits cisplatin resistance in non-small-cell lung cancer cells (NSCLCs)[J]. Neoplasma, 2020, 67(1): 147-157. DOI:10.4149/neo_2019_190511N420 |
| [15] |
OUYANG Y M, LI Y J, HUANG Y G, et al. CircRNA circPDSS1 promotes the gastric cancer progression by sponging miR-186-5p and modulating NEK2[J]. J Cell Physiol, 2019, 234(7): 10458-10469. DOI:10.1002/jcp.27714 |
| [16] |
ZHANG Z Q, ZHANG W, MAO J S, et al. miR-186-5p functions as a tumor suppressor in human osteosarcoma by targeting FOXK1[J]. Cell Physiol Biochem, 2019, 52(3): 553-564. DOI:10.33594/000000039 |
| [17] |
ZHU K, SU Y L, XU B, et al. MicroRNA-186-5p represses neuroblastoma cell growth via downregulation of Eg5[J]. Am J Transl Res, 2019, 11(4): 2245-2256. |
| [18] |
LIU Y, ZHENG W, PAN Y, et al. Low expression of miR-186-5p regulates cell apoptosis by targeting toll-like receptor 3 in high glucose-induced cardiomyocytes[J]. J Cell Biochem, 2019, 120(6): 9532-9538. DOI:10.1002/jcb.28229 |
| [19] |
JIANG J M, MO H L, LIU C, et al. Inhibition of miR-186-5p contributes to high glucose-induced injury in AC16 cardiomyocytes[J]. Exp Ther Med, 2018, 15(1): 627-632. DOI:10.3892/etm.2017.5445 |
| [20] |
ADAMS M N, BURGESS J T, HE Y W, et al. Expression of CDCA3 is a prognostic biomarker and potential therapeutic target in non-small cell lung cancer[J]. J Thorac Oncol, 2017, 12(7): 1071-1084. DOI:10.1016/j.jtho.2017.04.018 |
| [21] |
ZHANG Y, YIN W, CAO W, et al. CDCA3 is a potential prognostic marker that promotes cell proliferation in gastric cancer[J]. Oncol Rep, 2019, 41(4): 2471-2481. DOI:10.3892/or.2019.7008 |
| [22] |
ZHANG W, LU Y X, LI X M, et al. CDCA3 promotes cell proliferation by activating the NF-κB/cyclin D1 signaling pathway in colorectal cancer[J]. Biochem Biophys Res Commun, 2018, 500(2): 196-203. DOI:10.1016/j.bbrc.2018.04.034 |



