乳腺癌是女性最常见的恶性肿瘤, 其发病率逐年增加且呈年轻化的趋势[1]。在乳腺癌的分子分型中, 以激素受体阳性(hormone receptor positive, HR+)者居多, 约占70%[2]。化疗和内分泌治疗是乳腺癌综合性治疗的重要组成部分, 内分泌治疗通过降低或竞争性抑制肿瘤生长依赖的激素(主要为雌激素)或其受体, 抑制肿瘤细胞增殖, 而化疗则主要杀伤增殖较活跃的肿瘤细胞。因作用机制不同, 乳腺癌内分泌治疗不宜和化疗同时联用, 否则可能相互拮抗而降低化疗疗效, 这一原则已被临床广泛采纳。
绝经前乳腺癌患者, 性激素随不同生理时期波动。在月经周期, 雌激素低谷水平低于50 pg/mL, 高峰水平达500 pg/mL, 妊娠期雌激素则可有更大的生理波动。在内环境雌激素水平低谷期, 类似于内分泌治疗所产生的药物效应, 若在此期给予化疗, 即客观上存在的化疗同时伴随内分泌治疗的现象, 可能降低化疗敏感性, 但目前临床中这一现象普遍存在, 并未引起充分重视[3-4]。此外, 乳腺癌患者在化疗期间易出现化疗诱发闭经或卵巢功能损伤及早衰[5], 均可能导致雌激素水平降低, 影响化疗疗效及患者长期预后。
因此, 本研究在HR+乳腺癌细胞及荷瘤裸鼠模型中模拟不同生理时期雌激素(estradiol, E2)水平, 探讨月经周期不同时相及妊娠期雌激素水平对蒽环类一线化疗药表柔比星(法玛新, epirubicin, EPI)化疗疗效的影响及其可能的增敏作用。
1 材料与方法 1.1 材料与试剂人乳腺癌MCF-7、MDA-MB-231细胞株由重庆医科大学分子肿瘤及表观遗传学实验室提供; RPMI1640培养基购于美国Gibco公司; 胎牛血清购于以色列Biological Industries(BI)公司; 胰酶购于上海碧云天生物技术有限公司; 雌二醇环戊丙酸酯(estradiol cypionate, ECP)、Cell Counting Kit-8(CCK-8)试剂盒购于美国MedChemExpress(MCE)公司; 17β-雌二醇(17β-estradiol, E2)、二甲基亚砜(DMSO)购于美国Sigma公司; 试剂级玉米油购于上海阿拉丁试剂公司; 表柔比星(法玛新, epirubicin, EPI)购于美国辉瑞制药(Pfizer)公司; Matrigel基质胶购于美国Corning公司; 裸鼠(BALB/c-nu/nu)购于北京华阜康生物科技股份有限公司(合格证号:1103221911008935)。
1.2 方法 1.2.1 细胞培养与传代MCF-7、MDA-MB-231细胞, 分别于RPMI1640培养基添加10%胎牛血清, 37 ℃、5%CO2培养。待70%~80%融合, 0.25%胰酶消化, 接种或传代。
1.2.2 CCK-8检测不同浓度雌激素对乳腺癌细胞增殖的影响分别取对数期MCF-7、MDA-MB-231细胞, 按5 000/孔接种至96孔板, 每组设置3个平行复孔。过夜孵育后更换为含E2的新鲜培养基, 终浓度分别为0、50、500、2 500、5 000、10 000 pg/mL, 继续培养24 h后弃上清, 加入含10% CCK-8的培养基110 μL, 避光孵育1 h, 设置酶标仪波长参数为450 nm, 检测各孔光密度值[D(450)]。
1.2.3 CCK-8检测不同浓度雌激素预处理对表柔比星化疗疗效的影响分别取对数期MCF-7、MDA- MB-231细胞, 约5 000/孔, 接种至96孔板, 每组设置3个平行复孔。过夜孵育后更换为含E2的新鲜培养基, 终浓度分别为0、50、500、2 500、5 000、10 000 pg/mL, 培养12 h后弃上清, MCF-7细胞更换为含EPI终浓度为0.8 μg/mL(IC50)的新鲜培养基, MDA-MB-231细胞更换为含EPI终浓度为0.5 μg/mL(IC50)的新鲜培养基, 分别继续处理24 h后弃上清, 加入含10% CCK-8的培养基110 μL, 避光孵育1 h, 设置酶标仪波长参数为450 nm, 检测各孔光密度值[D(450)]。
1.2.4 MCF-7荷瘤裸鼠模型制备BALB/c-nu/nu裸鼠, 雌性, 4周龄, 体质量14~18 g, 35只, 饲养于SPF级环境, 按实验动物伦理委员会批准方案(审查批号:2019-287)进行实验。雌二醇环戊丙酸酯(ECP)2 mg/kg, 裸鼠后肢肌肉注射2 d后, 取对数生长期的MCF-7细胞, 经胰酶消化, PBS洗涤, 细胞计数并调整细胞数为2×107/mL, 与Matrigel基质胶1 :1混合后, 取0.2 mL接种于裸鼠右侧胸壁第二乳垫脂肪层下, 待10 d后瘤块直径长至约0.8 cm, 将荷瘤裸鼠采取随机数字表法分为7组, 每组5只。
1.2.5 双侧卵巢切除(ovariectomy, OVX)模型的制备戊巴比妥钠(50 mg/kg)腹腔麻醉, 行裸鼠双侧卵巢切除术, 将裸鼠俯卧固定于手术台上, 碘伏消毒皮肤, 于背部正中脊柱旁0.5 cm, 肋弓下缘0.5 cm, 切开进入腹腔, 可见乳白色组织, 将其轻提出腹腔, 可见暗红色绿豆大小“桑葚样”的卵巢包裹其中, 分离后结扎, 剪去卵巢, 止血, 分层缝合, 碘伏消毒切口。同样方法切除对侧卵巢, 保温待麻醉苏醒。术后恢复1周, 待伤口愈合后进一步实验处理。
1.2.6 实验动物分组及给药各组MCF-7乳腺癌荷瘤裸鼠分别给予腹腔注射雌激素(E2)或玉米油(corn oil)预处理12 h后, 腹腔注射表柔比星(EPI)或生理盐水(NS)处理, 给药频率为隔日1次, 持续10 d。ECP为长效药物, 其肌注最长作用时间约为11 d(https://www.medchemexpress.cn/Estradiol-cypionate.html)。从裸鼠接种MCF-7细胞前肌注ECP到化疗用药开始前间隔约3周, 认为此时动物体内可能残存ECP对实验的影响较小。①未行双侧卵巢切除(Non-OVX)组, 共10只, 分为2个亚组, 各5只。A组:corn oil 10 mL/kg+NS 10 mL/kg; B组:corn oil 10 mL/kg+EPI 5 mg/kg。②双侧卵巢切除(OVX)组, 共10只, 分为2个亚组, 各5只。C组:corn oil 10 mL/kg+NS 10 mL/kg; D组:corn oil 10 mL/kg+EPI 5 mg/kg。③双侧卵巢切除(OVX)+外源性E2组, 共15只, 分为3个亚组, 各5只。E组:E2 0.1 mg/kg+EPI 5 mg/kg; F组:E2 5 mg/kg+EPI 5 mg/kg; G组:E2 10 mg/kg+EPI 5 mg/kg。
1.2.7 动物实验检测指标及方法① 隔日测量裸鼠体质量, 游标卡尺测量肿瘤体积变化。②化疗完毕后完整剥离肿瘤组织, 称量并计算抑瘤率。
抑瘤率=(1-治疗组平均瘤质量/对照组平均瘤质量)×100%
1.3 统计学处理采用SPSS 22.0统计软件, 数据以x±s表示, 组间比较采用单因素方差分析, 以P<0.05表示差异有统计学意义。
2 结果 2.1 雌激素对乳腺癌细胞增殖的影响如图 1所示:E2促进HR+乳腺癌MCF-7细胞的增殖活性, 且呈剂量依赖性。与50 pg/mL E2组(相当于月经周期雌激素谷值)比较, 500 pg/mL E2组(相当于月经周期雌激素峰值)、2 500、5 000 pg/mL E2组(相当于妊娠期雌激素水平)及10 000 pg/mL E2组(相当于超生理剂量水平)均显著增强MCF-7细胞增殖活性(P<0.05)。E2在MDA-MB-231细胞中则未发现明显的促细胞增殖现象, 各组间差异无统计学意义(P>0.05)。
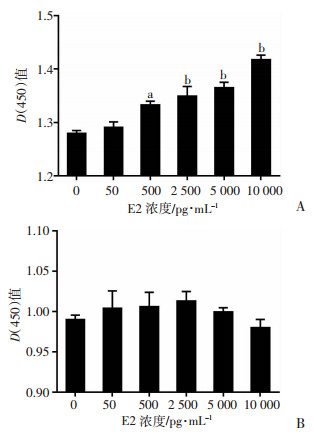
|
| A:MCF-7细胞; B:MDA-MB-231细胞; a:P<0.05, b:P<0.01, 与50 pg/mL E2组比较 图 1 不同浓度E2对乳腺癌细胞增殖的影响 |
2.2 雌激素对乳腺癌细胞表柔比星化疗敏感性的影响
如图 2所示:E2增强EPI对HR+乳腺癌MCF-7细胞的增殖抑制及杀伤作用, 且呈剂量依赖性。与50 pg/mL E2组比较, 2 500、5 000、10 000 pg/mL E2组均显著增强EPI对MCF-7细胞的化疗敏感性及杀伤作用(P<0.01)。E2在MDA-MB-231细胞中则无明显对EPI化疗疗效的影响(P>0.05)。
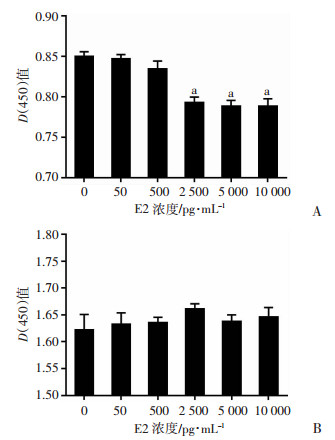
|
| A:MCF-7细胞; B:MDA-MB-231细胞; a:P<0.01, 与50 pg/mL E2组比较 图 2 不同浓度E2对EPI(0.5 μg/mL)化疗效果的影响 |
2.3 雌激素联合表柔比星对MCF-7乳腺癌荷瘤裸鼠的抑瘤作用
化疗结束后各组裸鼠MCF-7乳腺癌瘤块大小见图 3。OVX+E2+EPI化疗组(E、F、G组)的平均瘤质量均显著低于Non-OVX空白对照组(A组)、OVX空白对照组(C组)及OVX+EPI化疗组(D组), 差异均有统计学意义(P<0.01, 表 1)。G组的平均瘤质量最轻, 与Non-OVX+EPI化疗组(B组)比较差异无统计学意义(P=0.07);E组、F组与B组平均瘤质量差异也无统计学意义(P>0.05)。B组抑瘤率为23.3%, D组抑瘤率最低, 为10.8%, OVX+E2+EPI化疗组的抑瘤率均升高(表 1)。
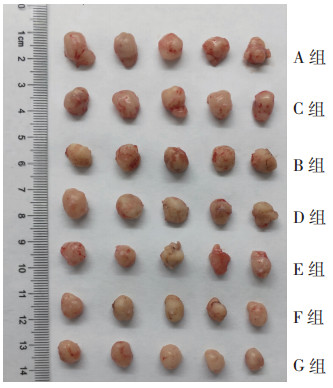
|
| 图 3 各组药物处理后裸鼠MCF-7乳腺癌瘤块大小 |
| 组别 | 手术 | 药物处理 | 瘤质量/g (x±s) |
抑瘤率(%) | |
| E2 | EPI | ||||
| A | Non-OVX | Corn oil | NS | 0.326±0.071 | |
| B | Non-OVX | Corn oil | 5 mg/kg | 0.250±0.023a | 23.3 |
| C | OVX | Corn oil | NS | 0.334±0.050 | |
| D | OVX | Corn oil | 5 mg/kg | 0.298±0.062 | 10.8 |
| E | OVX | 0.1 mg/kg | 5 mg/kg | 0.206±0.027bc | 38.3 |
| F | OVX | 5 mg/kg | 5 mg/kg | 0.208±0.031bc | 37.7 |
| G | OVX | 10 mg/kg | 5 mg/kg | 0.196±0.028bc | 41.3 |
| a:P<0.05, b:P<0.01, 分别与A、C组比较; c:P<0.01, 与D组比较 | |||||
3 讨论
乳腺癌生长可受到多种内分泌激素的调节, 包括雌激素、孕激素、甲状腺素、胰岛素等[6-7]。雌激素已被证实能够促进HR+乳腺癌细胞从G0/G1期向S-G2/M期的转化[8-9]。绝经前HR+乳腺癌患者, 性激素可随不同生理时期波动, 如果在雌激素水平低谷期应用化疗, 此时肿瘤细胞代谢多受抑制并较少处于S-G2/M增殖活跃期, 即客观上存在化疗与内分泌治疗同时联用的现象, 可能降低肿瘤细胞对化疗的敏感性, 影响疗效; 而在雌激素水平较高时期, 可能促使更多肿瘤细胞进入增殖活跃期, 此时联合化疗可能取得比单用化疗药物更好的疗效, 并纠正乳腺癌化疗期间伴随的内分泌治疗现象[3]。因此, 在化疗期间应用雌激素促使肿瘤细胞增殖活跃以提高其对化疗的敏感性在理论上可行。
在20世纪80年代, 激素增敏化疗学说已被提出, 并发现内分泌治疗可通过抑制乳腺癌细胞增殖拮抗化疗药物的细胞毒性作用[10-11], 奠定了目前临床乳腺癌化疗与内分泌治疗不推荐同时应用的基础。但目前尚无研究探讨绝经前HR+乳腺癌患者, 月经周期不同时相雌激素水平的变化及妊娠期乳腺癌雌激素水平可能对化疗效果的影响。本研究以不同生理时期血液生化雌激素水平作为参考(50~5 000 pg/mL, 即10-10~10-8 mol/L), 此雌激素浓度范围, 也在既往体外细胞研究中作为生理水平雌激素应用[12]。本研究细胞实验结果显示, E2呈剂量依赖性促进HR+乳腺癌MCF-7细胞的增殖活性, 提示在月经周期不同时相雌激素浓度作用下, MCF-7细胞的增殖活性存在显著差异, 可能影响化疗药物的敏感性。进一步研究发现, E2呈剂量依赖性增强化疗药物EPI对MCF-7细胞的增殖抑制作用, 且2 500、5 000 pg/mL E2组(相当于妊娠期雌激素可达水平)较50 pg/mL E2组显著增强EPI对MCF-7细胞的化疗敏感性及杀伤作用(P值均 < 0.001)。EPI为蒽环类细胞周期非特异性化疗药物, 可影响细胞周期的各个阶段, 促进肿瘤细胞的增殖代谢活性, 增强对蒽环类药物的胞内摄入及细胞毒性作用[13]。
在动物实验中, 通过建立双侧卵巢切除(OVX)MCF-7荷瘤裸鼠模型, 降低裸鼠内源性雌激素水平[14], 探讨卵巢去势对化疗疗效的影响及雌激素可能的化疗增敏作用。本实验结果显示Non-OVX+EPI化疗组(B组)及OVX+E2+EPI化疗组(E、F、G组)的平均瘤质量均低于OVX+EPI化疗组(D组)。提示化疗敏感性很大程度上受肿瘤细胞增殖状态的影响, 裸鼠卵巢去势后相当于内分泌治疗效应, 肿瘤细胞增殖活性受到抑制[14], 此时联合化疗, 可能降低化疗药物的敏感性, 影响疗效; 而高剂量外源性雌激素联合化疗组疗效最优, 可能通过提高肿瘤细胞的增殖活性, 增强化疗药物的杀伤作用。因而, 促使肿瘤细胞在化疗期间增殖活跃, 对提高化疗疗效具有重要意义。但本研究中不同剂量外源性雌激素联合化疗组(E、F、G组)的组间差异不显著, 推测可能受给药时机、药物处理时间等因素的影响, 仍需进一步研究更优的雌激素与化疗联合方式。
此外, 本课题组前期报道了2例关于妊娠期乳腺癌患者化疗效果的病例分析[15], 发现先化疗后终止妊娠患者较先终止妊娠后行化疗患者效果更优。2例患者的临床病理特征相似, 但对于首疗程化疗敏感性却存在明显差异。考虑除与肿瘤个体差异有关外, 还可能与终止妊娠后, 内环境妊娠相关激素水平显著降低, 影响肿瘤细胞的增殖活性, 从而降低对化疗药物的敏感性有关。此现象在本研究细胞实验中也得到了初步验证, 2 500、5 000 pg/mL E2组较50 pg/mL E2组显著增强EPI对MCF-7细胞的化疗杀伤作用(P值均 < 0.001)。一项基于基因表达的Meta分析也提示[16], 乳腺癌患者新辅助化疗的敏感性与增殖相关基因显著相关, 增殖活性较高的肿瘤更易达到病理完全缓解(pathologic complete response, pCR)。
本研究在HR+乳腺癌MCF-7细胞及荷瘤裸鼠层面, 探讨绝经前HR+乳腺癌患者不同生理时期雌激素水平及卵巢去势影响化疗效果的临床问题, 发现E2呈剂量依赖性促进HR+乳腺癌细胞对EPI的化疗敏感性及化疗杀伤作用, 提示在雌激素水平较高的生理时期应用化疗药物, 有望提高HR+乳腺癌患者的化疗效果、改善预后。但本研究仅为细胞及动物模型层面对乳腺癌患者不同生理时期化疗的初步模拟, 仍需进一步基础及临床研究的论证。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2015[J]. CA: A Cancer J Clin, 2015, 65(1): 5-29. DOI:10.3322/caac.21254 |
| [2] |
AHMED S S, THIKE A A, ZHANG K, et al. Clinicopathological characteristics of oestrogen receptor negative, progesterone receptor positive breast cancers: re-evaluating subsets within this group[J]. J Clin Pathol, 2017, 70(4): 320-326. DOI:10.1136/jclinpath-2016-203847 |
| [3] |
LUO Q Q, HUANG J B, WU Y T, et al. Tidal chemotherapy in premenopausal patients with hormone receptor positive breast cancer[J]. Med Hypotheses, 2017, 102: 4-7. DOI:10.1016/j.mehy.2017.03.003 |
| [4] |
HUANG J B, JI G Y, XING L, et al. Neo-endocrinochemotherapy: a novel approach for enhancing chemotherapeutic efficacy in clinic?[J]. Med Hypotheses, 2013, 80(4): 441-446. DOI:10.1016/j.mehy.2012.12.037 |
| [5] |
BEDOSCHI G, NAVARRO P A, OKTAY K. Chemotherapy-induced damage to ovary: mechanisms and clinical impact[J]. Future Oncol, 2016, 12(20): 2333-2344. DOI:10.2217/fon-2016-0176 |
| [6] |
HUANG J B, JIN L B, JI G Y, et al. Implication from thyroid function decreasing during chemotherapy in breast cancer patients: chemosensitization role of triiodothyronine[J]. BMC Cancer, 2013, 13: 334. DOI:10.1186/1471-2407-13-334 |
| [7] |
HUANG J B, JI G Y, XING L, et al. Chemosensitization role of endocrine hormones in cancer chemotherapy[J]. Chin Med J, 2013, 126(1): 175-180. |
| [8] |
BEZWODA W R, MEYER K. Effect of alpha-interferon, 17 beta-estradiol, and tamoxifen on estrogen receptor concentration and cell cycle kinetics of MCF 7 cells[J]. Cancer Res, 1990, 50(17): 5387-5391. |
| [9] |
TIAN J M, RAN B, ZHANG C L, et al. Estrogen and progesterone promote breast cancer cell proliferation by inducing cyclin G1 expression[J]. Revista Brasileira De Pesquisas Med E Biol, 2018, 51(3): 1-7. DOI:10.1590/1414-431X20175612 |
| [10] |
HUG V, HORTOBAGYI G N, DREWINKO B, et al. Tamoxifen-citrate counteracts the antitumor effects of cytotoxic drugs in vitro[J]. J Clin Oncol, 1985, 3(12): 1672-1677. DOI:10.1200/JCO.1985.3.12.1672 |
| [11] |
WOODS K E, RANDOLPH J K, GEWIRTZ D A. Antagonism between tamoxifen and doxorubicin in the MCF-7 human breast tumor cell line[J]. Biochem Pharmacol, 1994, 47(8): 1449-1452. DOI:10.1016/0006-2952(94)90346-8 |
| [12] |
WEICHSELBAUM R R, HELLMAN S, PIRO A J, et al. Proliferation kinetics of a human breast cancer line in vitro following treatment with 17beta-estradiol and 1-beta-D-arabinofuranosylcytosine[J]. Cancer Res, 1978, 38(8): 2339-2342. |
| [13] |
HUG V, JOHNSTON D, FINDERS M, et al. Use of growth-stimulatory hormones to improve the in vitro therapeutic index of doxorubicin for human breast tumors[J]. Cancer Res, 1986, 46(1): 147-152. |
| [14] |
OSBORNE C K, HOBBS K, CLARK G M. Effect of estrogens and antiestrogens on growth of human breast cancer cells in athymic nude mice[J]. Cancer Res, 1985, 45(2): 584-590. |
| [15] |
邢雷, 黄剑波, 孔令泉, 等. 妊娠乳腺癌患者2例终止妊娠前或后行首疗程化疗的疗效分析并文献复习[J]. 重庆医科大学学报, 2013, 38(2): 220-221. XING L, HUANG J B, KONG L Q, et al. Effect of chemotherapy before or after termination in pregnancy-associated breast cancer patients: two cases report[J]. J Chongqing Med Univ, 2013, 38(2): 220-221. DOI:10.3969/j.issn.0253-3626.2013.02.029 |
| [16] |
STOVER D G, COLOFF J L, BARRY W T, et al. The role of proliferation in determining response to neoadjuvant chemotherapy in breast cancer: a gene expression-based meta-analysis[J]. Clin Cancer Res, 2016, 22(24): 6039-6050. DOI:10.1158/1078-0432.CCR-16-0471 |



