2. 400038 重庆,陆军军医大学(第三军医大学)基础医学院生物医学分析测试中心
2. Biomedical Analysis Center, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
心肌再灌注损伤(myocardial reperfusion injury, MRI)的机制至今尚未完全阐明, 是临床亟待解决的难题之一。既往研究显示, MRI与氧化应激、自噬、能量代谢障碍及中性粒细胞浸润等都具有密切关系[1-7]。其中, 氧化应激在缺血再灌注损伤中占重要地位[4, 8]。Sestrin2蛋白作为一种新发现的蛋白, 在减少活性氧(reactive oxygen species, ROS)聚集、维持能量平衡等方面发挥重要作用。现已证明其与癌症、2型糖尿病及阿尔茨海默病等的发生、发展有关[9-10]。近来, Sestrin2蛋白通过诱导自噬、激活AMPK信号通路等不同机制在脑缺血再灌注方面发挥了保护作用[11-13], 被认为可能是体内一个重要的潜在保护因子。核转录相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)相关信号通路是目前发现的重要的内源性抗氧化应激通路之一。它通过调控抗氧化反应元件(anti-oxidative response element, ARE), 激活下游抗氧化因子, 如GST、HO-1、NQO-1、SOD等发挥抗氧化作用。多项研究表明, Nrf2及其下游抗氧化基因的激活, 可以保护心肌缺血再灌注损伤[14-16]。但是, Sestrin2蛋白在心肌细胞缺血再灌注中的作用及与Nrf2-ARE信号通路的关系目前尚不清楚。鉴于心肌缺氧复氧损伤与心肌缺血再灌注损伤具有相同的病理生理学机制, 本研究通过构建心肌细胞缺氧复氧模型来模拟心肌细胞缺血再灌注损伤, 并采用小干扰RNA(siRNA)方法沉默Sestrin2蛋白, 检测相关蛋白表达及细胞凋亡情况, 探讨Sestrin2蛋白在心肌缺血再灌注中的作用及其可能的作用途径, 为进一步研究和临床预防MRI提供新思路。
1 材料与方法 1.1 材料与试剂H9C2大鼠心肌细胞购自上海细胞库; 胎牛血清(FBS)、DMEM培养基、PBS缓冲液、青霉素/链霉素双抗及无糖培养基均购自美国Gibco公司; 细胞计数试剂盒(cell counting kit 8, CCK-8)购自日本Dojindo公司; BCA蛋白测定试剂盒, 凝胶配制试剂盒购自碧云天生物科技公司; ECL显影试剂盒购自葆光生物; siRNA转染试剂购自锐博生物科技有限公司; Annexin V-APC(货号:550475)和7-AAD染色试剂(货号:559925)购自BD Biosciences公司; 一抗Sestrin2抗体(货号:10795-1-AP, 兔抗大鼠多克隆抗体)、Nrf2抗体(货号:16396-1-AP, 兔抗大鼠多克隆抗体)购自Proteintech公司; Vinculin抗体(货号:13901, 兔抗大鼠单克隆抗体)购自Cell Signaling Technology公司; 二抗为辣根过氧化物酶(HRP)标记的山羊抗兔抗体购自Cell Signaling Technology; 混合气体购自重庆瑞科气体有限公司; LDH试剂盒(货号A020-2)购自南京建成生物有限公司; siRNA序列购自广州锐博生物有限公司, 产品编号为siG150609022533, 靶序列为5′-GCAGAGACCCATTGAACAA-3′。
1.2 实验方法 1.2.1 细胞培养将H9C2心肌细胞传代于含10%FBS、1%双抗混合液的DMEM培养基中, 置于5%CO2, 37 ℃培养箱中培养, 观察细胞状态, 细胞生长至80%~90%, 用0.25%胰酶消化进行细胞传代。
1.2.2 心肌细胞缺氧复氧模型的建立2×105/孔细胞铺于6孔板, 置于5%CO2, 37 ℃培养箱中培养48 h后进行实验。采用Billups-Rothenberg低氧厌氧培养箱充入混合气体(95%N2、5%CO2)构建心肌细胞缺氧复氧模型。细胞分为对照组、缺氧4 h组、复氧2 h组和复氧4 h组。对照组于5%CO2, 37 ℃细胞培养箱中正常培养。缺氧前先将培养基换成无糖无血清培养基同步化处理3 h, 将缺氧组与复氧组细胞放入厌氧培养箱充入混合气体进行缺氧处理, 缺氧4 h后将6孔板取出, 复氧组更换为有糖培养基于5%CO2, 37 ℃细胞培养箱中复氧处理2、4 h。
1.2.3 采用CCK-8检测细胞存活率将8×103/孔细胞接种于96孔板, 过夜贴壁后, 对照组置于5%CO2细胞培养箱中正常培养, 实验组按上述方法进行缺氧复氧处理。缺氧及缺氧复氧结束后, 各组细胞按CCK-8试剂盒说明书, 加入CCK-8反应液, 于37 ℃敷箱中孵育1 h, 酶标仪450 nm波长检测光密度值。
1.2.4 采用微量酶标法进行心肌细胞LDH含量测定将8×103/孔细胞接种于96孔板, 过夜贴壁, 建立缺氧复氧模型后, 取上清按照LDH试剂盒指示操作。
1.2.5 流式细胞术检测细胞凋亡建立细胞缺氧复氧模型, 胰酶消化细胞后PBS清洗3次, 按试剂盒说明加Annexin V和7-AAD染料, 避光处理15 min用流式细胞仪检测细胞凋亡。
1.2.6 siRNA转染2×105/孔细胞铺于6孔板, 过夜贴壁。用120 μL 1×riboFECTTM CP Buffer(v2)稀释10 μL 20 μmol/L siRNA储备液, 轻轻混匀后, 加入12 μL riboFECTTM CP Reagent(v4), 轻轻吹打混匀, 室温孵育0~15 min, 制备成转染复合物, 加入到1 858 μL不含双抗的DMEM培养基中进行siRNA转染。将H9C2心肌细胞分为对照组、缺氧4 h+si-NC组(阴性对照组)、缺氧4 h+siRNA组、复氧4 h+si-NC(阴性对照组)、复氧4 h+siRNA组。构建针对Sestrin2蛋白沉默的siRNA与其阴性对照(si-NC), 利用脂质体转染法导入H9C2心肌细胞。
1.2.7 Western blot检测Sestrin2、Nrf2/HO-1蛋白含量变化建立缺氧复氧模型, 胰酶消化细胞后用PBS洗3遍, 加RIPA(加蛋白酶抑制剂)裂解液裂解细胞, BCA试剂盒检测蛋白浓度。取20 μg蛋白样本加入5×蛋白上样缓冲液于100 ℃变性10 min。进行SDS-PAGE凝胶电泳, 完毕后将蛋白印迹转至PVDF膜上, 5%脱脂奶粉封闭1 h后剪膜, 分别加Vinculin抗体(1 :2 000稀释)、Sestrin2抗体(1 :2 000稀释)、Nrf2抗体(1 :2 000稀释)、HO-1抗体(1 :2 000稀释)孵育, 4 ℃过夜。TBST洗膜3遍, 孵育二抗2 h, 再用TBST洗3遍后, 加ECL显影液曝光。上述步骤重复至少3次。
1.3 统计学分析利用GraphPad Prism 8.0和FlowJo10.0进行数据处理, 数据以x±s表示。两组样本之间采用独立样本t检验, 多组样本两两比较采用多因素方差分析。检验水准α=0.05。
2 结果 2.1 心肌细胞缺氧复氧模型的建立CCK-8结果显示, 细胞存活率随复氧时间呈下降趋势, 与对照组比较, 复氧4 h组细胞存活率显著降低(P<0.01, 图 1); LDH结果表明, 随复氧时间增加, 细胞损伤加重。与对照组比较, 复氧4 h组LDH活性显著增加(P<0.01, 图 2)。流式细胞检测结果显示, 与对照组比较, 缺氧4 h组细胞凋亡率明显增高(P<0.01, 图 3A), 随复氧时间增加, 细胞凋亡率呈上升趋势, 具有时间依赖性(P<0.05, 图 3B)。缺氧4 h复氧4 h为心肌细胞缺氧复氧模型建立的时间点, 可作为后续研究时间。
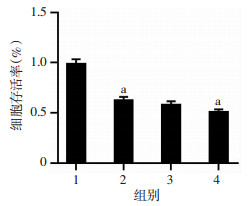
|
| 1:对照组; 2:缺氧4 h组; 3:复氧2 h组; 4:复氧4 h组; a:P<0.01, 与对照组比较 图 1 CCK-8测定缺氧及复氧后各组细胞存活率 |
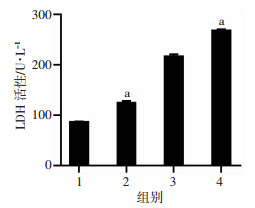
|
| 1:对照组; 2:缺氧4 h组; 3:复氧2 h组; 4:复氧4 h组; a:P<0.01, 与对照组比较 图 2 LDH测定缺氧及复氧后各组心肌细胞损伤 |
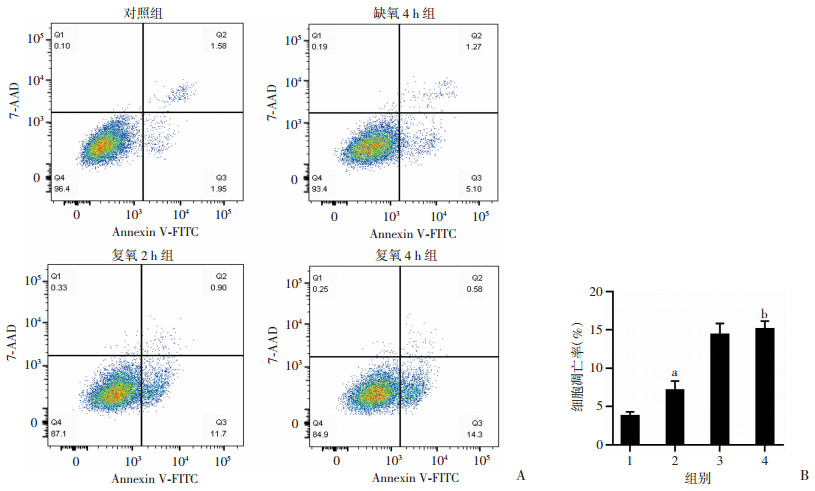
|
| A:流式细胞术结果; B:各组细胞凋亡率比较; 1:对照组; 2:缺氧4 h组; 3:复氧2 h组; 4:复氧4 h组; a:P<0.01, 与对照组比较; b:P<0.01, 与缺氧4 h组比较 图 3 流式细胞术测定缺氧及复氧后各组心肌细胞凋亡率 |
2.2 缺氧复氧对Sestrin2蛋白表达的影响
Western blot结果显示, 与对照组比较, 缺氧4 h(si-NC)组和复氧4 h(si-NC)组Sestrin2蛋白表达量均增加(P<0.01, 图 4)。复氧4 h组蛋白表达比单纯缺氧4 h组更高(P<0.01)。说明Sestrin2蛋白参与了心肌缺氧及缺氧复氧损伤过程。
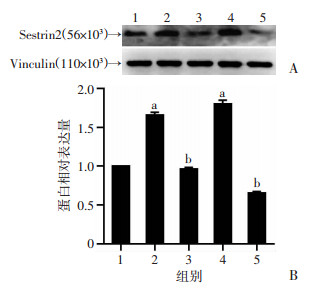
|
| A: Western blot检测结果; B:蛋白半定量分析; 1:对照组; 2:缺氧4 h+si-NC组; 3:缺氧4 h+siRNA组; 4:复氧4 h+si-NC组; 5:复氧4 h+siRNA组; a:P<0.01, 与对照组比较; b:P<0.05, 分别与其相应阴性对照组比较 图 4 Western blot检测缺氧、复氧及siRNA干扰后Sestrin2蛋白含量变化 |
2.3 siRNA干扰Sestrin2蛋白表达对心肌细胞凋亡的影响
Western blot结果显示, 与阴性对照组相比, 缺氧4 h组与复氧4 h组siRNA沉默Sestrin2蛋白表达效果明显(P<0.01, 图 4B)。流式细胞术结果显示, siRNA沉默Sestrin2蛋白表达后, 细胞凋亡率升高(P<0.01, 图 5), 证明Sestrin2蛋白的激活与心肌细胞凋亡显著性相关, 可能起到保护性作用。

|
| A~E:流式细胞术检测各组细胞凋亡情况; F:各组细胞凋亡率分析; 1:对照组; 2:缺氧4 h+si-NC组; 3:缺氧4 h+ siRNA组; 4:复氧4 h+si-NC组; 5:复氧4 h+siRNA组; a:P<0.01, 分别与缺氧4 h+si-NC组和复氧4 h+si-NC组比较 图 5 流式细胞术检测siRNA沉默Sestrin2蛋白表达后的细胞凋亡率变化 |
2.4 siRNA干扰Sestrin2蛋白表达对Nrf2及HO-1蛋白表达的影响
Western blot结果显示, 在缺氧复氧损伤过程中Sestrin2蛋白表达增加, Nrf2及HO-1表达也增加, 说明Sestrin2与Nrf2相关蛋白可能具有相关关系。同时, siRNA沉默Sestrin2蛋白表达后, Nrf2及HO-1蛋白表达也降低(P<0.01, 图 6)。

|
| A:Western blot检测结果; B~D:HO-1、Nrf2、Sestrin2蛋白的相对表达量; 1:对照组; 2:复氧4 h+si-NC组; 3:复氧4 h+siRNA组; a:P<0.01, 与复氧4 h+si-NC组比较 图 6 Western blot检测复氧4 h Sestrin2蛋白沉默后Nrf2及HO-1蛋白含量的变化 |
3 讨论
目前, 急性心肌梗死(acute myocardial infarction, AMI)的发病率和病死率呈逐渐上升趋势。尽快进行经皮冠状动脉介入(percutaneous coronary intervention, PCI)术是减少AMI后心肌梗死面积和改善患者临床预后的关键治疗措施。然而伴随血管再通后诱发的心肌再灌注损伤, 会导致心律失常等一系列恶性心血管事件, 其具体机制尚不明确, 临床也尚无有效的预防和治疗措施。既往研究显示缺血再灌注损伤与氧化应激、免疫炎症反应、中性粒细胞浸润等有密切关系[5-7], 其中氧化应激占重要地位。目前, 抗氧化治疗被认为是预防氧化应激损害的关键, 但是实验和临床研究均显示外源性抗氧化剂进入细胞后的效果不佳。故而, 寻找特异性内源性抗氧化治疗方式获得广泛关注[17-18]。Sestrin2蛋白在癌症[19-20]、年龄相关疾病[21-22]等方面, 被证明可通过内源性抗氧化应激等方式阻碍或延缓相关疾病的发生、发展。新近, ISHIHARA等[23]发现在肾脏缺血再灌注损伤过程中, Sestrin2蛋白可以通过调节自噬, 发挥肾脏保护作用。
因心肌细胞缺氧复氧与缺血再灌注损伤具有相似的病理生理过程, 本研究利用Billups-rothenberg低氧厌氧培养箱充入混合气体的物理性缺氧复氧方式模拟心肌缺血再灌注过程。结果发现缺氧时细胞凋亡率升高, 存活率降低, 心肌细胞出现损伤, 复氧后细胞损伤进一步加重, 凋亡呈升高趋势, 说明本实验缺氧4 h后再复氧4 h可以达到缺氧复氧损伤状态。同时发现在缺氧复氧损伤过程中, 心肌细胞的Sestrin2蛋白表达量增加, 证明Sestrin2蛋白参与了心肌细胞缺氧复氧损伤过程。本研究用siRNA沉默Sestrin2蛋白的表达后, 流式细胞术检测细胞凋亡, 发现细胞凋亡显著性加重, 进一步说明Sestrin2蛋白参与心肌缺氧复氧过程, 并可以作为减轻心肌细胞损伤的潜在性作用靶点。Nrf2相关信号通路是已知细胞内抗氧化应激的重要通路之一。在基础状态下, 其与keap1结合成复合体并被降解。而受到氧化刺激后, Nrf2进入细胞核与氧化应答元件结合, 激活下游HO-1、TrxR1等抗氧化基因的表达, 发挥抗氧化作用[24]。BAE等[25]研究显示, Sestrin2通过P62依赖性自噬降解keap1, 激活Nrf2相关信号通路下游抗氧化基因Rbx1, 在脂质诱导的肝脏氧化损伤方面发挥保护作用。本研究进一步发现, 用siRNA沉默Sestrin2蛋白表达后, Nrf2蛋白表达降低, 其下游抗氧化蛋白HO-1表达也同时降低。所以, 我们初步认为Sestrin2蛋白参与心肌缺氧复氧损伤的作用可能与Nrf2/HO-1相关信号通路激活相关。其深层机制还需进一步研究。综上所述, 本研究发现Sestrin2蛋白作为一种重要的内源性抗氧化应激蛋白存在于心肌细胞中, 且参与心肌缺氧复氧损伤的过程。因其具有内源性, 且可以调控抵抗多种疾病的氧化损伤, 可能通过激活刺激该蛋白或者其相关靶点等方法预防或治疗心肌再灌注损伤。
| [1] |
SZUMMER K, JERNBERG T, WALLENTIN L. From early pharmacology to recent pharmacology interventions in acute coronary syndromes: JACC state-of-the-art review[J]. J Am Coll Cardiol, 2019, 74(12): 1618-1636. DOI:10.1016/j.jacc.2019.03.531 |
| [2] |
FORTUNI F, CRIMI G, ANGELINI F, et al. Early complete revascularization in hemodynamically stable patients with ST-segment elevation myocardial infarction and multivessel disease[J]. Can J Cardiol, 2019, 35(8): 1047-1057. DOI:10.1016/j.cjca.2019.03.006 |
| [3] |
KWON O, PARK D W, PARK S J. Completeness of revascularization as a determinant of outcome: a contemporary review and clinical perspectives[J]. Can J Cardiol, 2019, 35(8): 948-958. DOI:10.1016/j.cjca.2018.12.038 |
| [4] |
DHALLA N S, ELMOSELHI A B, HATA T, et al. Status of myocardial antioxidants in ischemia-reperfusion injury[J]. Cardiovasc Res, 2000, 47(3): 446-456. DOI:10.1016/s0008-6363(00)00078-x |
| [5] |
KHUANJING T, PALEE S, CHATTIPAKORN S C, et al. The effects of acetylcholinesterase inhibitors on the heart in acute myocardial infarction and heart failure: From cells to patient reports[J]. Acta Physiol (Oxf), 2020, 228(2): e13396. DOI:10.1111/apha.13396 |
| [6] |
FAN Q, TAO R, ZHANG H, et al. Dectin-1 contributes to myocardial ischemia/reperfusion injury by regulating macrophage polarization and neutrophil infiltration[J]. Circulation, 2019, 139(5): 663-678. DOI:10.1161/CIRCULATIONAHA.118.036044 |
| [7] |
LIU C Y, ZHANG Y H, LI R B, et al. LncRNA CAIF inhibits autophagy and attenuates myocardial infarction by blocking p53-mediated myocardin transcription[J]. Nat Commun, 2018, 9(1): 29. DOI:10.1038/s41467-017-02280-y |
| [8] |
CASIN K M, FALLICA J, MACKOWSKI N, et al. S-nitrosoglutathione reductase is essential for protecting the female heart from ischemia-reperfusion injury[J]. Circ Res, 2018, 123(11): 1232-1243. DOI:10.1161/CIRCRESAHA.118.313956 |
| [9] |
CHEN S D, YANG J L, LIN T K, et al. Emerging roles of sestrins in neurodegenerative diseases: counteracting oxidative stress and beyond[J]. J Clin Med, 2019, 8(7): E1001. DOI:10.3390/jcm8071001 |
| [10] |
LEE J H, BUDANOV A V, TALUKDAR S, et al. Maintenance of metabolic homeostasis by Sestrin2 and Sestrin3[J]. Cell Metab, 2012, 16(3): 311-321. DOI:10.1016/j.cmet.2012.08.004 |
| [11] |
KIM K M, YANG J H, SHIN S M, et al. Sestrin2: a promising therapeutic target for liver diseases[J]. Biol Pharm Bull, 2015, 38(7): 966-970. DOI:10.1248/bpb.b15-00228 |
| [12] |
QUAN N H, SUN W Q, WANG L, et al. Sestrin2 prevents age-related intolerance to ischemia and reperfusion injury by modulating substrate metabolism[J]. FASEB J, 2017, 31(9): 4153-4167. DOI:10.1096/fj.201700063R |
| [13] |
MORRISON A, CHEN L, WANG J, et al. Sestrin2 promotes LKB1-mediated AMPK activation in the ischemic heart[J]. FASEB J, 2015, 29(2): 408-417. DOI:10.1096/fj.14-258814 |
| [14] |
ZHAO Y, LIU X H, FU X J, et al. Protective effects of epigallocatechin gallate against ischemia reperfusion injury in rat skeletal muscle via activating Nrf2/HO-1 signaling pathway[J]. Life Sci, 2019, 239: 117014. DOI:10.1016/j.lfs.2019.117014 |
| [15] |
ZHANG J L, ZHANG Q Q, LIU G, et al. Therapeutic potentials and mechanisms of the Chinese traditional medicine Danshensu[J]. Eur J Pharmacol, 2019, 864: 172710. DOI:10.1016/j.ejphar.2019.172710 |
| [16] |
GU M H, HE P K, LYU C F, et al. Spinosin and 6'''-Feruloylspinosin protect the heart against acute myocardial ischemia and reperfusion in rats[J]. Mol Med Rep, 2019, 20(5): 4253-4261. DOI:10.3892/mmr.2019.10686 |
| [17] |
HAUSENLOY D J, YELLON D M. Myocardial ischemia-reperfusion injury: a neglected therapeutic target[J]. J Clin Invest, 2013, 123(1): 92-100. DOI:10.1172/JCI62874 |
| [18] |
JAKOBS P, SERBULEA V, LEITINGER N, et al. Nuclear factor (erythroid-derived 2)-like 2 and thioredoxin-1 in atherosclerosis and ischemia/reperfusion injury in the heart[J]. Antioxid Redox Signal, 2017, 26(12): 630-644. DOI:10.1089/ars.2016.6795 |
| [19] |
DAI J M, HUANG Q C, NIU K W, et al. Sestrin 2 confers primary resistance to sorafenib by simultaneously activating AKT and AMPK in hepatocellular carcinoma[J]. Cancer Med, 2018, 7(11): 5691-5703. DOI:10.1002/cam4.1826 |
| [20] |
LOAYZA-PUCH F, DROST J, ROOIJERS K, et al. P53 induces transcriptional and translational programs to suppress cell proliferation and growth[J]. Genome Biol, 2013, 14(4): R32. DOI:10.1186/gb-2013-14-4-r32 |
| [21] |
QUAN N H, WANG L, CHEN X, et al. Sestrin2 prevents age-related intolerance to post myocardial infarction via AMPK/PGC-1α pathway[J]. J Mol Cell Cardiol, 2018, 115: 170-178. DOI:10.1016/j.yjmcc.2018.01.005 |
| [22] |
CHUNG H S, HWANG H J, HWANG S Y, et al. Association of serum Sestrin2 level with metabolic risk factors in newly diagnosed drug-naïve type 2 diabetes[J]. Diabetes Res Clin Pract, 2018, 144: 34-41. DOI:10.1016/j.diabres.2018.07.024 |
| [23] |
ISHIHARA M, URUSHIDO M, HAMADA K, et al. Sestrin-2 and BNIP3 regulate autophagy and mitophagy in renal tubular cells in acute kidney injury[J]. Am J Physiol Renal Physiol, 2013, 305(4): F495-F509. DOI:10.1152/ajprenal.00642.2012 |
| [24] |
CALVERT J W, JHA S, GUNDEWAR S, et al. Hydrogen sulfide mediates cardioprotection through Nrf2 signaling[J]. Circ Res, 2009, 105(4): 365-374. DOI:10.1161/CIRCRESAHA.109.199919 |
| [25] |
BAE S H, SUNG S H, OH S Y, et al. Sestrins activate Nrf2 by promoting p62-dependent autophagic degradation of Keap1 and prevent oxidative liver damage[J]. Cell Metab, 2013, 17(1): 73-84. DOI:10.1016/j.cmet.2012.12.002 |



