程序性细胞死亡分子1/配体1(programmed death 1/programmed death ligand 1, PD-1/PD-L1)抑制剂已经改变了晚期非小细胞肺癌(non-small-cell-lung cancer, NSCLC)一线治疗的格局。对于EGFR、ALK驱动基因阴性、PD-L1表达阳性的晚期NSCLC患者的一线治疗, NCCN指南[1](2020年第3版)给了两种推荐策略:单纯免疫检测点抑制剂(immune checkpoint inhibitor, ICIs)治疗和ICIs联合化疗。在大型随机对照研究(RCT)中, 单纯ICIs治疗策略包含PD-1/PD-L1阻断剂单药(ICIs单药)和PD-1/PD-L1阻断剂联合CTLA-4阻断剂(双免疫治疗)。单纯ICIs治疗策略以及免疫联合其他治疗(如抗血管生成抑制剂)策略旨在让更多的患者从免疫治疗中获益, 而不必接受化疗所带来的心理恐惧、治疗痛苦和不良反应, 即免去化疗。免去化疗是吴一龙教授点评2019年免疫一线晚期肺癌五大关键词之一(长期生存、全线覆盖、免去化疗即去化疗、挺进早期、精准预测)。因此, 晚期NSCLC一线治疗去化疗逐渐成了备受关注的话题。
单纯免疫治疗策略中, 2019年ASCO发表以帕博利珠单抗为代表的KEYNOTE-001临床研究[2]数据显示:PD-1单药一线治疗晚期NSCLC的5年生存率为23%, PD-L1高表达者则为29.6%。2020年ASCO报道的以纳武利尤单抗为代表的CheckMate227临床研究[3]结果对单纯免疫治疗策略进行了补充, 采用纳武利尤单抗联合伊匹木单抗方案(双免疫治疗), 与化疗组比较, 3年总生存率(overall survival, OS)分别是:PD-L1≥1%人群, 33% vs 22%;PD-L1<1%人群, 34% vs 15%。
临床实践中对于是否免去化疗存在一定争议, 哪些特定人群可以免去化疗?哪些情况下需要加上化疗?免去化疗有哪些治疗选择?免去化疗与加上化疗之间如何转接?免去化疗是否一定带来不良反应的减轻?如何精准地筛选到最优质的免去化疗患者?对于这些问题, 目前的数据还有限, 正在等待更多的数据更新, 尤其是长期生存率。
面对这样的学术争议和临床困惑, 来自肿瘤科、呼吸内科、分子诊断科等学科的重庆肺癌精准治疗协作组(Chongqing precision lung oncology group, CPLOG)展开学术沙龙, 通过文献复习和经验交流, 探讨“晚期NSCLC一线去化疗时代是否已来临”, 以期对基层医生的临床实践给予指导意见。
1 主题背景介绍李力副教授(陆军军医大学大坪医院呼吸内科)
晚期NSCLC一线去化疗时代是否已来临?我们是否能够精准地发现哪些患者可以去化疗?哪些患者需要接受化疗?复习文献并同时梳理最新研究报道, 深挖晚期一线NSCLC接受ICIs单药和ICIs联合化疗以及双免疫治疗的主要循证医学证据, 作为专家们讨论的依据。
通过免疫组织化学法进行PD-L1检测, 可将人群分为3大类:PD-L1高表达、PD-L1低表达以及PD-L1阴性。PD-L1高表达人群包括PD-L1≥50%(PD-L1检测克隆号:22C3和28-8)或者TC3和/或IC3(PD-L1检测克隆号:SP-142)。PD-L1低表达人群包括PD-L1表达1%~49%(PD-L1检测克隆号:22C3和28-8)和TC1/2和/或IC1/2(PD-L1检测克隆号:SP-142)。PD-L1阴性人群是指用上述克隆号的抗体对病理标本进行免疫组织化学染色后未观察到肿瘤细胞或者免疫细胞上有PD-L1表达。就这3类人群进行“去化疗”分析如下。
1.1 PD-L1高表达且驱动基因阴性的晚期NSCLC, 一线去化疗能够实现吗?针对PD-L1高表达且驱动基因阴性的晚期NSCLC一线免疫治疗策略, 根据KEYNOTE-024、KEYNOTE-042和IMpower110研究, 是采用单药ICIs还是ICIs联合化疗, CPLOG已经形成专家建议[4], 应综合考虑患者的临床特征, 包括PS评分、性别、年龄、吸烟史、肿瘤负荷等临床因素, 同时结合基因突变、TMB以及CD8+T细胞浸润等免疫指标检测, 部分患者可以接受单纯免疫治疗(帕博利珠单抗或阿替利珠单抗), 部分患者需要接受免疫联合化疗。
双免疫疗法是去化疗的新策略, 代表性研究为CheckMate227[5]。CheckMate227是一项多中心、开放、Ⅲ期临床研究, Part1研究结果显示在PD-L1高表达的晚期NSCLC一线人群中, 双免疫治疗组(纳武利尤单抗联合低剂量伊匹木单抗)对比化疗组的客观缓解率(objective response rate, ORR)为44.4% vs 35.4%;中位无进展生存期(progression free survival, PFS)为6.7个月vs 5.6个月, HR值为0.62(95%CI:0.49~0.79), 中位OS为21.2个月vs 14.0个月, HR值为0.70(95%CI:0.55~0.90);ICIs单药组(纳武利尤单抗)对比化疗组的客观缓解率为36.9% vs 35.4%;中位PFS均为5.6个月, HR值为0.75(95%CI:0.59~0.95), 中位OS为18.1个月vs 14.0个月, HR值为0.69(95%CI:0.53~1.01)。从临床疗效来看, 免疫单药策略(纳武利尤单抗)和双免疫策略(纳武利尤单抗联合低剂量伊匹木单抗)都比化疗有生存获益趋势。不良反应方面, 双免疫治疗组、化疗组以及纳武利尤单抗组3~4级不良反应发生率分别是33%、36%、19%。
1.2 PD-L1阴性且驱动基因阴性的晚期NSCLC, 一线去化疗能够实现吗?对于PD-L1阴性且驱动基因阴性的晚期一线NSCLC, 双免疫治疗组对比化疗组, 在CheckMate227研究中OS的HR值为0.62(95%CI:0.48~0.78), 两组的ORR分别为27.3% vs 23.1%, 疾病缓解时间为18个月vs 4.8个月。目前仅有CheckMate227研究结果提示双免疫对比化疗带来显著的生存获益。因此, “去化疗”策略为双免疫疗法。
目前指南中, 该人群的标准治疗为ICIs联合化疗。POOL分析[6]KEYNOTE-021G、KEYNOTE-189和KEYNOTE-407中PD-L1阴性人群中免疫联合化疗对比化疗带来显著的长期生存获益, OS的HR值为0.56(95%CI:0.43~0.73)。但是, 不同的ICIs联合化疗对比化疗带来的长期生存获益各不相同。KEYNOTE-189[7]和KEYNOTE-407[8]研究结果表明:帕博利珠单抗联合化疗对比化疗, OS的HR值分别为0.52(95%CI:0.36~0.74)和0.79(95%CI:0.56~1.11)。其中, KEYNOTE-407中OS的HR值跨1。IMpower150[9]研究显示, 阿替利珠单抗联合化疗及贝伐珠单抗显著延长OS, HR值为0.77(95%CI:0.61~0.99)。然而, IMpower130[10]、IMpower131[11]和IMpower132[12]研究显示:阿替利珠单抗联合化疗组与化疗组的生存获益差异无统计学意义。CheckMate227研究Part1中纳武利尤单抗联合化疗对比化疗OS差异无统计学意义, HR值为0.78(95%CI:0.60~1.02)。因此, PD-L1阴性且驱动基因阴性者, 应采用帕博利珠单抗联合化疗, 或者阿替利珠单抗联合化疗及贝伐珠单抗。
1.3 PD-L1低表达且驱动基因阴性的晚期NSCLC, 一线去化疗能够实现吗?对于PD-L1低表达且驱动基因阴性的晚期一线NSCLC, 多项研究显示ICIs单药并不优于化疗。如, KEYNOTE-042的全球研究[13]和中国研究[14]中, PD- L1表达1%~49%人群OS的HR值均跨1, 分别为0.69 (95% CI:0.40~1.20)和0.92 (95%CI:0.77~1.11)。同样, 双免疫治疗策略也不优于化疗。CheckMate227研究显示双免疫治疗组对比化疗组无生存获益, 两组的中位OS都是15.1个月。因此, PD-L1低表达且驱动基因阴性的晚期NSCLC一线的标准治疗方案是ICIs联合化疗。
值得注意的是, 对于PD-L1低表达人群, 不同ICIs联合化疗的临床研究有不同的研究结论。KEYNOTE-189[7]和KEYNOTE-407[8]研究表明:帕博利珠单抗联合化疗带来的生存获益均优于化疗, OS的HR值分别为0.62(95%CI:0.42~0.92)和0.59(95%CI:0.42~0.84)。IMpower150[9]研究显示:阿替利珠单抗联合化疗加贝伐珠单抗显著延长OS, HR值为0.56(95%CI:0.41~0.77)。然而, IMpower130[10]和IMpower131[11]研究显示:阿替利珠单抗联合化疗组与化疗组的生存获益差异无统计学意义。
2 小组讨论阮志华教授(陆军军医大学第一附属医院肿瘤科)
我们探讨去化疗的治疗策略, 旨在找到什么样的患者接受怎样的治疗。CheckMate227研究为晚期一线NSCLC提供了双免疫治疗策略, 这是一种新的治疗策略。在作用机制方面, 伊匹木单抗与纳武利尤单抗的机制略有差别, 但互为补充。抗CTLA4单抗诱导新生的抗肿瘤性T细胞参与免疫应答, 而纳武利尤单抗主要恢复已经活化的T细胞的杀伤功能。CTLA4与B7分子的结合, 会降低T细胞的活化水平, 抑制T细胞增殖, 抗CTLA4单抗使得刺激信号恢复, 更多的肿瘤特异性T细胞因此活化和增殖。纳武利尤单抗竞争性结合PD-L1, 解除PD-1/PD-L1结合对于T细胞的免疫抑制作用, 从而恢复T细胞的肿瘤杀伤能力, 并刺激细胞因子的产生。
其他实体瘤的临床研究也显示双免疫治疗策略优于化疗, 如黑色素瘤, KEYNOTE-029[15]研究显示双免疫组的3年OS率为73%, CheckMate067[16]研究显示双免疫组的3年OS率为58%。
朱宇熹教授(重庆医科大学附属第一医院肿瘤科)
OS是最重要的临床获益参考指标, 鉴于免疫治疗带来部分患者的长期生存获益, 尤其是HR值可以比较生存获益的程度和临床意义的大小, 现有研究结果总体上支持一部分患者可以实现去化疗。特别是对于PD-L1高表达人群, 结合文献数据支持去化疗, 如上所述, 可用ICIs单药或者双免疫治疗策略。但要注意4个问题。
(1) 临床实践中, 并不是所有PD-L1高表达人群都可以去化疗。Meta分析提示:ICIs联合化疗对比单药ICIs的ORR和PFS有差异, OS差异无统计学意义[17]。仍有研究显示联合化疗带来更好的OS获益。在《PD-L1高表达晚期非小细胞肺癌一线免疫治疗策略的探讨》[4]中已经给出了临床决策的建议。但值得注意的是:同样是PD-L1高表达人群, 接受帕博利珠单药治疗在KEYNOTE-024和KEYNOTE-042中位OS值分别是30个月和20个月, 提示PD-L1高表达人群在不同的临床研究中生存获益有差异。
(2) 双免疗法在临床决策时应该结合PD-L1和TMB两个指标进行评估, 尤其对于PD-L1阴性且驱动基因阴性者, TMB-high可选择双免疫疗法。
(3) 双免疗法在某些方面较化疗有更大的毒性[1]。
(4) 免疫治疗不管是单药还是双药, 需警惕药物使用早期仍有部分患者无效, 甚至快速进展或死亡。
杨志祥教授(重庆市中医院放射治疗科)
PD-L1表达在1%~49%的人群亚组值得关注。在KEYNOTE-042中国研究[14]中, OS的HR值为0.69 (95% CI:0.40~1.20)。对比化疗组, ICIs组长期生存数据差异无统计学意义, 但两组的中位持续缓解时间分别为17.4个月vs 8.1个月, 提示PD-L1表达在1%~49%的人群中仍有一部分患者单药免疫治疗是获益的, 因此单药免疫治疗也可以是一种选择。
对于PD-L1表达在1%~49%的人群, 尽量采用免疫联合化疗, 但对于拒绝化疗或者身体状况不能耐受化疗, 如血象不达标、肝肾功不全者, 结合KEYNOTE-042的研究结果, 可以考虑帕博利珠单抗单药治疗, 如能结合其他Biomarker指标如TMB、MSI/DMMR检测结果来组合、筛选免疫获益人群, 则有助于提高治疗有效率。
需要注意的是, 对于PD-L1表达在1%~49%的人群, 选择免疫单药治疗时, 应该选择帕博利珠单抗, 而不是纳武利尤单抗。CheckMate227研究显示:PD-L1≥1%人群中, 纳武利尤单抗单药不优于化疗, OS为15.7个月vs 14.9个月, HR值为0.88(95% CI:0.75~1.04)。CheckMate026研究[18]也显示:PD-L1≥1%的人群中, OS为14.4个月vs 13.2个月, HR值为1.02(95% CI:0.80~1.30)。
罗虎博士(陆军军医大学第一附属医院呼吸内科)
CheckMate227研究中, 纳武利尤单抗联合低剂量伊匹木单抗在PD-L1<1%的人群中对比化疗带来显著的生存获益。这部分人群可以考虑去化疗。需要注意的是, 分层分析显示:只有PD-L1阴性且TMB high人群, 双免疫疗法才带来PFS的获益, 而对于TMB-low人群, 双免疫疗法并不带来PFS获益。
在没有双免疫治疗的前提下, PD-L1阴性人群中, ICIs联合化疗是标准治疗。在众多的Ⅲ期临床研究中, 仅KEYNOTE-189和IMpower150研究结果显示免疫联合化疗对比化疗带来长期的生存获益。提示我们需要进行更多治疗模式的探索。
除了ICIs单药或者免疫双药的方法, 还可以考虑免疫与其他治疗手段结合。正在开展的临床研究中, 包括更多的联合治疗模式, 比如免疫联合放疗、免疫联合小分子多靶点TKI(安罗替尼[19]、乐伐替尼[20]、阿帕替尼[21]、Sitravatinib[22])、免疫联合抗血管生成治疗[23](简化的IMpower150模式)、免疫检测点抑制剂联合其他免疫治疗方法(如Car-T[23]、细胞因子[23]、甚至非特异性免疫制剂胸腺法新[24]等)。
杨镇洲教授(重庆医科大学第二附属医院肿瘤科)
对于CheckMate227研究中双免疫治疗取代化疗的问题, 个人观点不支持。
(1) 联合治疗兼顾疗效的同时, 首要考虑毒副反应。CheckMate227研究中双免疫治疗方案中, 尽管采用低剂量伊匹木单抗(1 mg/kg、Q6W), 3~4级治疗相关不良反应双免疫治组和化疗组分别为33%和36%。但双免疫治疗组引起治疗中断的比例为12%, 是化疗组(中断率5%)的2倍多[5]。
(2) 临床治疗策略要考虑药物经济学。双免疫治疗在PD-L1≥1%的人群, 对比化疗组OS绝对值延长1.4个月, 在PD-L1<1%的人群, OS的绝对值延长5个月。从药物经济学的角度, 纳武利尤单抗和伊匹木单抗的价格昂贵, 化疗药物更加经济, 患者能够承担。采用双免疫治疗方案在临床实践中要让患者多花几倍的费用换来几个月的生存获益。
此外, 在免疫联合化疗的选择时要注意不同ICIs的疗效不同。在CheckMate227研究中, 对于PD-L1<1%的人群, 从OS的角度, 免疫联合化疗并不优于化疗, 这一结果与KEYNOTE-189模式和KEYNOTE-407模式结论不一致。提示在ICIs联合化疗时应选择帕博利珠单抗而不是纳武利尤单抗。
宫亮教授(陆军军医大学第一附属医院呼吸内科)
如何找到合适的人群接受最佳的治疗方案?我们试图回答这个最根本的问题, 找到一些证据来筛选出去化疗的人群或者可能去化疗的人群。从哪里开始呢?我们从二线免疫治疗中得到启发——早期肿瘤缓解的患者能够带来长期的生存获益。CheckMate017/057研究[25]中, 纳武利尤单抗对比多西他赛, 客观缓解率为19.7% vs 11.2%, 5年的OS率为13.4% vs 2.6%。
在驱动基因阴性的晚期NSCLC一线治疗中, PD-L1高表达人群中哪一部分能去化疗?除考虑上述生物标志物、ICIs的种类和联合方式等因素外, 2019年WCLC更新KEYNOTE-024研究3年OS数据表明[26]:早期治疗肿瘤有退缩(PR和CR)患者能够在后期的治疗中带来长期生存获益。接受2年帕博利珠单抗单药治疗的38例患者中, 有28例PR, 3例是CR的患者。从ICIs开始使用, 肿瘤有应答的人群, 可能会长期获益, 可考虑继续使用单药, 不需要联合化疗。
谢启超教授(重庆医科大学附属第三医院肿瘤科)
我认为目前去化疗还尚早, 免疫治疗仍离不开化疗。
(1) 化疗在新辅助治疗和术后辅助治疗中分别贡献5%的长期生存率[27]。在免疫治疗时代, 化疗带来高的客观缓解率是对于免疫单药疗效的补充, KEYNOTE-042和KEYNOTE-189研究中OS的HR值分别为0.69(95%CI:0.56~0.85)和0.42(95%CI:0.26~0.68)。
(2) 目前免疫治疗最好的数据KEYNOTE-001研究5年生存率也只有20%左右。在免疫治疗耐药后再挑战也只有50%的有效, 免疫治疗获益的人群有限, 且部分患者还会出现3~4级毒副反应。免疫治疗无效、疗效差或者耐药者还是要回归化疗或者免疫联合化疗的治疗方式。
(3) 我们不希望化疗的副反应, 以及化疗对于身心的创伤, 如果能筛选出化疗副反应轻、应答效果好的人群, 化疗将占据更为重要的临床地位。
辇伟奇教授(重庆市肿瘤医院肿瘤实验室)
晚期NSCLC一线去化疗获益人群的选择, 首先应充分考量现有标志物PD-L1、TMB在三种一线治疗方案(ICIs单药、ICIs联合化疗以及双免疫治疗)中对于疗效预测的作用。
接受ICIs单药治疗PD-L1高表达人群获得30%~ 40%的客观缓解率。KEYNOTE-024和KEYNOTE-042研究中ORR为47%和39.5%, OS分别为30个月和20个月。IMpower110研究[28]中, TC3/IC3人群的ORR为38.3%, OS为20.2个月。
在CTLA-4联合免疫治疗中, 同时结合PD-L1和TMB可以筛选出45%左右的人群获得抗肿瘤应答。CheckMate227研究中PD-L1阳性同时TMB high的人群, 双免疫治疗组的ORR为45%, OS为23个月。在MYSTIC研究[29], PD-L1状态未知, 同时TMB>20 Mut/Mb的人群ORR为48%, OS为21.9个月。
在ICIs联合化疗中, TMB的疗效预测作用有限[30]。KEYNOTE-407研究中, 联合组对比化疗组, 分别在TMB≥175 Mut/exon和TMB<175 Mut/exon亚组的OS差异均无统计学意义。在KEYNOTE-189研究, TMB≥175 Mut/exon的人群中, 联合组的OS不优于化疗组, 反而在TMB<175 Mut/exon人群中, 联合组的疗效优于化疗组。
其次, 我们需要考虑标志物表达的异质性和检测体系的复杂性, 部分新型标志物的应用尚需标准化。应尽可能完善免疫治疗临床实践中标志物的多维与全程检测、监测。如利用NGS去发现免疫正性基因和免疫负性基因[31] (STK11、KRAS、ERBB2、KEAP1、JAK1/2), 不仅对免疫治疗疗效有很好的预测, 也便于治疗过程中的药物调整。
李梦侠教授(陆军军医大学大坪医院肿瘤科)
目前的标志物尚不能完美预测免疫药物的临床疗效。临床实践中, 基于去化疗的最大可能性考量, 综合临床特征、基因突变情况、免疫指标等进行人群的初步分类, 将晚期一线NSCLC大致分为Chemo-based population和去化疗population。
PD-L1的免疫组化检测和TMB测算对免疫治疗的疗效预测有限, 临床中常常观察到PD-L1阴性或/和TMB中低水平的患者有较好的ICIs的应答。同时一些ICIs的负向调控基因常常也无法准确预测超进展或者无效, 因此, 通过尝试性给药可能是筛选单药ICIs有效的患者, 提高去化疗率的重要途径。
建议可以按如下流程进行。对于驱动基因阴性的晚期一线NSCLC先接受为时6周的ICIs单药治疗(2周方案的ICIs行3个周期治疗或3周方案的ICIs行2个周期治疗), 而后进行评估, 如果有临床应答(定义为至少发生影像学改善、症状改善和生化改善其中之一), 则继续使用免疫治疗; 对于无临床应答者(定义为无影像学改善、症状改善和生化改善的患者), 则采用其他方案治疗, 如联合抗血管、联合免疫或者改用化疗方案, 从而最大程度地筛选单药免疫治疗获益的人群, 实现去化疗。
孙建国教授(陆军军医大学第二附属医院肿瘤科)
晚期NSCLC一线去化疗的时代是否已来临?大家讨论哪些人群可以去化疗, 哪些人群需要接受化疗。在临床实践中, 我们处于患者授权的时代(We are in the time of patient empowerment), 患者在一线治疗中使用哪种方案发挥着重要作用。
关于驱动基因阴性的晚期NSCLC患者的一线治疗是否去化疗, 建议考虑如下因素并给予相应处理顺序。
首先, 考虑患者意愿。如果患者拒绝接受化疗或者不能接受化疗(骨髓增生不良, 合并再生障碍性贫血, 白细胞低, 肾功能不全, 每周需要透析3次的患者)可首选去化疗治疗的方案。
其次, 考虑PD-L1分层。对于PD-L1≥50%的人群, ICIs单药是优选, 双免疫治疗是次选。对于PD-L1阴性的人群建议双免疫优选, 结合CheckMate227数据, 同时考虑TMB High, 虽然OS没有分层数据, 但PFS有获益。PD-L1阴性且TMB Low的人群首选化疗, 但对于拒绝化疗的患者, 也可以考虑免疫联合其他非化疗的方式, 不过这些研究的证据级别较低(2A、2B)。PD-L1表达在1%~49%的人群接受ICIs单药和双免疫治疗效果有限, 以ICIs联合化疗为主。
其三, 考虑去化疗的全程管理。可以结合上一期PD-L1高表达人群的学术沙龙意见[4]进行整合, 获得完整的去化疗适宜人群以及全疗程管理的流程图(图 1)。
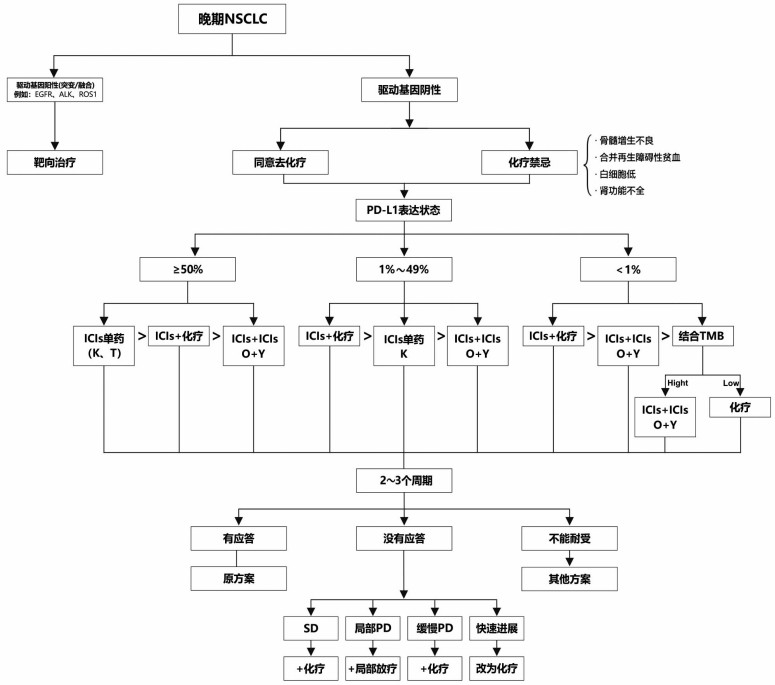
|
| 图 1 晚期一线NSCLC的去化疗适宜人群以及全疗程管理的流程图 |
3 结语
关于单纯免疫治疗的策略, KEYNOTE-024和KEYNOTE-042的帕博利珠单抗单药已获得NCCN和CSCO指南推荐, CheckMate 227研究中, 纳武利尤单抗和伊匹木单抗(Ipilimumab)联合的双免疫疗法, 也纳入NCCN指南推荐, 而免疫联合化疗的策略, KEYNOTE-189(帕博利珠单抗)和IMpower150(阿替利珠单抗)获得NCCN和CSCO指南推荐, 但仅有帕博利珠单抗联合化疗获得国内适应证。
关于初治的晚期NSCLC的患者去化疗的讨论, 集中反映了重庆地区肺癌诊治专家对研究文献的剖析和凝练, 结合自身经验、体会进行个体化分析, 对于临床实践具有重要的指导意义。本建议仍有尚未解决的问题。此外, 本建议所列举的循证医学证据, 均来自分层分析或回顾性研究, 需要大规模前瞻性研究来证实。
重庆肺癌精准治疗协作组成员(按姓氏汉语拼音排序):宫亮, 李力, 李梦侠, 罗虎, 辇伟奇, 阮志华, 孙建国, 谢启超, 杨志祥, 杨镇洲, 朱宇熹
执笔:宫亮(陆军军医大学第一附属医院呼吸内科), 李力(陆军军医大学大坪医院呼吸内科), 阮志华(陆军军医大学第一附属医院肿瘤科)
| [1] |
美国国家综合癌症网络. NCCN临床实践指南: 非小细胞肺癌(2020.V3)[EB/OL].[2020-02-11]. |
| [2] |
GARON E B, HELLMANN M D, RIZVI N A, et al. Five-year overall survival for patients with advanced non-small-cell lung cancer treated with pembrolizumab: results from the phase I KEYNOTE-001 study[J]. J Clin Oncol, 2019, 37(28): 2518-2527. DOI:10.1200/JCO.19.00934 |
| [3] |
SURESH S R. Nivolumab+ipilimumab versus platinum-doublet chemotherapy as first-line treatment for advanced non-small cell lung cancer: Three-year update from CheckMate 227 Part 1[C]. 2020 American Association of Cancer Research, Abstract #9500.[2020-05-14]. |
| [4] |
孙建国, 李梦侠, 杨镇洲. PD-L1高表达晚期非小细胞肺癌一线免疫治疗策略的探讨[J]. 第三军医大学学报, 2020, 42(3): 314-318. SUN J G, LI M X, YANG Z Z. First line immunotherapy for advanced non-small cell lung cancer with high expression of PD-L1[J]. J Third Mil Med Univ, 2020, 42(3): 314-318. DOI:10.16016/j.1000-5404.201909228 |
| [5] |
RECK M, SCHENKER M, LEE K H, et al. Nivolumab + low-dose ipilimumab versus platinum-doublet chemotherapy as first-line treatment for advanced non-small cell lung cancer: CheckMate 227 Part 1 final analysis[C]. 2019 European Society for Medical Oncology.[2019-09-28]. |
| [6] |
BORGHAEI H, LANGER C, PAZ-ARES L, et al. Pembrolizumab plus chemotherapy for advanced NSCLC without tumor PD-L1 expression: pooled analysis of KN021G, KN189 and KN407[C]. 2019 World Conference on Lung Cancer.[2019-9-10]. |
| [7] |
GANDHI L, RODRÍGUEZ-ABREU D, GADGEEL S, et al. Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer[J]. N Engl J Med, 2018, 378(22): 2078-2092. DOI:10.1056/NEJMoa1801005 |
| [8] |
PAZ-ARES L, LUFT A, VICENTE D, et al. Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer[J]. N Engl J Med, 2018, 379(21): 2040-2051. DOI:10.1056/NEJMoa1810865 |
| [9] |
SOCINSKI M A, JOTTE R M, CAPPUZZO F, et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC[J]. N Engl J Med, 2018, 378(24): 2288-2301. DOI:10.1056/NEJMoa1716948 |
| [10] |
WEST H, MCCLEOD M, HUSSEIN M, et al. Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2019, 20(7): 924-937. DOI:10.1016/S1470-2045(19)30167-6 |
| [11] |
JOTTE R, CAPPUZZO F, VYNNYCHENKO I, et al. IMpower131: final OS results of carboplatin + nab-paclitaxel ±atezolizumab in advanced squamous NSCLC[C]. 2019 World Conference on Lung Cancer.[2019-09-10]. |
| [12] |
BARLESI F, NISHIO M, COBO M, et al. LBA54 IMpower132: Efficacy of atezolizumab (atezo) + carboplatin (carbo)/cisplatin (Cis) + pemetrexed (pem) as 1L treatment in key subgroups with stage Ⅳ non-squamous non-small cell lung cancer (NSCLC)[J]. Ann Oncol, 2018, 29: viii743-viii744. DOI:10.1093/annonc/mdy424.066 |
| [13] |
MOK T S K, WU Y L, KUDABA I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial[J]. Lancet, 2019, 393(10183): 1819-1830. DOI:10.1016/S0140-6736(18)32409-7 |
| [14] |
WU Y, ZHANG L, FAN Y, et al. MA11.02 KEYNOTE-042 China study: first-line pembrolizumab vs chemotherapy in Chinese patients with advanced NSCLC with PD-L1 TPS ≥1%[J]. J Thorac Oncol, 2019, 14(10): S290-S291. DOI:10.1016/j.jtho.2019.08.584 |
| [15] |
LONG G V, ATKINSON V, CEBON J S, et al. Standard-dose pembrolizumab in combination with reduced-dose ipilimumab for patients with advanced melanoma (KEYNOTE-029): an open-label, phase 1b trial[J]. Lancet Oncol, 2017, 18(9): 1202-1210. DOI:10.1016/S1470-2045(17)30428-X |
| [16] |
LONG G V, WEBER J S, LARKIN J, et al. Nivolumab for patients with advanced melanoma treated beyond progression: analysis of 2 phase 3 clinical trials[J]. JAMA Oncol, 2017, 3(11): 1511-1519. DOI:10.1001/jamaoncol.2017.1588 |
| [17] |
PILOTTO S, CARBOGNIN L, ROSSI A, et al. Avoiding chemotherapy for advanced nononcogene addicted NSCLC overexpressing PD-L1: Rule or option?[J]. Semin Oncol, 2018, 45(3): 176-180. DOI:10.1053/j.seminoncol.2018.08.002 |
| [18] |
CARBONE D P, RECK M, PAZ-ARES L, et al. First-line nivolumab in stage Ⅳ or recurrent non-small-cell lung cancer[J]. N Engl J Med, 2017, 376(25): 2415-2426. DOI:10.1056/nejmoa1613493 |
| [19] |
HAN B H, CHU T Q, ZHONG RB, et al. Efficacy and safety of sintilimab with anlotinib as first-line therapy for advanced non-small cell lung cancer (NSCLC)[C]. 2019 World Conference on Lung Cancer.[2019-09-10]. |
| [20] |
HUI R N, NISHIO M, RECK M, et al. Randomized, double-blind, phase 3 trial of first-line pembrolizumab + platinum doublet chemotherapy (chemo) ±lenvatinib in patients (pts) with metastatic nonsquamous non-small-cell lung cancer (NSCLC): LEAP-006[J]. J Clin Oncol, 2019, 37(15_suppl): TPS9118. DOI:10.1200/jco.2019.37.15_suppl.tps9118 |
| [21] |
ZHOU C C. Efficacy of PD-1 monoclonal antibody SHR-1210 plus apatinib in patients with advanced nonsquamous NSCLC with wild-type EGFR and ALK[C]. 2019 American Society of Clinical Oncology.[2019-06-04]. |
| [22] |
GOH J, GAO B, MARKMAM B, et al. A phase 1B study to assess safety, tolerability, pahmacokientics, and preliminary antitumor activity of sitravatinib in combination with tislelizumab in patients with advanced solid tumor[C]. 2019 American Association of Cancer Research.[2019-04-02]. |
| [23] |
O'DONNELL J S, TENG M W L, SMYTH M J. Cancer immunoediting and resistance to T cell-based immunotherapy[J]. Nat Rev Clin Oncol, 2019, 16(3): 151-167. DOI:10.1038/s41571-018-0142-8 |
| [24] |
BO C, WU Q, ZHAO H, et al. Thymosin α1 suppresses migration and invasion of PD-L1 high-expressing non-small-cell lung cancer cells via inhibition of STAT3-MMP2 signaling[J]. Oncol Targets Ther, 2018, 11: 7255-7270. DOI:10.2147/OTT.S177943 |
| [25] |
GETTINGER S, BORGHAEI H, BRAHMER J, et al. Five-Year Outcomes From the Randomized, Phase 3 Trials CheckMate 017/057: Nivolumab vs Docetaxel in Previously Treated NSCLC[C]. 2019 World Conference on Lung Cancer.[2019-09-10]. |
| [26] |
RECK M, RODRIGUEZ-ABREU D, ROBINSON A G. KEYNOTE-024 3-year survival update: pembrolizumab versus platinum-based chemotherapy for advanced NSCLC[C]. 2019 World Conference on Lung Cancer.[2019-09-10]. |
| [27] |
FELIP E, ROSELL R, MAESTRE J A, et al. Preoperative chemotherapy plus surgery versus surgery plus adjuvant chemotherapy versus surgery alone in early-stage non-small-cell lung cancer[J]. J Clin Oncol, 2010, 28(19): 3138-3145. DOI:10.1200/JCO.2009.27.6204 |
| [28] |
SPIGEL D R, DE MARINIS F, GIACCONE G, et al. IMpower110: Interim OS analysis of a phase iii study of atezolizumab (atezo) vs platinum-based chemotherapy (chemo) as 1L treatment (tx) in PD-L1-selected NSCLC[C]. 2019 European Society for Medical Oncology.[2019-09-27]. |
| [29] |
PETERS S, CHO C B, REINMUTH N, et al. Tumor mutation burden(TMB) as a biomarker of survival in metastatic non-small cell lung cancer(mNSCLC): blood and tissue TMB analysis from MYSTIC[C]. 2019 American Society of Clinical Oncology.[2019-06-04]. |
| [30] |
PAZ-ARES L, LANGER C J, NOVELLO S, et al. Pembrolizumab plus platinum-based chemotherapy for metastatic NSCLC: Tissue TMB(tTMB) and outcome in KEYNOTE-021, 189, 407[C]. 2019 World Conference on Lung Cancer.[2019-09-10]. |
| [31] |
RIZZO M, ABATE N, CHANDALIA M, et al. Liraglutide reduces oxidative stress and restores heme oxygenase-1 and ghrelin levels in patients with type 2 diabetes: a prospective pilot study[J]. J Clin Endocrinol Metab, 2015, 100(2): 603-606. DOI:10.1210/jc.2014-2291 |

