2. 030001 太原,山西医科大学基础医学院病理学与病理生理学教研室
2. Department of Pathology and Pathophysiology, College of Basic Medical Sciences, Shanxi Medical University, Taiyuan, Shanxi Province, 030001, China
脓毒血症时,内毒素(lipopolysaccharide,LPS)进入体内导致全身炎症反应综合症,进一步造成重要脏器功能障碍。内毒素导致的心脏功能障碍表现为心脏收缩功能障碍和心肌顺应性降低。内毒素导致的心肌损伤由多种相互影响的因素导致,包括炎性损伤,氧自由基损伤,能量代谢障碍和心肌细胞凋亡或者坏死[1]。能量代谢障碍是内毒素导致心肌受损的重要机制。
琥珀酸是三羧酸循环中关键的中间产物。生理条件下,线粒体内琥珀酸脱氢酶(succinate dehydrogenase, SDH)将琥珀酸氧化为延胡索酸,同时释放电子参与氧化磷酸化[2]。研究指出,内毒素可使巨噬细胞内琥珀酸含量增加。堆积的琥珀酸可作为信号传导因子促进巨噬细胞炎性因子释放并且抑制抗炎细胞因子的合成[3]。另外,缺血心肌细胞内也存在琥珀酸大量堆积,是心肌缺血再灌注损伤的重要机制[2, 4, 5]。由于琥珀酸的堆积与SDH活性的改变密切相关,本研究采用LPS处理大鼠建立脓毒血症心肌损伤模型,探讨琥珀酸和SDH在心肌组织中的变化和对心肌炎性损伤的影响。
1 材料与方法 1.1 动物选择和试剂SPF级健康雄性SD大鼠40只,2~3月龄,体重200~220 g,由重庆医科大学实验动物中心提供。脂多糖(055:B5)、SDH抑制剂丙二酸二甲酯(Dimethyl malonate,DMM)和琥珀酸检测试剂盒购自美国Sigma-Aldrich公司。SDH抗体(SDH-a抗体)购于美国Abcam公司。核因子κB抑制蛋白-α(inhibitor of NF-κB,IκB-α)抗体和磷酸化IkB-α抗体购自美国CST公司。缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)抗体、辣根过氧化物酶标记的山羊抗兔I g G二抗、FITC标记荧光二抗和2, 6-二异丙基苯胺(2, 6-diisopropylaniline,DAPI)购自武汉博士德生物工程有限公司。大鼠肌钙蛋白I(cTnI)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白介素-1β(interleukin-1β,IL-1β)酶联免疫(ELISA)检测试剂盒购自美国R & D公司。
1.2 分组和药物处理采用随机数字表法,将大鼠随机分为40组(n=8):生理盐水处理组(C组)、琥珀酸脱氢酶抑制剂DMM+生理盐水处理组(DC组)、LPS处理组(E组)和DMM+LPS处理组(DE组)。E组和DE组腹腔注射LPS 20 mg/kg,建立大鼠内毒素血症模型,C组和DC组给予等容量生理盐水。在LPS给予大鼠4 h后,DC组和DE组给予腹腔注射DMM 160 mg/kg,C组和E组给予等量生理盐水。DMM处理4 h后(即LPS处理8 h后)收集标本做进一步检测。
1.3 检测指标及方法 1.3.1 标本的采集及制备LPS处理大鼠8h后,腹腔注射戊巴比妥钠(45 mg/kg)麻醉起效后,剪开大鼠腹部,采集腹主动脉血样2 ml, 低温离心10 min(3500×g,4℃,离心半径12 cm),取上清液,-70℃保存,用于测定血清cTnI含量。剖开胸腔,迅速摘取心脏,置于PBS液中清洗3次。冰浴下剪碎心脏,RIPA裂解液裂解,研磨匀浆,低温离心10 min(12000×g,4℃,离心半径10 cm)。提取上清液,用于Western Blot法检测心肌组织内相关蛋白表达和ELISA法检测心肌组织内TNF-α和IL-1β含量。
1.3.2 心肌组织内琥珀酸含量的检测在实验结束后,麻醉大鼠后立即打开胸腔,取出心脏并于PBS液中清洗3次后,将心脏放入液氮速冻(2 min左右完成)。液氮条件下将心肌组织研磨成粉,取10 mg组织粉末加入100微升琥珀酸检测缓冲液在4℃条件下迅速匀浆,低温离心5 min(10000×g,4℃,离心半径10 cm)后取上清液待测。采用琥珀酸检测试剂盒并按照说明书操作流程检测心肌组织内琥珀酸含量。
1.3.3 免疫荧光法检测心肌组织内SDH的表达实验完成后,腹腔注射戊巴比妥钠(45 mg/kg)麻醉大鼠,摘取心脏,取心室肌组织部分PBS清洗,4%多聚甲醛固定,脱水,石蜡包埋,切片,烤片。此后二甲苯脱蜡,不同梯度乙醇浸泡复水,双蒸水清洗3次,每次2 min。将切片放于盛有枸橼酸盐缓冲液的溶液中,置于微波炉内加热(95℃)10 min。室温冷却15 min,PBS清洗。蒸馏水清洗,PBS浸泡5 min。在切片组织上滴加正常山羊血清,室温封闭60 min。吸水纸吸掉封闭液,再在每张切片组织上滴加足够量的兔抗大鼠SDH-a抗体(比例为1:200)并放入湿盒,4℃孵育过夜。阴性对照用PBS液代替一抗。取出湿盒,室温复温30 min,PBS浸洗切片3次,每次3 min。吸水纸吸干切片组织上多余液体后滴加稀释好的FITC荧光二抗(比例为1:800),湿盒中37℃孵育60 min。PBS清洗3次,每次3 min。滴加DAPI避光孵育15 min。PBS清洗4次,每次5 min。用含有抗荧光淬灭剂的封片液封片,然后在激光扫描共聚焦显微镜下观察采集图像。
1.3.4 Western blot法检测心肌组织内SDH、HIF-1α、IκB-α和磷酸化IκB-α的表达量心肌组织检测标本制备同前。蛋白浓度采用BCA蛋白浓度检测试剂盒测定。取蛋白样本50μg,上样于SDS-PAGE电泳凝胶,并在80 V下电泳。将凝胶中的目标蛋白电转于PVDF膜上。在含5%脱脂奶粉的TBST液中封闭2 h后,将兔抗大鼠抗SDH-a、HIF-1α、IκB-α和磷酸化IκB-α抗体(稀释度均为1:1 000)孵于膜上,4℃过夜。PBS洗涤3次,将辣根过氧化物酶标记的山羊抗兔IgG孵于膜上,并在37℃环境中孵育2 h。PBS洗涤3次,使用ECL-plus显色剂在Bio-Rad显色仪中显色。采用Quentity One软件测定条带灰度值,以目的蛋白条带灰度值与内参β-actin灰度值的比值反映目的蛋白表达水平。
1.3.5 血清cTnI及心肌组织TNF-α和IL-1β含量的检测采用大鼠cTnI、TNF-α和IL-1β酶联免疫(ELISA)检测试剂盒检测血清cTnI浓度及心肌组织TNF-α和IL-1β的含量。按照ELISA试剂盒说明书进行操作。
1.4 统计学处理采用SPSS 17.0统计学软件进行分析,计量资料以x±s表示,组间比较采用单因素方差分析,采用Tukey test进行进一步比较。P < 0.05为差异有统计学意义。
2 结果 2.1 SDH抑制剂DMM对内毒素血症大鼠血清cTnI浓度的影响C组和DC组大鼠血清cTnI浓度无明显差异(P > 0.05)。与对照组(C组)比较,LPS处理大鼠8 h后,E组和DE组血清cTnI浓度显著升高(C组与E组、DE组比较,P < 0.05)。DMM处理内毒素血症大鼠4 h后,血清cTnI浓度显著降低(DE组与E组比较,P < 0.05)。如图 1。
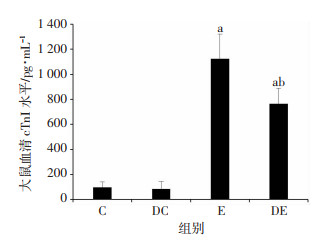
|
| C组:生理盐水处理组;DC组:SDH抑制剂DMM+生理盐水处理组;E组:LPS处理组;DE组:SDH抑制剂DMM+LPS处理组。a:P < 0.05,与C组比较;b:P < 0.05,与E组比较 图 1 SDH抑制剂DMM对内毒素血症大鼠血清cTnI含量的影响 |
2.2 DMM对内毒素血症大鼠心肌组织内琥珀酸含量的影响
C组和DC组大鼠心肌组织内琥珀酸含量无明显差异(P > 0.05)。与C组比较,E组和DE组心肌组织内琥珀酸含量显著升高,差异有统计学意义(P < 0.05)。与E组比较,DE组心肌组织内琥珀酸含量显著降低(P < 0.05),说明SDH抑制剂DMM能有效抑制内毒素血症大鼠心肌组织内的琥珀酸含量增加。如图 2。
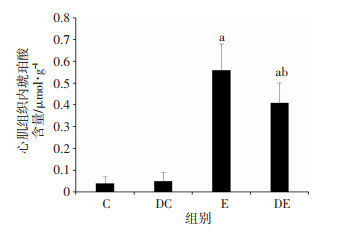
|
| C组:生理盐水处理组;DC组:SDH抑制剂DMM+生理盐水处理组;E组:LPS处理组;DE组:SDH抑制剂DMM+LPS处理组。a:P < 0.05,与C组比较;b:P < 0.05,与E组比较 图 2 DMM对内毒素血症大鼠心肌组织内琥珀酸含量的影响 |
2.3 各组心肌组织大鼠SDH表达量的比较
C组和DC组大鼠心肌组织内SDH表达量无明显差异。与C组比较,E组和DE组心肌组织内SDH表达水平显著升高(P < 0.05)。E组和DE组大鼠心肌组织内SDH表达量无明显差异(P > 0.05)。该结果说明LPS处理可显著提高大鼠心肌组织内SDH表达量,而DMM对大鼠体内琥珀酸脱氢酶表达量无明显影响。如图 3。
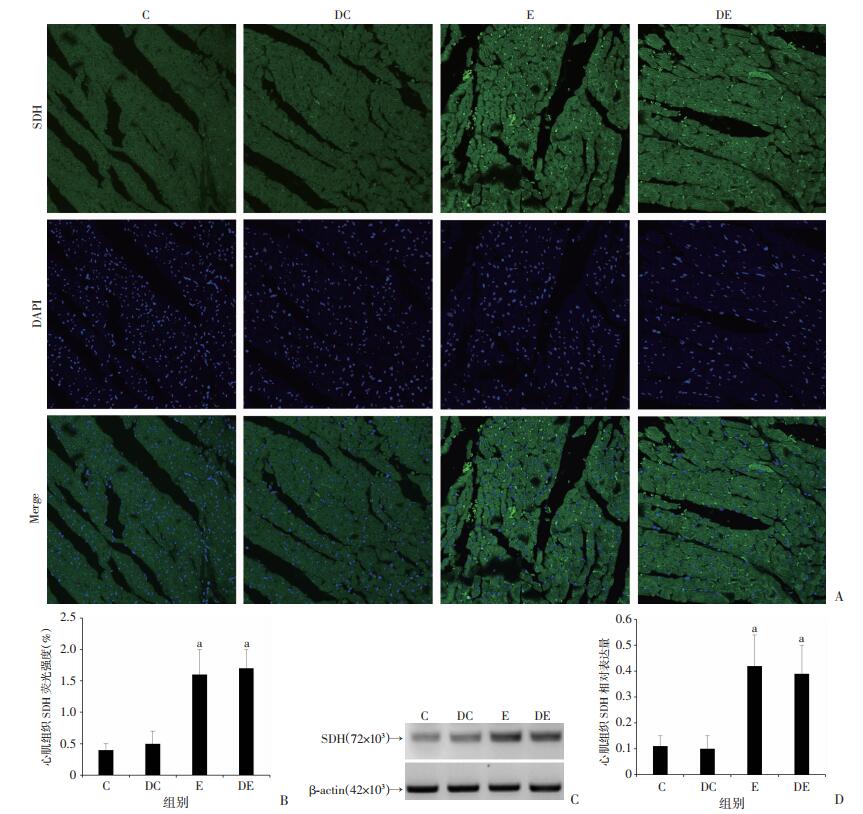
|
|
C组:生理盐水处理组;DC组:SDH抑制剂DMM+生理盐水处理组;E组:LPS处理组;DE组:SDH抑制剂DMM+LPS处理组。a:P < 0.05,与C组比较 A:免疫荧光检测心肌组织内SDH的表达(×400倍);B:采用imageJ软件分析各组心肌组织SDH荧光强度并比较;C:Western Blot法检测各组心肌组织内SDH表达所获得的免疫条带;D:各组心肌组织内SDH的相对表达量(即SDH免疫条带与β-actin免疫条带的灰度值之比)。 图 3 各组心肌组织大鼠琥珀酸脱氢酶表达量的比较 |
2.4 DMM对内毒素血症大鼠心肌组织内IκB-α磷酸化程度和HIF-1α表达量的影响
C组和DC组大鼠心肌组织内IκB-α磷酸化程度和HIF-1α表达量无明显差异(P > 0.05)。与C组比较,E组和DE组心肌组织内IκB-α磷酸化程度和HIF-1α表达量显著升高(P < 0.05),提示LPS处理明显激活大鼠心肌组织的炎性反应。与E组比较,DE组心肌组织内p-IκB-α和HIF-1α的表达量显著降低(P < 0.05),提示DMM有效抑制内毒素血症大鼠心肌组织炎性反应通路。如图 4。
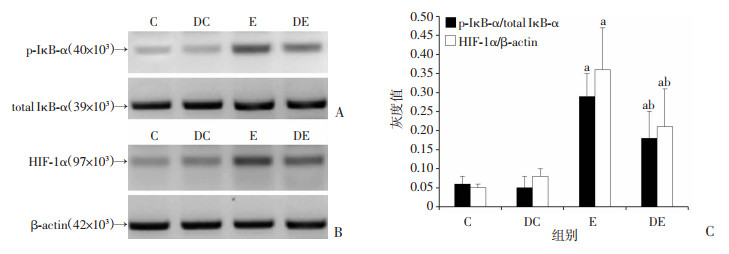
|
|
C组:生理盐水处理组;DC组:SDH抑制剂DMM+生理盐水处理组;E组:LPS处理组;DE组:SDH抑制剂DMM+LPS处理组。a:P < 0.05,与C组比较;b:P < 0.05,与E组比较。 A:Western Blot法检测各组心肌组织p-IκB-α和总IκB-α表达所获得的免疫条带;B:Western Blot法检测各组心肌组织内HIF-1α表达所获得的免疫条带;C:各组心肌组织IκB-α磷酸化相对表达量。 图 4 DMM对内毒素血症大鼠心肌组织内IκB-α磷酸化程度和HIF-1α表达量的影响 |
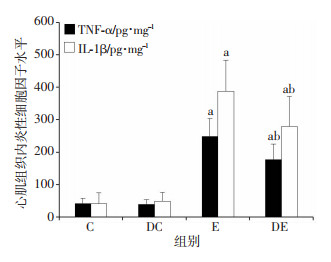
2.5 DMM对内毒素血症大鼠心肌组织内TNF-α和IL-1β含量的影响
C组和DC组大鼠心肌组织内TNF-α和IL-1β水平无明显差异(P > 0.05)。与C组比较,E组和DE组心肌组织内TNF-α和IL-1β水平显著升高(P < 0.05)。与E组比较,DE组心肌组织内TNF-α和IL-1β水平显著降低(P < 0.05)。该结果说明DMM有效抑制内毒素血症大鼠心肌组织内炎性因子的产生。如图 5。
|
| C组:生理盐水处理组;DC组:SDH抑制剂DMM+生理盐水处理组;E组:LPS处理组;DE组:SDH抑制剂DMM+LPS处理组。a:P < 0.05,与C组比较;b:P < 0.05,与E组比较。 图 5 DMM对内毒素血症大鼠心肌组织内TNF-α和IL-1β含量的影响 |
3 讨论
本研究大鼠内毒素血症模型参照文献Brent[6]和Liu[7]等介绍的方法。DMM的给予剂量参考Evanna等的研究[3]。本研究发现:首先,内毒素血症大鼠心肌组织内琥珀酸和SDH含量均升高;其次,SDH抑制剂能显著抑制内毒素血症大鼠心肌组织内的琥珀酸含量升高;最后,SDH抑制剂可能通过调节NF-κB和HIF-1α通路而降低内毒素血症大鼠心肌组织内的炎性反应。
脓毒血症期间,血管功能异常和免疫细胞有氧代谢显著升高导致其余器官组织氧供明显降低,能量获取方式从氧化磷酸化转变为糖酵解(Warburg effect)[8],同时伴有明显的线粒体功能障碍和代谢中间产物的堆积[9]。研究指出,在缺血心肌组织中,SDH被反向激活和酮戊二酸脱氢酶催化导致缺血心肌中琥珀酸堆积[2, 4, 10]。由于琥珀酸有促进炎性反应的作用,本研究检测了内毒素血症大鼠心肌组织内琥珀酸含量和其关键调节酶SDH的表达变化和其关系。结果发现,内毒素血症大鼠心肌组织内琥珀酸含量和SDH的表达均明显升高,而SDH的抑制剂DMM能有效减少内毒素血症大鼠心肌组织内的琥珀酸含量,提示该模型下SDH也被反向激活进而促进琥珀酸的堆积。SDH的反向激活与Edward等的研究结果相似, 而与Evanna等的结果相反,其可能原因在于本研究涉及的细胞与前者一致,而与后者不同[2, 3]。
已有多个研究证实,琥珀酸作为信号传递因子通过促进HIF-1α的表达而导致细胞内炎性细胞因子IL-1β的产生,其可能机制包括抑制脯氨酰羟化酶活性和诱导活性氧的产生等[3, 5, 10, 11]。本研究中,DMM可抑制琥珀酸堆积而降低HIF-1α的表达和IL-1β的合成,从反面提示该模型中琥珀酸参与HIF-1α介导的炎性通路,其机制可能和以上研究阐述的机制相关。本研究还发现,DMM可抑制琥珀酸堆积而降低IκB-α的磷酸化水平。IκB-α是转录因子NF-κB的抑制性结合蛋白IκB的一个亚型,IκB-α磷酸化后被水解性降解,使NF-κB游离并转位至细胞核中而激活TNF-α等基因的转录[12]。因此,本研究提示琥珀酸堆积促进IκB-α磷酸化进而通过NF-κB介导TNF-α的合成,其具体机制可能是琥珀酸通过产生活性氧和炎性细胞因子而间接促进IκB-α磷酸化和激活NF-κB炎症通路[13]。
缺血心肌细胞中,大量堆积的琥珀酸可通过自分泌的方式,分泌至心肌细胞外并激活心肌细胞膜上的琥珀酸受体1(succinate receptor 1, SUCNR1),使后者活化而加重心肌损伤[5]。由于琥珀酸-SUCNR1通路与炎性反应密切相关,该模型中琥珀酸是否可通过激活SUCNR1而调节HIF-1α和IκB-α有待进一步研究[14]。
总之,本研究发现琥珀酸在内毒素血症大鼠心肌组织中的含量变化和炎性损伤的关系,以及SDH活性抑制剂在其中的保护作用,为研究和治疗脓毒血症心肌损伤提供新的靶点。
| [1] |
FLYNN A, MANI B C, MATHER P J. Sepsis-induced cardiomyopathy: a review of pathophysiologic mechanisms[J]. Heart Fail Rev, 2010, 15(6): 605-11. DOI:10.1007/s10741-010-9176-4 |
| [2] |
CHOUCHANI E T, PELL V R, GAUDE E, et al. Ischaemic accumulation of succinate controls reperfusion injury through mitochondrial ROS[J]. Nature, 2014, 515(7527): 431-435. DOI:10.1038/nature13909 |
| [3] |
MILLS E L, KELLY B, LOGAN A, et al. Succinate dehydrogenase supports metabolic repurposing of mitochondria to drive inflammatory macrophages[J]. Cell, 2016, 167(2): 457-470. DOI:10.1016/j.cell.2016.08.064 |
| [4] |
CHOUCHANI E T, PELL V R, JAMES A M, et al. A unifying mechanism for mitochondrial superoxide production during ischemia-reperfusion injury[J]. Cell Metab, 2016, 23(2): 254-63. DOI:10.1016/j.cmet.2015.12.009 |
| [5] |
LI J, YANG Y L, LI L Z, et al. Succinate accumulation impairs cardiac pyruvate dehydrogenase activity through GRP91-dependent and independent signaling pathways: therapeutic effects of ginsenoside Rb1[J]. Biochim Biophys Acta Mol Basis Dis, 2017, 1863(11): 2835-2847. DOI:10.1016/j.bbadis.2017.07.017 |
| [6] |
BRENT R, MARIUXI C, JEREMY L, et al. Mesenchymal stem cells attenuate myocardial functional depression and reduce systemic and myocardial inflammation during endotoxemia[J]. Surgery, 2010, 148(2): 444-452. DOI:10.1016/j.surg.2010.03.010 |
| [7] |
LIU Ling, WANG P, LIANG C, et al. Distinct effects of nampt inhibition on mild and severe models of lipopolysaccharide-induced myocardial impairment[J]. Int Immunopharmacol, 2013, 17(2): 342-349. DOI:10.1016/j.intimp.2013.06.017 |
| [8] |
VANDERHAEGHEN T, VANDEWALLE J, LIBERT C, et al. Hypoxia-inducible factors in metabolic reprogramming during sepsis[J]. FEBS J, 2020. DOI:10.1111/febs.15222 |
| [9] |
JOSEPH L C, REYES M V, LAKKADI K R, et al. PKCdelta causes sepsis-induced cardiomyopathy by inducing mitochondrial dysfunction[J]. Am J Physiol Heart Circ Physiol, 2020. DOI:10.1152/ajpheart.00749.2019 |
| [10] |
MURPHY M P, O'NEILL L A J. Krebs cycle reimagined: the emerging roles of succinate and itaconate as signal transducers[J]. Cell, 2018, 174(4): 780-784. DOI:10.1016/j.cell.2018.07.030 |
| [11] |
TANNAHILL G M, CURTIS A M, ADAMIK J, et al. Succinate is an inflammatory signal that induces IL-1β through HIF-1α[J]. Nature, 2013, 496(7444): 238-242. DOI:10.1038/nature11986 |
| [12] |
LEE T H, JUNG M, BANG M, et al. Inhibitory effects of a spinasterol glycoside on lipopolysaccharide-induced production of nitric oxide and proinflammatory cytokines via down-regulating MAP kinase pathways and NF-κB activation in RAW264.7 macrophage cells[J]. Int Immunopharmaco, 2012, 13(3): 264-70. DOI:10.1016/j.intimp.2012.05.005 |
| [13] |
LEPETSOS P, PAPAVASSILIOU K A, PAPAVASSILIOU A G, et al. Redox and NF-κB signaling in osteoarthritis[J]. Free Radic Biol Med, 2019, 132: 90-100. DOI:10.1016/j.freeradbiomed.2018.09.025 |
| [14] |
LITTLEWOOD-EVANS A, APFEL V, et al. GPR91 senses extracellular succinate released from inflammatory macrophages and exacerbates rheumatoid arthritis[J]. J Exp Med, 2016, 213(9): 1655-1662. DOI:10.1084/jem.20160061 |



