年龄相关性黄斑变性(age-related macular degeneration,AMD)是导致西方国家中老年人视力丧失的主要原因,其发病率随着社会人口老龄化而增加[1]。早期AMD的主要表现为视网膜玻璃膜疣的形成和视网膜色素沉着[2],其中玻璃疣的主要成分为淀粉样蛋白β(amyloid β,Aβ)[3]。研究表明Aβ可诱导视网膜上皮(retinal pigment epithelial, RPE)细胞炎症和凋亡反应,并参与AMD的发生和发展[4]。肝X受体(liver X receptor,LXR)属于核受体超家族,其成员包括LXRα和LXRβ,不仅在胆固醇和脂质代谢中起重要作用[5],还参与炎症[6]和免疫[7]的调节。LXRβ在视网膜中普遍表达,相反LXRα的表达却很少[8]。研究表明:在不同的病理条件下,LXR激动剂激活不同的LXR亚型来发挥作用,比如在实验性自身免疫性葡萄膜炎(experimental autoimmune uveitis, EAU)小鼠模型中[9],LXR激动剂主要通过激活LXRα来抑制眼内炎症,提示LXRα可能在抗炎中起主要作用;而在N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)诱导的视网膜变性小鼠中[10],LXR激动剂则主要通过激活LXRβ来保护视网膜神经元免受损伤,提示LXRβ似乎在神经保护中占主导地位。与之类似,课题组前期研究表明[11]:LXR激动剂TO90(一种人工合成的针对LXRα和LXRβ的选择性激动剂)可通过激活LXRα缓解Aβ诱导的RPE细胞炎症反应,但其具体作用机制尚不清楚。沉默信息调节因子1 (silencing information regulator 1, SIRT1)是一种烟酰胺腺嘌呤二核苷酸依赖性(nicotinamide adenine dinucleotide-dependent, NADP)脱乙酰化酶,可通过与炎症相关因子NF-κB和凋亡相关因子p53结合并使其脱乙酰化,减少乙酰化-NF-κB(acetylated NF-κB, ace-NF-κB)和乙酰化-p53(acetylated p53, ace-p53)的表达,从而抑制这两条通路的活性,导致终末炎症因子及p53下游因子p21的表达下降,发挥抗炎和抗凋亡反应的作用[12]。有研究表明LXR激动剂可通过增加SIRT1信号传导来调节脂质代谢[13]。另外,LXR和SIRT1作为共同体在糖尿病性视网膜病变中参与脂质调节[14]。但LXR是否可通过调节SIRT1参与AMD的病理生理过程,尚不清楚。本研究检测湿性AMD患者外周血单核细胞(human peripheral blood mononuclear cell, PBMC)中SIRT1的mRNA表达,采用Aβ刺激ARPE-19细胞系来模拟早期AMD体外微环境,评估LXR-SIRT1轴在Aβ诱导的RPE炎症和凋亡反应中的作用。
1 材料与方法 1.1 实验材料 1.1.1 实验细胞从14例未接受抗VEGF治疗的湿性AMD患者和14例同年龄段健康受试者的静脉中抽取10 mL外周血用以提取PBMC。参与者的基本信息见表 1。RPE细胞系ARPE-19来自美国典型培养物保藏中心(ATCC)。本研究取得患者知情同意,并获得重庆医科大学附属第一医院伦理委员会审批[2019年科研伦理(2019-130)号]。
| 参与者 | n | 年龄/岁[中位数(范围)] | 女性[例(%)] | 男性[例(%)] |
| 正常受试者 | 14 | 69.5(62~78) | 7(50.0) | 7(50.0) |
| 湿性AMD患者 | 14 | 66.5(63~78) | 6(42.9) | 8(57.1) |
1.1.2 主要试剂与仪器
Aβ1-40和Aβ40-1购自美国Sigma公司;TO901317(TO90)购自美国Cayman公司;DMEM/F12培养基购自美国Gibco公司;细胞计数试剂盒8(CCK-8)购自美国Bryotime;TRIzol、PrimeScriptⒸ RT、Green PCR Kit试剂盒购自TaKaRa公司;特异性抗SIRT1、LXRα、NF-κB、ace-NF-κB、p53、ace-p53、p21、RPE65、ZO-1单克隆抗体购自美国Abcam公司;GAPDH特异性抗体购自中国杭州贤至公司;特异性二抗购自美国Proteintech公司;包含有SIRT1-shRNA和乱序shRNA的慢病毒购自上海吉凯公司。多功能酶标仪(Thermo Fisher Scientific,美国);ABI 7500 Real-time PCR仪(Applied Biosystems,美国)。
1.2 方法 1.2.1 寡聚Aβ1-40的制备寡聚Aβ的制备方法见文献[15],1 mg Aβ1-40或Aβ40-1冻干粉溶解在400 μL六氟异丙醇中,将所得溶液在室温下孵育60 min,随后在冰上静置10 min,以100 μL/管分装至4个离心管中,每管加入200 μL双蒸水,室温下孵育20 min后,用氮气流轻吹15 min以蒸发溶液中的六氟异丙醇,最后在37 ℃下孵育4 d,于-80 ℃保存备用。
1.2.2 TO90的处理和使用5 μmol/L浓度的TO90可在避免细胞毒性的前提下激活RPE细胞中LXRα而不是LXRβ来发挥作用[16],因此在实验中使用5 μmol/L的TO90浓度。将TO90粉剂溶解在二甲基亚砜(DMSO)中至100 mg/mL浓度,-80 ℃下储存备用。Aβ处理ARPE-19细胞前6 h,预防性给予TO90或载体。TO90在使用时用DMEM/F12培养基稀释,使终浓度为5 μmol/L且DMSO含量小于2%。载体为含有2%DMSO的培养基。
1.2.3 CCK-8测定ARPE-19细胞增殖活力ARPE-19细胞(104/孔)接种在96孔培养板上,达到融合后,将其饥饿12 h。0、0.1、1.0、5.0、10.0 μmol/L浓度的寡聚Aβ1-40刺激ARPE-19细胞24、48、72 h后,更换原培养基为含有10%WST-8的DMEM/F12培养基(100 μL/孔)。随后将ARPE-19细胞在37 ℃温育2~4 h,使用多功能酶标仪在450 nm波长下读取上清液的光密度值。刺激组细胞的光密度用未刺激组细胞的光密度标准化,实验重复3~4次。另外,用同样的步骤将已转染和未转染的ARPE-19细胞接种在96孔培养板上,检测病毒转染对ARPE-19细胞增殖活力的影响。
1.2.4 Real-time PCR检测IL-1β、SIRT1和p21的表达将ARPE-19细胞分为未刺激组,1.0、5.0 μmol/L Aβ1-40组,5.0 μmol/L Aβ40-1组。用TRIzol法提取RNA,然后使用反转录试剂盒将RNA反转录为cDNA,-20 ℃保存备用。检测时,根据荧光定量试剂盒使用说明在ABI 7500上扩增cDNA并检测荧光强度。每个样品设置1个副孔,并计算两者的平均Ct值作为最终Ct值,使用内源性对照β-肌动蛋白将数据标准化。对于每个样品,通过2-ΔΔCt方法进行统计,计算SIRT1、IL-1β和p21的mRNA表达,实验重复3~5次。基因的引物序列见表 2。
| 基因名称 | 登记号 | 序列 |
| SIRT1 | NM_012238.5 | 正义链: 5′-TAGCCTTGTCAGATAAGGAAGGA-3′ |
| 反义链: 5′-TGTTCTGGGTATAGTTGCGAAGT-3′ | ||
| IL-1β | NM_000576.2 | 正义链: 5′-CTCGCCAGTGAAATGATGGCT-3′ |
| 反义链: 5′-GTCGGAGATTCGTAGCTGGAT-3′ | ||
| P21 | NM_001291549.1 | 正义链: 5′-TCCTCATCCCGTGTTCTCCT-3′ |
| 反义链: 5′-CCCTTCAAAGTGCCATCTGTT-3′ | ||
| β-actin | NM_001101.3 | 正义链: 5′-GGATGCAGAAGGAGATCACTG-3′ |
| 反义链: 5′-TGTTCTGGGTATAGTTGCGAAGT-3′ |
1.2.5 Western blot检测SIRT1、LXRα、NF-κB、ace-NF-κB、p53、ace-p53、p21和RPE65的表达
首先检测ARPE-19细胞中RPE65的蛋白表达以确定细胞来源,随后将细胞分为未刺激组、5.0 μmol/L Aβ1-40组、5.0 μmol/L Aβ1-40+5.0 μmol/L TO90组、5.0 μmol/L TO90组,检测SIRT1、LXRα、NF-κB、ace-NF-κB、p53、ace-p53和p21的蛋白表达。最后在ARPE-19细胞中敲低SIRT1, 将ARPE-19细胞分为未刺激组、5.0 μmol/L Aβ1-40组、5.0 μmol/L Aβ1-40+阴性对照(NC)组、5.0 μmol/L Aβ1-40+NC+5.0 μmol/L TO90组、5.0 μmol/L Aβ1-40+iSIRT1组、5.0 μmol/L Aβ1-40+iSIRT1+5.0 μmol/L TO90组,检测NF-κB、ace-NF-κB、p53、ace-p53和p21的蛋白表达。ARPE-19细胞总蛋白用苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)和放射免疫沉淀分析(RIPA)裂解液的混合液(PMSF :RIPA=1 :100)提取,随后向提取的蛋白质中加入上样缓冲液并于沸水中煮沸5 min使蛋白质变性,-20 ℃保存备用。电泳时,每个样品的蛋白上样量保持一致(40~60 μg),用12%SDS-PAGE凝胶分离蛋白,并电转到聚偏二氟乙烯膜上。随后将膜用5%脱脂牛奶封闭1 h,并与SIRT1(1 :1 000)、LXRα(1 :500)、NF-κB(1 :10 000)、ace-NF-κB(1 :500)、p53(1 :500)、ace-p53(1 :500)、p21(1 :1 000)、RPE65(1 :500)和GAPDH(1 :2 000)的特异性一抗在4 ℃孵育12~16 h。然后将条带洗涤3次,与相应的二抗(1 :5 000)在37 ℃孵育1 h。条带蛋白信号用ECL试剂盒检测,Image J分析蛋白条带密度。使用内源对照GAPDH将数据标准化,实验重复3~6次。
1.2.6 慢病毒转染敲低ARPE-19细胞中SIRT1的表达RPE细胞接种在6孔板或12孔板中,待达到30%~40%融合后,用含有SIRT1-shRNA和乱序-shRNA的慢病毒感染ARPE-19细胞(MOI=10)。转染12~16 h后将原培养基更换为不含病毒的培养基,培养至ARPE-19细胞融合后,在荧光显微镜下观察ARPE-19细胞荧光评估感染效率。分别使用Real-time PCR和Western blot在基因和蛋白质水平评估SIRT1的敲低效率。
1.2.7 免疫荧光检测RPE65和ZO-1的表达将ARPE-19细胞接种到细胞爬片上,当细胞达到融合时,用4%多聚甲醛固定爬片15 min。PBS洗涤爬片3次,用0.1%Triton X-100作用5 min穿透细胞膜,再次洗涤3次后,用含10%山羊血清的PBS封闭爬片1 h,随后与含RPE65(1 :100)和ZO-1(1 :100)特异性一抗的混合液在4 ℃下孵育过夜。PBS洗涤3次后,将爬片与抗鼠和抗兔荧光二抗(1 :50)的混合液在37 ℃下孵育1 h。最后洗涤爬片3次,将细胞核用DAPI染色5 min,封片液封闭爬片,在共聚焦荧光显微镜下观察所有荧光图像,照相并保存。
1.3 统计学分析所有数据用x±s描述。人PBMC中SIRT1 mRNA表达采用SPSS 20统计软件行非参数检验分析。其余结果通过GraphPad Prism 5.0行单因素方差分析。检验水准:α=0.05。
2 结果 2.1 ARPE-19细胞中RPE65和ZO-1的表达免疫荧光结果显示:ARPE-19细胞系ZO-1染色阳性(图 1A、C),表明细胞之间紧密连接的形成,细胞处于融合状态。免疫荧光及Western blot检测结果显示RPE65表达阳性(图 1B~D),证实ARPE-19是RPE来源细胞。
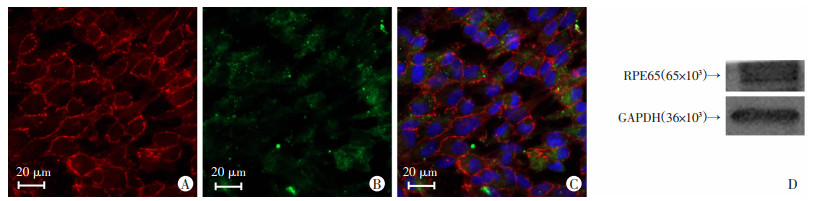
|
| A:ZO-1染色阳性;B:RPE65染色阳性;C:共同显示ZO-1、RPE65和DAPI染色;D:Western blot检测结果显示RPE65阳性表达 图 1 免疫荧光和Western blot检测ARPE-19细胞中RPE65和ZO-1的表达 |
2.2 Aβ1-40对ARPE-19细胞增殖活力的影响
CCK-8检测结果显示:与未刺激组相比,0.1、1.0、5.0 μmol/L的Aβ1-40刺激ARPE-19细胞24、48、72 h均不会影响细胞增殖活力。而与未刺激组相比,10.0 μmol/L Aβ1-40处理ARPE-19细胞24、48、72 h均显著降低细胞增殖活力(P < 0.05,图 2)。为了避免细胞毒性,后续实验分别使用1.0、5.0 μmol/L Aβ1-40的浓度刺激24 h,以评估Aβ1-40对ARPE-19细胞炎症和凋亡反应的影响。
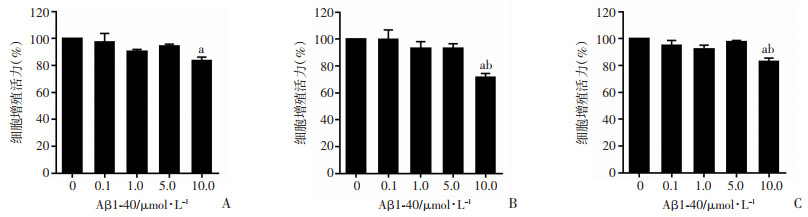
|
| a: P < 0.05,与未刺激组比较;b:P < 0.05,与0.1 μmol/L刺激组比较 图 2 CCK-8检测不同浓度的Aβ1-40刺激24 h(A)、48 h(B)、72 h(C)后对ARPE-19细胞增殖活力的影响 |
2.3 Aβ1-40对SIRT1、p21和IL-1β mRNA表达的影响
Real-time PCR检测结果显示:与未刺激组和5.0 μmol/L Aβ40-1组相比,1.0、5.0 μmol/L Aβ1-40均降低SIRT1的mRNA表达(P < 0.05,图 3A),同时增加IL-1β的表达(P < 0.05,图 3B)。但仅有浓度为5.0 μmol/L的Aβ1-40增加p21的mRNA表达(P < 0.05,图 3C)。因此,本研究使用5.0 μmol/L浓度的Aβ1-40建立ARPE-19细胞的炎症和凋亡反应模型。与正常受试者相比,湿性AMD患者PBMC中SIRT1的mRNA表达降低(P < 0.01,图 3D)。
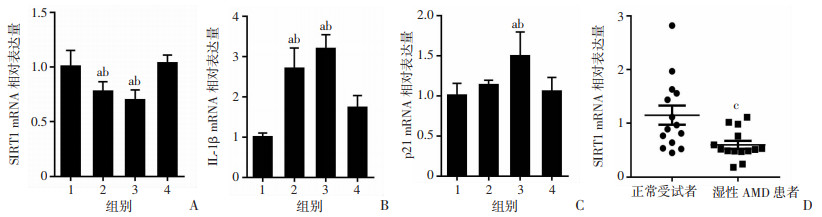
|
| A~C:分别为ARPE-19细胞中SIRT1、IL-1β、p21 mRNA的表达;D:湿性AMD患者和正常受试者PBMC中SIRT1 mRNA表达(n=14) 1:DMEM/F12;2:1.0 μmol/L Aβ1-40;3:5.0 μmol/L Aβ1-40;4:5.0 μmol/L Aβ40-1;a:P < 0.05,与DMEM/F12组比较;b:P < 0.05,与5 μmol/L Aβ40-1组比较;c:P < 0.01,与正常受试者比较 图 3 RT-PCR检测Aβ1-40刺激对ARPE-19细胞SIRT1、IL-1β和p21 mRNA表达的影响及湿性AMD患者PBMC中SIRT1 mRNA的表达 |
2.4 LXR激动剂预处理及Aβ1-40刺激对LXRα、SIRT1表达的影响
Western blot检测结果显示:与未用TO90处理组相比,TO90处理组LXRα蛋白表达升高,表明TO90成功激活LXRα(P < 0.01,图 4A、C)。Real-time PCR和Western blot结果显示:与Aβ1-40组相比,Aβ1-40+TO90组SIRT1的表达在mRNA及蛋白水平上调(P < 0.01,图 4A、B、D),表明TO90在基因和蛋白水平上显著逆转了由Aβ1-40引起的SIRT1的下调。
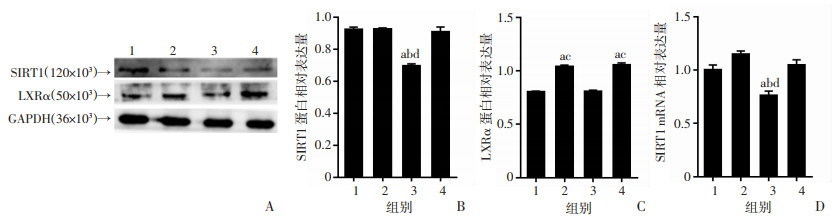
|
| A~C:分别为SIRT1、LXRα蛋白表达;D:SIRT1 mRNA表达 1:未刺激组;2:Aβ1-40+TO90组;3:Aβ1-40组;4:TO90组;a:P < 0.01,与未刺激组比较;b:P < 0.01,与Aβ1-40+TO90组比较;c:P < 0.01,与Aβ1-40组比较;d:P < 0.01,与TO90组比较 图 4 RT-PCR和Western blot检测TO90预处理及Aβ1-40刺激对ARPE-19细胞SIRT1和LXRα表达的影响 |
2.5 LXR激动剂预处理及Aβ1-40刺激对NF-κB和p53信号通路的影响
Western blot检测结果显示:与未刺激组相比,Aβ1-40组中SIRT1下游因子ace-NF-кB(p65)、NF-кB、ace-p53、p53和p21的蛋白表达显著增加(P < 0.05),表明Aβ1-40通过增加NF-кB和p53信号通路的乙酰化和活化来诱导ARPE-19细胞炎症和凋亡反应。与Aβ1-40组相比,Aβ1-40+TO90组中上述因子的蛋白表达下调(P < 0.05,图 5),表明LXR激动剂通过增加SIRT1的脱乙酰化酶活性来抑制NF-κB和p53信号通路的乙酰化和活化。

|
| 1:未刺激组;2:Aβ1-40+TO90组;3:Aβ1-40组;4:TO90组;a:P < 0.05,与Aβ1-40比较 图 5 Western blot检测TO90预处理及Aβ1-40刺激对ARPE-19细胞ace-NF-κB(A、B)、NF-κB(A、C)、ace-p53(A、D)、p53(A、E)和p21(A、F)蛋白表达的影响 |
2.6 慢病毒转染敲低ARPE-19中SIRT1的表达
CCK-8检测结果显示:相对于未处理组,阴性对照(NC)组细胞增殖活力降低。此外,与NC组比较,iSIRT1组细胞增殖活力进一步降低(P < 0.01, 图 6A)。Real-time PCR和Western blot检测结果显示:与未处理组和NC组相比,iSIRT1组SIRT1的表达降低(P < 0.01,图 6B~D)。表明病毒转染本身不影响SIRT1的表达,iSIRT1成功降低了SIRT1的表达。
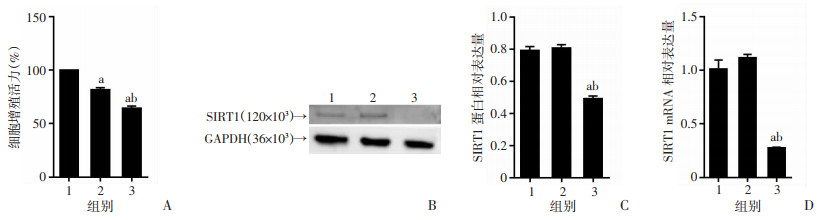
|
| A:病毒转染对ARPE-19细胞增殖活力的影响;B~D:SIRT1的蛋白和mRNA表达 1:未处理组;2:NC组;3:SIRT1组;a:P < 0.01,与未处理组比较;b:P < 0.01,与NC组比较 图 6 病毒转染对ARPE-19细胞增殖活力及SIRT1表达的影响 |
2.7 iSIRT1对LXR激动剂在改善Aβ导致的ARPE-19细胞炎症和凋亡反应中的影响
Western blot检测结果显示:与Aβ1-40+NC+TO90组相比,Aβ1-40+iSIRT1+TO90组ace-NF-кB、NF-κB、ace-p53、p53和p21的蛋白表达显著增加(P < 0.01,图 7),结果表明LXR激动剂虽然可以抑制Aβ引起的NF-кB和p53信号通路的乙酰化和活化,但iSIRT1减弱LXR激动剂的这种抑制作用,进一步证实SIRT1参与LXR激动剂的抗炎和抗凋亡作用。
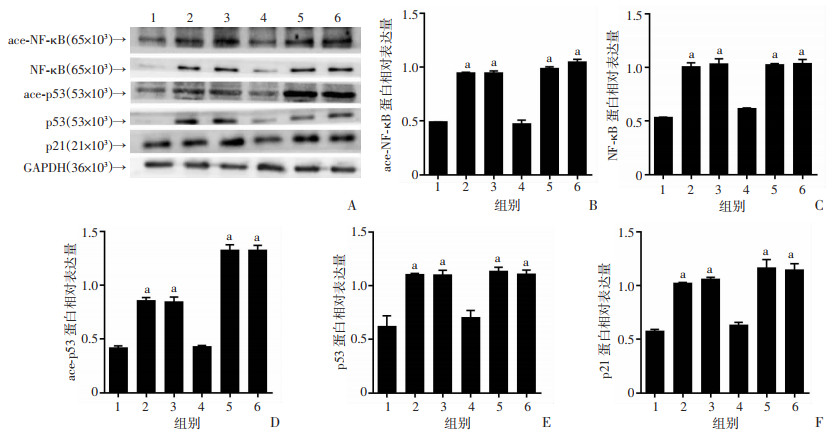
|
| 1:未刺激组;2:Aβ1-40+载体;3:Aβ1-40+NC;4:Aβ1-40+NC+TO90;5:Aβ1-40+iSIRT1;6:Aβ1-40+iSIRT1+TO90;a:P < 0.01,与Aβ1-40+NC+TO90比较 图 7 Western blot检测iSIRT1、TO90预处理及Aβ1-40刺激对ARPE-19细胞ace-NF-κB(A、B)、NF-κB(A、C)、ace-p53(A、D)、p53(A、E)和p21(A、F)蛋白表达的影响 |
3 讨论
本研究除了证实Aβ引起IL-1β的上调外,还证明了在Aβ诱导的RPE损伤和湿性AMD患者PBMC中,SIRT1表达降低同时伴有凋亡相关基因p21表达升高。另外,我们发现LXR激动剂通过增加SIRT1的去乙酰化酶活性,促进NF-κB和p53信号通路的去乙酰化并抑制其活化,从而达到抗炎和抗凋亡反应的作用。敲低SIRT1后,LXR激动剂对NF-κB和p53信号通路的抑制作用显著降低,进一步表明SIRT1信号级联在LXR激动剂的抗炎和抗凋亡作用中的关键性。在这项研究中,我们的数据证实LXR激动剂通过SIRT1信号级联改善Aβ诱导的RPE细胞炎症和凋亡反应。
Aβ的作用一直是国内外研究的焦点,它不仅沉积在玻璃膜疣中与AMD的发生和发展密切相关,而且与其他年龄相关性疾病如阿尔茨海默病和动脉粥样硬化关系密切,因为后两者疾病患者的血管壁和结缔组织中沉积物的主要成分也为Aβ,且与疾病的病理表现和临床症状密切相关[17-18]。由此得出,Aβ作为这些沉积物的共同主要成分,在这些疾病中可能引发相似的病理过程。研究证实:小鼠眼内注射Aβ可引起视网膜炎症和细胞凋亡反应,但不会引起组织学改变,这与AMD患者的早期临床表现一致[19]。RPE细胞的炎症和凋亡被认为在AMD的发病机制中起着关键作用,而Aβ可引发RPE细胞一系列炎症反应[20]并加速细胞凋亡[21],这与早期AMD的视网膜微环境类似。ARPE-19细胞是人类RPE来源的永生化单个细胞系,与RPE细胞在体内参与形成视网膜屏障的融合状态存在差异。但是,也有研究表明ARPE-19细胞在体外经过一段时间的培养后,确实可以重新分化出RPE表型[22]。本实验通过细胞免疫荧光确实检测到了RPE细胞特异性蛋白RPE65以及细胞间紧密连接ZO-1的存在,尽可能使细胞状态接近其生理状态下在体内的状态。我们用Aβ刺激ARPE-19细胞建立早期AMD体外模型作为研究对象。前期有大量的研究已经证实Aβ对ARPE-19细胞毒性作用的时间-剂量关系[23],本研究结果表明ARPE-19细胞增殖活力与Aβ刺激时间和浓度呈负相关,这与YE等[4]的研究结果类似,但与MASUDA等[24]的研究结果不同,该研究认为低浓度的Aβ提高细胞增殖活力,高浓度的Aβ降低细胞增殖活力。由于IL-1β参与Aβ诱导的炎症反应[25],同时是RPE细胞刺激后释放的早期重要炎症因子之一[26],并受NF-κB的调控[27],因此,在本研究中,选择IL-1β作为炎症反应的指标。本研究结果表明:Aβ通过增加RPE细胞中的NF-κB乙酰化和活化来诱导炎症。此外,Aβ增加ARPE-19细胞中p53信号通路的乙酰化和活化,表明细胞凋亡途径参与Aβ对ARPE-19细胞的损伤。本研究支持Aβ增加RPE细胞的炎症和凋亡反应的结论。
在AMD的发生和发展中,大量体内外实验证实SIRT1在其中发挥保护作用。比如SIRT1通过激活HIF-2α抑制脉络膜新生血管生成和VEGF-A的表达[28]。SIRT1使p53脱乙酰化以预防氧化应激引起的细胞凋亡[29]。与这些研究一致,本研究结果表明:在湿性AMD患者的PBMC及Aβ刺激造成的RPE损伤中,SIRT1表达下调,伴有NF-кB和p53信号通路在蛋白水平的乙酰化和活化,而用LXR激动剂治疗可以抵消这些不利影响;并且敲低SIRT1后,LXR激动剂的这种作用显著降低,表明LXR通过调控SIRT1改善Aβ诱导的RPE炎症和凋亡反应。然而,与本研究结果不同的是,有研究表明SIRT1可反过来增加LXR的脱乙酰化并使其激活[30]。但是,另一项研究却表明SIRT1的过表达不能增强LXR相关信号通路的活性[31],这说明两者之间可能存在其他调控机制。另外,ATP结合盒转运蛋白A1(ATP-binding cassette transporters A1, ABCA1)是LXRs的重要靶基因,参与胆固醇和磷脂的转运,并调节细胞脂质稳态[32]。除SIRT1外,研究也表明ABCA1参与LXR的抑炎作用[33]。我们前期的研究也提示:在Aβ诱导的视网膜炎症中,TO90还可通过激活LXRα-ABCA1轴来发挥抑炎作用[34]。
本研究由于从干性AMD患者收集的PBMC样本不足,因此无法检测干性AMD患者PBMC中SIRT1的表达。当然,本研究也没有解决LXR对SIRT1的特定调控机制,这需要更深入的实验来证实,例如ChIP或免疫共沉淀实验。
综上所述,本研究证明了LXR激动剂和SIRT1信号传导在Aβ刺激导致的RPE细胞损伤中的作用,并表明LXR激动剂对SIRT1具有一定的调节作用,主要与NF-κB和p53信号通路的乙酰化和活化相关。通过敲低SIRT1,我们的假设得到了进一步证实。这些发现可能为前瞻性临床试验中评估LXR激动剂对AMD患者的作用提供理论依据。
| [1] |
WONG W L, SU X Y, LI X, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis[J]. Lancet Glob Health, 2014, 2(2): e106-e116. DOI:10.1016/S2214-109X(13)70145-1 |
| [2] |
FERRIS F L 3rd, WILKINSON C P, BIRD A, et al. Clinical classification of age-related macular degeneration[J]. Ophthalmology, 2013, 120(4): 844-851. DOI:10.1016/j.ophtha.2012.10.036 |
| [3] |
ANDERSON D H, TALAGA K C, RIVEST A J, et al. Characterization of beta amyloid assemblies in drusen: the deposits associated with aging and age-related macular degeneration[J]. Exp Eye Res, 2004, 78(2): 243-256. DOI:10.1016/j.exer.2003.10.011 |
| [4] |
YE Z, HE S Z, LI Z H. Effect of Aβ protein on inhibiting proliferation and promoting apoptosis of retinal pigment epithelial cells[J]. Int J Ophthalmol, 2018, 11(6): 929-934. DOI:10.18240/ijo.2018.06.06 |
| [5] |
WANG B, TONTONOZ P. Liver X receptors in lipid signalling and membrane homeostasis[J]. Nat Rev Endocrinol, 2018, 14(8): 452-463. DOI:10.1038/s41574-018-0037-x |
| [6] |
CEROI A, DELETTRE F A, MAROTEL C, et al. The anti-inflammatory effects of platelet-derived microparticles in human plasmacytoid dendritic cells involve liver X receptor activation[J]. Haematologica, 2016, 101(3): e72-e76. DOI:10.3324/haematol.2015.135459 |
| [7] |
CAO E Y, LINDGREN A, MARTINSSON S, et al. Promoting intestinal lymphatic transport targets a liver-X receptor (LXR) agonist (WAY-252, 623) to lymphocytes and enhances immunomodulation[J]. J Control Release, 2019, 296: 29-39. DOI:10.1016/j.jconrel.2019.01.002 |
| [8] |
ZHENG W C, REEM R E, OMAROVA S, et al. Spatial distribution of the pathways of cholesterol homeostasis in human Retina[J]. PLoS ONE, 2012, 7(5): e37926. DOI:10.1371/journal.pone.0037926 |
| [9] |
YANG H X, ZHENG S J, QIU Y G, et al. Activation of liver X receptor alleviates ocular inflammation in experimental autoimmune uveitis[J]. Invest Ophthalmol Vis Sci, 2014, 55(4): 2795-2804. DOI:10.1167/iovs.13-13323 |
| [10] |
ZHENG S J, YANG H X, CHEN Z H, et al. Activation of liver X receptor protects inner retinal damage induced by N-methyl-D-aspartate[J]. Invest Ophthalmol Vis Sci, 2015, 56(2): 1168-1180. DOI:10.1167/iovs.14-15612 |
| [11] |
DAI B L, LEI C Y, LIN R, et al. Activation of liver X receptor α protects amyloid β1-40 induced inflammatory and senescent responses in human retinal pigment epithelial cells[J]. Inflamm Res, 2017, 66(6): 523-534. DOI:10.1007/s00011-017-1036-4 |
| [12] |
TSENG R C, WANG Y C. SIRT1 (sirtuin (silent mating type information regulation 2 homolog) 1 (S. cerevisiae))[J]. Atlas Genet Cytogenet Oncol Haematol, 2010, 14(12): 1152. DOI:10.4267/2042/44919 |
| [13] |
HAN X, CUI Z Y, SONG J, et al. Acanthoic acid modulates lipogenesis in nonalcoholic fatty liver disease via FXR/LXRs-dependent manner[J]. Chem Biol Interact, 2019, 311: 108794. DOI:10.1016/j.cbi.2019.108794 |
| [14] |
HAMMER S S, BELI E, KADY N, et al. The mechanism of diabetic retinopathy pathogenesis unifying key lipid regulators, sirtuin 1 and liver X receptor[J]. EBioMedicine, 2017, 22: 181-190. DOI:10.1016/j.ebiom.2017.07.008 |
| [15] |
KURJI K H, CUI J Z, LIN T, et al. Microarray analysis identifies changes in inflammatory gene expression in response to amyloid-beta stimulation of cultured human retinal pigment epithelial cells[J]. Invest Ophthalmol Vis Sci, 2010, 51(2): 1151-1163. DOI:10.1167/iovs.09-3622 |
| [16] |
LEI C Y, LIN R, WANG J M, et al. Amelioration of amyloid β-induced retinal inflammatory responses by a LXR agonist TO901317 is associated with inhibition of the NF-κB signaling and NLRP3 inflammasome[J]. Neuroscience, 2017, 360: 48-60. DOI:10.1016/j.neuroscience.2017.07.053 |
| [17] |
SELKOE D J, PODLISNY M B, JOACHIM C L, et al. Beta-amyloid precursor protein of Alzheimer disease occurs as 110- to 135-kilodalton membrane-associated proteins in neural and nonneural tissues[J]. Proc Natl Acad Sci USA, 1988, 85(19): 7341-7345. DOI:10.1073/pnas.85.19.7341 |
| [18] |
DE MEYER G R, DE CLEEN D M, COOPER S, et al. Platelet phagocytosis and processing of beta-amyloid precursor protein as a mechanism of macrophage activation in atherosclerosis[J]. Circ Res, 2002, 90(11): 1197-1204. DOI:10.1161/01.res.0000020017.84398.61 |
| [19] |
LIU C Q, CAO L N, YANG S, et al. Subretinal injection of amyloid-β peptide accelerates RPE cell senescence and retinal degeneration[J]. Int J Mol Med, 2015, 35(1): 169-176. DOI:10.3892/ijmm.2014.1993 |
| [20] |
CARRERO I, GONZALO M R, MARTIN B, et al. Oligomers of β-amyloid protein (Aβ1-42) induce the activation of cyclooxygenase-2 in astrocytes via an interaction with interleukin-1β, tumour necrosis factor-α, and a nuclear factor κ-B mechanism in the rat brain[J]. Exp Neurol, 2012, 236(2): 215-227. DOI:10.1016/j.expneurol.2012.05.004 |
| [21] |
MÜLLER T, MEYER H E, EGENSPERGER R, et al. The amyloid precursor protein intracellular domain (AICD) as modulator of gene expression, apoptosis, and cytoskeletal dynamics-relevance for Alzheimer's disease[J]. Prog Neurobiol, 2008, 85(4): 393-406. DOI:10.1016/j.pneurobio.2008.05.002 |
| [22] |
SAMUEL W, JAWORSKI C, POSTNIKOVA O A, et al. Appropriately differentiated ARPE-19 cells regain phenotype and gene expression profiles similar to those of native RPE cells[J]. Mol Vis, 2017, 23: 60-89. |
| [23] |
BRUBAN J, GLOTIN A L, DINET V, et al. Amyloid-beta(1-42) alters structure and function of retinal pigmented epithelial cells[J]. Aging Cell, 2009, 8(2): 162-177. DOI:10.1111/j.1474-9726.2009.00456.x |
| [24] |
MASUDA N, TSUJINAKA H, HIRAI H, et al. Effects of concentration of amyloid β (Aβ) on viability of cultured retinal pigment epithelial cells[J]. BMC Ophthalmol, 2019, 19(1): 70. DOI:10.1186/s12886-019-1076-3 |
| [25] |
HALLE A, HORNUNG V, PETZOLD G C, et al. The NALP3 inflammasome is involved in the innate immune response to amyloid-beta[J]. Nat Immunol, 2008, 9(8): 857-865. DOI:10.1038/ni.1636 |
| [26] |
KAARNIRANTA K, SALMINEN A. Age-related macular degeneration: activation of innate immunity system via pattern recognition receptors[J]. J Mol Med, 2009, 87(2): 117-123. DOI:10.1007/s00109-008-0418-z |
| [27] |
HISCOTT J, MAROIS J, GAROUFALIS J, et al. Characterization of a functional NF-kappa B site in the human interleukin 1 beta promoter: evidence for a positive autoregulatory loop[J]. Mol Cell Biol, 1993, 13(10): 6231-6240. DOI:10.1128/mcb.13.10.6231 |
| [28] |
BALAIYA S, KHETPAL V, CHALAM K V. Hypoxia initiates sirtuin1-mediated vascular endothelial growth factor activation in choroidal endothelial cells through hypoxia inducible factor-2α[J]. Mol Vis, 2012, 18: 114-120. |
| [29] |
ZHUGE C C, XU J Y, ZHANG J F, et al. Fullerenol protects retinal pigment epithelial cells from oxidative stress-induced premature senescence via activating SIRT1[J]. Invest Ophthalmol Vis Sci, 2014, 55(7): 4628-4638. DOI:10.1167/iovs.13-13732 |
| [30] |
LI X L, ZHANG S W, BLANDER G, et al. SIRT1 deacetylates and positively regulates the nuclear receptor LXR[J]. Mol Cell, 2007, 28(1): 91-106. DOI:10.1016/j.molcel.2007.07.032 |
| [31] |
ESCOLÀ-GIL J C, JULVE J, LLAVERIAS G, et al. Resveratrol administration or SIRT1 overexpression does not increase LXR signaling and macrophage-to-feces reverse cholesterol transport in vivo[J]. Transl Res, 2013, 161(2): 110-117. DOI:10.1016/j.trsl.2012.10.008 |
| [32] |
PHILLIPS M C. Molecular mechanisms of cellular cholesterol efflux[J]. J Biol Chem, 2014, 289(35): 24020-24029. DOI:10.1074/jbc.R114.583658 |
| [33] |
ITO A, HONG C, RONG X, et al. LXRs link metabolism to inflammation through Abca1-dependent regulation of membrane composition and TLR signaling[J]. Elife, 2015, 4: e08009. DOI:10.7554/eLife.08009 |
| [34] |
LEI C Y, LIN R, WANG J M, et al. Amelioration of amyloid β-induced retinal inflammatory responses by a LXR agonist TO901317 is associated with inhibition of the NF-κB signaling and NLRP3 inflammasome[J]. Neuroscience, 2017, 360: 48-60. DOI:10.1016/j.neuroscience.2017.07.053 |



