2. 550004 贵阳, 贵州医科大学附属医院:影像科
2. Department of Imaging, Affiliated Hospital of Guizhou Medical University, Guiyang, Guizhou Province, 550004, China
颞叶癫痫(temporal lobe epilepsy,TLE)为最常见的局灶性癫痫[1],易出现认知功能尤其是执行功能受损[2],既往研究发现前额叶病变为导致执行功能障碍的直接原因[3]。近年来,有研究发现执行功能障碍者有额颞叶连接纤维束的损害[4],也有研究认为癫痫执行障碍为大脑网络改变所致[5]。左侧颞叶癫痫(L-TLE)为TLE的一部分,有研究证明L-TLE患者左侧脑网络连通性减少,其执行控制网络呈明显偏侧化[6],但机制尚无统一定论。TLE患者常规MRI平扫不能发现结构损伤,弥散张量成像(diffusion tensor imaging,DTI)能敏感地显示常规MRI平扫不能发现的微观组织损害,并能描述脑区结构和功能的关系[7]。本研究比较L-TLE患者与健康对照的执行功能和脑白质纤维束损害特点,以及执行功能改变与脑白质纤维束改变的关系,在了解L-TLE执行控制网络的同时,亦为研究执行功能损害进一步提供病理生理学依据。
1 资料与方法 1.1 研究对象 1.1.1 L-TLE组收录2018年11月至2019年11月就诊本院的L-TLE患者。纳入标准:①符合2001年ILAE颁布的TLE诊断标准[8],根据发作症状、发作间期及发作期脑电图纳入左侧TLE患者,无其他神经系统疾病。②年龄为18~60岁,受教育年限>6年。③除海马硬化外,头颅MRI平扫未发现其他病灶。④语言功能、智力发育正常[简易精神状态评价量表(Mini-mental State Examination, MMSE)>24分],无其他引起语言功能及智力障碍的相关病因。排除标准:①合并有其他神经系统疾病,如痴呆、帕金森病、脑血管病等;有明确的心肺肾脏系统疾病,精神因素所致的假性癫痫样发作。②有精神病史,如严重抑郁症[汉密顿抑郁量表(Hamilton Depression Scale, HAMD)≥24分]、焦虑症[汉密尔顿焦虑量表(Hamilton Anxiety Scale, HAMA)≥21分]、精神分裂症等。③有任何智力残疾史(小学文化MMSE<20分,初中以上文化MMSE<24分)、酗酒及药物滥用史。④头颅MRI有病灶者、不能行MRI检查以及不配合MRI检查者。
1.1.2 对照组选取与L-TLE患者组年龄、性别、利手及受教育程度相匹配的健康志愿者作为健康对照组。受试者均在同一台MRI扫描仪器上接受相同序列的MRI扫描。本研究取得所有受试患者和健康志愿者的知情同意,并获得贵州医科大学附属医院伦理委员会的批准(2018伦审第063号)。
1.2 方法 1.2.1 一般资料收集记录所有研究对象的人口统计学资料(姓名、性别、年龄、受教育程度、疾病史),对癫痫患者需询问发病年龄、病程、发作次数、服药种类及剂量、脑电图结果。执行功能评估方法包括:词语流畅性试验、数字广度测验、Stroop色词干扰试验A~C(Stroop color word interference test A~C, Stroop test, A~C)、连线试验A和B。
1.2.2 图像采集使用荷兰Philips公司Achieva3.0T超导磁共振扫描仪在标准的头线圈内完成扫描,首先采用快速自旋回波序列行常规头部MR扫描以排除脑器质性疾病,扫描参数:T2WI(TR/TE= 8 000 ms/ 120 ms)、T1WI(TR/TE=11.76 ms/ 5.82 ms)、FLAIR(TR/TE=4 800 ms/273.83 ms);DTI是通过单次激发自旋回波平面成像获得的,扫描参数:TR=5 067 ms, TE=70 ms, FOV=240 mm×240 mm, recon体素尺寸=2 mm×2 mm×2 mm,矩阵=144×144,切片厚度=2 mm, NSA=2, gap=0 mm。
1.2.3 DTI数据处理DTI数据先采用PANDA软件进行预处理[9]:①通过将扩散加权图像与参考b0图像进行有效对齐;②消除涡流畸变和运动伪影的影响;③采用去颅骨的方法将非脑组织和背景噪声从校正后的图像中分离出来;④图像进行弥散张量重建,得到标准化的部分各异向性(fractional anisotropy, FA)图。然后利用FMRIB软件包进行基于纤维束示踪的空间统计(tract based spatial statistics,TBSS)分析[10-11],简要步骤:①利用非线性配准,将受试者FA配准到标准空间(FMRIB58_FA模板);②利用所有配准到标准空间的FA图像得到平均FA图及白质骨架;③平均FA阈值设置为0.2,去除低于阈值的纤维束;④同法处理平均弥散率(mean diffusivity, MD)值。纤维束区域参照“JHUW White Matter Tractography Atlas”进行分割。
1.3 统计学分析采用SPSS 25.0统计软件,符合正态分布的计量指标用x±s表示,偏态资料用中位数(四分位间距)表示。对年龄、病程、受教育年限及执行功能评分进行独立样本t检验或mann-whitney检验,方差不齐采用校正t检验,性别行χ2检验;执行功能评分分别与微观结构有变化的脑白质纤维束的FA、MD值行以性别、年龄和受教育年限作为控制变量的Pearson偏相关分析或Spearman相关分析;使用FSL的Randomise函数对两组间的FA、MD值进行统计检验,采用FDR校正。P < 0.05表示差异有统计学意义。
2 结果 2.1 人口统计学资料和临床特征研究对象共计42例,均为右利手,各组年龄、受教育年限以及性别分布差异均无统计学意义(表 1)。
| 组别 | L-TLE组 | HC组 | 统计值 | P值 |
| 男/女 | 7/14 | 8/13 | 0.104 | 0.747 |
| 年龄/岁 | 27(31-21) | 30(42-24) | -0.101 | 0.919 |
| 受教育年限/年 | 12(15.0-9.5) | 12(15.5-9.0) | -1.223 | 0.221 |
| 病程/年 | 3(8.0-1.5) | - | - | - |
| 起病年龄/岁 | 23.71±9.99 | - | - | - |
| 数字广度顺向/分 | 9(11.50-7.00) | 11(13.50-8.50) | -2.190 | 0.028 |
| 数字广度逆向/分 | 6(8.00-4.00) | 6(9.50-4.00) | -0.737 | 0.461 |
| Stroop A/s | 26(33.05-21.00) | 25(65.00-21.28) | -1.108 | 0.268 |
| Stroop B/s | 36(46.50-34.00) | 36(42.80-29.50) | -0.680 | 0.497 |
| Stroop C/s | 69(86.85-60.00) | 57(65.50-55.00) | -2.659 | 0.008 |
| 词语流畅性/个 | 12.48±3.31 | 17.62±3.65 | 4.780 | < 0.001 |
| 连线A/s | 45.1(70.5-31.5) | 43(48.0-34.7) | -0.969 | 0.333 |
| 连线B/s | 101.6(155.7-66.2) | 80(102.5-65.5) | -1.661 | 0.097 |
2.2 执行功能测试
L-TLE组在数字广度顺向分数、词语流畅性分数显著低于对照组,StroopC耗时显著高于对照组,差异有统计学意义(P < 0.05);在StroopA、StroopB、连线A、连线B测试中,两组之间差异均无统计学意义(表 1)。
2.3 脑白质纤维束FA值、MD值与对照组比,L-TLE组在左侧丘脑前辐射、左侧扣带束海马部、胼胝体枕部FA值降低,差异有统计学意义(FDR校正P < 0.05,表 2、图 1)。
| 组别 | 左丘脑前辐射 | 右丘脑前辐射 | 左皮质脊髓束 | 右皮质脊髓束 | 左扣带束 | 右扣带束 | 左扣带束海马部 | 右扣带束海马部 | 胼胝体枕部 | 胼胝体额部 | 左下额枕束 | 右下额枕束 | 左下纵束 | 右下纵束 | 左上纵束 | 右上纵束 | 左钩束 | 右钩束 | 左上纵束颞部 | 右上纵束颞部 |
| HC组 | 34.99±1.31 | 33.00(33.47-31.12) | 51.01±1.63 | 50.58±1.71 | 45.00±2.13 | 38.76±2.07 | 30.34±3.61 | 26.86±2.91 | 50.87±1.52 | 38.11±1.39 | 38.12±1.46 | 37.91±1.22 | 37.64±1.82 | 39.91±2.17 | 34.29±1.65 | 35.15±1.47 | 33.92±2.77 | 34.06(36.58-32.54) | 43.14±3.11 | 46.41±2.91 |
| L-TLE组 | 33.67±2.29 | 31.43(32.75-30.76) | 50.40±1.28 | 50.26±1.66 | 43.32±3.30 | 37.91±3.07 | 26.88±3.09 | 25.49±2.77 | 49.81±1.69 | 37.16±1.92 | 37.21±1.58 | 37.43±1.68 | 36.89±1.38 | 39.50±1.94 | 33.83±1.40 | 34.62±1.59 | 32.72±2.63 | 34.89(35.98-31.46) | 43.02±3.37 | 45.48±2.83 |
| 统计值 | 2.312 | 1.748 | 1.351 | 0.428 | 1.959 | 1.055 | 3.342 | 1.554 | 2.148 | 1.840 | 1.944 | 1.068 | 1.496 | 0.657 | 0.967 | 1.117 | 1.437 | 0.373 | 0.114 | 1.050 |
| P值 | 0.027 | 0.105 | 0.184 | 0.671 | 0.057 | 0.298 | 0.002 | 0.128 | 0.038 | 0.073 | 0.059 | 0.292 | 0.143 | 0.515 | 0.339 | 0.270 | 0.159 | 0.870 | 0.910 | 0.300 |
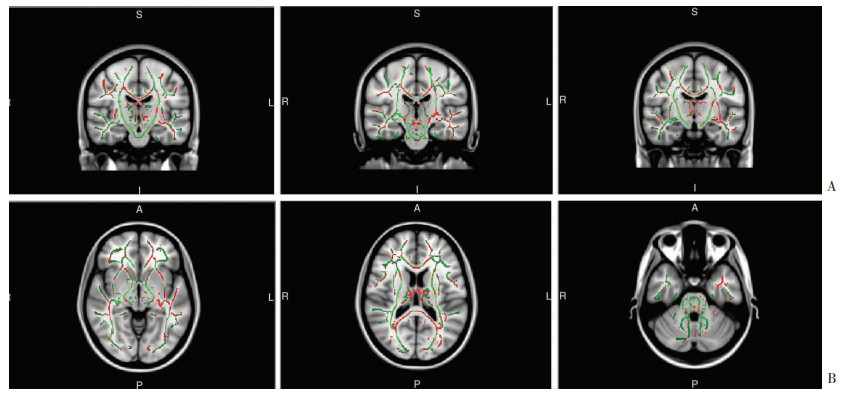
|
| A:从左到右为分别为左侧丘脑前辐射、胼胝体枕部、左侧扣带束海马部冠状位图;B:从左到右为分别为左侧丘脑前辐射、胼胝体枕部、左侧扣带束海马部轴位图纤维束区域参照“JHUW White Matter Tractography Atlas”进行分割, 绿色区域示白质纤维骨架,红色区域示L-TLE组相对于对照组FA值降低区域 图 1 L-TLE组与对照组脑白质纤维束FA差异表现 |
L-TLE组在左侧丘脑前辐射、双侧扣带束、左侧扣带束海马部、胼胝体额部、双侧钩束MD值较对照组升高,差异有统计学意义(FDR校正P < 0.05,表 3)。
| 组别 | 左丘脑前辐射 | 右丘脑前辐射 | 左皮质脊髓束 | 右皮质脊髓束 | 左扣带束 | 右扣带束 | 左扣带束海马部 | 右扣带束海马部 | 胼胝体枕部 | 胼胝体额部 | 左下额枕束 | 右下额枕束 | 左下纵束 | 右下纵束 | 左上纵束 | 右上纵束 | 左钩束 | 右钩束 | 左上纵束颞部 | 右上纵束颞部 |
| HC组 | 78.30(81.70-76.50) | 77.80(82.50-76.35) | 76.71±2.24 | 76.31±2.79 | 72.20(72.85-69.05) | 70.50±2.81 | 72.83±6.09 | 82.40(84.40-79.20) | 84.30(88.00-83.50) | 81.97±2.22 | 76.40(77.95-75.25) | 77.20(80.50-76.10) | 78.12±3.14 | 78.67±2.99 | 75.13±2.76 | 75.83±2.83 | 77.27±2.98 | 79.02±3.52 | 80.80±5.04 | 80.01±4.84 |
| L-TLE组 | 80.30(87.25-78.60) | 80.30(82.70-77.85) | 77.30±2.49 | 76.95±2.42 | 73.70(77.05-71.50) | 73.36±2.90a | 77.61±7.03 | 84.20(86.85-82.35) | 86.00(93.25-81.60) | 84.63±3.13 | 78.20(79.30-75.95) | 79.50(81.10-77.55) | 79.46±1.68 | 78.66±2.23 | 76.34±2.14 | 77.41±2.87 | 80.16±3.09 | 81.39±2.77 | 81.05±5.31 | 80.17±4.07 |
| 统计值 | -2.126 | -1.334 | -0.802 | -0.791 | -2.302 | -3.250 | -2.351 | -1.912 | -0.415 | -3.181 | -1.561 | -1.824 | -1.730 | 0.012 | -1.587 | -1.791 | -3.085 | -2.422 | -0.161 | -0.114 |
| P值 | 0.034 | 0.182 | 0.427 | 0.433 | 0.021 | 0.002 | 0.024 | 0.056 | 0.678 | 0.003 | 0.119 | 0.068 | 0.094 | 0.991 | 0.120 | 0.081 | 0.004 | 0.020 | 0.873 | 0.910 |
2.4 L-TLE患者执行功能评分与微观结构有差异的纤维束相关分析
在L-TLE患者中,StroopC与左侧丘脑前辐射FA值(r=-0.461,P=0.035)呈负相关,与左侧丘脑前辐射MD值(r=0.634,P=0.002)呈正相关;词语流畅性与左侧扣带束海马部FA值(r=0.486,P=0.026)呈正相关,与左侧钩束MD值(r=-0.513,P=0.017)呈负相关;连线B与左侧丘脑前辐射MD值(r=0.481,P=0.043)呈正相关(表 4)。
| 脑白质纤维束 | StroopC | 词语流畅性 | 连线B | |||||
| r值 | P值 | r值 | P值 | r值 | P值 | |||
| 左侧丘脑前辐射FA值 | -0.461 | 0.035 | -0.006 | 0.981 | -0.303 | 0.221 | ||
| 左侧扣带束海马部FA值 | -0.113 | 0.656 | 0.486 | 0.026 | -0.171 | 0.496 | ||
| 左侧丘脑前辐射MD值 | 0.634 | 0.002 | 0.169 | 0.501 | 0.481 | 0.043 | ||
| 左侧钩束MD值 | 0.197 | 0.433 | -0.513 | 0.017 | -0.001 | 0.996 | ||
3 讨论
执行功能是指管理复杂、目标导向的思想和行为的能力,其核心是抑制、反应抑制和干涉控制、工作记忆和认知灵活性,被认为是更高级的认知加工[12],对我们的生活质量有着显著影响。有研究者利用生活质量量表及执行功能评估量表对TLE患者进行评估,发现执行功能是一个重要的生活质量预测因子[13],亦可作为脑卒中康复后功能状态的可靠预测指标[14]。既往研究证明执行功能控制部位位于额叶[3]。额叶作为大脑半球中最大的脑叶,含有丰富的联络纤维,包括扣带束、下额枕束、上纵束、丘脑前辐射、钩束和弓状束等[15],并通过这些纤维连接传递功能至各个脑区。当额叶皮层与脑区之间出现纤维连接障碍时,将导致额叶相关功能障碍。颞叶癫痫致痫灶位于颞叶,又如何影响执行功能异常,目前大多数学者认为TLE患者执行功能障碍是由于其额颞叶间纤维束受损,亦有人认为,癫痫为网络性疾病,除了颞叶相关认知功能损害以外,还出现颞叶以外的认知受损。L-TLE患者致痫灶位于左侧颞叶,右利手的L-TLE患者优势大脑半球亦位于左侧,执行功能脑网络改变是否以优势半球为主?研究发现右利手的L-TLE患者在执行言语工作记忆时大脑激活具有左侧大脑半球优势,呈左侧偏侧化[16]。也有研究认为执行控制网络的紊乱可能是L-TLE患者执行功能损伤的潜在病理机制[17],但仍无统一定论。故本研究通过研究L-TLE患者脑白质纤维束连接与执行功能关系,在了解L-TLE脑白质纤维束连通性的同时亦为执行功能障碍机制的研究奠定理论基础。
本研究发现L-TLE患者存在执行功能障碍,主要在数字广度顺向完成组数低于对照组,词语流畅性均数低于对照组,在StroopC耗时高于对照组,差异有统计学意义,说明L-TLE患者在注意力、短时记忆力、反应能力上较对照组差。研究结果与既往研究相同,KUCUKBOYACI等[4]在利用词语流畅性研究颞叶癫痫患者任务切换能力中发现,左侧颞叶癫痫及右侧颞叶癫痫的词语流畅性平均分显著低于对照。KELLER等[18]在研究颞叶癫痫患者前额叶皮层及海马体积与执行功能之间关系时,利用了Stroop色词干扰实验评估患者执行功能,该研究主要采用B词卡,发现L-TLE患者实验耗时均高于对照组,该研究还发现颞叶癫痫患者神经功能损害可能由致痫灶扩散所致,背侧前额叶皮质萎缩可能为颞叶癫痫患者执行功能损害原因。
DTI是近年兴起的MRI新技术,主要利用大脑水分子扩散运动的各向异性进行成像,反映活体组织的空间组成信息及病理状态下各组织之间水分子交换状况。在癫痫应用中,可利用DTI检测癫痫患者白质完整性,对癫痫患者致痫灶进行定侧及定位[19];有学者利用fMRI、静息态fMRI及DTI预测难治性癫痫在左侧颞叶切除后的认知功能,结果发现该3种方法均能有效地预测前颞叶切除术后的功能重组和认知结果[20]。在此次研究中,我们利用DTI技术研究了L-TLE患者及HC的脑白质纤维束FA、MD值,并进行比较,发现L-TLE患者在左侧丘脑前辐射、左侧扣带束海马部、胼胝体枕部FA值降低,在左侧丘脑前辐射、双侧扣带束、左侧扣带束海马部、胼胝体额部、双侧钩束MD值升高,而这些在常规MR上却未能发现,且纤维束损害以致痫侧为主,我们推测,其原因可能为L-TLE致痫灶位于左侧,癫痫反复发作导致致痫灶扩散并出现邻近纤维束损害。与既往研究类似,NARENMANDULA等[21]利用DTI研究MRI阴性的颞叶癫痫患者白质完整性与言语记忆功能之间关系,发现与对照组相比,L-TLE患者左海马旁、扣带回、右侧弓状束、左侧穹隆的平均扩散率明显高于对照组,其中右侧穹隆FA和左侧钩束MD与命名性得分显著相关;左穹隆FA与语言延迟记忆分数、非语言延迟记忆分数存在显著相关;左侧钩束MD和语言流利性得分显著相关。在本研究中,还发现患者丘脑前辐射受损,其中StroopC与左侧丘脑前辐射FA值呈负相关,与左侧丘脑前辐射MD值呈正相关,连线B与左侧丘脑前辐射MD值呈正相关,进一步证实前额叶皮质-丘脑通路是探索TLE执行功能障碍机制的重要结构。
钩束为脑白质联合纤维束之一,通过双向单突触通路连接眶额皮质与前颞叶,部分有关癫痫研究的结果显示:钩束可能具有语言记忆和词汇检索功能[22]。亦有研究者认为:钩束对精神行为及情绪障碍有一定的潜在意义[23]。PAPAGND等[24]研究了44例左侧额叶或颞叶胶质瘤切除的患者,发现钩束对术后3个月的语言功能有明显影响,尤其是命名能力,同时对言语流畅性也有一定损害。在本研究中,我们亦发现词语流畅性与左侧钩束有关,进一步表明额颞叶间纤维传导能力下降与执行功能有关。同时,我们还发现左侧扣带束海马部与词语流畅性相关。扣带回是边缘系统的重要组成部分,其内部纤维联系较为复杂,涉及包括注意力、记忆和动机在内的多种认知功能[25]。在有关注意力的研究中,发现在执行有冲突的任务或任务难度增加时,扣带束都有显著的激活[26]。亦有研究证实扣带束完整性可预测慢性轻度创伤性脑损伤患者的认知功能[27]。
综上所述,本研究发现MRI阴性L-TLE患者出现执行功能障碍,并出现脑白质纤维束尤其是额颞叶间纤维束的损害,其损害以致痫侧为主。相关分析显示左侧丘脑前辐射、左扣带束海马部及左侧钩束与执行功能分数呈明显相关性。研究结果进一步为MRI阴性的TLE患者执行功能损害提供了理论依据,同时亦表明L-TLE患者执行功能可能存在左侧偏侧化。
当然,该研究仍有很多不足之处,首先,样本量较少,导致部分结果可能有偏倚。其次,因患者服药种类及剂量不一,故未排除药物对执行功能及影像学改变的影响;最后,仅研究部分白质纤维结构,是否还有更多的脑白质结构受损还需进一步探索。
利益冲突声明 所有作者均声明不存在利益冲突
| [1] |
BLAIR R D G. Temporal lobe epilepsy semiology[J]. Epilepsy Res Treat, 2012, 2012: 1-10. DOI:10.1155/2012/751510 |
| [2] |
BERTOGLIO D, JONCKERS E, ALI I, et al. In vivo measurement of brain network connectivity reflects progression and intrinsic disease severity in a model of temporal lobe epilepsy[J]. Neurobiol Dis, 2019, 127: 45-52. DOI:10.1016/j.nbd.2019.02.012 |
| [3] |
ROCA M, PARR A, THOMPSON R, et al. Executive function and fluid intelligence after frontal lobe lesions[J]. Brain, 2010, 133(Pt 1): 234-247. DOI:10.1093/brain/awp269 |
| [4] |
KUCUKBOYACI N E, GIRARD H M, HAGLER D J Jr, et al. Role of frontotemporal fiber tract integrity in task-switching performance of healthy controls and patients with temporal lobe epilepsy[J]. J Int Neuropsychol Soc, 2012, 18(1): 57-67. DOI:10.1017/S1355617711001391 |
| [5] |
REYES A, KAESTNER E, BAHRAMI N, et al. Cognitive phenotypes in temporal lobe epilepsy are associated with distinct patterns of white matter network abnormalities[J]. Neurology, 2019, 92(17): e1957-e1968. DOI:10.1212/WNL.0000000000007370 |
| [6] |
ZANÃO T A, LOPES T M, DE CAMPOS B M, et al. Patterns of default mode network in temporal lobe epilepsy with and without hippocampal sclerosis[J]. Epilepsy Behav, 2019, 106523. DOI:10.1016/j.yebeh.2019.106523 |
| [7] |
FILIPPI M, AGOSTA F. Diffusion tensor imaging and functional MRI[J]. Handb Clin Neurol, 2016, 136: 1065-1087. DOI:10.1016/B978-0-444-53486-6.00056-9 |
| [8] |
ENGEL J Jr, International League Against Epilepsy(ILAE). A proposed diagnostic scheme for people with epileptic seizures and with epilepsy: report of the ILAE task force on classification and terminology[J]. Epilepsia, 2001, 42(6): 796-803. DOI:10.1046/j.1528-1157.2001.10401.x |
| [9] |
CUI Z X, ZHONG S Y, XU P F, et al. PANDA: a pipeline toolbox for analyzing brain diffusion images[J]. Front Hum Neurosci, 2013, 7: 42. DOI:10.3389/fnhum.2013.00042 |
| [10] |
SMITH S M, JENKINSON M, JOHANSEN-BERG H, et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data[J]. Neuroimage, 2006, 31(4): 1487-1505. DOI:10.1016/j.neuroimage.2006.02.024 |
| [11] |
SMITH S M, JOHANSEN-BERG H, JENKINSON M, et al. Acquisition and voxelwise analysis of multi-subject diffusion data with tract-based spatial statistics[J]. Nat Protoc, 2007, 2(3): 499-503. DOI:10.1038/nprot.2007.45 |
| [12] |
DIAMOND A. Executive functions[J]. Annu Rev Psychol, 2013, 64: 135-168. DOI:10.1146/annurev-psych-113011-143750 |
| [13] |
EHRLICH T, REYES A, PAUL B M, et al. Beyond depression: The impact of executive functioning on quality of life in patients with temporal lobe epilepsy[J]. Epilepsy Res, 2019, 149: 30-36. DOI:10.1016/j.eplepsyres.2018.11.004 |
| [14] |
SHEA-SHUMSKY N B, SCHOENEBERGER S, GRIGSBY J. Executive functioning as a predictor of stroke rehabilitation outcomes[J]. Clin Neuropsychol, 2019, 33(5): 854-872. DOI:10.1080/13854046.2018.1546905 |
| [15] |
MARTINO J, DE WITT HAMER P C, VERGANI F, et al. Cortex-sparing fiber dissection: an improved method for the study of white matter anatomy in the human brain[J]. J Anat, 2011, 219(4): 531-541. DOI:10.1111/j.1469-7580.2011.01414.x |
| [16] |
HUANG W L, HUANG D H, CHEN Z R, et al. Alterations in the functional connectivity of a verbal working memory-related brain network in patients with left temporal lobe epilepsy[J]. Neurosci Lett, 2015, 602: 6-11. DOI:10.1016/j.neulet.2015.06.031 |
| [17] |
ZHANG C, YANG H Y, QIN W, et al. Characteristics of resting-state functional connectivity in intractable unilateral temporal lobe epilepsy patients with impaired executive control function[J]. Front Hum Neurosci, 2017, 11: 609. DOI:10.3389/fnhum.2017.00609 |
| [18] |
KELLER S S, BAKER G, DOWNES J J, et al. Quantitative MRI of the prefrontal cortex and executive function in patients with temporal lobe epilepsy[J]. Epilepsy Behav, 2009, 15(2): 186-195. DOI:10.1016/j.yebeh.2009.03.005 |
| [19] |
GOUBRAN M, HAMMOND R R, DE RIBAUPIERRE S, et al. Magnetic resonance imaging and histology correlation in the neocortex in temporal lobe epilepsy[J]. Ann Neurol, 2015, 77(2): 237-250. DOI:10.1002/ana.24318 |
| [20] |
OSIPOWICZ K, SPERLING M R, SHARAN A D, et al. Functional MRI, resting state fMRI, and DTI for predicting verbal fluency outcome following resective surgery for temporal lobe epilepsy[J]. J Neurosurg, 2016, 124(4): 929-937. DOI:10.3171/2014.9.JNS131422 |
| [21] |
NARENMANDULA B, ZHOU X J, LI Y C, et al. Effects of white matter microstructure lesions on language and memory function in magnetic resonance imaging-negative temporal lobe epilepsy determined by diffusion tensor imaging[J]. Neurol India, 2016, 64(6): 1233-1242. DOI:10.4103/0028-3886.193839 |
| [22] |
VON DER HEIDE R J, SKIPPER L M, KLOBUSICKY E, et al. Dissecting the uncinate fasciculus: disorders, controversies and a hypothesis[J]. Brain, 2013, 136(Pt 6): 1692-1707. DOI:10.1093/brain/awt094 |
| [23] |
BHATIA K, HENDERSON L, YIM M, et al. Diffusion tensor imaging investigation of uncinate fasciculus anatomy in healthy controls: description of a subgenual stem[J]. Neuropsychobiology, 2017, 75(3): 132-140. DOI:10.1159/000485111 |
| [24] |
PAPAGNO C, CASAROTTI A, COMI A, et al. Long-term proper name anomia after removal of the uncinate fasciculus[J]. Brain Struct Funct, 2016, 221(1): 687-694. DOI:10.1007/s00429-014-0920-8 |
| [25] |
BUBB E J, METZLER-BADDELEY C, AGGLETON J P. The cingulum bundle: Anatomy, function, and dysfunction[J]. Neurosci Biobehav Rev, 2018, 92: 104-127. DOI:10.1016/j.neubiorev.2018.05.008 |
| [26] |
FANI N, KING T Z, CLENDINEN C, et al. Attentional control abnormalities in posttraumatic stress disorder: Functional, behavioral, and structural correlates[J]. J Affect Disord, 2019, 253: 343-351. DOI:10.1016/j.jad.2019.04.098 |
| [27] |
JANG S H, KIM S H, LEE H D. Traumatic axonal injury of the cingulum in patients with mild traumatic brain injury: a diffusion tensor tractography study[J]. Neural Regen Res, 2019, 14(9): 1556-1561. DOI:10.4103/1673-5374.255977 |



