2. 510000 广州,广州创芯国际生物研究院
2. Guangzhou Accurate International Biological Research Institute, Guangzhou, Guangdong Province, 510000, China
鼻咽癌(nasal pharyngeal cancer, NPC)是一种具有明显地域高发现象、发生在鼻咽的顶部和侧壁、病因与EB病毒(epstein-barr virus, EBV)感染密切相关的人类恶性肿瘤。中国及东南亚发病率高、拉丁美洲次之。在我国,鼻咽癌的发病率也有明显差异性,呈南北高低趋势,以华南地区多见,有着广东癌之称[1]。目前研究表明:Ⅰ、Ⅱ、Ⅲ、Ⅳ期初发鼻咽癌患者,经放疗和化疗综合性治疗后,5年生存率超过70%[2]。尽管如此,仍然有25%的鼻咽癌患者因为局部复发或者远处转移而治疗失败[3]。有研究表明肿瘤干细胞与癌症发生、发展、复发和转移密切相关[4],不仅能够自我更新,并且还具有对传统放化疗的抵抗效应[5-7]。因此,筛选出对鼻咽癌干细胞敏感的化疗药物具有重要意义。
肿瘤类器官是将患者的肿瘤组织进行体外3D立体培养,具有干性潜能的肿瘤细胞会聚集成球生长,从而形成相应器官的类似组织,并具有自我更新和自我组织能力、维持其来源组织的生理结构和功能的特点,能够保留原来肿瘤组织的分子生物学特征[8]。荷兰科学家SATO教授利用患者结肠癌组织,成功培养出世界首例肿瘤类器官——结肠癌类器官,为肿瘤研究做出了里程碑式的贡献,推动了肿瘤精准治疗的进展[9]。与传统2D细胞系和患者来源异种移植(patient-derived xenografts, PDX)相比,类器官具有个体化、组织需求量小、培养周期短、与来源组织差异小的优势,能够快速高通量筛药得出药敏结果,成为肿瘤患者体外筛药的最佳替身[10]。本研究拟探讨建立鼻咽癌类器官培养体系,以期为鼻咽癌基础研究与临床筛药提供新兴的实验模型。
1 材料与方法 1.1 鼻咽癌组织于2018年3-8月取南方医院耳鼻喉科临床标本库中南方医院耳鼻喉科收治的鼻咽癌患者新鲜肿瘤组织标本共10例,其中2例为复发鼻咽癌患者手术肿瘤组织且半年内未接受放化疗,8例初发鼻咽癌门诊活检入标本库的新鲜肿瘤组织,分成两部分,完成类器官培养和病理石蜡切片形态学鉴定。本研究已获得南方医科大学南方医院伦理委员会审批,审批号:[2009]伦审字(05)号。
1.2 试剂主要包括:Ⅳ型胶原酶、DNA酶、透明质酸酶(美国Life Technologies公司),A83-01、Y-27632(美国Sigma-Aldrich公司),Recombinant human FGF10、Recombinant human EGF、Recombinant human HGF、Rsponding-1d等细胞因子(美国Peprotech公司),Matrigel(美国BD公司),Ki67、CD133免疫组化抗体,浓缩型DAB试剂盒,EBER原位杂交试剂盒(北京中杉金桥生物技术有限公司)。
1.3 设备主要包括:3111型二氧化碳培养箱(美国Thermo公司),DL-CJ-1NDII超净台或生物安全柜(北京东联哈尔公司),TAITECPR-12型振荡器(日本TAITEC公司),高压灭菌锅(山东新华医疗),石蜡切片机(德国LEICARM135切片机);CKX-41型倒置显微镜(日本Olympus公司),5702型低速离心机(德国Eppendorf公司),BCD-470WDPG型冰箱(青岛海尔集团)。
1.4 方法 1.4.1 鼻咽癌类器官培养基的配制配制50 mL的鼻咽癌类器官培养基,将1 mL B27、125 μL N-acetyl- l-cysteine、5 μL EGF、2 μL A83-01、50 μL Noggin、50 μL R-spondin 1、50 μL dihydrotestosterone、5 μL FGF10、5 μL人重组HGF及5 μL 100 mmol/L ROCK抑制剂Y-27632混合加入AMDM/F12培养基至50 mL,再加入1 mL双抗。
1.4.2 鼻咽癌组织的取样、消化和培养入组患者门诊喉镜或者手术冷器械切除的鼻咽癌肿瘤组织保存于无菌的组织保存液中(1640培养基加2%双抗混合液),4 ℃保存24 h。鼻咽癌组织在超净台内用含2%双抗的HBSS洗涤3次,称量。将肿瘤组织(>50 mg)用眼科剪剪成约0.3 mm3,加入1 mL消化液Ⅰ(130 mg Ⅳ型胶原酶+15 mg透明质酸酶溶解于100 mL AMDM/F12中配成混合液)富集于15 mL离心管中,37 ℃摇床消化1.5 h。首次消化结束后,1 000 r/min离心3 min,弃上清,加入消化液Ⅱ(500 mg分散酶+10 mg DNase Ⅰ溶解于100 mL AMDM/F12中配成混合液)1 mL消化10 min。第2次消化结束后,用2 mL HBSS终止消化,1 000 r/min离心3 min,去上清后,用2 mL HBSS重悬组织沉淀,并用100 μm滤网过滤。过滤液1 000 r/min离心得到细胞沉淀,弃上清,采用红细胞裂解液重悬细胞沉淀作用2 min,离心去上清,得白色沉淀。取与细胞沉淀等体积的预冷AMDM/F12培养基重悬细胞沉淀,再用移液枪吸取2倍AMDM/F12体积的Matrix胶混合细胞悬液。以30 μL每个胶滴接种于6孔板中,每孔3胶滴。将6孔板倒置于37 ℃培养箱中30 min后,每孔加入2 mL类器官培养基,37 ℃培养箱中培养。显微镜下观察类器官的形成和生长状态,2~3 d换液1次,5 d传代。
1.4.3 鼻咽癌类器官及对应肿瘤组织石蜡切片的制备收集生长5~7 d鼻咽癌类器官,弃去培养基上清,向每孔中加入1 mL 4 ℃ life cell recovery细胞回收液,置于4 ℃摇床消化1 h。用1 mL移液器将所有溶液及类器官回收到15 mL离心管中,轻柔吹打数次,4 ℃ 1 000 r/min离心5 min,弃上清,加入1 mL预冷HBSS清洗细胞沉淀,离心富集鼻咽癌类器官沉淀,类器官来源鼻咽癌组织收集至15 mL离心管,加入1 mL 10%中性福尔马林过夜固定。次日,1 000 r/min 5 min离心富集鼻咽癌类器官沉淀,加200 μL处于液态的Histogel,将沉淀从底部吹起,预包埋鼻咽癌类器官,切忌将沉淀吹散。
1.4.4 HE染色待Histogel凝固后,与对应鼻咽癌肿瘤组织常规包埋、脱水,制成石蜡切片,进行HE染色,镜下观察。
1.4.5 免疫组化染色按免疫组织化学法的试剂盒说明书严格操作,一抗CD133、ki67单克隆抗体工作浓度为1 :1 000,每批染色均设立阴性对照(PBS液代替一抗)。所有切片采用盲法由2名高年资病理科医师进行独立判定。镜下观察,阳性细胞出现棕褐色染色,在显微镜下随机选择10个高倍视野(×400),每个视野统计100个细胞,计算染色阳性的细胞比例,染色阳性率≤25%为阴性,26%~50%为阳性,≥51%为强阳性。
1.4.6 CD44免疫荧光按免疫荧光的试剂盒说明书严格操作,加入一抗小鼠抗CD44单克隆抗体,工作浓度为1 :1 000,4 ℃孵育过夜,PBS冲洗,加入FTTC标记的二抗羊抗兔,37 ℃孵育30 min,DAPI染核5 min,荧光显微镜下观察。
1.4.7 EBER原位杂交染色将切片滴加20 μL杂交液并置于原位杂交仪75 min,转至37 ℃孵育4 h,置于含0.2% SDS浸泡,滴加适量一抗,孵育30 min, 滴加二抗,孵育30 min,滴加HRP聚合物,DAB显色,苏木精复染,酒精脱水,树胶封片,镜下观察。
1.4.8 鼻咽癌类器官药敏试验采用胶滴肿瘤药敏检测技术(collagen gel droplet embedded culture-drug sensitivity test,CD-DST)进行药物敏感性预测试验。试验药物及其工作浓度:卡铂2.0 μg/mL、紫杉醇1 μg/mL、替吉奥2.0 μg/mL、长春瑞滨0.05 μg/mL和吉西他滨8 μg/mL。根据5种化疗药物药代动力学,吉西他滨与类器官接触作用1 h,替吉奥作用144 h,其余3种药物与类器官作用24 h,用PBS洗干净药物,加入新的类器官培养基培养5 d,每孔加入30 μL中性红溶液,于37 ℃培养箱中60 r/min低速振荡2 h。染色结束,移除培养基,加入2 mL PBS洗涤。培养板每孔中加入4 mL 10%中性福尔马林固定45 min后弃除福尔马林,用PBS洗涤,去除水分风干,拍照测光密度值。计算癌细胞存活率(T/C),C为对照光密度,T为受试药光密度,对药物敏感的类器官肿瘤细胞外围会坏死崩解,中性红无法着色,因此T/C越低,受试药敏感越高。参考值:0<T/C≤50%,判为高度敏感;50%<T/C≤60%,判为中度敏感;T/C>60%,判为低度敏感。
2 结果 2.1 鼻咽癌类器官模型的建立入组10例鼻咽癌患者中,2例复发鼻咽癌患者,手术原位取材约5 mm×5 mm,质量分别为300.0、289.6 mg,2例均成功培养成类器官。8例初发鼻咽癌患者门诊喉镜取材,平均质量55.7 mg,成功5例,失败3例(类器官来源鼻咽癌肿瘤组织质量均<50 mg),10例样本培养成功7例,失败3例(表 1)。在Matrix作为生长支架和类器官培养基细胞因子的作用下,鼻咽癌细胞团甚至单个鼻咽癌干细胞能够持续生长分裂。24 h后便可形成实心球状结构,并逐渐长大,形成鼻咽癌特征的3D细胞团(图 1)。此鼻咽癌类器官可持续生长、传代,长期培养时间可超过45 d。
| 患者序号 | 年龄/岁 | 性别 | 分期 | 是否接受化疗 | 分化 | 肿瘤组织质量/mg | 培养成功 |
| P1 | 41 | 男 | T3N2M0 | 否 | 未分化 | 67.1 | 是 |
| P2 | 51 | 男 | T3N2M0 | 否 | 未分化 | 32.1 | 否 |
| P3 | 48 | 女 | T2N2M0 | 否 | 低分化 | 41.0 | 否 |
| P4 | 62 | 男 | T3N3M0 | 否 | 未分化 | 50.2 | 是 |
| P5 | 45 | 女 | T3N2M0 | 否 | 未分化 | 38.1 | 否 |
| P6 | 41 | 女 | T2N2M0 | 否 | 未分化 | 77.3 | 是 |
| P7 | 38 | 女 | T4N2M1 | 否 | 未分化 | 49.6 | 是 |
| P8 | 44 | 男 | T3N2M0 | 否 | 未分化 | 90.1 | 是 |
| P9 | 65 | 男 | rT3N2M0 | 紫杉醇+顺铂 | 未分化 | 300.0 | 是 |
| P10 | 54 | 女 | rT4N2M0 | 紫杉醇+顺铂 | 未分化 | 289.6 | 是 |
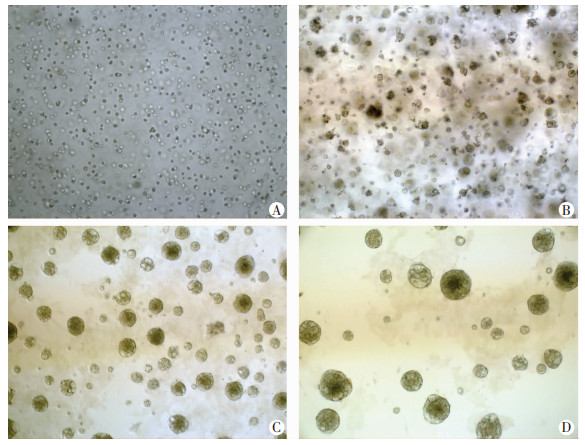
|
| A:第1天;B:第3天;C:第5天;D:第7天 图 1 鼻咽癌类器官的生长过程 (×10) |
2.2 鼻咽癌类器官光镜下的形态特征
共收集10例鼻咽癌肿瘤组织,初治鼻咽癌8例,复发鼻咽癌2例;其中2例低分化鳞癌,其余8例均为未分化非角化性癌。培养成功的鼻咽癌类器官大体形态多数为规则实心圆球,少部分为椭圆形, 极少数为不规则形。鼻咽癌类器官光镜下观察多数较致密,透光度较差。初发鼻咽癌和复发鼻咽癌组织培养的类器官大体形态无明显差异,复发鼻咽癌类器官相对初发鼻咽癌类器官更密集,直径更大(图 2)。
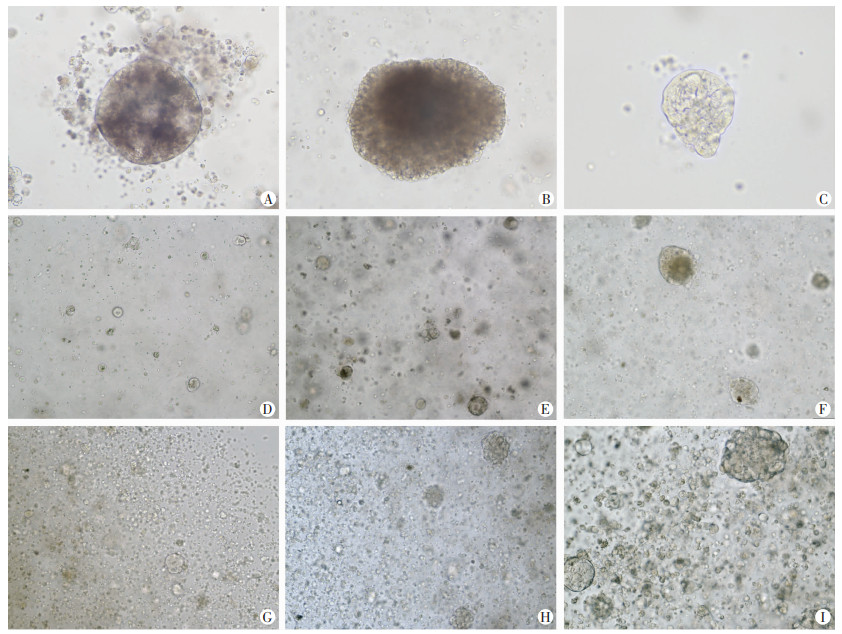
|
| A:圆球形鼻咽癌类器官;B:椭圆形鼻咽癌类器官;C:不规则形鼻咽癌类器官;D:初发鼻咽癌类器官第2天;E:初发鼻咽癌类器官第5天;F:初发鼻咽癌类器官第9天;G:复发鼻咽癌类器官第2天;H:复发鼻咽癌类器官第5天;I:复发鼻咽癌类器官第9天 图 2 鼻咽癌类器官大体形态观察 (×20) |
2.3 鼻咽癌类器官病理学特征与亲本组织的对比
鼻咽癌类器官脱水包埋制成石蜡切片,与类器官来源亲本肿瘤组织的切片同批次做HE染色,染色结果经由2名南方医科大学南方医院病理科主任医师独立阅片判读。鼻咽癌类器官细胞核异型性特征与亲本组织HE染色高度一致,可以从病理学层面判断二者具有同源性(图 3)。
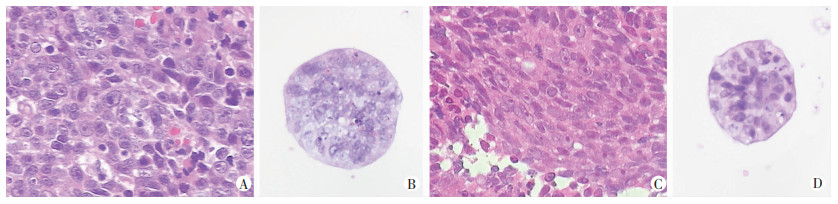
|
| A:P1患者肿瘤组织;B: P1患者肿瘤组织来源鼻咽癌类器官;C:P2患者肿瘤组织;D:P2患者肿瘤组织来源鼻咽癌类器官 图 3 鼻咽癌类器官和亲本肿瘤组织HE染色病理学特征对比 (×40) |
2.4 鼻咽癌类器官免疫组织化学染色观察
鼻咽癌组织CD133呈阳性表达,鼻咽癌类器官CD133免疫组化呈强阳性,提示鼻咽癌类器官可能富集了亲本肿瘤组织中CD133+的鼻咽癌干细胞。鼻咽癌类器官Ki67阳性细胞比例大于50%,表示类器官具有较好的增殖活力(图 4)。
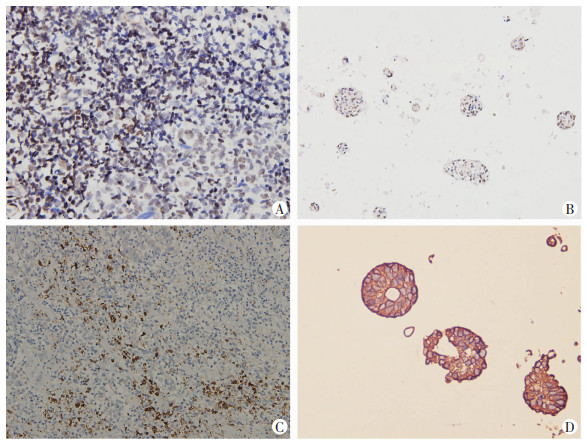
|
| A:亲本肿瘤组织Ki67染色;B:鼻咽癌类器官Ki67免疫组化染色;C:鼻咽癌类器官CD133免疫组化染色;D:鼻咽癌类器官CD133染色 图 4 亲本肿瘤组织与对应类器官Ki67和CD133免疫组化染色 (PV二步法×20) |
2.5 鼻咽癌类器官免疫荧光染色观察
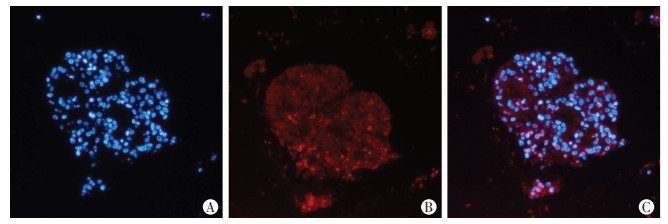
鼻咽癌类器官切片做干细胞标志CD44免疫荧光染色,类器官细胞膜上强表达CD44,鼻咽癌类器官是CD44+的干细胞(图 5)。
|
| A:DAPI;B:CD44;C:Merge 图 5 免疫荧光染色检测干细胞标志CD44表达 (×20) |
2.6 鼻咽癌类器官EBER原位杂交实验
鼻咽癌类器官石蜡切片与来源鼻咽癌组织石蜡切片同时做原位杂交染色,类器官胞核EBER强表达,Ki67染色显示类器官中大部分细胞处于分裂阶段,因此胞浆弱表达。类器官EBER原位杂交染色阳性表达,鼻咽癌类器官可以很好地保留鼻咽癌组织中的EB病毒(图 6)。

|
| A:亲本肿瘤组织;B:鼻咽癌类器官箭头示细胞核 图 6 鼻咽癌组织与鼻咽癌类器官原位杂交染色 (×20) |
2.7 鼻咽癌类器官CD-DST药敏检测
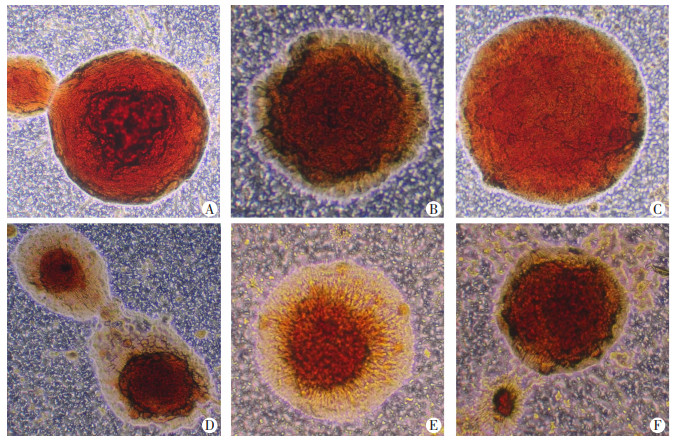
鼻咽癌类器官在吉西他滨、替吉奥、卡铂、紫杉醇和长春瑞滨作用后的体外增殖率变化(存活细胞数/总细胞数),即癌细胞存活率(T/C)变化。该类器官对紫杉醇、长春瑞滨、卡铂高度敏感,对吉西他滨中度敏感,对5-氟尿嘧啶低度敏感(表 2、图 7)。
| 试验药物 | T/C(%) | 判读结果 |
| 吉西他滨 | 50.18±10.36 | 中度敏感 |
| 5-氟尿嘧啶 | 64.18±12.06 | 低度敏感 |
| 卡铂 | 32.17±6.21 | 高度敏感 |
| 紫杉醇 | 22.93±7.12 | 高度敏感 |
| 长春瑞滨 | 44.73±5.23 | 高度敏感 |
|
| A:对照组,不加任何药物;B:与吉西他滨作用的类器官中度敏感;C:与5-氟尿嘧啶作用的类器官低度敏感;D:与卡铂作用的类器官高度敏感;E:与紫杉醇作用的类器官高度敏感;F:与长春瑞滨作用的类器官高度敏感 图 7 鼻咽癌类器官与药物作用反应 |
3 讨论
鼻咽癌发生、发展和转移的研究模型主要是鼻咽癌细胞株和患者来源异种移植(PDX),但两种模型都有较大的局限性。从1955年开始就有学者广泛地研究错误标记细胞的文献,保守估计可能涉及大约3.3万篇用HeLa细胞污染的细胞株得到错误的研究结果[11]。同时,缺乏持续带有EBV的鼻咽癌细胞系是长期困扰EBV和鼻咽癌基础研究领域的问题,并且许多广泛使用的鼻咽癌细胞系最终被鉴定为HeLa细胞的污染[12-13]。更重要的是,这些细胞系经过大量实验室在相同或者不同条件下培养传代了几十年,在遗传和生物学特性上已经发生了很多改变[14]。PDX具有很好的保留亲本肿瘤异质性的优势,但面临移植成功率低、测序通量低、价格高和时间长等短板[15]。
类器官是成体干细胞或肿瘤干细胞能在体外长出有序的3D结构,有望成为提高新药研发效率和提高肿瘤治疗效果的独特的新工具[4, 16-17]。肿瘤干细胞在基质胶的支撑作用下3D立体培养、自我更新、分化组装成类器官,重现来源组织的病理生理学和遗传学特征。因此,类器官最大的优势是可以作为患者肿瘤的化身,能够较好地保留亲本肿瘤的异质性,同时可以高通量筛药,有效预测药物治疗疗效,寻求个体化抗癌疗法[18-20]。2011年,SATO教授团队[9]成功建立培养肿瘤类器官培养体系,培养成功世界第1例结肠癌类器官后引发雪崩效应,肝癌、膀胱癌、前列腺癌、肺癌及宫颈癌等肿瘤类器官相继问世[21-25]。纪念斯隆凯特琳癌症中心培养的前列腺癌类器官与亲本肿瘤组织测序结果高度相似,每个类器官与他们起源的患者癌症基因几乎完全一致[23]。肿瘤类器官可以很好地保留亲本肿瘤组织的基因组学和遗传学特性,从而保留亲本肿瘤的异质性,可以精准预测抗癌药物的疗效,成为患者最佳的体外试药替身[26]。本研究选择门诊和手术鼻咽癌组织,建立鼻咽癌类器官培养体系和类器官筛药平台,为实现鼻咽癌患者的个性化精准治疗提供试验数据。
鼻咽癌干细胞是存在于鼻咽癌组织中的一小部分具有自我更新及多向分化潜能的细胞,对鼻咽癌的发生、发展、转移和复发起着至关重要的作用,可能是放疗、化疗抵抗和免疫治疗失败的根本原因[27-28]。CD133、CD44是公认的肿瘤干细胞标志物,CD44+/CD133+细胞相较于CD44-/CD133-细胞具有强致瘤性[29]。随后研究者在鼻咽癌细胞中分离出了CD133+细胞[30-31],证明了CD133/CD44可作为鼻咽癌干细胞的特异性细胞表面标志物。本研究中鼻咽癌组织石蜡切片CD133免疫组化实验结果显示有小部分CD133阳性的鼻咽癌干细胞。与之对应的鼻咽癌类器官CD133免疫组化表达强阳性,同时,类器官石蜡切片CD44免疫荧光染色显示强阳性。类器官Ki67阳性细胞比例大于细胞总数50%,表明类器官富集了肿瘤组织中的鼻咽癌干细胞并促进了增殖,维持其干性。同时,EB病毒可以通过其基因LMP1上调非编码RNA mirR-21激活AKT信号通路促进鼻咽癌细胞向干细胞转化[32]。EB病毒可能是促进鼻咽癌干细胞生成并维持其干性的重要因素之一,因此,建立一个能够持续携带EB病毒的鼻咽癌体外模型是亟待解决的问题。本研究中鼻咽癌类器官EBER原位杂交试验胞核强阳性,可以较完好地保留亲本肿瘤携带EB病毒的特征,成为鼻咽癌基础科研和临床治疗研究完美的模型。精准医疗的首要目标是肿瘤个体化治疗,将肿瘤转化为慢性病,让患者长期携瘤生存,类器官的出现使这个目标的实现成为可能。本研究中入组患者按照指南和病情制定合适临床化疗方案,对应类器官使用同样的药物进行筛药,筛药结果与国际鼻咽癌一线治疗指南以及患者治疗情况基本一致。由此推论,鼻咽癌类器官相比其他体外模型,可能有助于准确和高效地筛选出有疗效的化疗及靶向药物。另一方面,本研究中鼻咽癌类器官不具备血管系统和免疫环境,采用鼻咽癌类器官筛选免疫治疗药物仍存在一定的局限性。
综上所述,鼻咽癌类器官保留了2D细胞株和PDX的优势,弥补了二者的不足。该模型的建立,为鼻咽癌基础研究和临床个体化治疗提供了支撑,促进了鼻咽癌基础研究和临床治疗模式的发展。
| [1] |
ZHOU X Y, ZHAO W L, CHEN Y F, et al. Patient-derived tumor models for human nasopharyngeal carcinoma[J]. Enzymes, 2019, 46: 81-96. DOI:10.1016/bs.enz.2019.08.007 |
| [2] |
SUN X M, SU S F, CHEN C Y, et al. Long-term outcomes of intensity-modulated radiotherapy for 868 patients with nasopharyngeal carcinoma: an analysis of survival and treatment toxicities[J]. Radiother Oncol, 2014, 110(3): 398-403. DOI:10.1016/j.radonc.2013.10.020 |
| [3] |
CHUNG A K, OUYANG C N, LIU H, et al. Targeted sequencing of cancer-related genes in nasopharyngeal carcinoma identifies mutations in the TGF-β pathway[J]. Cancer Med, 2019, 8(11): 5116-5127. DOI:10.1002/cam4.2429 |
| [4] |
TIRINO V, DESIDERIO V, PAINO F, et al. Cancer stem cells in solid tumors: an overview and new approaches for their isolation and characterization[J]. FASEB J, 2013, 27(1): 13-24. DOI:10.1096/fj.12-218222 |
| [5] |
BAO S D, WU Q L, MCLENDON R E, et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response[J]. Nature, 2006, 444(7120): 756-760. DOI:10.1038/nature05236 |
| [6] |
EYLER C E, RICH J N. Survival of the fittest: cancer stem cells in therapeutic resistance and angiogenesis[J]. J Clin Oncol, 2008, 26(17): 2839-2845. DOI:10.1200/JCO.2007.15.1829 |
| [7] |
XIE P, YANG J P, CAO Y, et al. Promoting tumorigenesis in nasopharyngeal carcinoma, NEDD8 serves as a potential theranostic target[J]. Cell Death Dis, 2017, 8(6): e2834. DOI:10.1038/cddis.2017.195 |
| [8] |
COCOLA C, MOLGORA S, PISCITELLI E, et al. FGF2 and EGF are required for self-renewal and organoid formation of canine normal and tumor breast stem cells[J]. J Cell Biochem, 2017, 118(3): 570-584. DOI:10.1002/jcb.25737 |
| [9] |
SATO T, STANGE D E, FERRANTE M, et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium[J]. Gastroenterology, 2011, 141(5): 1762-1772. DOI:10.1053/j.gastro.2011.07.050 |
| [10] |
HOUR F Q, MOGHADAM A J, SHAKERI-ZADEH A, et al. Magnetic targeted delivery of the SPIONs-labeled mesenchymal stem cells derived from human Wharton's jelly in Alzheimer's rat models[J]. J Control Release, 2020, 321: 430-441. DOI:10.1016/j.jconrel.2020.02.035 |
| [11] |
HORBACH S P J M, HALFFMAN W. The ghosts of HeLa: How cell line misidentification contaminates the scientific literature[J]. PLoS ONE, 2017, 12(10): e0186281. DOI:10.1371/journal.pone.0186281 |
| [12] |
CHAN S Y, CHOY K W, TSAO S W, et al. Authentication of nasopharyngeal carcinoma tumor lines[J]. Int J Cancer, 2008, 122(9): 2169-2171. DOI:10.1002/ijc.23374 |
| [13] |
STRONG M J, BADDOO M, NANBO A, et al. Comprehensive high-throughput RNA sequencing analysis reveals contamination of multiple nasopharyngeal carcinoma cell lines with HeLa cell genomes[J]. J Virol, 2014, 88(18): 10696-10704. DOI:10.1128/JVI.01457-14 |
| [14] |
SHEN Y, SCHMIDT B U S, KUBITSCHKE H, et al. Detecting heterogeneity in and between breast cancer cell lines[J]. Cancer Converg, 2020, 4(1): 1. DOI:10.1186/s41236-020-0010-1 |
| [15] |
GAO D, CHEN Y. Organoid development in cancer genome discovery[J]. Curr Opin Genet Dev, 2015, 30: 42-48. DOI:10.1016/j.gde.2015.02.007 |
| [16] |
范圣先, 尹健一, 王剑, 等. 结肠类器官的构建与应用研究进展[J]. 中华胃肠外科杂志, 2019, 22(11): 1095-1100. FAN S X, YIN J Y, WANG J, et al. New frontiers in the establishment and application of colonic organoids[J]. Chin J Gastrointest Surg, 2019, 22(11): 1095-1100. DOI:10.3760/cma.j.issn.1671-0274.2019.11.017 |
| [17] |
FOWLER J L, ANG L T, LOH K M. A critical look: Challenges in differentiating human pluripotent stem cells into desired cell types and organoids[J]. WIREs Dev Biol, 2020, 9: e368. DOI:10.1002/wdev.368 |
| [18] |
HAUSSER J, ALON U. Tumour heterogeneity and the evolutionary trade-offs of cancer[J]. Nat Rev Cancer, 2020, 20(4): 247-257. DOI:10.1038/s41568-020-0241-6 |
| [19] |
WIECHMANN S, MAISONNEUVE P, GREBBIN B M, et al. Conformation-specific inhibitors of activated Ras GTPases reveal limited Ras dependency of patient-derived cancer organoids[J]. J Biol Chem, 2020, 295(14): 4526-4540. DOI:10.1074/jbc.RA119.011025 |
| [20] |
VLACHOGIANNIS G, HEDAYAT S, VATSIOU A, et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers[J]. Science, 2018, 359(6378): 920-926. DOI:10.1126/science.aao2774 |
| [21] |
BROUTIER L, MASTROGIOVANNI G, VERSTEGEN M M, et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening[J]. Nat Med, 2017, 23(12): 1424-1435. DOI:10.1038/nm.4438 |
| [22] |
GAO D, VELA I, SBONER A, et al. Organoid cultures derived from patients with advanced prostate cancer[J]. Cell, 2014, 159(1): 176-187. DOI:10.1016/j.cell.2014.08.016 |
| [23] |
LEE S H, HU W H, MATULAY J T, et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer[J]. Cell, 2018, 173(2): 515-528.e17. DOI:10.1016/j.cell.2018.03.017 |
| [24] |
KIM M, MUN H, SUNG C O, et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening[J]. Nat Commun, 2019, 10(1): 3991. DOI:10.1038/s41467-019-11867-6 |
| [25] |
BORETTO M, MAENHOUDT N, LUO X L, et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening[J]. Nat Cell Biol, 2019, 21(8): 1041-1051. DOI:10.1038/s41556-019-0360-z |
| [26] |
VLACHOGIANNIS G, HEDAYAT S, VATSIOU A, et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers[J]. Science, 2018, 359(6378): 920-926. DOI:10.1126/science.aao2774 |
| [27] |
TIRINO V, DESIDERIO V, PAINO F, et al. Cancer stem cells in solid tumors: an overview and new approaches for their isolation and characterization[J]. FASEB J, 2013, 27(1): 13-24. DOI:10.1096/fj.12-218222 |
| [28] |
MANNELLI G, GALLO O. Cancer stem cells hypothesis and stem cells in head and neck cancers[J]. Cancer Treat Rev, 2012, 38(5): 515-539. DOI:10.1016/j.ctrv.2011.11.007 |
| [29] |
DAHLROT R H. The prognostic value of clinical factors and cancer stem cell-related markers in gliomas[J]. Dan Med J, 2014, 61(10): B4944. |
| [30] |
ZHUANG H W, MO T T, HOU W J, et al. Biological charac- teristics of CD133(+) cells in nasopharyngeal carcinoma[J]. Oncol Rep, 2013, 30(1): 57-63. DOI:10.3892/or.2013.2408 |
| [31] |
JIANG Q P, ZHANG Q B, WANG S, et al. A fraction of CD133+ CNE2 cells is made of giant cancer cells with morphological evidence of asymmetric mitosis[J]. J Cancer, 2015, 6(12): 1236-1244. DOI:10.7150/jca.12626 |
| [32] |
YANG C F, YANG G D, HUANG T J, et al. EB-virus latent membrane protein 1 potentiates the stemness of nasopharyngeal carcinoma via preferential activation of PI3K/AKT pathway by a positive feedback loop[J]. Oncogene, 2016, 35(26): 3419-3431. DOI:10.1038/onc.2015.402 |



