垂体腺瘤占颅内肿瘤的10%~15%,分为功能性腺瘤和非功能性腺瘤。生长激素瘤是功能性垂体腺瘤之一,常常引起肢端肥大症,主要以血浆高水平生长激素(growth hormone, GH)和胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)以及体貌改变为特征[1]。垂体腺瘤的神经精神异常的研究源于19世纪。到20世纪时,瑞士的两位神经病学家BLEULER和BLICKENSTORFER通过对肢端肥大症与库欣综合征患者不同形式人格的研究,将这类神经精神疾病命名为“内分泌精神综合征”[2]。但随后的报道很少,极少研究分析了垂体腺瘤和激素过多患者的人格和精神病理学。近年来,有研究发现垂体腺瘤患者常伴有神经精神异常,其中63%的肢端肥大症患者具有神经精神障碍,主要与抑郁症有关[3]。尽管经过长期的治疗,仍会持续性地影响患者的生活质量。对抑郁症患者脑部结构的研究发现:大脑灰质的改变是抑郁症的发病机制之一,其中灰质厚度改变的研究较多,许多脑区灰质厚度变薄与抑制症密切相关[4]。但肢端肥大症患者大脑灰质厚度是否有改变,这些改变是否与抑郁症有关,目前还不清楚。
准确的大脑结构分析依赖于数据的获取方案与分析方法,目前多采用磁共振图像自动分析法,既避免了高强度的人工劳作,同时也避免了人为因素的影响,所得结果可重复性高。软件自动分析常用的是基于体素的形态学分析法和基于皮层表面的分析方法。灰质厚度的测量常采用高分辨率磁共振图像(3D-T1 SPGR),运用软件基于脑表面分析方法重建脑结构图,可清楚显示灰质白质以及脑区分割[5]。本研究应用Freesurfer软件的脑表面分析法研究肢端肥大症患者是否存在脑灰质厚度差异,这些差异是否与年龄、GH和IGF-1激素高低以及抑郁症程度相关。阐明这些问题有益于临床医师深入了解肢端肥大症引起的大脑结构改变以及相关抑郁表现的病因,在临床上制定相应的治疗策略和干预措施。
1 资料与方法 1.1 病例搜集收集2015年1月27日至2019年6月30日我科诊断为肢端肥大症的患者和体检科健康对照各30例。肢端肥大症患者纳入标准为:①符合肢端肥大症诊断标准,无生长抑素或其他药物治疗史;②无其他神经系统和其他可影响中枢神经系统疾病;③无酒精和药物依赖史,无长期使用影响中枢神经系统药物史;④无磁共振检查禁忌证。收集患者年龄、性别、血液激素水平、汉密尔顿抑郁量表(Hamilton Depression Scale, HAMD)评分等临床资料,以及术前磁共振3D T1-SPGR薄层扫描图像。研究获得本院伦理委员会批准(2018-研第049-02)。
1.2 图像采集与处理使用General Electrics 3.0T磁共振,采用3D T1- SPGR序列扫描,参数为:TR=800 ms,TE=50 ms,NEX=2,翻转角:8°,视野240 mm×240 mm,矩阵256×256,层厚1.2 mm,共采集轴位图像144~170层,扫描时间7.05 min。通过两名影像医师确定脑实质内无器质性病变。采用Freesurfer 6.0软件(http://surfer.nmr.mgh.harvard.edu/),详细的方法和技术按照文献[6]进行。首先矫正头动伪影,去除头皮颅骨等组织,基于信号强度和几何信息自动分割软脑膜,灰质与白质,将三角表面镶嵌应用于每一个大脑半球,每侧大脑半球皮层被分割为34个解剖区,灰质厚度为软脑膜到灰/白质交界的最短距离,皮层图谱由每一个区域的平均厚度值构成,并用10的高斯核平滑。
1.3 统计学分析利用Freesurfer软件6.0一般线性模型(general linear model,GLM),运用错误发现率方法进行多重比较矫正,比较肢端肥大症与健康对照组之间的灰质厚度差异。运用GraphPad 7.0软件分析灰质厚度与年龄、GH、IGF-1激素水平和抑郁症HAMD评分的相关性,以及HAMD评分与GH和IGF-1水平的相关性。P < 0.05被认为差异具有统计学意义。
2 结果 2.1 临床资料肢端肥大症患者中男性18例,女性12例,年龄为19~59(43±11)岁;HAMD评分为5~42(23±12)分,其中诊断为严重抑郁症患者占20%,抑郁症患者34%,可能抑郁症患者36%,无抑郁症患者10%;GH值:4.11~55.00 (28±17)μg/L,IGF-1值:368~1 345 (647±348)ng/mL;健康对照组中男性18例,女性12例,年龄为20~61(44±8)岁,HAMD评分为4~12(8±3)分。
2.2 灰质厚度分析与健康对照比较,肢端肥大症患者灰质厚度存在明显异常,其中右侧额中回下部、右侧额中回上部、右侧中央前回、右侧缘上回、右侧楔前叶、右侧海马旁回、右侧梭状回和左侧内嗅皮层灰质厚度减低(P < 0.01,图 1、2,表 1)。
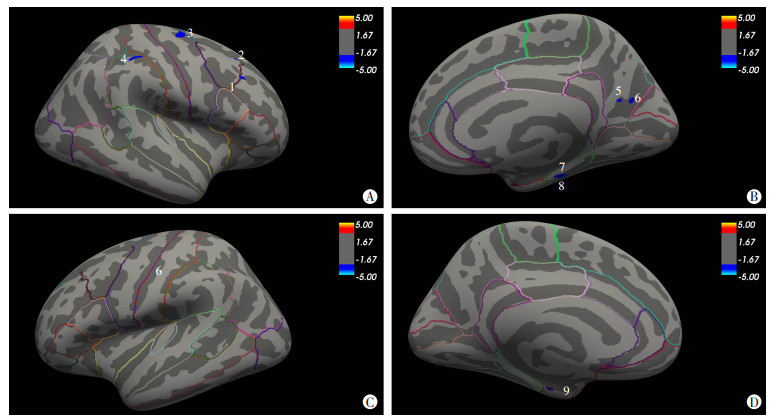
|
| A:右侧大脑半球外侧;B:右侧大脑半球内侧;C:左侧大脑半球外侧;D:左侧大脑半球内侧数字代表灰质厚度有差异的脑区;1:右侧额中回下部;2:右侧额中回上部;3:右侧中央前回;4:右侧缘上回;5、6:右侧楔前叶;7:右侧海马旁回;8:右侧梭状回;9:左侧内嗅皮层;图中彩色指示条为P值的负对数值,值越小差异越明显,红色代表灰质厚度无明显变化,蓝色代表灰质厚度明显减低(P < 0.01) 图 1 肢端肥大症患者灰质厚度减低脑区汇总投射图 |

|
| A:右侧大脑半球;B:背面观双侧大脑半球;C:左侧大脑半球数字表示差异显著脑区;红色区域体积大小代表灰质变薄区cluster的面积大小;1:右侧额中回下部;2:右侧额中回上部;3:右侧中央前回;4:右侧缘上回;5、6:右侧楔前叶;7:右侧海马旁回;8:右侧梭状回;9:左侧内嗅皮层 图 2 肢端肥大症患者灰质厚度减低脑区面积示意图 |
| 编号 | 脑区 | Talairach坐标/mm | -log(P)值 | Cluster/mm2 | ||
| X | Y | Z | ||||
| 1 | 右侧额中回下部 | 40.5 | 24.9 | 34.1 | 2.8 | 32 |
| 2 | 右侧额中回上部 | 27.5 | 21.0 | 42.7 | 2.7 | 28 |
| 3 | 右侧中央前回 | 24.5 | -11.0 | 63.1 | 3.4 | 90 |
| 4 | 右侧缘上回 | 44.5 | -32.6 | 39.8 | 3.2 | 135 |
| 5 | 右侧楔前叶 | 22.8 | -61.1 | 23.3 | 2.7 | 30 |
| 6 | 右侧楔前叶 | 11.1 | -58.1 | 22.5 | 2.8 | 38 |
| 7 | 右侧海马旁回 | 32.5 | -24.7 | -22.4 | 2.5 | 70 |
| 8 | 右侧梭状回 | 37.5 | -26.6 | -22.7 | 2.7 | 62 |
| 9 | 左侧内嗅皮层 | -20.4 | -13.1 | -27.3 | 3.9 | 35 |
2.3 肢端肥大症灰质变薄脑区与临床资料相关性分析
相关性分析结果显示:右侧楔前叶和右侧海马旁回灰质厚度变化与年龄无相关性(r < 0.01,P=0.898; r=0.02, P=0.447)(图 3A、4A);右侧楔前叶和右侧海马旁回灰质厚度变薄与GH激素水平呈负相关(r=-0.32, P=0.001;r=-0.26, P=0.003)(图 3B、4B),与IGF-1水平呈负相关(r=-0.17, P=0.026;r=-0.20, P=0.013)(图 3C、4C)。进一步分析显示:右侧楔前叶和右侧海马旁回灰质厚度变薄与抑郁症HAMD评分呈负相关(r=-0.23, P=0.007;r=-0.18, P=0.018) (图 5),而且抑郁症HAMD评分与GH和IGF-1水平呈正相关(r=0.26, P=0.004;r=0.29, P=0.002)(图 6)。其他与健康对照组比较有差异脑区和临床资料的相关性分析差异均无统计学意义。
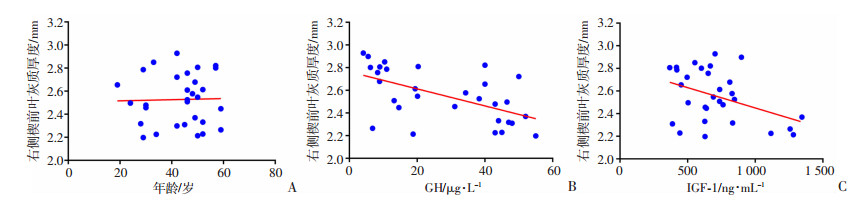
|
| A:右侧楔前叶灰质厚度与年龄无相关性(r < 0.01,P=0.898);B:右侧楔前叶灰质厚度与GH水平呈负相关(r=-0.32,P=0.001);C:右侧楔前叶灰质厚度与IGF-1水平呈负相关(r=-0.17,P=0.026) 图 3 肢端肥大症患者右侧楔前叶灰质厚度与年龄、GH和IGF-1水平的相关性 |
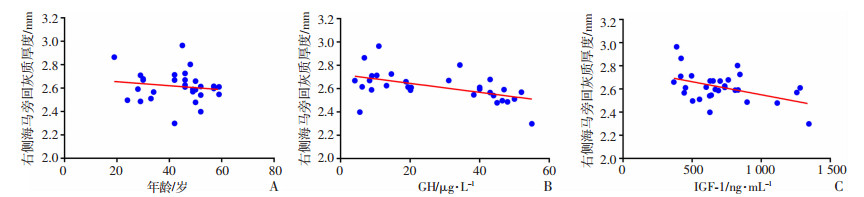
|
| A:右侧海马旁回灰质厚度与年龄无相关性(r=0.02,P=0.45);B:右侧海马旁回灰质厚度与GH水平呈负相关(r=-0.26,P=0.003);C:右侧海马旁回灰质厚度与IGF-1呈负相关(r=-0.20,P=0.013) 图 4 肢端肥大症患者右侧海马旁回灰质厚度减低与年龄、GH和IGF-1水平的相关性 |
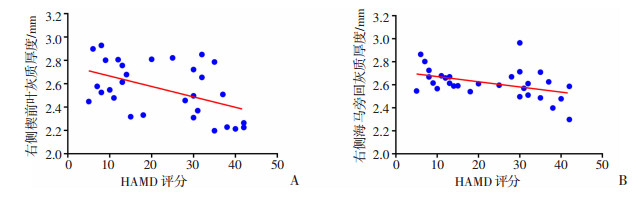
|
| A:右侧楔前叶灰质厚度与HAMD评分呈负相关(r=-0.23, P=0.007);B:右侧海马旁回灰质厚度与HAMD评分呈负相关(r=-0.18,P=0.018) 图 5 肢端肥大症患者右侧楔前叶和右侧海马旁回灰质厚度与HAMD评分的相关性 |

|
| A:HAMD评分与GH水平呈正相关(r=0.26, P=0.004);B:HAMD评分与IGF-1水平呈正相关(r=0.29,P=0.002) 图 6 肢端肥大症患者HAMD评分与GH和IGF-1的相关性 |
3 讨论
肢端肥大症常常是垂体生长激素腺瘤的并发症,大多数患者存在神经精神异常,其中以抑郁症为主。本研究结果显示:肢端肥大症患者灰质厚度与健康对照比较存在差异,主要表现为右侧额中回下部、右侧额中回上部、右侧中央前回、右侧缘上回、右侧楔前叶、右侧海马旁回、右侧梭状回和左侧内嗅皮层灰质厚度变薄;进一步分析显示:右侧楔前叶和海马旁回灰质厚度的改变与GH和IGF-1激素水平也呈负相关, 同时与肢端肥大症抑郁症评分呈负相关,表明肢端肥大症可能通过高水平的GH和IGF-1激素改变大脑结构,而右侧楔前叶和海马旁回灰质厚度的变薄与患者出现抑郁症表现有关。
肢端肥大症患者的脑结构磁共振研究显示全灰质和白质体积增加,而具体的灰质改变目前缺乏报道[7]。但从抑郁症患者的脑结构研究发现:抑郁症患者灰质厚薄的改变存在不一致性,不同年龄首发的抑郁症患者,不同脑区灰质厚度的改变不一致。有研究以25岁为分界,将其分为早发性抑郁和晚发性抑郁,早发性抑郁患者常以扣带回、海马旁回、楔前叶、舌状叶和梭状叶的增厚为主[8-9]。也有研究表明家族性抑郁症患者的右侧海马旁回和梭状回变薄[10]。本研究发现右侧海马旁回和右侧楔前叶灰质厚度存在异常,但并非灰质厚度增厚而是变薄。楔前叶被认为是压力相关脑区,是青少年抑郁的一个潜在生物学标记,而且诱发抑郁的核心机制是压力引起的生理和认知变化[11]。肢端肥大症患者体貌特征的巨大变化可能使患者楔前叶皮层发生异常改变,致使患者生理和心理产生异常。为了排除年龄的影响,本研究做了相关性分析,结果表明右侧海马旁回和右侧楔前叶灰质厚度的变化与年龄趋势无关。因此,我们认为肢端肥大症引起海马旁回和楔前叶灰质厚度变薄是肢端肥大症相关抑郁的特有诱因,具体的机制还有待进一步研究阐明。
肢端肥大症常以体貌特征改变和血液高GH激素水平为特征,其中63%的患者伴有神经精神异常,这可能与激素分泌过多有关。有研究显示体内GH激素下降后, 神经精神异常的临床症状有所改善。与此同时GH激素缺乏也能导致神经精神异常。进一步的研究显示高水平的IGF-1也与抑郁首发有关,作者认为是脑损害后的补偿机制[12]。但也有研究表明肢端肥大症相关性抑郁和焦虑似乎与GH和IGF-1的分泌水平无关[3]。长期治疗的肢端肥大症患者表现出更明显的精神病理学特征和适应不良的人格特征,表明GH激素分泌过多已经造成了不可逆的神经精神改变[3]。最近的研究显示:高水平IGF-1与抑郁症和老年痴呆性抑郁呈正相关[13-14]。本研究结果显示:HAMD抑郁评分与GH和IGF-1的血液水平呈正相关,支持上述观点。因此,我们认为长期高水平GH和IGF-1可能是抑郁症的诱发因素,并且长期、持久地改变了脑组织结构。有研究证实即使肢端肥大症患者GH激素的生化指标得到控制,患者的精神健康依然不能完全恢复正常, 这和我们的观点相吻合[15]。
GH和IGF-1激素在脑的发育、髓鞘化、神经发生和可塑性方面有着重要作用,具有促进神经生长的作用,被认为具有神经生长因子相似的营养神经和保护神经的功能,在神经退行性疾病中有改善症状、提高患者生存质量的作用[16]。但是,这些只是短期GH激素的作用效果,长期暴露于高水平GH和IGF-1激素环境,神经系统以及神经细胞的改变情况尚不清楚。有研究显示高水平GH和IGF-1可明显改变脑组织的结构和功能,引起脑功能的损伤[17]。GH受体广泛分布于大脑灰质,然而IGF-1受体仅分布于海马旁回和前额叶皮层等。这两个激素不仅能导致患者器官肥大、面部形象改变、关节病、糖尿病以及高血压,也能使患者神经精神受损,常表现为注意力、信息处理速度、预警、视觉和语言记忆、执行功能以及决策执行能力受损。目前推测肢端肥大症患者神经精神受损可能与GH和IGF-1的高分泌明显相关。在认知功能方面,有研究表明端肥大症治疗后得到明显改善,也有研究得出相反的结论,指出肢端肥大症治愈后,患者并未得到认知功能的改善,说明长期暴露于高水平GH和IGF-1可能已经引起脑结构的长期改变[2, 18]。结构磁共振研究表明:肢端肥大症患者脑总灰/白质体积明显增加发生于激素过多的起初10年,并且侧脑室变小,女性和放射治疗被认为是神经精神异常的影响因素,其中神经精神异常主要表现为抑郁和焦虑[3]。但是,肢端肥大症患者各个脑区的具体变化,以及这些变化与肢端肥大症相关抑郁症的关系尚不明确。本研究发现血液GH和IGF-1水平与右侧海马旁回和右侧楔前叶灰质厚度变化呈负相关,并且与HAMD抑郁评分呈正相关,与以前抑郁症的相关研究观点[10, 13]吻合。
综上所述,肢端肥大症患者存在多个脑区灰质厚度变薄,并且右侧楔前叶和右侧海马旁回灰质的厚度与抑郁程度评分、GH和IGF-1水平呈负相关,加之有研究表明肢端肥大症引起的脑结构变化可能长期存在[2, 18],提示肢端肥大症引起的右侧楔前叶和右侧海马旁回灰质厚度变薄可能是肢端肥大症相关抑郁的病因。但本研究样本量较少,需要进一步扩大样本去验证上述发现。
| [1] |
ALSUMALI A, COTE D J, REGESTEIN Q R, et al. The impact of transsphenoidal surgery on neurocognitive function: a systematic review[J]. J Clin Neurosci, 2017, 42: 1-6. DOI:10.1016/j.jocn.2017.01.015 |
| [2] |
SIEVERS C, DIMOPOULOU C, PFISTER H, et al. Prevalence of mental disorders in acromegaly: a cross-sectional study in 81 acromegalic patients[J]. Clin Endocrinol (Oxf), 2009, 71(5): 691-701. DOI:10.1111/j.1365-2265.2009.03555.x |
| [3] |
PERTICHETTI M, SERIOLI S, BELOTTI F, et al. Pituitary adenomas and neuropsychological status: a systematic literature review[J]. Neurosurg Rev, 2019. DOI:10.1007/s10143-019-01134-z |
| [4] |
SCHMAAL L, HIBAR D P, SÄMANN P G, et al. Cortical abnormalities in adults and adolescents with major depression based on brain scans from 20 cohorts worldwide in the Enigma Major Depressive Disorder Working Group[J]. Mol Psychiatry, 2017, 22(6): 900-909. DOI:10.1038/mp.2016.60 |
| [5] |
FISCHL B, SALAT D H, BUSA E, et al. Whole brain segmentation: automated labeling of neuroanatomical structures in the human brain[J]. Neuron, 2002, 33(3): 341-355. DOI:10.1016/s0896-6273(02)00569-x |
| [6] |
FISCHL B, DALE A M. Measuring the thickness of the human cerebral cortex from magnetic resonance images[J]. Proc Natl Acad Sci USA, 2000, 97(20): 11050-11055. DOI:10.1073/pnas.200033797 |
| [7] |
SIEVERS C, SÄMANN P G, DOSE T, et al. Macroscopic brain architecture changes and white matter pathology in acromegaly: a clinicoradiological study[J]. Pituitary, 2009, 12(3): 177-185. DOI:10.1007/s11102-008-0143-1 |
| [8] |
JAWORSKA N, MACMASTER F P, GAXIOLA I, et al. A preliminary study of the influence of age of onset and childhood trauma on cortical thickness in major depressive disorder[J]. Biomed Res Int, 2014, 2014: 410472. DOI:10.1155/2014/410472 |
| [9] |
TRUONG W, MINUZZI L, SOARES C N, et al. Changes in cortical thickness across the lifespan in major depressive disorder[J]. Psychiatry Res, 2013, 214(3): 204-211. DOI:10.1016/j.pscychresns.2013.09.003 |
| [10] |
PAPMEYER M, GILES S, SUSSMANN J E, et al. Cortical thickness in individuals at high familial risk of mood disorders as they develop major depressive disorder[J]. Biol Psychiatry, 2015, 78(1): 58-66. DOI:10.1016/j.biopsych.2014.10.018 |
| [11] |
BARTLETT E A, KLEIN D N, LI K Q, et al. Depression severity over 27 months in adolescent girls is predicted by stress-linked cortical morphology[J]. Biol Psychiatry, 2019, 86(10): 769-778. DOI:10.1016/j.biopsych.2019.04.027 |
| [12] |
KOPCZAK A, STALLA G K, UHR M, et al. IGF-I in major depression and antidepressant treatment response[J]. Eur Neuropsychopharmacol, 2015, 25(6): 864-872. DOI:10.1016/j.euroneuro.2014.12.013 |
| [13] |
BOT M, MILANESCHI Y, PENNINX B W, et al. Plasma insulin-like growth factor I levels are higher in depressive and anxiety disorders, but lower in antidepressant medication users[J]. Psychoneuroendocrinology, 2016, 68: 148-155. DOI:10.1016/j.psyneuen.2016.02.028 |
| [14] |
FRANZ B, BUYSSE D J, CHERRY C R, et al. Insulin-like growth factor 1 and growth hormone binding protein in depression: a preliminary communication[J]. J Psychiatr Res, 1999, 33(2): 121-127. DOI:10.1016/s0022-3956(98)00066-1 |
| [15] |
GERAEDTS V J, DIMOPOULOU C, AUER M, et al. Health outcomes in acromegaly: depression and anxiety are promising targets for improving reduced quality of life[J]. Front Endocrinol (Lausanne), 2014, 5: 229. DOI:10.3389/fendo.2014.00229 |
| [16] |
BARCELÓ P, NICOLAU C, GAMUNDÍ A, et al. Comparing the behavioural effects of exogenous growth hormone and melatonin in young and old wistar rats[J]. Oxid Med Cell Longev, 2016, 2016: 5863402. DOI:10.1155/2016/5863402 |
| [17] |
ASHPOLE N M, SANDERS J E, HODGES E L, et al. Growth hormone, insulin-like growth factor-1 and the aging brain[J]. Exp Gerontol, 2015, 68: 76-81. DOI:10.1016/j.exger.2014.10.002 |
| [18] |
ROSÉN T, WIRÉN L, WILHELMSEN L, et al. Decreased psychological well-being in adult patients with growth hormone deficiency[J]. Clin Endocrinol (Oxf), 1994, 40(1): 111-116. DOI:10.1111/j.1365-2265.1994.tb02452.x |



