宫腔粘连(intrauterine adhesions, IUA)又称Asherman综合征,是由于子宫内膜基底层受损导致子宫内膜修复功能障碍,从而引起宫腔形态发生改变的一种疾病[1],也是导致经量减少、甚至闭经及女性不孕症的主要原因之一。目前国内外仍无统一有效治疗宫腔粘连的方案,因此受到妇产科医师广泛关注。课题组前期基础研究得出:人羊膜间充质干细胞(human amniotic mesenchymal stem cells,hAMSCs)移植在治疗SD大鼠宫腔粘连中发挥重要作用[2-3],但是hAMSCs在治疗IUA的过程中具体发挥何种作用,目前尚不清楚。hAMSCs作为间充质来源干细胞,具有多系分化潜能[4]。研究表明许多不同的信号通路在调控干细胞自我更新及定向分化等方面发挥着重要作用,而核因子-κB是一种广泛存在于细胞中的多功能核转录因子,具有广泛的生物活性,可被多种炎症因子触发,对控制细胞生长、分化、细胞凋亡等通路的基因调节也发挥着重要作用,在IUA子宫内膜组织中存在NF-κB通路的异常激活[5-6]。那么NF-κB信号通路在IUA的治疗过程中是否也发挥着重要的作用呢?因此,本研究以NF-κB信号通路为切入点,探讨其在hAMSCs移植治疗宫腔粘连过程中所发挥的作用。
1 材料与方法 1.1 材料 1.1.1 羊膜来源羊膜标本取自于重庆医科大学附属大学城医院及重庆医科大学附属第一医院产科,无传染性疾病及其他基础疾病的正常孕产妇剖宫产分娩的胎盘,已签署知情同意书,无菌条件下分离羊膜。本研究获得重庆医科大学伦理委员会批准(20141230)。
1.1.2 实验动物SPF级健康雌性SD大鼠18只,购自重庆医科大学实验动物中心。体质量220~250 g,每5只1笼,常规喂养。
1.1.3 实验试剂实验所用试剂有:胎牛血清(PAN ES)、DMEM/F12培养液(Gibco公司)、胰蛋白酶(碧云天)、Ⅰ型胶原酶(Sigma公司)、HE及Masson染色试剂盒(北京索莱宝科技有限公司)、免疫组化试剂盒SP9001(中杉金桥)、兔抗鼠IκB-α抗体(Abcam公司)、兔抗鼠Vimentin、P65、E-cadherin(CST公司)、BAY11-7082(碧云天)。逆转录试剂盒、TB green来自TaKaRa公司。PCR引物由上海生物工程有限公司合成。
1.2 方法 1.2.1 hAMSCs分离、提取课题组成员已成功从人羊膜组织中提取出人羊膜间充质干细胞,鉴定结果如下:hAMSCs表面表达CD29、CD90,不表达CD45、HLA-DR,间质标志物波形蛋白阳性表达,不表达上皮标志物角蛋白[2-3]。分离提取步骤如下:无菌条件下制备新鲜羊膜组织,PBS反复冲洗除去残留血液及绒毛膜并将其剪成组织碎块;用与组织等体积的0.05%胰蛋白酶于37 ℃恒温震荡消化30 min,反复2次,含血清培养基终止消化,离心弃上清液;用约为组织体积1.5倍的1 mg/mL Ⅰ型胶原酶37 ℃震荡消化90 min。200目细胞筛过滤,收集滤液,离心、取沉淀,用含10%胎牛血清的DMEM/F12培养基培养,每2~3 d换液1次,细胞融合达80%以上时传代;取第3代细胞备用[3]。
1.2.2 实验分组及建模将18只健康雌性SD大鼠均分为3组,即:Sham组、IUA模型组和hAMSCs组(移植组)。Sham组:不予以特殊处理;IUA模型组及hAMSCs组均参照韩华等方法进行建模:向大鼠腹腔注射10%水合氯醛(3 mL/kg)麻醉,于下腹正中纵行切开,找出“V”形子宫,无齿镊轻夹右侧子宫两端,并沿子宫长轴方向,向宫腔缓慢注入95%乙醇约0.5 mL,5 min后,见子宫呈苍白色,抽出乙醇,生理盐水反复冲洗宫腔[7-8],建立宫腔粘连(IUA)模型;移植组:SD大鼠建模完成1周后,二次开腹,向建模侧(右)宫腔注射200 μL hAMSCs (2×106个/mL)细胞悬液。
1.2.3 组织学染色、图像采集及分析hAMSCs移植4周后处死所有大鼠。均取右侧子宫固定、包埋,作子宫横断面切片,HE、Masson染色及IHC均参考试剂说明书进行操作。HE染色计算子宫内膜腺体个数,Masson染色计算纤维化面积百分比(子宫内膜间质纤维化总面积除以子宫内膜间质和腺体面积之和),镜下观胶原纤维呈蓝色。免疫组化染色检测各组子宫内膜组织中IκB-α、P65、E-cadherin、Vimentin表达量,阳性表达为棕黄色。以Image J软件对图片进行数据测量,每组随机选择3个标本,每张切片随机选择3个高倍视野进行拍照,并取其平均值进行后续比较。
1.2.4 hAMSCs诱导分化取第3代hAMSCs于6孔板中常规培养,待细胞融合达30%~40%时,诱导组培养基更换为含2%FBS的DMEM/F12+(10 ng/mL TGF-β1+10 ng/mL EGF+10 ng/mL PDGF-BB),对照组用2%FBS的DMEM/F12单独培养hAMSCs。隔天换液,连续诱导培养5 d。为进一步确定NF-κB信号通路与hAMSCs诱导分化的关系,在hAMSCs诱导分化培养基中添加入10 nmol/L BAY11-7082(抑制p-IκB-α的降解,抑制剂组),从而非可逆性抑制NF-κB通路的活化,以仅添加生长因子的诱导组作为对照。隔天换液,连续培养5 d。
1.2.5 实时荧光定量PCR比较以上诱导分化实验中各组hAMSCs的IκB-α、CK-7、CK-19 mRNA表达水平。按照细胞RNA提取试剂说明书提取实验组和对照组6孔板中总RNA,分别以IκB-α、CK-7、CK-19为非特异性引物,按照逆转录试剂盒说明书进行逆转录。IκB-α引物序列:上游5′-CTACTGGACGACCGCCACGACAGC-3′,下游5′-CGAGGCGGATCTCCTGCAG-CTCCTTG-3′;CK-7引物序列:上游5′-AGGAGATGGCCAAATGCAGC-3′,下游5′-ATGGCCCGGTTCATCTCTGA-3′;CK-19引物序列:上游5′-CAGGTCAGTGTGGA-GGTGGA-3′,下游5′-CTTCAGTCCGGCTGGTGAAC-3′;GAPDH引物序列:上游5′-GTCCCAGCTTAGGTTCAT-3′,下游5′-ATCTCCACTTTGCCACTG-3′,PCR反应体系:每毛细管反应体系总量为20 μL。PCR反应扩增条件为95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,循环40次;65 ℃终末延伸。以GADPH为内参,根据Ct值计算目的基因:IκB-α、CK-7、CK-19 mRNA表达水平,每个基因设置3个复孔。重复3次。计算各组基因相对表达量2-△△Ct值。
1.3 统计学分析采用SPSS 22.0统计软件处理。计量资料数据以x±s表示。首先进行正态分析及方差齐性检验,两组比较采用独立样本t检验,多组比较采用单因素方差分析,运用LSD法进行各组间多重比较。检验水准α=0.05。
2 结果 2.1 IUA模型的建立和hAMSCs治疗评价Sham组宫腔结构清晰、形态完整,子宫内膜腺体散在分布于黏膜下层和基底层,上皮层连续(图 1A),胶原纤维分布均匀(图 2A);与Sham组比较,IUA模型组宫腔容积明显变窄或消失,上皮细胞层变薄或缺失,间质层厚度变薄,腺体样结构消失(P < 0.05,图 1B、表 1),同时明显可见胶原纤维颜色加深,子宫内膜呈明显纤维化改变(图 2B、表 1);提示成功建立IUA模型。与IUA模型组比较,hAMSCs组宫腔形态基本恢复,明显可见上皮层新生,腺体数目明显增加(P < 0.001,图 1C、表 1),子宫内膜纤维化程度明显减轻(图 2C、表 1)。提示宫腔内移植hAMSCs能有效地促进子宫内膜腺体样结构生长和减轻子宫内膜纤维化程度,从而发挥治疗宫腔粘连的作用。
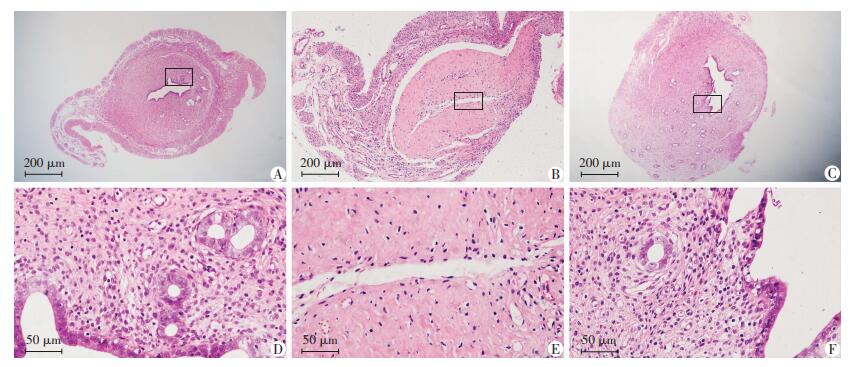
|
| A:Sham组; B:IUA模型组; C:hAMSCs组;D、E、F:分别为A、B、C黑框部分放大 图 1 HE染色观察各组子宫内膜组织中腺体数量变化 |
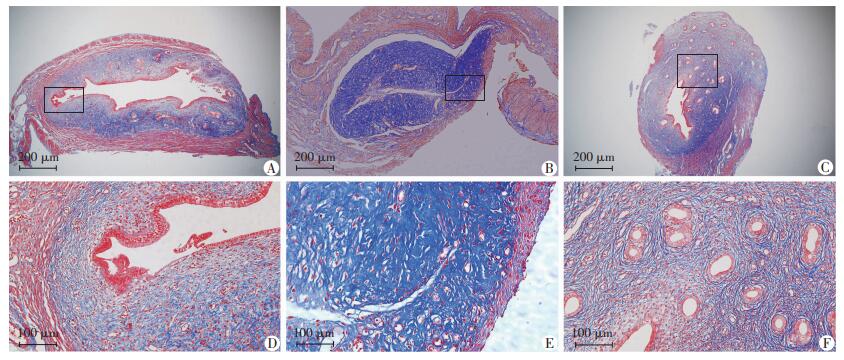
|
| A:Sham组; B:IUA模型组; C:hAMSCs组;D、E、F:分别为A、B、C黑框部分放大 图 2 Masson染色检测各组子宫内膜纤维化面积 |
| 组别 | 腺体数目/个 | 纤维化百分比(%) |
| Sham组 | 6.33±0.33 | 0.40±0.07 |
| IUA模型组 | 0.00±0.00a | 0.71±0.07a |
| hAMSCs组 | 5.11±0.19ab | 0.41±0.06b |
| F值 | 689.091 | 72.364 |
| P值 | < 0.001 | < 0.001 |
| a:P < 0.05, 与Sham组比较;b:P < 0.001, 与IUA模型组比较 | ||
2.2 hAMCSCs移植抑制子宫内膜组织中IκB-α/NF-κB通路激活,Vimentin表达下调,E-cadherin表达上调
对各组子宫内膜组织行免疫组织化学染色,发现IκB-α在Sham组及hAMSCs组子宫内膜间质及上皮细胞的胞质中均有表达,在粘连子宫内膜组织中以间质表达为主;P65在hAMSCs组及正常的子宫内膜组织中,主要在间质部的腺样结构及小血管周围的细胞胞质中表达,而在IUA模型组的子宫内膜组织中以间质部弥漫表达为主,且在细胞核表达量明显增加;E-cadherin主要在上皮细胞表达;Vimentin主要在子宫内膜间质细胞表达(图 3)。与Sham组(正常子宫内膜组织)比较,IUA模型组IκB-α、P65、Vimentin表达均明显增加(P < 0.05,表 2),而E-cadherin表达明显减少(P < 0.001);IUA模型组中P65表达明显增加且向细胞核易位,提示:NF-κB通路激活可能与宫腔粘连的形成有关。与IUA模型组比较,hAMSCs组IκB-α、P65、Vimentin明显下降(P < 0.001,表 2),E-cadherin显著增加(P < 0.001,表 2);hAMSCs组IκB-α、P65、Vimentin、E-cadherin表达与Sham组差异无统计学意义(P>0.05,表 2)。提示hAMSCs移植能抑制子宫内膜组织中NF-κB信号通路的激活,并抑制间质过度增生、促进子宫内膜上皮细胞的生长。
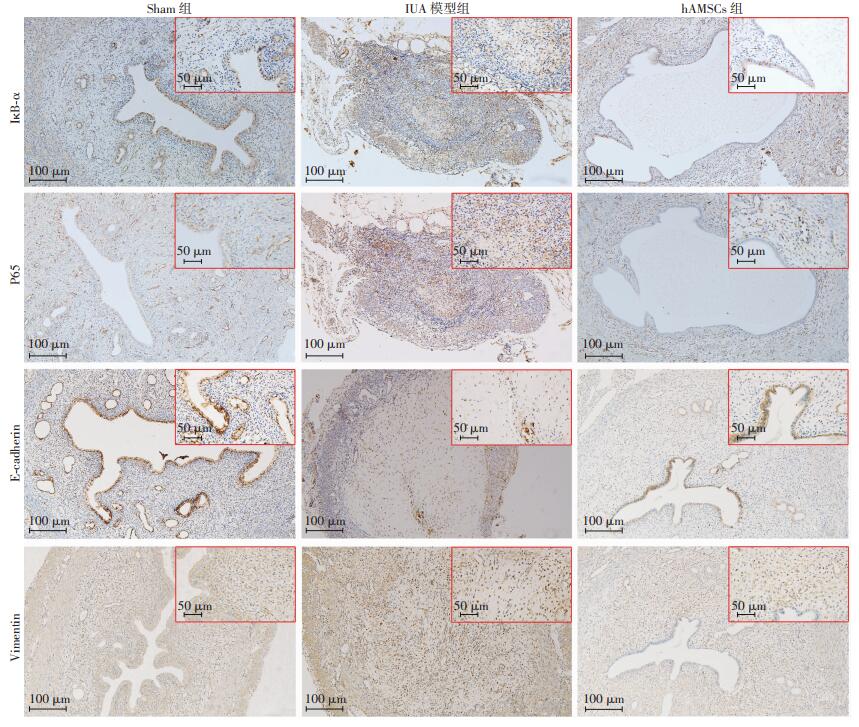
|
| 右上框为局部放大 图 3 免疫组化检测各组子宫内膜组织中IκB-α、P65、E-CAD、VIM的表达 |
| 组别 | IκB-α | P65 | E-cad | VIM |
| Sham组 | 0.24±0.01 | 0.37±0.01 | 0.47±0.09 | 0.24±0.03 |
| IUA模型组 | 0.35±0.01a | 0.44±0.01a | 0.30±0.05a | 0.48±0.04a |
| hAMSCs组 | 0.25±0.01b | 0.37±0.01b | 0.45±0.10b | 0.24±0.03b |
| F值 | 259.847 | 125.159 | 11.272 | 169.287 |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 |
| a:P < 0.05, 与Sham组比较;b:P < 0.001, 与IUA模型组比较 | ||||
2.3 抑制NF-κB信号通路激活促进hAMSCs向子宫内膜上皮细胞分化
于诱导第5天倒置显微镜下观察,诱导组较对照组细胞体积略增大,形态基本相似,均以长梭形为主,分布均匀(图 4A、B);RT-PCR结果显示:与对照组比较,诱导组IκB-α mRNA表达明显减少(P < 0.001),CK-7 mRNA表达明显增加(P < 0.05);CK-19 mRNA表达差异无统计学意义(P>0.05,图 4C)。hAMSCs本身并不表达角蛋白,而诱导组hAMSCs角蛋白mRNA水平明显增加,提示在基因表达水平上,hAMSCs具有向子宫内膜上皮样细胞分化潜能,在此过程中IκB-α mRNA表达下降表明hAMSCs上皮化可能与NF-κB信号通路有关。与诱导组比较,抑制剂组CK-7、CK-19 mRNA表达量明显增加(P < 0.05,图 4D),表明抑制NF-κB信号通路能够促进hAMSCs表达上皮标志物角蛋白,从而推测抑制NF-κB信号通路可能能够促进hAMSCs向子宫内膜上皮样细胞分化。
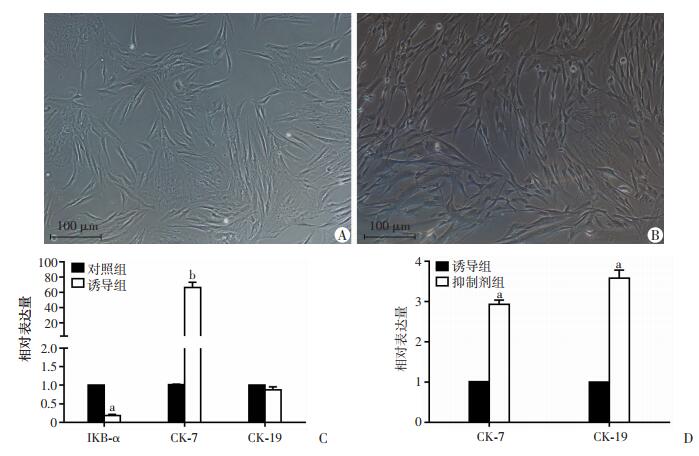
|
| A:对照组间充质细胞形态(×100);B:诱导组间充质细胞形态(×100);C:RT-PCR检测hAMSCs诱导5 d后诱导组和对照组IκB-α、CK-7、CK-19 mRNA表达水平a:P < 0.001,b:P < 0.05, 与对照组比较;D:RT-PCR检测hAMSC经抑制剂处理5 d后,抑制剂组与诱导组(对照)CK-7、CK-19 mRNA相对表达水平a:P < 0.05, 与诱导组比较 图 4 诱导分化后人羊膜间充质干细胞形态学特征及上皮细胞标志物蛋白相对表达水平 |
3 讨论
宫腔粘连是由于创伤、感染等各种原因导致子宫内膜损伤后致使宫腔或(和)宫颈被纤维粘连带完全或部分性封闭,从而引起育龄期妇女月经异常、继发不孕、反复流产等临床症状[1]。针对IUA的发病机制目前尚不明确,有研究者认为,子宫内膜损伤后上皮-间质转化(epithelial-to-mesenchymal transition,EMT)是IUA发病的可能机制之一,间质细胞标志物VIM会随着纤维化程度增加而表达增加[9]。本研究结果显示:模型组较对照组(正常子宫内膜组织中)中腺体数目明显减少,宫腔形态部分或完全消失,间质组织结构紊乱并形成广泛粘连、伴大量胶原纤维沉积,同时子宫内膜组织中E-cad表达下降,VIM表达增加,表明成功建立了SD大鼠宫腔粘连模型。hAMSCs移植后,子宫内膜腺体数目明显增加,子宫内膜纤维化面积百分比显著下降,E-cad表达增加,VIM表达下降,表明hAMSCs具有促进子宫内膜修复的作用。宫腔粘连主要由感染、创伤等引起的子宫基底层受损,存在多种炎症因子如:TNF-α、TGF-β、IL-1、IL-6和NF-κB表达上调[10-11]。研究表明NF-κB信号通路可被多种炎症因子触发,并介导炎症级联效应[12]。表明IUA的形成可能与NF-κB通路激活密切相关。在本研究中模型组(IUA模型组)较对照组中P65表达量明显增加,且可见部分P65易位到细胞核,表明模型组中NF-κB通路被激活。这与文献[5-6,11]报道相符。NF-κB通路被激活一般是由于细胞受到内外刺激,细胞表面受体被激活,导致IKK激酶活化,磷酸化IκB-α,释放NF-κB,活化的NF-κB进入细胞核介导下游靶基因转录。因此,NF-κB通路激活后IκB-α应表达下调,而此研究中IUA模型中IκB-α表达上调可能原因如下:①通路激活后由于P-IκB-α不断降解、NF-κB表达上调,反馈性促进IκB-α表达增加引起;②通路激活是由于外界刺激导致IκB-α总表达水平增加,当IκB-α表达超过一定阈值后自发发生磷酸化降解,激活NF-κB。
NF-κB与肿瘤源性EMT有关已被大量研究证实[13-14],抑制肿瘤细胞NF-κB通路激活则可减少肿瘤细胞的入侵和转移,降低EMT的发生,并增加E-Cadherin表达[15]。本研究中hAMSCs移植后子宫内膜组织中IκB-α、P65表达均下降,且P65主要表达部位以细胞质为主,说明hAMSCs能够有效地抑制子宫内膜组织中NF-κB信号通路的激活。可能是由于hAMSCs移植后,子宫内膜组织中总IκB-α表达下调,降低IκB-α磷酸化机率,抑制P65活化,从而抑制通路激活,与此同时,子宫内膜组织中E-Cadherin表达增加,VIM表达明显下降。可能是由于抑制NF-κB信号通路后,促进了人羊膜间充质干细胞MET的发生,从而引起子宫内膜组织中E-Cadherin表达增加,VIM表达下降。结合在hAMSCs组子宫内膜组织中明显可见上皮细胞生长,且hAMSCs具有多系分化潜能。因此,推测新生的子宫内膜上皮细胞可能是由人羊膜间充质干细胞转化而来。抑制NF-κB通路可能促进人羊膜间充质干细胞向子宫内膜上皮转化。有研究表明生长因子TGF-β、EGF、PDGF-BB等存在于不断更新的上皮组织中,可促进子宫内膜上皮干细胞克隆性生长及促进小鼠骨髓间充质干细胞向子宫内膜上皮细胞的分化[16]。因此,本研究将TGF-β、EGF、PDGF-BB作为外源性诱导因子用于诱导hAMSCs向子宫内膜上皮细胞分化,同时监测hAMSCs诱导分化过程中IκB-α表达变化。于诱导分化第5天,人羊膜间充质干细胞形态学上虽未明显向子宫内膜上皮细胞转变,但RT-PCR结果提示:诱导组角蛋白mRNA水平明显增加。表明hAMSCs在基因转录水平上具有向子宫内膜上皮细胞分化的可能,而hAMSCs在形态学上并没有明显向上皮样细胞转化。表型的改变通常是基因转录,RNA加工、转运,蛋白质翻译后修饰等一系列过程及环境因素共同作用的结果,提示可能需进一步延长诱导时间、优化诱导方案来引起细胞形态学上的改变。在此过程中IκB-α表达下调,说明下调IκB-α表达促进hAMSCs向子宫内膜上皮细胞转化。分析IκB-α表达下调可能原因如下:①通路激活,IκB-α不断发生磷酸化降解,使得总IκB-α表达水平下降;②hAMSCs细胞内总IκB-α表达水平下调,降低IκB-α磷酸化概率,从而抑制通路激活;究竟是激活通路还是抑制通路促进hAMSCs上皮化呢?BAY11-7082与生长因子共培养hAMSCs。RT-PCR检测结果显示:NF-κB通路抑制后角蛋白mRNA表达水平明显增加,提示:抑制NF-κB信号通路的激活能够促进hAMSCs表达上皮标志物角蛋白。推测抑制NF-κB信号通路可能具有促进hAMSCs向子宫内膜上皮细胞分化潜能。综上,说明了人羊膜间充质干细胞具有治疗宫腔粘连的作用,其作用机制可能是通过抑制NF-κB信号通路的激活促进hAMSCs向子宫内膜上皮样细胞分化实现的。
本实验结果表明在特定的诱导培养条件下,人羊膜间充质干细胞在基因表达水平上符合上皮细胞的特征,但是缺乏相关蛋白水平证据支持。拟在接下来的研究中通过蛋白水平验证及进一步通过表达和基因敲除探究NF-κB信号通路在人羊膜间充质干细胞向子宫内膜上皮细胞分化过程中具体作用机制,并进一步通过体内实验观察hAMSCs治疗宫腔粘连后大鼠的受孕率及生育情况,观察hAMSCs治疗的远期效果,为宫腔粘连患者的治愈带来希望。
| [1] |
ASHERMAN J G. Amenorrhoea Traumatica (Atretica)[J]. J Obstet Gynaecol Br Emp, 1948, 55(1): 23-30. DOI:10.1111/j.1471-0528.1948.tb07045.x |
| [2] |
阳媛.羊膜间充质干细胞移植联合雌激素治疗宫腔粘连的动物实验研究[D].重庆: 重庆医科大学, 2018. YANG Y. Human amniotic mesenchymal stem cells transplantation combined with estrogen in the treatment of intrauterine adhesions: a rat experimental study[D]. Chongqing: Chongqing Medical University, 2018. |
| [3] |
毛艳华.羊膜间充质干细胞联合雌激素治疗宫腔粘连的体外实验研究[D].重庆: 重庆医科大学, 2018. MAO Y H. In vitro experimental study of treatment effect of human amniotic mesenchymal stem cells combined with estrogen on intrauterine adhesions[D]. Chongqing: Chongqing Medical University, 2018. |
| [4] |
丛姗, 宋瑾, 张惠娟, 等. 人羊膜间充质干细胞(hAMSCs)的分离、体外培养及诱导分化[J]. 农业生物技术学报, 2015, 23(1): 20-31. CONG S, SONG J, ZHANG H J, et al. Isolation and culture of human amniotic mesenchymal stem cells(hAMSCs) and its differentiation potential in vitro[J]. J Agric Biotechnol, 2015, 23(1): 20-31. DOI:10.3969/j.issn.1674-7968.2015.01.003 |
| [5] |
刘晓丽, 王晶, 陈春林. Smad2、Erk2及NF-kB在宫腔粘连组织中表达的临床研究[J]. 妇产与遗传(电子版), 2017, 7(4): 16-20. LIU X L, WANG J, CHEN C L. The expression of Smad2, Erk2, and NF-κB in endometrium of patient with intrauterine adhesion[J]. Obstet-Gynecol Genet Electron Ed, 2017, 7(4): 16-20. DOI:10.3868/j.issn.2095-1558 |
| [6] |
马娜娜, 王祥珍. 核转录因子κb在宫腔粘连大鼠模型中的表达[J]. 中国计划生育和妇产科, 2014, 6(2): 61-64, 68. MA N N, WANG X Z. The expression of nuclear transcription factor κb in rat model of intrauterine adhesions[J]. Chin J Fam Plan Gynecotokol, 2014, 6(2): 61-64, 68. DOI:10.3969/j.issn.1674-4020 |
| [7] |
韩华, 薛改, 李洁, 等. 宫腔粘连模型大鼠子宫内膜胞饮突发育和整合素β3表达[J]. 现代妇产科进展, 2017, 26(5): 345-348. HAN H, XUE G, LI J, et al. The development of pinopodes and expression of integrin beta 3 in the endometrium of rat model of intrauterine adhesion[J]. Prog Obstet Gynecol, 2017, 26(5): 345-348. DOI:10.13283/j.cnki.xdfckjz.2017.05.007 |
| [8] |
SUN L, ZHANG S W, CHANG Q Y, et al. Establishment and comparison of different intrauterine adhesion modelling procedures in rats[J]. Reprod Fertil Dev, 2019. DOI:10.1071/RD18397 |
| [9] |
LIU X, DUAN H, ZHANG H H, et al. Integrated data set of micrornas and mRNAs involved in severe intrauterine adhesion[J]. Reprod Sci, 2016, 23(10): 1340-1347. DOI:10.1177/1933719116638177 |
| [10] |
SANTAMARIA X, ISAACSON K, SIMÓN C. Asherman's syndrome: it may not be all our fault[J]. Hum Reprod, 2018, 33(8): 1374-1380. DOI:10.1093/humrep/dey232 |
| [11] |
XUE X, CHEN Q, ZHAO G, et al. The overexpression of TGF-β and CCN2 in intrauterine adhesions involves the NF-κB signaling pathway[J]. PLoS ONE, 2015, 10(12): e0146159. DOI:10.1371/journal.pone.0146159 |
| [12] |
LEGLER D F, MICHEAU O, DOUCEY M A, et al. Recruitment of TNF receptor 1 to lipid rafts is essential for TNFα-mediated NF-κB activation[J]. Immunity, 2003, 18(5): 655-664. DOI:10.1016/s1074-7613(03)00092-x |
| [13] |
ASGAROVA A, ASGAROV K, GODET Y, et al. PD-L1 expression is regulated by both DNA methylation and NF-kB during EMT signaling in non-small cell lung carcinoma[J]. Oncoimmunology, 2018, 7(5): e1423170. DOI:10.1080/2162402X.2017.1423170 |
| [14] |
LI Y, WANG L H, ZHANG H T, et al. Disulfiram combined with copper inhibits metastasis and epithelial-mesenchymal transition in hepatocellular carcinoma through the NF-κB and TGF-β pathways[J]. J Cell Mol Med, 2018, 22(1): 439-451. DOI:10.1111/jcmm.13334 |
| [15] |
KUPHAL S, POSER I, JOBIN C, et al. Loss of E-cadherin leads to upregulation of NF kappaB activity in malignant melanoma[J]. Oncogene, 2004, 23(52): 8509-8519. DOI:10.1038/sj.onc.1207831 |
| [16] |
张雯碧, 程明军, 徐丛剑. 小鼠骨髓间充质干细胞向子宫内膜上皮细胞方向分化的体外实验[J]. 现代妇产科进展, 2010, 19(4): 257-260. ZHANG W B, CHENG M J, XU C J. Differentiation of mice's marrow mesenchymal stem cells into endometrial epithelial cells in vitro[J]. Prog Obstet Gynecol, 2010, 19(4): 257-260. DOI:10.13283/j.cnki.xdfckjz.2010.04.009 |



