2019冠状病毒病(coronavirus disease 2019, COVID-19)是新型冠状病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)感染并以肺部病变为主的新型传染病。国家卫健委发布2020年1号公告, 将其纳入《中华人民共和国传染病防治法》规定的乙类传染病, 并采取甲类传染病的预防和措施。CT作为其主要的检查手段[1], 可以帮助评估肺炎的情况、发展程度。另外, 淋巴细胞是机体免疫调节的重要细胞, 常见的淋巴细胞包括T细胞、B细胞、NK细胞, T淋巴细胞亚群包括CD3+T(CD3+)、CD3+CD4+T(CD4+)、CD3+CD8+T(CD8+)、CD4+T/CD8+T(CD4+/CD8+)。淋巴细胞亚群检测能帮助了解疾病发生发展、治疗对机体免疫功能的影响、患者自身免疫功能状态等。淋巴细胞介导的免疫水平是否与患者肺部影像表现相关是值得探讨的问题。因此, 本研究回顾性分析本院COVID-19患者的免疫相关检查指标及CT肺炎症指数, 以评价两者的应用价值及相关性。
1 资料与方法 1.1 一般资料回顾性分析2020年1-2月本院收治的渝西片区80例经临床确诊[1]的COVID-19患者的CT及临床资料, 其中男性45例, 女性35例; 年龄18~89岁, 平均年龄51.2岁。排除年龄小于18岁、CT检查阴性的轻型患者。根据新型冠状病毒肺炎诊疗方案(试行第七版)[1]临床分型:普通型68例, 重型8例, 危重型4例。将80例患者分为重症组(重型、危重型)和非重症组(普通型), 其中重症组12例, 男性7例, 女性5例, 年龄40~89(65.3±17.2)岁; 非重症组68例, 男性38例, 女性30例, 年龄18~83(48.7±13.0)岁。两组年龄差异有统计学意义(P<0.05), 性别差异无统计学意义(P>0.05)。所有患者核酸检测阴性出院[1], 平均病程23 d。
患者均行胸部CT平扫检查, 检查1~2次24例, 3~4次41例, 5~6次15例。将患者发病(出现临床症状或早于临床症状出现的核酸检测阳性)后分3个时间段行CT检查:发病<1周检查49例, 发病1~2周检查72例, 发病>2周检查65例。患者入院后均查外周血血常规、T淋巴细胞亚群, 部分患者查淋巴细胞全套、免疫5项、白细胞介素6(IL-6), 住院期间复查血常规及淋巴细胞亚群, 出院前均查血常规。
1.2 检查方法胸部CT平扫, 采用飞利浦Brilliance iCT、西门子SOMATOM go.TOP CT。扫描参数为:管电压120 kV, 自动管电流, 矩阵512×512, 层厚5 mm, 层间隔5 mm。CT扫描范围自胸廓入口至后肋膈角水平; 重建层厚1 mm。
1.3 影像学分析参照重庆市医师协会放射医师分会制定的“肺部炎症指数”定量评估方法进行量化[2]。根据病变分布与病变大小, 将CT表现进行粗略评分, 即为肺炎症指数(pulmonary inflammation index, PII), 肺炎症指数=(病变分布评分+大小评分+实变评分)/总评分(40)×100%。病变分布评分:按病变分布肺段计分, 一个肺段计1分, 左右肺共计20分(其中左肺上叶尖后段及下叶前内基底段各视为2个计分段)。病变大小评分:按病变占据肺段体积是否超过50%计分, ≥50%计1分, <50%计0分, 最多计分不超过20分。病变实变评分:双肺出现实变计1分。肺炎症指数由两名有丰富工作经验的放射诊断医师进行目测评价, 意见有分歧时协商一致。
1.4 统计学分析采用SPSS 19.0统计学软件进行分析。正态分布计量资料以x±s表示, 组间比较采用t检验; 不符合正态分布计量资料以中位数(四分位数间距)[M(Q)]表示; 2组患者CD3+T计数、CD3+CD4+T计数、CD3+CD8+T计数、淋巴细胞(Lym)计数、CT肺炎症指数、IL-6比较采用Mann-Whitney U检验。CT肺炎症指数与淋巴细胞亚群之间的关系采用Spearman相关性分析。计数资料以例(%)表示, 采用χ2检验或Fisher确切概率法, P<0.05认为差异具有统计学意义。
2 结果 2.1 临床资料分析 2.1.1 临床表现80例患者中, 出现发热、咳嗽均53例(66.25%), 呼吸困难11例(13.75%), 出现消化系统症状14例(17.50%), 神经系统症状8例(10.00%), 合并高血压、冠心病、糖尿病者分别为15例(18.75%)、2例(2.50%)、6例(7.50%); 重症组与非重症组患者的发热、呼吸困难及消化系统症状(呕吐、纳差、腹泻)比较, 差异有统计学意义(P<0.05)。重症组患者合并糖尿病的比例高于非重症组(P<0.05)。见表 1。
| 组别 | n | 临床症状[例(%)] | 合并基础疾病[例(%)] | 总病程 (x±s)/d |
||||||||
| 发热 | 咳嗽 | 呼吸困难 | 消化系统症状 | 神经系统症状 | 高血压 | 冠心病 | 糖尿病 | 其他 | ||||
| 重症组 | 12 | 11(91.67) | 10(83.33) | 6(50.00) | 5(41.67) | 2(16.67) | 3(25.00) | 1(8.33) | 4(33.33) | 2(16.67) | 26.3±10.6 | |
| 非重症组 | 68 | 42(61.76) | 43(63.24) | 5(7.35) | 9(13.24) | 6(8.82) | 12(17.65) | 1(1.47) | 2(2.94) | 11(16.18) | 22.8±7.0 | |
| P值 | <0.05 | >0.05 | <0.05 | <0.05 | >0.05 | >0.05 | >0.05 | <0.05 | >0.05 | >0.05 | ||
2.1.2 入院时各免疫相关指标分析
80例患者入院时T淋巴细胞亚群中, CD3+、CD4+、CD8+计数降低者分别为32例(40.00%)、54例(67.50%)、24例(30.00%), 正常者分别为47例(58.75%)、25例(31.25%)、53例(66.25%), 升高者分别为1例(1.25%)、1例(1.25%)、3例(3.75%); CD4+/CD8+异常者42例(52.50%), 其中降低、升高分别为29例(36.25%)、13例(16.25%)。重症组(n=12)CD3+、CD4+、CD8+三项降低者均为11例(91.67%)。淋巴细胞计数降低或正常(n=80), 降低者38例(47.50%), 其中重症组11例。另外, 80例患者中13例(16.25%)淋巴细胞亚群完全正常, 其中非重症组12例, 重症组1例, 平均病程19.6 d。
C反应蛋白(n=80)、IL-6(n=79)升高或正常, 升高者分别为41例(51.25%)、39例(49.37%)。NK细胞计数(NK)、B淋巴细胞计数(CD3-CD19+B)(n=75)正常者分别为72例(96.00%)、69例(92.00%); 白细胞计数(n=80)正常者70例(87.50%); 免疫球蛋白补体(n=74)包括IgA、IgG、IgM、C3、C4, 正常者分别为63例(85.14%)、62例(83.78%)、69例(93.24%)、70例(94.59%)、53例(71.62%)。
2.2 CT影像表现及CT肺炎症指数患者CT影像学表现发病1周内主要为单发或双肺多发、胸膜下或沿支气管血管束分布、斑片状或节段性磨玻璃密度影(GGO)为主病灶, 病灶内纹理增粗呈网格状, 可呈“铺路石征”改变; 部分病例1周左右可见多发实变影。随时间推移病变进展, 可累及多个肺叶, 病灶变密实, GGO与实变影或条索影共存, 可见空气支气管征、小叶间隔增厚(图 1)。各时间段影像表现有重叠, 转归期可见双肺内病灶逐渐吸收, 密度减低, 磨玻璃影可完全消失, 双肺可见多发条索影。在发病<1周、1~2周、>2周不同时间段, 重症组CT炎症指数均高于非重症组(P<0.05, 表 2)。
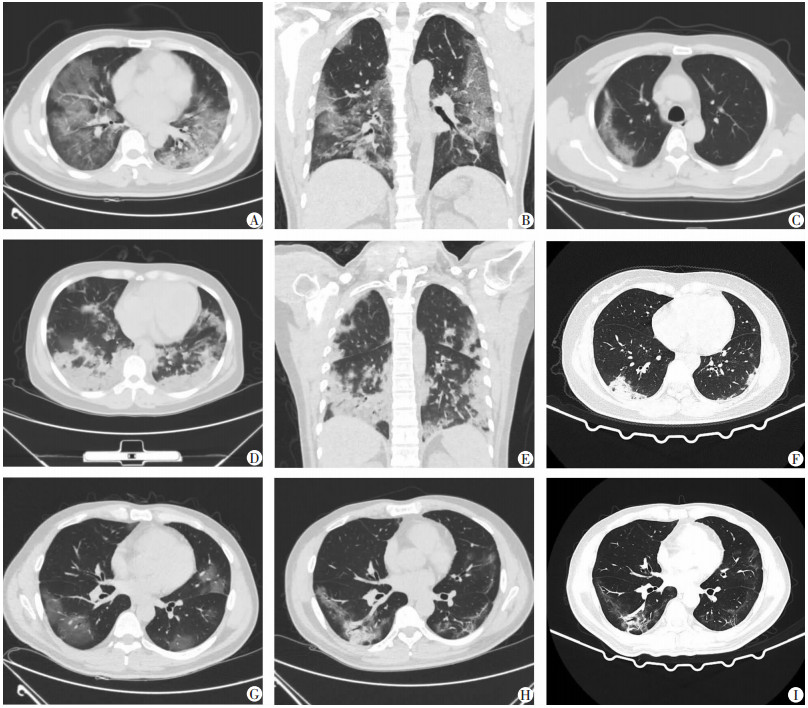
|
| A、B:危重型(男性, 48岁)患者CT平扫(A)示双肺多发斑片及片状磨玻璃影合并实变病灶, 冠状面(B)可见“铺路石征”, 肺炎症指数约70.0%;C:普通型(男性, 44岁)患者CT平扫示右肺上叶片状GGO合并少许实变灶, 肺炎症指数约30.0%;D、E:重型(女性, 40岁)患者CT平扫(D)示双肺多发实变病灶为主, 冠状面(E)可见空气支气管征, 肺炎症指数约67.5%;F:普通型(女性, 39岁)患者CT平扫示双肺胸膜下斑片状稍高密度影, 肺炎症指数约35.0%;G、H、I:分别为同一患者发病<1周(以磨玻璃影为主)、1~2周(新增斑片状实变影)、>2周(实变及磨玻璃影均有所吸收)CT影像表现 图 1 不同临床分型、不同时间段CT影像表现 |
| 组别 | CD3+T/μL-1 | CD3+CD4+T/μL-1 | CD3+CD8+T/μL-1 | ||||||||
| <1周 | 1~2周 | >2周 | <1周 | 1~2周 | >2周 | <1周 | 1~2周 | >2周 | |||
| 重症组 | 352(313) | 165(109) | 795(353) | 218(289) | 98(106) | 414(243) | 138(75) | 66(26) | 415(302) | ||
| 非重症组 | 748(451) | 910(592) | 1 056(409) | 436(220) | 599(377) | 596(282) | 290(172) | 303(227) | 402(223) | ||
| P值 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | >0.05 | ||
| 组别 | Lym/×109·L-1 | 肺炎症指数/% | IL-6/pg·mL-1 | ||||||||
| <1周 | 1~2周 | >2周 | <1周 | 1~2周 | >2周 | <1周 | 1~2周 | >2周 | |||
| 重症组 | 0.76(0.66) | 0.53(0.28) | 0.85(1.04) | 52.5(25.0) | 57.5(22.5) | 48.8(38.8) | 20.08(33.11) | 1.50(9.41) | 6.08(11.23) | ||
| 非重症组 | 1.23(0.69) | 1.35(0.64) | 1.45(0.55) | 20.0(28.1) | 20.0(30.0) | 20.0(32.5) | 7.05(18.66) | 1.86(5.80) | 1.50(2.14) | ||
| P值 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | >0.05 | <0.05 | ||
| 在发病<1周、1~2周、>2周3个时间段T淋巴细胞亚群重症组例数分别为10、9、7例, 非重症组例数分别为55、34、28例, 淋巴细胞计数重症组例数分别为10、12、10例, 非重症组例数分别为61、67、57例, 肺炎症指数重症组例数分别为7、9、10例, 非重症组例数分别为42、63、55例, IL-6重症组例数分别为9、12、9例, 非重症组例数分别为57、49、45例 | |||||||||||
筛选出CT检查资料相对完整的67例患者, 分析每位患者不同时间的CT影像结合炎症指数, 发现CT肺部炎症高峰时间出现在发病<1周为30例(44.8%), 在1~2周为27例(40.3%), 在>2周为10例(14.9%); 肺炎开始吸收时间出现在发病<1周为1例(1.5%), 1~2周为32例(47.8%), >2~3周为25例(37.3%), >3周为9例(13.4%)。肺部炎症较多的患者出院时肺部仍遗留病灶, CT肺炎症指数可能仍较高, 但病灶密度较前均不同程度减低, 范围不同程度减小, 整体呈好转趋势。
2.3 不同时间段淋巴细胞亚群两组间比较及与CT肺炎症指数相关性评价 2.3.1 两组不同时间段淋巴细胞、IL-6比较分析发现在发病<1周、1~2周、>2周3个时间段重症组较非重症组CD3+、CD4+、Lym值均下降明显(P<0.05);在发病<1周、1~2周重症组CD8+值较非重症组下降明显(P<0.05), >2周时两组间CD8+值比较, 差异无统计学意义(P>0.05);其中非重症组发病<1周CD3+、CD4+、CD8+、Lym中位数值最低, 重症组1~2周各值最低。在发病<1周、>2周重症组IL-6值较非重症组上升明显(P<0.05), 1~2周两组间IL-6值比较, 差异无统计学意义(P>0.05)。见表 2。
出院前80例患者复查血常规, 18例(22.50%)患者淋巴细胞计数减低, 62例(77.50%)为正常。
2.3.2 CT肺炎症指数与淋巴细胞亚群相关性分析因影像表现变化的幅度较实验室指标小, 仅选择所有患者复查最高一次的CT肺炎症指数与接近于CT检查时间的淋巴细胞亚群检查结果进行相关性分析。重症组最高一次的CT肺炎症指数中位数为61.25%, 非重症组最高一次的CT肺炎症指数中位数为23.75%, 重症组较非重症组肺炎症指数升高明显(P<0.05);重症组2例肺炎指数小于50%, 其余均为50%以上, 非重症组7例肺炎指数大于50%, 其余均为50%及以下。
CT肺炎症指数与CD3+T、CD3+CD4+T、CD3+CD8+T、Lym值呈显著负相关(P<0.05), 而与CD4+T/CD8+T没有相关性。见表 3。
| 项目 | CD3+T | CD3+CD4+T | CD3+CD8+T | CD4+T/CD8+T | Lym |
| CT肺炎症指数 | -0.484 | -0.422 | -0.474 | 0.093 | -0.476 |
| P值 | <0.05 | <0.05 | <0.05 | >0.05 | <0.05 |
3 讨论
淋巴细胞亚群分析是检测免疫功能的重要指标, 总体反映机体当前的免疫功能状态及平衡水平, 并可以辅助诊断某些疾病(如感染、恶性肿瘤、自身免疫性疾病等), 分析疾病免疫相关机制, 对观察疗效及评估预后有重要意义。细胞免疫主要指T细胞介导的免疫应答, 其特征是出现以单核细胞浸润为主的炎症反应和/或特异性的细胞毒性。本研究发现部分COVID-19患者T淋巴细胞亚群绝对值不同程度减低(重症组占比高), 52.50%的患者CD4+/CD8+比值异常(升高或降低), 反映了细胞免疫功能下降及紊乱, 而NK细胞、B淋巴细胞、免疫球蛋白补体大多数正常, 说明SARS CoV-2可能主要破坏T淋巴细胞, 使其数量减少, 细胞免疫受影响, 导致患者有效防御能力下降, 与文献[3-4]报道一致。T淋巴细胞亚群中CD4+降低的比例最大(67.50%), CD3+、CD4+在发病<1周、1~2周、>2周3个时间段重症组均显著低于非重症组, 差异有统计学意义, CD8+降低的比例相对较小, 且>2周两组间CD8+值比较无明显差异, 说明CD8+的参考价值较CD3+、CD4+小。由于本组病例重型及危重型比例偏少, 导致各指标正常的比例相对较多, 但根据以上结果重症组较非重症组淋巴细胞降低的比例更大, 绝对值更低, 且80例患者出院前淋巴细胞降低的比例从入院时的47.50%下降至22.50%, 说明淋巴细胞的绝对值与疾病的严重程度有一定相关性; 本组13例(非重症组占12例)淋巴细胞亚群完全正常的患者病程也相对较短。外周血淋巴细胞减少, 可能是与疾病严重程度和死亡率相关的关键因素[4]。另外, 根据既往研究, 部分COVID-19患者CD8+减低, 与SARS的淋巴细胞亚群改变较一致, 而不同于其他CD8+升高的病毒感染(如HIV、EB病毒等)[5-6]。
本研究以中老年人居多, 且重症组较非重症组年龄更大, 可能与老年人免疫力低有关; 大多数患者有发热、咳嗽等症状, 可合并其他消化系统及神经系统症状。COVID-19患者早期CT表现以磨玻璃密度影为主, 病变进展, 可累及多个肺叶, 病灶变密实, 磨玻璃与实变影或条索影共存, 较少出现胸腔积液和心包积液, 各时间段影像表现有重叠。本研究发现CT肺部炎症高峰时间主要出现在发病2周内, 肺炎开始吸收时间主要出现在发病1~3周, 转归期病灶逐渐吸收, 呈多发条索影, 与文献[7-9]报道一致; CT肺炎症指数可以量化炎症病变的负荷, 值越大, 炎症病变范围越大。该指标可更好地量化肺炎随访变化的程度, 帮助评估病情。本研究发现在病程的各阶段重症组CT炎症指数均高于非重症组, 差异有统计学意义, 说明COVID-19的影像学改变与疾病的严重程度较一致; 有学者应用AI平台定量计算肺炎病灶占整肺体积百分比, 以评价病程进展, 发现重型及危重型患者炎症病灶占比呈现递增趋势[10]。本组病例中有少数存在不匹配情况, 非重症组7例患者肺炎指数大于50.00%, 重症组2例炎症指数小于50.00%, 可能部分老年患者由于合并基础疾病而整体病情较重, 而单就肺部表现而言可能与整体病情不匹配; 少数普通型患者肺部炎症较多, 可能与患者的耐受能力、肺部病灶的总体密度等有关; CT肺炎症指数有一定的局限性, 没有对CT值及更多病变细节进行评估, 所以还需结合临床, 但总体来说CT肺炎症指数是一个较好的半定量评估标准。
本研究发现CT肺炎症指数与T淋巴细胞亚群、淋巴细胞值呈负相关, 淋巴细胞值越低, 病情可能越严重, 反映在肺部的情况可能也越重, 反之淋巴细胞值不低, CT表现及病情可能相对较轻。COVID-19死亡患者的病理解剖示双肺弥漫性肺泡损伤伴粘液性渗出, 与影像学病灶分布情况相符合[11], 炎性渗出的多少反映在影像学上即密度的高低, 如磨玻璃影、实变影; 部分危重患者CD4+和CD8+减少的同时被过度激活[4], 病情进展, 肺泡损伤更严重、渗出明显增多。因此, 影像表现为病灶范围增大, 实变影增多。
另外, 本研究发现约半数患者IL-6比例升高。炎症因子能刺激免疫细胞增殖、分化并提高其功能, 各种免疫细胞、细胞因子相互协作, 从而清除入侵机体的病毒, 研究表明在人体受到感染时, 细胞因子的浓度可以提示疾病的严重程度[12]。研究显示, 在SARS CoV-2感染过程中, 如果入侵的病原体过多或增殖过快, 可能导致免疫失调或反应过度, 促炎细胞因子释放, 引发多器官功能衰竭, 即脓毒症的病理生理过程特点; 而后机体为了维持个体的生存和内环境的稳定, 启动负反馈机制导致免疫抑制, 多出现在病程的较晚阶段或部分重型、危重型患者, 可能导致二次感染、ARDS或多器官功能衰竭[10, 13-15]。本研究无死亡病例, 非重症组部分患者病程早期淋巴细胞有所下降, 1~2周便逐渐升高, 重症组患者1~2周淋巴细胞下降相对最明显, 后逐渐上升, IL-6早期重症组较非重症组升高明显, 而后也逐渐下降, 均提示病情呈好转趋势, 可能与治疗及患者自身免疫功能恢复有关, 患者病情均好转出院。
因此, 影像学结合临床实验室检查等指标, 可很好地评估COVID-19患者的病情发展及变化; 淋巴细胞及其亚群绝对值减低、CT肺部炎症表现是临床诊断COVID-19的重要参考指标, 对该病的诊断及治疗有着重要的指导意义。
| [1] |
国家卫生健康委办公厅.国家中医药管理局办公室.新型冠状病毒肺炎诊疗方案(试行第七版)[EB/OL].[2020-03-04]. |
| [2] |
重庆市医学影像医疗质量控制中心.重庆市医学影像医疗质量控制中心关于"规范新型冠状病毒肺炎"CT检查的建议[Z].[2020-01-31]. Chongqing Medical Imaging Quality Control Center. Chongqing medical imaging quality control center of "novel coronavirus pneumonia" CT inspection recommendations[Z].[2020-01-31]. |
| [3] |
CHEN N S, ZHOU M, DONG X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study[J]. Lancet, 2020, 395(10223): 507-513. DOI:10.1016/S0140-6736(20)30211-7 |
| [4] |
XU Z, SHI L, WANG Y J, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome[J]. Lancet Respir Med, 2020. DOI:10.1016/s2213-2600(20)30076-x |
| [5] |
李太生, 邱志峰, 韩扬, 等. 严重急性呼吸综合征急性期T淋巴细胞亚群异常改变[J]. 中华检验医学杂志, 2003, 26(5): 297-299. LI T S, QIU Z F, HAN Y, et al. The alterations of T cell subsets of severe acute respiratory syndrome during acute phase[J]. Chin J Lab Med, 2003, 26(5): 297-299. DOI:10.3760/j:issn:1009-9158.2003.05.012 |
| [6] |
DUNNE P J, FAINT J M, GUDGEON N H, et al. Epstein-Barr virus-specific CD8+ T cells that re-express CD45RA are apoptosis-resistant memory cells that retain replicative potential[J]. Blood, 2002, 100(3): 933-940. DOI:10.1182/blood-2002-01-0160 |
| [7] |
陆雪芳, 龚威, 王莉, 等.新型冠状病毒肺炎初诊临床特征及高分辨率CT影像表现[J/OL].中华放射学杂志, 2020.[Epub ahead of print]. |
| [8] |
管汉雄, 熊颖, 申楠茜, 等. 新型冠状病毒肺炎(COVID-19)临床影像学特征[J]. 放射学实践, 2020, 35(2): 125-130. GUAN H X, XIONG Y, SHEN N Q, et al. Clinical and thin-section CT features of patients with the COVID-19[J]. Radiol Pract, 2020, 35(2): 125-130. |
| [9] |
SHI H S, HAN X Y, JIANG N C, et al. Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study[J]. Lancet Infect Dis, 2020, 20(4): 425-434. DOI:10.1016/s1473-3099(20)30086-4 |
| [10] |
黄璐, 韩瑞, 于朋鑫, 等.新型冠状病毒肺炎不同临床分型间CT和临床表现的相关性研究[J/OL].中华放射学杂志, 2020.[Epub ahead of print]. |
| [11] |
刘茜, 王荣帅, 屈国强, 等. 新型冠状病毒肺炎死亡尸体系统解剖大体观察报告[J]. 法医学杂志, 2020, 36(1): 1-3. LIU Q, WANG R S, QU G Q, et al. General anatomy report of novel coronavirus pneumonia death corpse[J]. J Forensic Med, 2020, 36(1): 1-3. |
| [12] |
HUANG C L, WANG Y M, LI X W, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497-506. DOI:10.1016/S0140-6736(20)30183-5 |
| [13] |
HUANG C L, WANG Y M, LI X W, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497-506. DOI:10.1016/S0140-6736(20)30183-5 |
| [14] |
CHANNAPPANAVAR R, PERLMAN S. Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology[J]. Semin Immunopathol, 2017, 39(5): 529-539. DOI:10.1007/s00281-017-0629-x |
| [15] |
周红, 李小丽, 李斌. 重视2019冠状病毒病(COVID-19)诱导的脓毒症免疫抑制[J]. 第三军医大学学报, 2020, 42(6): 539-544. ZHOU H, LI X L, LI B. Pay attention to 2019 coronavirus disease (COVID-19) induced sepsis immunosuppression[J]. J Third Mil Med Univ, 2020, 42(6): 539-544. DOI:10.16016/j.1000-5404.202002172 |



