侵袭性真菌感染是指真菌侵犯内脏、皮下组织、皮肤角质层以下和黏膜所致的感染,主要病原菌有曲霉菌、念珠菌、隐球菌等[1]。近年来,由于广谱抗生素、肿瘤化疗药物和免疫抑制剂的广泛应用以及艾滋病的蔓延,全球侵袭性真菌感染形势日益严峻[1]。由于侵袭性真菌感染的临床表现缺乏特征性,缺乏有效的早期确诊手段,且治疗药物疗程长,预后差等,使得侵袭性真菌感染成了临床治疗难题[2]。伏立康唑是三唑类广谱抗真菌药物,其抗菌谱广,是侵袭性曲霉病、侵袭性念珠菌病以及不能耐受其他药物或其他药物治疗无效的尖端赛多孢菌病和镰孢菌病的选用药物。临床研究发现,伏立康唑的临床效应具有明显的浓度依赖性,在白种人中其有效治疗药物浓度范围为1~5.5 mg/L[3]。2018年,中国药理学会推荐伏立康唑的中国人群有效治疗浓度范围为0.5~5.0 mg/L[4]。而给予相同的剂量,不同个体的血药浓度差异显著,即相同剂量下不同患者疗效和不良反应存在显著的个体差异。当伏立康唑谷浓度>5.0 mg/L时,不良反应肝脏损害、神经毒性、视力模糊等发生率升高[5-6]。伏立康唑也可致低血钾和低血钠,但相对关注较少[7]。低血钾和低血钠可导致神经肌肉系统和心血管系统的损害,严重者可危及生命。本研究主要探讨肺部侵袭性真菌感染患者中伏立康唑所致低血钾和低血钠的发生情况及其与伏立康唑谷浓度的相关性,以期为临床用药提供参考。
1 对象与方法 1.1 入选标准对2017年10月8日至2019年4月30日我院收治的188例进行伏立康唑治疗药物监测患者的临床资料进行回顾性分析。纳入标准:(1)住院患者;(2)年龄≥18岁;(3)诊断为肺部真菌感染;(4)伏立康唑谷浓度为稳态谷浓度者;(5)使用伏立康唑前血钾血钠正常者。排除标准:(1)门诊患者;(2)孕妇;(3)临床资料不完整者。本研究经本院伦理委员会批准(批号:KY2019131)。
1.2 伏立康唑谷浓度监测患者接受伏立康唑静脉滴注负荷剂量6 mg/kg、维持剂量4 mg/kg给药后3 d以上,或口服首剂量加倍维持剂量4 mg/kg给药后3 d以上达稳态谷浓度者,于下次给药前30 min采集静脉血3~5 mL,液相色谱-串联质谱法测定伏立康唑谷浓度[8]。
1.3 收集指标及判断标准收集患者的性别、年龄、体质量、基础疾病、真菌感染类型、给药方式、给药剂量、伏立康唑谷浓度、血钾浓度、血钠浓度、给药后出现低血钾和低血钠的时间。血钾正常值范围为3.5~5.5 mmol/L,血钠正常值范围为135~ 150 mmol/L。低血钾的诊断标准为血钾为 < 3.5 mmol/L,低血钠的诊断标准为血钠 < 135 mmol/L。
1.4 统计学分析采用SPSS 18.0统计软件进行分析。对计数资料采用率表述;符合正态分布的计量数据采用x±s表示,不符合正态分布的计量数据采用中位数(第25百分位数,第75百分位数)表示;对伏立康唑谷浓度与血钾、血钠的相关性进行Pearson相关性分析。检验水准α=0.05。
2 结果 2.1 一般情况共纳入142例肺部侵袭性真菌感染患者,267个伏立康唑谷浓度。患者以男性为主(64.1%),年龄(57.0±16.8)岁,体质量(60.5±10.4)kg,基础疾病以白血病(26.8%)和高血压(32.4%)为主,其次为糖尿病、慢性阻塞性肺疾病、肾移植和冠状动脉粥样硬化性心脏病,感染真菌以曲霉菌为主(40.8%),其次为光滑假丝酵母菌、白色念珠菌和热带念珠菌,见表 1。
| 项目 | 例数 | 百分比 |
| 性别 | ||
| 男性 | 91 | 64.1% |
| 女性 | 51 | 35.9% |
| 年龄 | ||
| < 60岁 | 74 | 52.1% |
| ≥60岁 | 68 | 47.9% |
| 基础疾病 | ||
| 白血病 | 38 | 26.8% |
| 肾移植 | 19 | 13.4% |
| 慢性阻塞性肺疾病 | 23 | 16.2% |
| 高血压 | 46 | 32.4% |
| 糖尿病 | 24 | 16.9% |
| 冠状动脉粥样硬化性心脏病 | 15 | 10.6% |
| 真菌 | ||
| 曲霉菌 | 58 | 40.8% |
| 光滑假丝酵母菌 | 9 | 6.3% |
| 白色念珠菌 | 6 | 4.2% |
| 热带念珠菌 | 3 | 2.1% |
| 拟平滑假丝酵母菌 | 1 | 0.7% |
| 克柔念珠菌 | 1 | 0.7% |
| 高里氏念珠菌 | 1 | 0.7% |
| 其他 | 63 | 44.4% |
| 其他包括检出真菌未明确真菌类型24例和未检出真菌39例 | ||
2.2 伏立康唑谷浓度
患者伏立康唑给药方式为静脉滴注175例,口服92例;给药剂量为(7.16±1.98)mg/(kg·d);伏立康唑谷浓度为2.9(1.6,4.9)μg/mL,范围0.4~15.5 μg/mL。
2.3 低血钾和低血钠情况共42例患者出现低血钾,占29.6%;21例患者出现低血钠,占14.8%。伏立康唑使用后1~5 d出现低血钾和低血钠的比例最高,分别占57.1%和42.9%。出现低血钾和低血钠患者的给药方式均以静脉滴注为主,其给药剂量和谷浓度见表 2。口服伏立康唑后出现低血钾的时间长,3例患者分别为给药后12、16、22 d;静脉滴注给药后出现低血钾的时间短。8例患者同时出现了低血钾和低血钠,其中口服和静脉滴注各4例,伏立康唑谷浓度范围为0.4~6.1 μg/mL,谷浓度>5.0 μg/mL者2例。
| 不良反应 | 例数 | 给药后时间[例(%)] | 给药方式[例(%)] | 给药剂量/mg·kg -1·d -1
(±s) |
谷浓度/μg·mL -1
[M(P 25, P 75)] |
||||
| 1~5 d | 6~10 d | 11 d以上 | 口服 | 静脉滴注 | |||||
| 低血钾 | 42 | 24(57.1%) | 11(26.2%) | 7(16.7%) | 3(7.1%) | 39(92.9%) | 7.76±2.17 | 2.85(1.5,5.5) | |
| 低血钠 | 21 | 9(42.9%) | 7(33.3%) | 5(23.8%) | 4(22.2%) | 14(77.8%) | 6.93±1.74 | 1.90(1.3,4.5) | |
2.4 血钾和血钠与伏立康唑谷浓度的相关性
患者血钾和血钠与伏立康唑谷浓度不存在相关性(r=0.001,P=0.989;r=0.150,P=0.052)。见图 1。
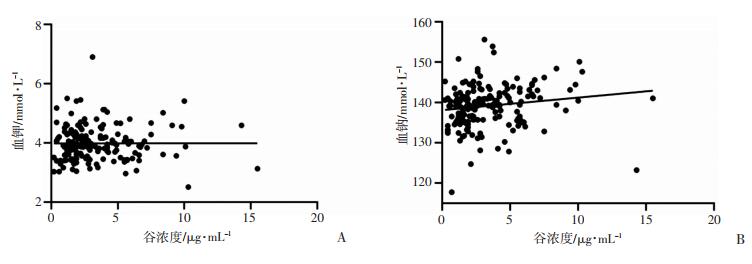
|
| A:患者血钾与伏立康唑谷浓度相关性;B:患者血钠与伏立康唑谷浓度相关性 图 1 肺部侵袭性真菌感染患者伏立康唑谷浓度与血钾和血钠浓度的相关性分析 |
3 讨论
本研究纳入的142例肺部侵袭性真菌感染患者中,年龄≥60岁患者所占比例接近50%,说明老年患者已成为侵袭性真菌感染的高危人群。患者基础疾病中,除白血病和肾移植等免疫力低下人群所占比例较高外,糖尿病、高血压、冠状动脉粥样硬化性心脏病所占比例也较高。本研究中侵袭性真菌感染以曲霉菌为主,其次为光滑假丝酵母菌、白色念珠菌和热带念珠菌。虽然本研究中有39例患者未检出真菌,真菌培养结果阴性,但结合患者肺部影像学表现、临床特征和抗生素使用情况等,临床上确诊为真菌感染。在肺部侵袭性真菌感染的诊治中,应注意上述临床特征。
人体中,伏立康唑通过抑制CYP-450依赖性的14α脱甲基酶CYP51A1,抑制羊毛甾醇转化为麦角甾醇,而麦角甾醇是糖皮质激素、盐皮质激素和性腺激素的必要启动因素[9-11]。白种人中伏立康唑长期应用所致荷尔蒙相关不良反应包括男性乳腺发育、肾上腺功能不全、低血钠和低血钾,发生率<5%[7]。刘学松等[12]研究显示,87例肺部真菌感染使用伏立康唑的患者中,低钾血症发生率为32%。武琳琳等[13]研究显示,伏立康唑治疗血液病合并侵袭性真菌病中,37例患者出现低钾血症13例。本研究中,接受伏立康唑治疗肺部侵袭性真菌感染患者的低血钾发生率为29.6% (42/142),与之前的报道类似。在常规给药剂量下,低血钾多发生于静脉滴注伏立康唑后1~5 d,静脉给药后发生低血钾的时间较短,口服给药后发生低血钾的时间较长,且与伏立康唑谷浓度不存在相关性,临床应用伏立康唑治疗时,应注意此不良反应特点。
低钠血症是老年患者常见的电解质异常,急性严重的低钠血症容易造成生命的危险,慢性的低钠血症也会使老年患者的病情更加复杂甚至增加患病率与病死率[14]。老年患者是侵袭性真菌感染的易感人群[15-16]。关于伏立康唑引起低血钠的研究较少。本研究中,在常规给药剂量下,伏立康唑所致低血钠的比例为14.8%,给药方式以静脉滴注为主,42.9%的患者低血钠发生于伏立康唑使用后1~5 d,且相关性研究显示,低血钠与伏立康唑谷浓度呈现相关的趋势(P=0.052)。因此,在侵袭性真菌感染患者中,特别是老年侵袭性真菌感染患者,应尤其注意伏立康唑所致低血钠。
本研究中,有8例患者同时出现了低血钾和低血钠,临床使用伏立康唑的过程中,应密切关注患者的电解质情况,适当补充钾盐和补液,避免出现严重的电解质紊乱。另外,除低血钾和低血钠外,本研究患者群中伏立康唑所致不良反应还包括肝功能损伤ALT升高、AST升高、总胆红素升高等52例(36.65%),神经精神系统症状烦躁、焦虑、恐惧、幻觉、幻视等21例(14.8%),视物模糊7例(4.9%)。因此,在伏立康唑的使用过程中,应进行TDM,以使其血药浓度保持在治疗范围内,以减少不良反应的发生。
纳入患者在使用伏立康唑前,都有合并使用其他抗生素的历史,本研究未分析其他抗生素可能产生的影响。但患者均在使用伏立康唑后很快出现低血钾和低血钠,说明低血钾和低血钠是由伏立康唑引起。本研究属于回顾性研究,样本量相对较小,研究结果尚需多中心大样本研究进一步证实。
综上,本研究显示,在常规治疗剂量下,静脉滴注伏立康唑引起低血钾和低血钠的比例较高,且多发生于伏立康唑使用后早期,与伏立康唑谷浓度不存在相关性,临床应用伏立康唑时应注意此不良反应。
| [1] |
OREN I, PAUL M. Up to date epidemiology, diagnosis and management of invasive fungal infections[J]. Clin Microbiol Infect, 2014, 20(Suppl 6): 1-4. DOI:10.1111/1469-0691.12642 |
| [2] |
张静, 何礼贤. 侵袭性肺真菌病诊治指南解读[J]. 中国药物应用与监测, 2011, 8(5): 261-265. ZHANG J, HE L X. Interpretation of guidelines for invasive pulmonary fungal disease[J]. Chin J Drug Appl Monit, 2011, 8(5): 261-265. DOI:10.3969/j.issn.1672-8157.2011.05.001 |
| [3] |
ULLMANN A J, AGUADO J M, ARIKAN-AKDAGLI S, et al. Diagnosis and management of aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline[J]. Clin Microbiol Infect, 2018, 24(Suppl 1): e1-e38. DOI:10.1016/j.cmi.2018.01.002 |
| [4] |
CHEN K, ZHANG X L, KE X Y, et al. Individualized medication of voriconazole: a practice guideline of the Division of Therapeutic Drug Monitoring, Chinese Pharmacological Society[J]. Ther Drug Monit, 2018, 40(6): 663-674. DOI:10.1097/FTD.0000000000000561 |
| [5] |
CHENG L, XIANG R F, LIU F, et al. Therapeutic drug monitoring and safety of voriconazole in elderly patients[J]. Int Immunopharmacol, 2020, 78: 106078. DOI:10.1016/j.intimp.2019.106078 |
| [6] |
HASHEMIZADEH Z, BADIEE P, MALEKHOSEINI S A, et al. Observational study of associations between voriconazole therapeutic drug monitoring, toxicity, and outcome in liver transplant patients[J]. Antimicrob Agents Chemother, 2017, 61(12): e01211-e01217. DOI:10.1128/AAC.01211-17 |
| [7] |
BENITEZ L L, CARVER P L. Adverse effects associated with long-term administration of azole antifungal agents[J]. Drugs, 2019, 79(8): 833-853. DOI:10.1007/s40265-019-01127-8 |
| [8] |
向荣凤, 尚圣兰, 熊丽蓉, 等. 液相色谱-串联质谱法测定人血浆中伏立康唑和伏立康唑氮氧化物浓度及其临床应用[J]. 第三军医大学学报, 2019, 41(15): 1478-1484. XIANG R F, SHANG S L, XIONG L R, et al. Determination of voriconazole and its N-oxide in human plasma by LC-MS/MS and its clinical application[J]. J Third Mil Med Univ, 2019, 41(15): 1478-1484. DOI:10.16016/j.1000-5404.201902067 |
| [9] |
SATOH T, TOMIKAWA Y, TAKANASHI K, et al. Studies on the interactions between drugs and estrogen. III. Inhibitory effects of 29 drugs reported to induce gynecomastia on the glucuronidation of estradiol[J]. Biol Pharm Bull, 2004, 27(11): 1844-1849. DOI:10.1248/bpb.27.1844 |
| [10] |
SATOH T, ITOH S, SEKI T, et al. On the inhibitory action of 29 drugs having side effect gynecomastia on estrogen production[J]. J Steroid Biochem Mol Biol, 2002, 82(2/3): 209-216. DOI:10.1016/s0960-0760(02)00154-1 |
| [11] |
SAAD A H, DEPESTEL D D, CARVER P L. Factors influencing the magnitude and clinical significance of drug interactions between azole antifungals and select immunosuppressants[J]. Pharmacotherapy, 2006, 26(12): 1730-1744. DOI:10.1592/phco.26.12.1730 |
| [12] |
刘学松, 何为群, 陈文英, 等. 肺部真菌感染患者伏立康唑血药浓度监测的临床应用[J]. 国际呼吸杂志, 2016, 36(20): 1521-1526. LIU X S, HE W Q, CHEN W Y, et al. Monitor the voriconazole trough concentration of patients with pulmonary fungal infection in clinical application[J]. Int J Respir, 2016, 36(20): 1521-1526. DOI:10.3760/cma.j.issn.1673-436X.2016.20.001 |
| [13] |
武琳琳, 江嘉义, 王晗晗, 等. 伏立康唑治疗血液病合并侵袭性真菌病的疗效及安全性观察[J]. 安徽医学, 2019, 40(6): 664-667. WU L L, JIANG J Y, WANG H H, et al. Efficacy and safety of voriconazole in the treatment of hematopathy with invasive mycosis[J]. Anhui Med J, 2019, 40(6): 664-667. DOI:10.3969/j.issn.1000-0399.2019.06.019 |
| [14] |
FILIPPATOS T D, MAKRI A, ELISAF M S, et al. Hyponatremia in the elderly: challenges and solutions[J]. Clin Interv Aging, 2017, 12: 1957-1965. DOI:10.2147/CIA.S138535 |
| [15] |
MATTHAIOU D K, DIMOPOULOS G, TACCONE F S, et al. Elderly versus nonelderly patients with invasive aspergillosis in the ICU: a comparison and risk factor analysis for mortality from the AspICU cohort[J]. Med Mycol, 2018, 56(6): 668-678. DOI:10.1093/mmy/myx117 |
| [16] |
LIANG S Y. Sepsis and other infectious disease emergencies in the elderly[J]. Emerg Med Clin North Am, 2016, 34(3): 501-522. DOI:10.1016/j.emc.2016.04.005 |



