2. 400038 重庆,陆军军医大学(第三军医大学)基础医学院微生物学教研室,重庆市微生物工程实验室;
3. 400715 重庆,西南大学生命科学学院, 现代生物医药研究所, 三峡库区生态环境与生物资源省部共建国家重点实验室培育基地;
4. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院急诊部
2. Department of Microbiology, Chongqing Laboratory of Microbiological Engineering, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. School of Life Sciences, Institute of Modern Biopharmaceuticals, State Key Laboratory Breeding Base of Eco-Environment and Bio-Resource of the Three Gorges Area, Key Laboratory of Eco-environments in the Three Gorges Reservoir Region of Ministry of Education, Southwest University, Chongqing, 400715;
4. Department of Emergency Medicine, Second Affiliated Hospital, Army Medical University (Third Military Medical University), 400037, China
金黄色葡萄球菌(Staphylococcus aureus,简称金葡菌)是一种重要的致病菌,除可引起皮肤软组织感染、肺炎、心内膜炎、脓毒症等疾病外,该菌还是脑脓肿的主要致病菌。近期的一篇Meta分析显示,在脑脊液及脓液细菌分离培养阳性的脑脓肿患者中,金葡菌引起的脑脓肿占18% (1 076/5 894),为第3位致病菌[1]。
目前,金葡菌脑脓肿的临床治疗主要包括抗生素治疗和外科手术治疗[2-3]。然而,由于抗生素的不合理使用,耐甲氧西林金葡菌(methicillin-resistant S. aureus, MRSA)等多重耐药菌的出现导致脑脓肿的治疗效果并不理想,脑脓肿患者病死率仍高达15%,且存活病例中约1/3遗留癫痫、智力减退、局灶性神经功能缺损症状等长期后遗症[2, 4]。因此,探索新的金葡菌脑脓肿特异性治疗手段具有重要的临床意义。
近年来,抗毒力因子治疗作为新兴的抗生素替代疗法备受关注。该方法通过寻找特异性制剂,封闭毒力因子的致病作用,促进机体免疫机制对致病菌的清除,实现治疗细菌感染的目的,具有高效、特异、不易产生耐药等优势[5]。特异性抗体是抗毒力因子治疗首选制剂之一。然而,在治疗脑脓肿疾病时,抗体能否通过人体的血脑屏障(blood brain barrier,BBB)从而实现治疗作用是个值得探索的问题。有研究表明,金葡菌在引起脑脓肿的过程中,存在BBB的持续性破坏[6]。这为利用毒力因子抗体治疗细菌性脑脓肿提供了契机,但是仍然缺乏相关的实验验证。
我们的前期研究表明,金葡菌在导致脑脓肿过程中,脂蛋白合成的关键酶——二酰基甘油基转移酶(diacylglycerol transferase, Lgt)发挥了重要作用[7]。受Lgt调控的脂蛋白SA2275是金葡菌的重要毒力因子之一[8]。为此,本研究以脂蛋白SA2275为金葡菌目标毒力因子,通过制备SA2275重组蛋白和相应的多克隆抗体,探讨其通过血脑屏障和在抑制金葡菌脑脓肿形成中的作用,为建立新的细菌性脑脓肿抗毒力因子疗法奠定实验基础。
1 材料与方法 1.1 实验材料 1.1.1 菌株及动物金葡菌MRSA菌株N315(同济大学医学院附属肺科医院余方友教授惠赠),Newman株(吉林大学于录教授惠赠);大肠埃希菌BL21感受态细菌(购自北京天根生物公司),大肠埃希菌表达质粒pET28a(本实验室保存)。BALB/c小鼠,C57BL/6小鼠(购自陆军军医大学实验动物中心)。
1.1.2 仪器与试剂PCR仪及SDS-PAGE蛋白电泳仪(美国Bio-Rad公司);离心机及超高速低温离心机(日本HITACHI公司);高压均质机(加拿大ATS公司);AKTA蛋白纯化仪(美国GE公司);25 μL微量注射器(上海上天仪器公司);磁力搅拌器(海门其林贝尔仪器公司);显微镜BX52(日本Olympus公司);0.45 μm针式滤器及10 kDa超滤管(美国Millipore公司);MultiScanGo多功能酶标仪(美国Thermo-Fisher公司)。细菌基因组提取试剂盒(北京天根生物公司);PCR产物回收试剂盒(美国Promega公司);琼脂糖(美国Invitrogen公司);卡那霉素(kanamycin,Kana),IPTG,磷酸二氢钠,咪唑,氯化钠,无钙、镁D-PBS及吐温-20(上海生工公司);PBS干粉(无锡傲锐东源公司);PMSF及BCA蛋白定量试剂盒(上海碧云天公司);PrimeSTAR®高保真DNA聚合酶,限制性内切酶及T4 DNA连接酶(大连宝生生物公司);弗氏佐剂,戊巴比妥钠及低熔点琼脂糖(美国Sigma-Aldrich公司);金葡菌培养基TSB(Tryptone Soya Broth),大肠埃希菌LB培养基胰蛋白胨(Tryptone)及酵母提取物(Yeast Extract)(英国Oxoid公司);cOmplete蛋白酶抑制剂(瑞士罗氏公司);脱脂奶粉(武汉博士德公司);96孔板(美国Corning公司);ELISA包被液(北京鼎国公司);ELISA显色试剂盒(美国R&D公司)。
1.2 实验方法 1.2.1 重组表达质粒的构建采用Primer Premier 5.0软件,以金葡菌N315基因组序列为模板,在sa2275基因上下游分别设计引物并加入限制性内切酶位点。上游引物pET28a- sa2275 (BamHⅠ)-F 5′-AAC GGATCC TGCGGAATGAAAAAGGAAG-3′, 下游引物pET28a- sa2275 (SalⅠ)-R 5′-AGC GTCGAC ATATTCAGTAGGTTTGAAATT-3′。细菌基因组提取试剂盒提取N315基因组作为模板,PrimeSTAR®高保真DNA聚合酶PCR反应扩增目的片段。经PCR产物回收试剂盒回收、纯化后,将回收DNA片段经1%琼脂糖凝胶电泳确认。PCR产物及pET28a质粒分别经酶切并回收。T4 DNA连接酶将sa2275片段与pET28a载体进行连接,连接产物转化至大肠埃希菌BL21中,涂布LB Kanar琼脂平板(Kana浓度50 μg/mL)。37 ℃培养,挑取单菌落提取质粒,经PCR筛选出阳性转化子,再经质粒测序鉴定出正确的克隆,即为含有pET28a-sa2275表达载体的转化子。
1.2.2 重组蛋白的诱导表达与纯化将pET28a-sa2275/BL21转化子接种至LB Kanar液体培养基(Kana浓度50 μg/mL)中,37 ℃振荡培养至D(600)≈ 0.5,加入终浓度为0.5 mmol/L的IPTG,22 ℃振荡培养,诱导表达3 h。取100 μL培养液,10 000×g离心3 min,收集菌体,加入60 μL 1×SDS上样缓冲液,沸水水浴变性处理10 min。离心后,取上清液经SDS-PAGE蛋白电泳,筛选得到能表达SA2275重组蛋白的工程菌,且明确蛋白为可溶性表达。将鉴定正确的工程菌接种于1 L培养基,加入IPTG,22 ℃振荡培养过夜。4 ℃,10 000×g离心10 min收集菌体,PBS溶液重悬,经高压均质机将菌体破碎。4 ℃,10 000×g离心30 min收集上清,0.45 μm滤器过滤,以备蛋白纯化。采用配制好的蛋白结合缓冲液(50 mmol/L磷酸二氢钠,0.5 mol/L氯化钠,20 mmol/L咪唑,1 mmol/L PMSF,pH=8.0)对镍层析柱进行平衡后,将过滤后的蛋白样品上样。以蛋白洗脱缓冲液(50 mmol/L磷酸二氢钠,0.5 mol/L氯化钠,500 mmol/L咪唑,1 mmol/L PMSF,pH=8.0)对镍柱进行预洗脱,至UV曲线稳定。随后,以不同咪唑浓度梯度(20~500 mmol/L)的蛋白洗脱缓冲液洗脱,每个浓度5~10个柱体积,收集洗脱峰处蛋白样品。经SDS-PAGE电泳后,将收集到的目的蛋白悬液经10 kDa超滤管浓缩,同时透析并更换缓冲液为PBS,BCA法测定浓度后,-80 ℃保存。
1.2.3 SA2275重组蛋白免疫BALB/c小鼠制备抗血清将40 μg SA2275重组蛋白与等体积弗氏佐剂乳化混合后,经皮下、肌肉多点注射BALB/c小鼠。第2周及第4周分别重复加强免疫一次,第5周取血制备含anti-SA2275的血清。同时,取相同条件饲养的正常小鼠血清作为阴性对照。ELISA检测,酶标仪测定450 nm波长处各孔的吸光度D(450),计算阳性血清与阴性血清的吸光度之比(P/N),取P/N≥2.1时所对应的抗体最高稀释倍数作为抗体的效价。血清混合分装后均于-80 ℃保存。
1.2.4 金葡菌感染小鼠脑脓肿模型制作及鉴定依据文献[9]的方法制作金葡菌感染小鼠脑脓肿模型:取对数生长期Newman菌悬液,离心收集菌体(菌量为1×109 CFU/mL琼脂糖),D-PBS重悬清洗2次,再加入3 mL D-PBS涡旋振荡重悬,与17 mL保温于42 ℃的1.4%低熔点琼脂糖溶液混合(总体积20 mL,菌量1×109 CFU/mL)。将琼脂糖菌悬液加入30 mL保温于37 ℃的灭菌液体石蜡中,室温搅拌混合1 min,冰浴搅拌2 min。分装于2个50 mL离心管中,加入D-PBS平衡,4 ℃,800×g离心10 min,弃上层液,重复用D-PBS清洗4次后,收集琼脂糖球沉淀,加入D-PBS至50 mL,室温静置5 min,吸取上清,分装于1.5 mL无菌EP管中,离心浓缩后获得直径约为50~100 μm的金葡菌琼脂糖球悬液。接着,用1%戊巴比妥钠溶液(50 mg/kg)腹腔注射麻醉小鼠,眼科剪备皮以暴露头皮。碘伏及75%乙醇消毒后,沿小鼠头部正中矢状线作1 cm长头皮纵切口,暴露皮下组织及颅骨。定位至前囟点,并向小鼠嘴侧1 mm,再向右侧旁开2 mm,即为拟注射部位。以无菌注射器针尖端钻开颅骨窗(直径0.5 mm左右)。25 μL微量注射器垂直进针3 mm,缓慢将5 μL琼脂糖球注入小鼠脑内(右侧纹状体)。停留2 min后缓慢退出针头。缝合头皮切口,碘伏消毒。建模第3天和第5天,将模型小鼠处死,取出全脑组织。肉眼观察后,4%多聚甲醛溶液固定,病理切片、HE染色,观察脓肿形成,鉴定脑脓肿模型制作效果。
1.2.5 小鼠脑组织总蛋白制备将200 μL anti-SA2275抗血清经腹腔注射C57BL/6小鼠(6~8周龄,雌性)作为实验组。等体积空白对照血清腹腔注射后小鼠,则作为血清对照组。anti-SA2275经腹腔注射C57BL/6小鼠而不构建脑脓肿模型,作为阴性对照组。常规饲养24 h后,将抗体处理组及血清对照组两组预处理C57BL/6小鼠制作金葡菌感染小鼠脑脓肿模型。阴性对照组小鼠则不感染金葡菌。72 h后,取出小鼠脑组织,立即以PBS冲洗并称量。冰浴下,将脑组织移入离心管中,加入1 mL cOmplete蛋白酶抑制剂溶液,制备组织匀浆。4 ℃静置20 h后,4 ℃,6 000×g离心30 min,取上清转移至EP管中。4 ℃,12 000×g离心10 min,上清液即为蛋白提取物,-80 ℃保存备检。
1.2.6 ELISA检测将SA2275蛋白用ELISA包被液稀释后加入96孔板中(100 ng/孔,体积50 μL),4 ℃放置过夜包被抗原。弃去孔板中液体,每孔加300 μL PBST溶液(含0.05%吐温-20的PBS缓冲液)清洗后,吸水纸上拍干。重复清洗3次后,每孔加入100 μL封闭液(5 g脱脂奶粉加入100 mL PBST混匀)室温封闭1 h。洗板3次后,加入一抗进行孵育(一抗为1.2.5中所制备的3组总蛋白样品)。每孔加入50 μL用封闭液梯度稀释的小鼠脑组织蛋白提取物,并设置anti-SA2275梯度稀释阳性对照,37 ℃孵育1.5 h。洗板3次后,加入50 μL用封闭液1 :5 000稀释的HRP羊抗鼠IgG(二抗),37 ℃孵育40 min。洗板3次后,每孔中加入100 μL R&D试剂进行显色后,加入50 μL终止液终止显色反应。酶标仪450 nm/540 nm双波长检测每孔吸光度。
1.2.7 抗体anti-SA2275抑制金葡菌脑脓肿形成实验将200 μL anti-SA2275抗血清(效价1 :51 200)经腹腔注射C57BL/6小鼠(6~8周龄,雌性)作为抗体处理组。同时,等体积空白对照血清腹腔注射小鼠,作为对照组。两组预处理C57BL/6小鼠常规饲养24 h后,分别制作金葡菌感染小鼠脑脓肿模型。建模5 d后,取出小鼠脑组织,匀浆后铺板进行细菌计数,或4%多聚甲醛固定后进行病理切片和HE染色。由小鼠大脑额极向枕极作冠状位的连续切片(层厚100 μm),获得脑脓肿连续切片。显微镜下(20 ×),将切片逐一转换成图像。利用Image J软件逐层计算出切片中小鼠脑脓肿面积。将脑脓肿面积与层厚的乘积累加后,得出脑脓肿的总体积。
1.3 统计学处理利用GraphPad Prism 7对实验结果进行统计学分析,细菌载量及脑脓肿体积组间采用Mann-Whitney检验,ELISA检测各组间进行t检验。
2 结果 2.1 pET28a-sa2275表达质粒的构建与鉴定将含sa2275基因的PCR扩增片段与pET28a载体连接后转化大肠埃希菌BL21,从LB Kana平板上挑取转化子,提取质粒并进行PCR扩增鉴定。结果如图 1所示,琼脂糖凝胶电泳可见大小约800 bp的目的条带,与预期sa2275(777 bp)的大小相符。进一步质粒测序结果表明,目标基因序列正确,无移码及突变,含pET28a-sa2275表达质粒的工程菌构建成功。
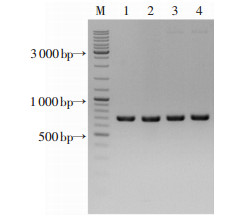
|
| M:Marker;1~4:sa2275 PCR产物条带(777 bp) 图 1 pET28a-sa2275表达质粒PCR鉴定 |
2.2 SA2275重组蛋白的表达及纯化
培养工程菌pET28a-sa2275/BL21,用IPTG诱导表达3 h,取样进行SDS-PAGE蛋白电泳分析。如图 2A所示,以未诱导菌作对照,在约33×103处可见目的蛋白条带,与预期SA2275重组蛋白理论分子量相一致。收集工程菌,破碎后制备含重组蛋白上清,采用镍柱亲和层析法纯化,以含500 mmol/L咪唑的蛋白洗脱缓冲液进行梯度洗脱,收集洗脱峰,经透析、超滤浓缩后,采用SDS-PAGE电泳鉴定,得到纯度较高的SA2275重组蛋白(图 2B)。

|
| A:SA2275重组蛋白诱导表达;M:Marker;C:未诱导菌对照;1~5:SA2275表达菌,▲:示SA2275重组蛋白条带。B:纯化后SA2275重组蛋白条带;M:Marker 图 2 SA2275重组蛋白诱导表达及纯化SDS-PAGE电泳图 |
2.3 金葡菌感染小鼠脑脓肿模型的建立
将金葡菌琼脂糖微球接种至C57BL/6小鼠脑实质内构建脑脓肿模型。如图 3所示,在建模第3天和第5天分别将小鼠处死,取出脑组织。感染第3天,肉眼观察可见,小鼠接种侧大脑半球肿胀,中线向对侧偏移;病理切片低倍镜下可见,脑实质内局限性病灶,形成占位效应,接种侧大脑半球明显肿胀;高倍镜下可见,该病灶内坏死出血,伴炎症细胞浸润,脑脓肿壁开始形成,但尚未与周围正常脑组织构成清晰界限。感染第5天,肉眼可见,小鼠接种侧大脑半球内脑脓肿形成,与周围正常脑组织分界清楚;高倍镜下可见,脑脓肿壁形成,脓肿腔内有大量炎症细胞浸润。上述结果表明,金葡菌感染小鼠脑脓肿模型制作成功。
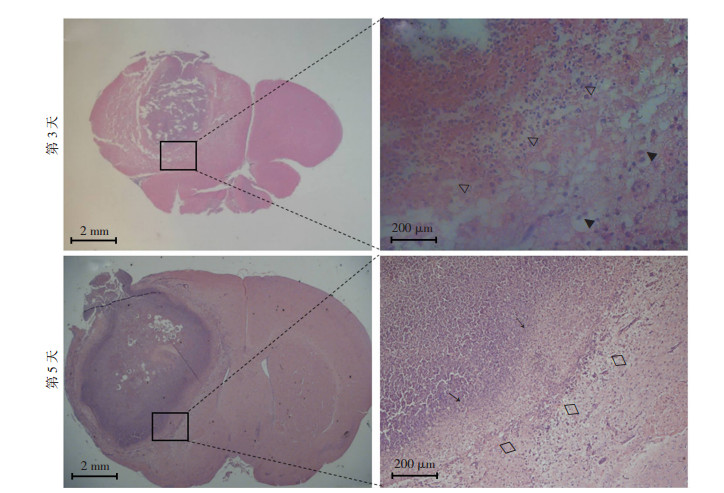
|
| △:示病灶内坏死出血;▲:示脓肿壁开始形成;◇:示正常脑组织;↑:示脑脓肿壁 图 3 HE染色观察金葡菌感染小鼠脑脓肿模型脑组织病理表现 |
2.4 抗体anti-SA2275通过脑脓肿模型小鼠BBB的能力检测
经检测anti-SA2275多克隆抗体效价为1 :51 200(图 4A)。为明确在金葡菌感染小鼠引起脑脓肿过程中,经腹腔注射的抗体能否通过BBB进入脑组织发挥治疗作用,我们设置实验组动物经腹腔注射anti-SA2275后24 h,再接种金葡菌Newman株琼脂糖球制备脑脓肿模型,注射正常小鼠血清的小鼠脑脓肿模型组(n=6)为阴性对照,未感染的anti-SA2275注射组为空白对照。建模后第3天,采集小鼠脑组织,利用ELISA法检测小鼠脑组织中anti-SA2275滴度。结果发现,实验组脑组织中anti-SA2275滴度显著高于阴性和空白对照组(图 4B,P < 0.01)。这一结果表明,在未感染小鼠中(空白对照组),抗体不能通过BBB,只有在金葡菌引起脑脓肿的过程中,抗体才能进入脑组织,这可能与金葡菌感染导致的小鼠BBB破坏有关。
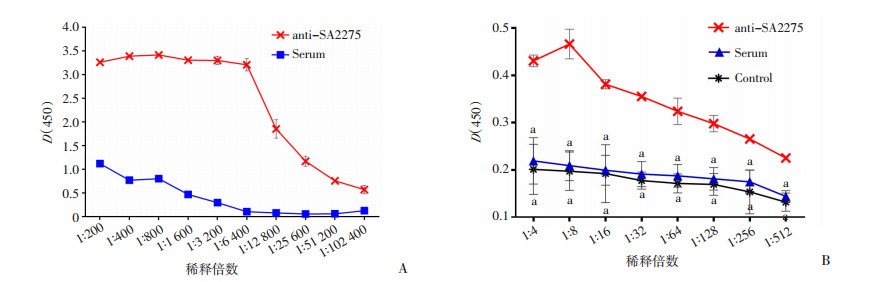
|
| A:anti-SA2275抗体效价,anti-SA2275抗体效价为1 :51 200;B:anti-SA2275滴度,anti-SA2275为小鼠脑脓肿模型腹腔注射anti-SA2275抗血清;Serum为小鼠脑脓肿模型腹腔注射正常血清;Control为未构建脑脓肿模型小鼠腹腔注射anti-SA2275抗血清a: P < 0.01, 与anti-SA2275比较 图 4 ELISA法检测anti-SA2275抗体效价及金葡菌脑脓肿模型脑组织中anti-SA2275滴度计量分析(x±s,n=6) |
2.5 抗体anti-SA2275显著抑制金葡菌所致的脑脓肿形成
为验证抗体anti-SA2275对金葡菌脑脓肿形成的保护作用,本研究将小鼠anti-SA2275抗血清经腹腔注射给药,24 h后接种金葡菌Newman株制作小鼠脑脓肿模型。5 d后处死小鼠,取出脑组织。将脑脓肿组织制备匀浆,铺板进行细菌计数。结果如图 5所示,anti-SA2275能显著降低小鼠脑脓肿中的细菌载量(图 5A,n=8, P < 0.05)及脓肿体积(图 5B,n=6, P < 0.05)。HE染色观察显示,在相近大脑横断面比较,anti-SA2275处理组与正常血清对照组小鼠脑内均可见脑脓肿形成,但anti-SA2275组小鼠脑脓肿面积明显减小(图 6)。
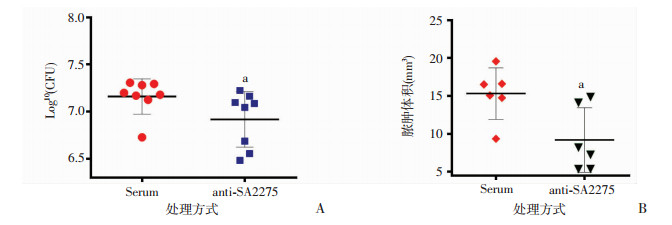
|
| A:小鼠脑脓肿中的细菌载量;B:小鼠脑脓肿体积a:P < 0.05,与Serum比较 图 5 anti-SA2275处理组及正常血清对照组在金葡菌感染小鼠脑脓肿形成中的作用 |
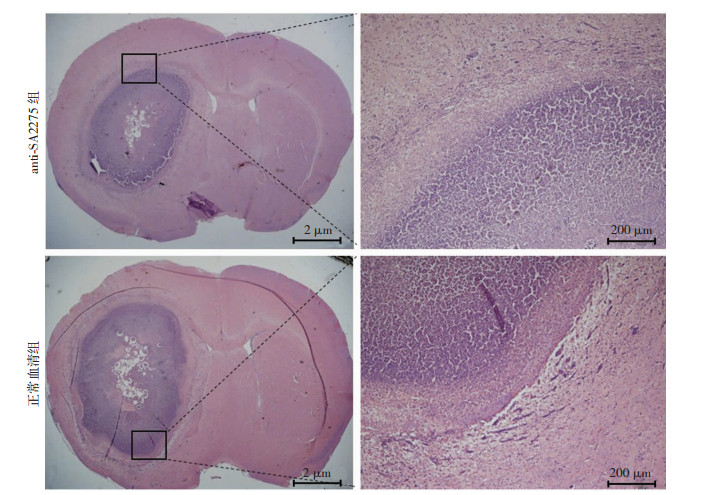
|
| 图 6 HE染色观察anti-SA2275处理组与正常血清对照组小鼠脑脓肿面积 |
3 讨论
脑脓肿是一种严重的中枢神经系统感染,治疗复杂性高,难度大,常常需要联合采用抗生素和外科手术处理[2-3]。金葡菌是引起脑脓肿的常见致病菌[1]。然而,随着金葡菌耐药性问题日益严峻,临床上使用抗生素治疗脑脓肿的效果不佳,亟须开展新型治疗方法的研究和探索[10]。与抗生素在治疗时不能区分致病菌与非致病菌的特性相比,针对致病菌特定毒力因子的抗毒力因子疗法近年来受到广泛关注[5, 11]。抗毒力因子疗法不是直接杀死病原菌,而是利用特异性抗体中和致病性毒力因子或者活性化合物分子,抑制病原菌的毒力,降低其致病性,从而有利于机体的免疫系统清除病原菌,达到替代抗生素治疗致病菌引起感染的目的[11-12]。采用抗体对毒力因子进行中和是抗毒力因子疗法常用的手段。在金葡菌感染的抗毒力因子疗法中,有研究发现金葡菌肠毒素B单克隆抗体可以对该菌导致的小鼠致死性休克发挥保护作用[13]。然而,抗毒力因子疗法作为一种新型的治疗方法,应用于感染引起的中枢神经系统疾病却罕见报道。
通过BBB是抗毒力因子制剂进入脑组织发挥治疗作用的关键。BBB是由被覆脑微血管的上皮细胞、周细胞、星形胶质细胞足突、血管基底膜共同组成,由细胞间紧密连接封闭。BBB将中枢神经系统与外周环境隔离,构成物理、物质转运和代谢的重要屏障,保护机体免受环境毒素的损伤。正常情况下,BBB阻止大部分物质通透,对通过其转运的物质具有严格的选择性,尤其是抗体等生物大分子无法透过[14-15]。动物实验研究发现,正常小鼠经腹腔注射给予单克隆抗体后,在腹腔中随体液经淋巴脉管系统吸收,再入血而分布至各器官,但在脑组织中的分布有限[16]。然而,金葡菌感染可导致BBB的破坏。MCLOUGHLIN等[17]利用异硫氰酸荧光素标记的葡聚糖证实,金葡菌感染能以剂量依赖的方式增加BBB的通透性,这一过程可能与感染降低了BBB结构中的内皮细胞钙粘素、密封蛋白-5、闭锁小带-1等的表达水平有关。BALDWIN和KIELIAN[6]在金葡菌致脑脓肿形成过程中监测到BBB的持续开放。这些研究表明,小鼠脑脓肿形成过程中,BBB通透性会持续增高,为抗体透过BBB发挥脑脓肿治疗作用提供了可能。
金葡菌可编码并表达多种毒力因子,在细菌的定植和感染过程中发挥重要作用。我们前期研究中证实Lgt、溶血素Hla、S表面蛋白SpA是金葡菌引起脑脓肿的关键毒力因子[7]。Lgt为金葡菌合成脂蛋白的关键酶,负责金葡菌中多种脂蛋白的合成。有研究将金葡菌N315株一簇保守的脂蛋白样基因簇(lipoprotein-like genes,lpl,sa2273-2275)敲除后,发现敲除株刺激巨噬细胞炎症因子的表达及对小鼠的致病性均显著降低[8]。SA2275即为该串联脂蛋白中的组分,能与宿主天然免疫细胞表面的TLR2受体结合,激活TLR2依赖的天然免疫系统,诱导宿主炎症反应,增强细菌致病性,因此是金葡菌重要的毒力因子之一[18]。本研究以金葡菌脂蛋白SA2275为毒力因子靶标,进行了脑脓肿的抗毒力因子治疗探讨。ELISA检测发现,经腹腔注射的抗体anti-SA2275不能通过未进行金葡菌感染的小鼠BBB,而感染小鼠在形成脑脓肿的过程中,抗体能顺利达到脑组织,至于金葡菌感染导致BBB损害的机理值得进一步探索。同时,本研究还观察到,到达脑组织的抗体能发挥治疗作用。具体体现在,治疗组小鼠在感染5天时脑组织的细菌载量较正常血清对照组明显降低;脑脓肿的体积也显著缩小。
综上所述,本研究以金葡菌脂蛋白SA2275为靶标,通过建立金葡菌脑脓肿模型,探讨了抗体在治疗金葡菌脑脓肿中的作用。发现抗体在金葡菌中枢感染的前提下能成功通过BBB到达脑组织发挥抗脑脓肿治疗作用,为金葡菌脑脓肿的治疗提供新的思路和可行的替代疗法,具有良好的实际应用前景。
| [1] |
BROUWER M C, COUTINHO J M, VAN DE BEEK D. Clinical characteristics and outcome of brain abscess: systematic review and meta-analysis[J]. Neurology, 2014, 82(9): 806-813. DOI:10.1212/WNL.0000000000000172 |
| [2] |
PATEL K, CLIFFORD D B. Bacterial brain abscess[J]. Neurohospitalist, 2014, 4(4): 196-204. DOI:10.1177/1941874414540684 |
| [3] |
BROUWER M C, TUNKEL A R, MCKHANN G M Ⅱ, et al. Brain abscess[J]. N Engl J Med, 2014, 371(5): 447-456. DOI:10.1056/nejmra1301635 |
| [4] |
WOODHOUSE A. Bacterial meningitis and brain abscess[J]. Medicine, 2017, 45(11): 657-663. DOI:10.1016/j.mpmed.2017.08.012 |
| [5] |
MVHLEN S, DERSCH P. Anti-virulence strategies to target bacterial infections[J]. Curr Top Microbiol Immunol, 2016, 398: 147-183. DOI:10.1007/82_2015_490 |
| [6] |
BALDWIN A C, KIELIAN T. Persistent immune activation associated with a mouse model of Staphylococcus aureus-induced experimental brain abscess[J]. J Neuroimmunol, 2004, 151(1/2): 24-32. DOI:10.1016/j.jneuroim.2004.02.002 |
| [7] |
ZHENG Y, SHANG W L, PENG H G, et al. Virulence determinants are required for brain abscess formation through Staphylococcus aureus infection and are potential targets of antivirulence factor therapy[J]. Front Microbiol, 2019, 10: 682. DOI:10.3389/fmicb.2019.00682 |
| [8] |
SHANG W L, RAO Y F, ZHENG Y, et al. B-lactam antibiotics enhance the pathogenicity of methicillin-resistant Staphylococcus aureus via SarA-controlled lipoprotein-like cluster expression[J]. mBio, 2019, 10(3): e00880-e00819. DOI:10.1128/mBio.00880-19 |
| [9] |
BLOCH O, PAPADOPOULOS M C, MANLEY G T, et al. Aquaporin-4 gene deletion in mice increases focal edema associated with staphylococcal brain abscess[J]. J Neurochem, 2005, 95(1): 254-262. DOI:10.1111/j.1471-4159.2005.03362.x |
| [10] |
TACCONELLI E, CARRARA E, SAVOLDI A, et al. Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis[J]. Lancet Infect Dis, 2018, 18(3): 318-327. DOI:10.1016/S1473-3099(17)30753-3 |
| [11] |
GUARNER F, MALAGELADA J R. Gut flora in health and disease[J]. Lancet, 2003, 361(9356): 512-519. DOI:10.1016/s0140-6736(03)12489-0 |
| [12] |
SAYLOR C, DADACHOVA E, CASADEVALL A. Monoclonal antibody-based therapies for microbial diseases[J]. Vaccine, 2009, 27: G38-G46. DOI:10.1016/j.vaccine.2009.09.105 |
| [13] |
CHOW S K, CASADEVALL A. Monoclonal antibodies and toxins: a perspective on function and isotype[J]. Toxins (Basel), 2012, 4(6): 430-454. DOI:10.3390/toxins4060430 |
| [14] |
PARDRIDGE W M. Biopharmaceutical drug targeting to the brain[J]. J Drug Target, 2010, 18(3): 157-167. DOI:10.3109/10611860903548354 |
| [15] |
AZAD T D, PAN J, CONNOLLY I D, et al. Therapeutic strategies to improve drug delivery across the blood-brain barrier[J]. Neurosurg Focus, 2015, 38(3): E9. DOI:10.3171/2014.12.FOCUS14758 |
| [16] |
FLESSNER M F, DEDRICK R L. Tissue-level transport mechanisms of intraperitoneally-administered monoclonal antibodies[J]. J Control Release, 1998, 53(1/2/3): 69-75. DOI:10.1016/s0168-3659(97)00238-1 |
| [17] |
MCLOUGHLIN A, ROCHFORT K D, MCDONNELL C J, et al. Staphylococcus aureus-mediated blood-brain barrier injury: an in vitro human brain microvascular endothelial cell model[J]. Cell Microbiol, 2017, 19(3). DOI:10.1111/cmi.12664 |
| [18] |
NGUYEN M T, GÖTZ F. Lipoproteins of gram-positive bacteria: key players in the immune response and virulence[J]. Microbiol Mol Biol Rev, 2016, 80(3): 891-903. DOI:10.1128/MMBR.00028-16 |



