动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)是神经外科最危重的疾病之一,致死率和致残率极高[1]。其病理机制研究既往主要集中在与神经元相关的脑皮质,但新近研究发现,白质的损伤在蛛网膜下腔出血后的神经功能障碍中也起着极为重要的作用,而其具体机制尚未完全阐明[2]。白质损伤(white matter damage, WMD)常见于众多脱髓鞘病变中,而在众多引起脱髓鞘病变白质损伤的因素中,炎症起着至关重要的作用[3]。炎症作为蛛网膜下腔出血后的主要热点之一,其与神经元凋亡及损伤的关系已被大量文献所报道[4-5],但蛛网膜下腔出血后炎症与白质损伤之间关系尚不清楚。
Dexras1(Rasd1)是一种脑组织富含的鸟苷酸结合蛋白,既往的研究主要聚焦于该分子在调节昼夜节律和肿瘤细胞凋亡中的作用方面[6-7]。最近的研究表明,Dexras1可以在体外抑制腺苷酸环化酶的活性,从而抑制cAMP-PKA-CREB信号通路[8]。进一步的研究表明,抑制cAMP降解和激活cAMP-CREB通路表达可以显著降低TNF-α和ILs的水平,并最终减少炎症[9-10]。因此,我们推测Dexras1可能通过cAMP-CREB通路促进炎症,而炎症作为蛛网膜下腔出血后主要的病理变化之一,我们有充分的理由相信Dexras1可能在蛛网膜下腔出血后的炎症反应中同样具有极其重要的作用。所以本实验将探索Dexras1在蛛网膜下腔出血中促进炎症并参与白质损伤的机制,为进一步研究蛛网膜下腔出血的治疗提供基础支持。
1 材料与方法 1.1 实验动物及分组90只成年健康雄性SD大鼠均购置于重庆医科大学实验动物中心,体质量为280~320 g,将SD大鼠随机编号抽签,且分为假手术sham组、蛛网膜下腔出血SAH组、蛛网膜下腔出血SAH时间点组、蛛网膜下腔出血+空载病毒SAH+LV-Scramble组、蛛网膜下腔出血+Dexras1慢病毒SAH+LV- Dexras1+组、蛛网膜下腔出血+Dexras1慢病毒SAH+LV- Dexras1-组,各类实验每组3只。在SD大鼠获取脑组织标本时参照MO等[11]的方法进行蛛血严重程度评分,评分低于5分及由于麻醉等原因在术中或术后非预期死亡的15只大鼠不计入实验分组。
1.2 药品与试剂对照慢病毒(LV-Scramble)和过表达及抑制Dexras1的慢病毒(LV- Dexras1)均购置于上海吉玛制药有限公司,基因名称及ID为:LV5-Rasd1(rat),NM_001270954.1,Dexras1慢病毒抑制序列为:LV3-Rasd1-Rat-127(S1):GCGACTCTGAACTGAGTATCC;LV3-Rasd1-Rat-320(S2):GGACACATCTGGCAATCATCC;LV3-Rasd1-Rat-582(S3):GGCGATGACCCTCAGCGTTGT。试剂:myelin basic protein抗体(MBP, 1 :1 000, Abcam公司, ab62631, 美国), Dexras1抗体(1 :1 000, Abcam公司, ab78459,美国), NeuN抗体(1 :50, Merck Millipore, Billerica, MA, USA),Iba-1抗体(1 :1 000, Abcam公司, ab15690, 美国), anti-GFAP(1 :1 000, Abcam公司,ab10062, 美国),TNF-α抗体(1 :1 000, Cell Singnaling Technology公司, #8184, 美国), IL-1β抗体(1 :1 000, Abcam公司, ab9722,美国)和β-actin抗体(1 :1 000, Cell Singnaling Technology公司, #4970, 美国).荧光定量PCR相关试剂(Takara公司,日本)。
1.3 SD大鼠SAH模型构建SD大鼠蛛网膜下腔出血SAH模型参考既往血管内穿刺法构建[12],予以戊巴比妥(50 mg/kg)经腹腔注射麻醉大鼠,大鼠取仰卧位,于颈部正中切口,逐渐分离并暴露颈总动脉、颈外动脉及颈内动脉。动脉夹阻断颈内动脉、颈总动脉,结扎颈外动脉远端后切断并游离颈外动脉,将颈外动脉残端拉下使其与颈内动脉成一直线,将4-0尼龙线插入颈外动脉残端,并继续前行经颈总动脉至颈内动脉颅内段,直到有阻力感后继续插入2 mm,穿刺成功后有落空感。尼龙线在穿刺成功后10 s拔出,结扎颈外动脉残端并恢复颈内动脉血流,这样血液便会经穿刺口破入蛛网膜下腔,最后缝合并消毒伤口。假手术组操作方法与模型组类似,但尼龙线插入后不刺破血管。术后将大鼠置于电热毯上复苏苏醒。
1.4 慢病毒侧脑室注射本实验选用LV-Dexras1过表达及抑制Dexras1 mRNA及蛋白的表达,从而验证Dexras1在蛛网膜下腔出血中的作用,侧脑室注射方法参考GERAERTS等[13]报道的方法,SAH造模前7 d通过SD大鼠侧脑室内分别注射慢病毒LV-Dexras1+、LV-Dexras1-或LV-Scramble[14]。腹腔注射戊巴比妥(50 mg/kg)使大鼠麻醉后,将其固定在脑立体定位装置(Stoelting,美国)上。在前囟右侧旁开1.3 mm,向后1.5 mm处予以微型电钻钻1小骨孔,通过立体定位装置将10 μL Hamilton微量注射器(Hamilton Co.,美国)从骨孔插入距离硬脑膜下3.8 mm达到侧脑室。随后将6 μL过表达病毒LV-Dexras1+(109 TU/mL)、6 μL敲低病毒LV-Dexras1-(109 TU/mL)或对照组病毒LV-Scramble (109TU/mL)以0.5 μL/min的速度缓慢注入右侧脑室。待注射完毕后停留5 min防止病毒回流,最后缓慢退出Hamilton注射器并予以骨蜡封闭骨孔后缝合头皮。
1.5 指标检测及方法 1.5.1 免疫荧光检测免疫荧光方法参考Zhou K[15]等报道的方法,大鼠SAH造模后24 h,经腹腔注射戊巴比妥(50 mg/kg)麻醉大鼠,随后予以生理盐水和4%多聚甲醛充分灌注大鼠后完整取出脑组织,接下来经固定、脱水后放置于-80 ℃中冻存,最后用冷冻切片机制作成10 μm厚的冰冻切片备用。实验时取出切片晾片10 min,PBS洗片3×10 min,0.5%Triton破膜1 h,PBS洗片3×10 min,予以枸橼酸盐溶液高火3 min及低火15 min进行抗原修复后自然冷却,PBS洗片3×10 min,山羊血清37 ℃孵育2 h封闭,甩干血清并孵育对应目的蛋白一抗4 ℃过夜。次日37 ℃复温1 h,PBS洗片3×10 min,37 ℃孵育相应的羊抗兔(CY3,武汉三鹰)和羊抗鼠(FITC,武汉三鹰)荧光二抗1 h,PBS洗片3×10 min;DAPI染核10 min,PBS洗片3×10 min,甘油封片后用荧光显微镜(FV1200,Olympus,日本)对切片进行观察和拍照分析。
1.5.2 Real-time PCR检测各组大鼠大脑皮质总RNA提取及逆转录成DNA方法参照Takara公司说明书。依据GenBank基因序列结果,扩增大鼠Dexras1 mRNA引物为Sense primer: 5′- GGACGCTTACACCCCTACCAT-3′,Anti-sense primer: 5′-GGAAACGGATGATTGCCAGA-3′,管家基因β-actin引物序列为Sense primer:5′-TGTCACCAACTGGGACGATA-3′,Anti-sense primer:5′-GGGGTGTTGAAGGTCTCAAA-3′。DNA扩增程序为预变性95 ℃ 30 s,PCR反应:95 ℃ 5 s、60 ℃ 30 s,共40个循环。结果使用Bio-Rad CFX Manager软件进行分析。
1.5.3 Western blot检测首先检测蛛网膜下腔出血后不同时间点的表达,发现Dexras1在蛛网膜下腔出血后24 h表达明显升高,因此将24 h作为其他相关指标的检测点,蛋白检测方法为在相应处理及时间点收集脑组织标本并冻存于-80 ℃[15],蛋白提取时分别称取各组皮质于EP管中,同时在各管中加入适量裂解液和蛋白酶抑制剂混合液(样本组织:裂解液=1 mg :3 μL),机械及超声破碎组织并放置于冰上20 min。然后以12 000 r/min在4 ℃离心机中离心15 min,吸取上清液,BCA试剂盒分别测量各标本蛋白浓度,予以蛋白上样缓冲液将各标本配平为相同浓度,蛋白标本煮沸变性离心后以上样量50 μg进行凝胶电泳,并经电转将蛋白固定至PVDF膜上,5%脱脂牛奶封闭2 h,4 ℃一抗孵育蛋白条带过夜。次日TBST洗膜3次,每次10 min,二抗孵育1 h,然后TBST洗膜3×10 min,ECL发光液显影蛋白条带,最后应用Fusion软件分析条带灰度值。
1.6 神经行为学评分参照MO等[11]的方法,在SAH后24 h使用modified garcia scale进行动物行为学评分,总分18分。观察指标主要包括以下6个项目:自主活动(0-3),四肢自主运动(0-3),前肢伸展性(0-3),攀爬运动(1-3),触须反应(1-3)及肢体的本体感觉(1-3)。将六项得分相加,评分越低提示神经功能缺损情况越严重;
1.7 脑组织含水量测定干湿法测定脑水含量参考Mo J等[11]的报道。在SAH造模后24 h处死大鼠并完整取出大脑组织,去除脑膜、表面血块后立即称量脑组织质量,即为湿质量,经过烘箱(105 ℃)中烘烤24 h后称重则为干质量。脑组织含水量=(湿质量-干质量)/湿质量×100%。
1.8 神经脊髓固蓝染色(Luxol fast blue staining)如前所述,神经脊髓固蓝染色(Luxol fast blue staining)参考TAKAHASHI等[16]的方法染色观察髓鞘变化。标本取材及制片同免疫荧光。用0.01 mol/L磷酸盐缓冲液PBS漂洗3次,每次10 min,接着将切片在0.1%luxol fast blue染色试剂盒(abcam,ab150675,MA,USA)中染色过夜,次日在95%乙醇和蒸馏水中漂洗以去除多余的蓝色斑点,然后将切片置于碳酸锂溶液中分色30 s,继续用70%的乙醇将颜色分离为灰色,白色物质为蓝色。下一步将其以80%、95%、100%的乙醇梯度脱水1 min,并用二甲苯透明2次,每次15 min,并且用中性树脂覆盖。最后使用Leica IM1000图像分析软件分析固蓝染色的区域。
1.9 统计学分析运用SPSS 23.0对所有数据进行统计分析,计量资料以x±s表示,两组间差异比较采用t检验; 多组间比较采用单因素分析,事后检验比较两组之间的差异采用Dunnett’s检验。检验水准α=0.05或0.01。
2 结果 2.1 蛛网膜下腔出血后Dexras1显著升高,MBP显著降低与sham组相比,SAH后6、12、24、48、72 h Dexras1的表达先升高后降低,24 h显著增高(P < 0.01),48 h后逐渐下降,72 h已经逐渐恢复接近sham组;MBP蛛网膜下腔出血后逐渐下降,24 h后显著降低(P < 0.01,图 1)。
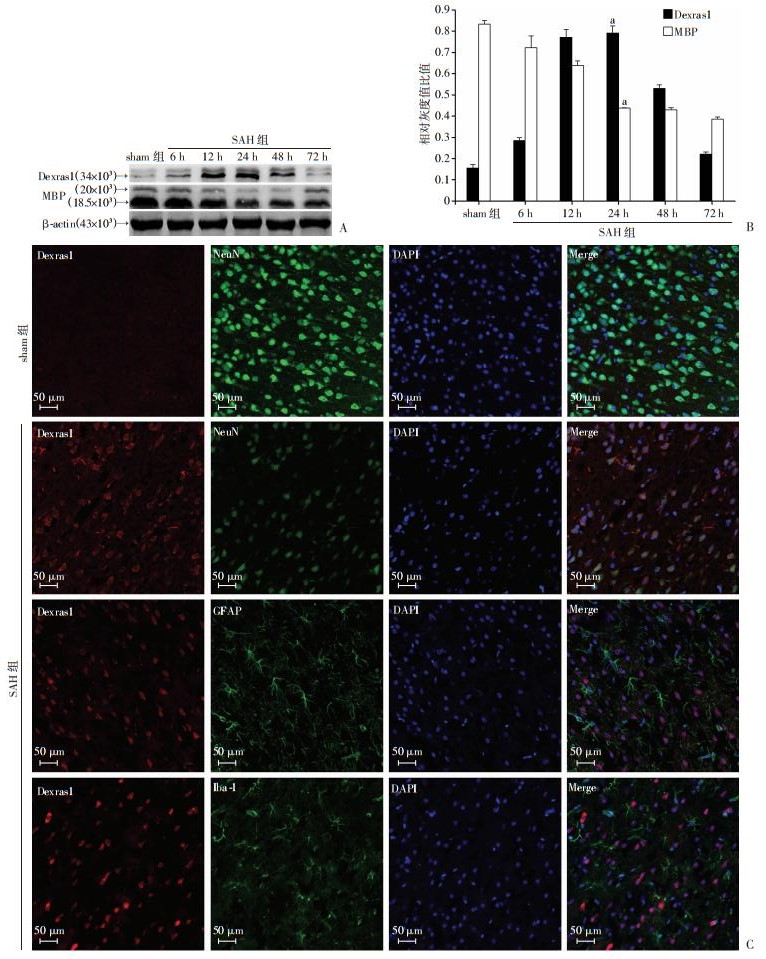
|
| A:Western blot检测蛛网膜下腔出血后不同时间点Dexras1和MBP的表达;B:半定量分析 a:P < 0.01,与sham组比较;C:免疫荧光检测示蛛网膜下腔出血后皮层Dexras1显著增加,并且主要定位于大鼠皮层神经元中 图 1 蛛网膜下腔出血后Dexras1、MBP的表达变化 |
2.2 Dexras1在蛛网膜下腔出血后主要定位于脑皮层神经元
免疫荧光检测Dexras1分别与神经元(NeuN)、星型胶质细胞(GFAP)及小胶质细胞(Iba-1)进行共定位,结果显示Dexras1在蛛网膜下腔出血后24 h表达明显增加且主要定位于脑皮层神经元(图 1C)。
2.3 Dexras1过表达及抑制后炎症因子TNF-α、IL-1β及髓鞘蛋白MBP的表达予以Dexras1慢病毒干预并造模后24 h,与SAH组和SAH+LV-Scramble组比较,SAH+LV-Dexras1+组Dexras1mRNA的表达显著升高(P < 0.01,图 2A),SAH+LV-Dexras1-组S2序列Dexras1mRNA的表达明显下降(P < 0.01,图 2B),同时Western blot结果显示SAH+LV-Dexras1+组Dexras1蛋白水平也明显升高(P < 0.01,图 2C、D),SAH+LV-Dexras1-组Dexras1蛋白水平明显下降(P < 0.01,图 2C、D),说明LV-Dexras1成功上调或下调了蛛网膜下腔出血后Dexras1mRNA及蛋白水平的表达。在有效上调及下调Dexras1后,发现SAH+LV-Dexras1+组较SAH+LV-Scramble组TNF-α及IL-1β蛋白表达明显增强(P < 0.01,图 2C、E),同时伴随着MBP蛋白水平的明显下降(P < 0.05,图 2C、D)。而SAH+LV-Dexras1-组较SAH+LV-Scramble组TNF-α及IL-1β蛋白表达明显下降(P < 0.01,图 2C、E),同时伴随着SAH+LV-Dexras1-组MBP蛋白水平的明显上升(P < 0.05,图 2C、D)。结果提示蛛网膜下腔出血后Dexras1的升高可能促进了炎症反应并导致了髓鞘碱性蛋白MBP的下降。
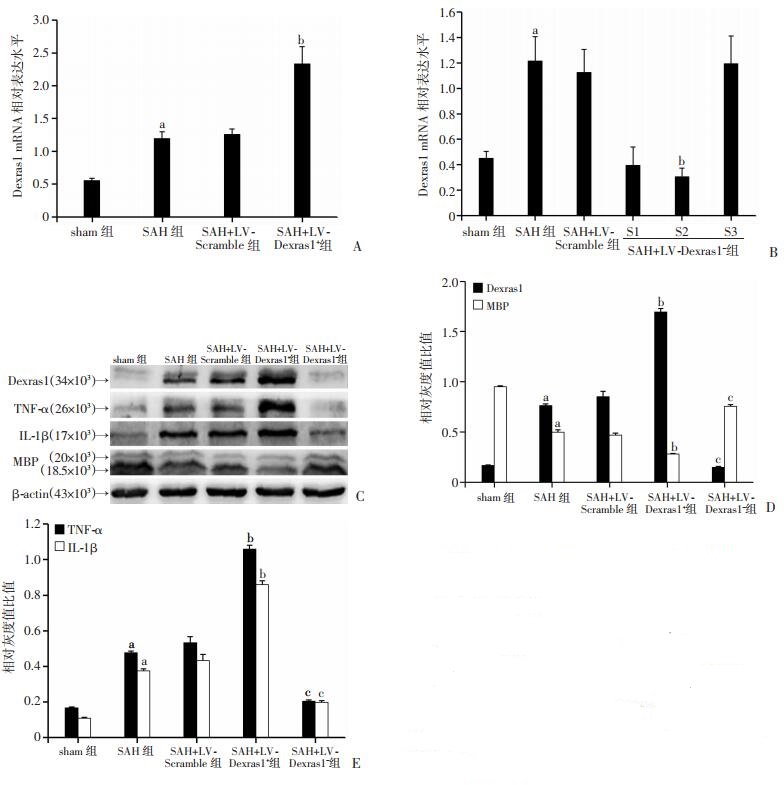
|
| a:P<0.05, 与sham组比较;b:P<0.05,与SAH+LV-scramble组比较;c:P<0.05,与SAH+LV-scramble组比较;A:LV-Dexrasl*干预后通过PCR检测DexraslmRNA 表达; B:LV-Dexras1-干预后,PCR检测Dexras I mRNA表达;C:Western blot检测LV-Dexrasl *和LV -Dexras1-干预后Dexras1 ,MBP ,TNF-a和IL-1β蛋白的表达;D:Western blot半定量分析;E:Western blot半定量分析 图 2 Dexras1过表达及抑制后炎症因子TNF-α.IL-1及髓鞘蛋白MBP的表达 |
2.4 Dexras1可能参与了蛛网膜下腔出血后白质损伤并加重了神经功能障碍
神经功能评分和脑组织含水量的检测是评估蛛网膜下腔出血后脑损伤的重要指标,与sham组比较,神经行为学评分在SAH后24 h显著降低(P < 0.05, 图 3A),脑组织含水量明显增加(P < 0.05, 图 3B);予以上调Dexras1干预SD大鼠后,SAH+LV-Dexras1+与SAH+LV-Scramble两组相比,神经行为学评分进一步降低(P < 0.05, 图 3A),脑水肿明显加重(P < 0.05, 图 3B);下调Dexras1干预SD大鼠后,SAH+LV-Dexras1—组与SAH+LV-Scramble两组相比,神经行为学评分明显升高(P < 0.05, 图 3A),脑水肿明显减轻(P < 0.05, 图 3B)。
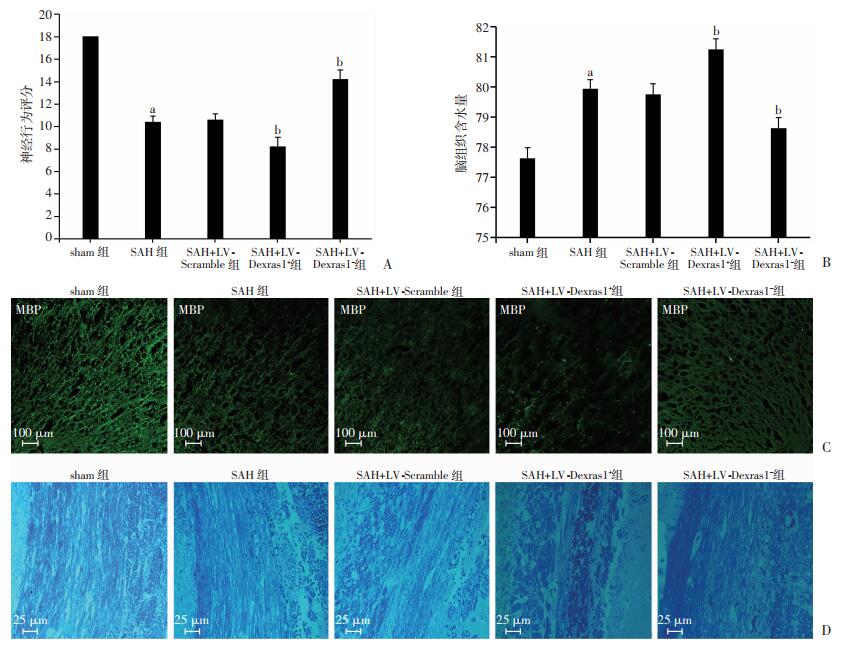
|
| a:P<0.05, 与sham组比较;b:P<0.05,与SAH+LV-scramble组比较;A:神经行为评分;B:脑组织各脑区含水量;C:免疫荧光检测各组皮层髓鞘碱性蛋白的变化; D:神经脊髓固蓝染色检测各组之间胼胝体髓鞘的变化 图3Dexras1在蛛网膜下腔出血后白质损伤及神经功能障碍中的作用 图 3 Dexras1在蛛网膜下腔出血后白质损伤及神经功能障碍中的作用 |
免疫荧光检测大鼠脑皮层中的髓鞘标记蛋白MBP,发现SAH组较sham组MBP的表达明显降低,髓鞘纹理减弱,髓鞘宽度变窄(图 3C)。LV-Dexras1上调干预SD大鼠后,SAH+LV-Dexras1+组MBP的表达进一步降低,髓鞘纹理愈加减弱;而用LV-Dexras1下调干预SD大鼠后,SAH+LV-Dexras1-组与SAH+LV-Scramble组相比可见MBP的表达明显增多,髓鞘纹理也更加清晰(图 3C)。
神经脊髓固蓝染色结果显示蛛网膜下腔出血后胼胝体髓鞘纹理明显紊乱及减少,同时伴随明显炎性的细胞浸润(图 3D);SAH+LV-Dexras1+组髓鞘损伤愈加恶化,炎性细胞浸润进一步增多;而SAH+LV-Dexras1-组则可见髓鞘损伤较SAH+LV-Scramble组明显减轻,同时炎性细胞浸润也明显减少(图 3D)。
以上结果均说明了Dexras1可能参与了蛛网膜下腔出血后白质损伤。
3 讨论蛛网膜下腔出血是神经外科最危重的神经外科疾病之一,YEO等[17]发现22例SAH患者在7周后皮质脊髓束(corticospinal tract,CST)可出现损伤,并导致了蛛网膜下腔出血患者运动功能的减弱;EGASHIRA[18]等发现SAH后的小鼠早期即出现白质纤维的损害,神经元轴突和Olgs等的损伤;上述研究结果表明,SAH后存在白质损伤可能是导致神经功能障碍的重要病理机制,是患者预后不良的主要原因之一,但目前SAH后白质损伤的相关机制却鲜有研究。
白质损伤常见于众多脱髓鞘病变中,既往研究认为白质损伤主要与炎症、少突胶质细胞凋亡及铁死亡等相关[19-20]。脑白质区域主要成分包含大量星形胶质细胞和小胶质细胞,当中枢神经系统发生损伤后,这些炎性胶质细胞会激活并分泌大量的炎症细胞因子加重脑损伤[21]。而KUMMER等也在对SAH后的白质损伤进行机制探讨时发现,在胼胝体联合、外囊、内囊等白质区域也存在明显的胶质细胞活化情况,并与白质损伤严重程度密切相关[22]。为了进一步探讨SAH后的炎性反应与白质损伤的关系,我们通过构建大鼠蛛网膜下腔出血模型,在该模型中观察炎症反应及髓鞘改变情况。
Dexras1是由一氧化氮(NO)激活的一种小G蛋白,可以在激活的小胶质细胞/巨噬细胞或神经元中产生[23],前期对Dexras1的研究主要聚焦于调节昼夜节律和肿瘤细胞凋亡等方面[6-7]。KHAN等[24]在近期研究中通过基因敲减Dexras1发现其可以在实验性视神经炎中改善髓鞘损伤,从而发挥神经保护作用。而Dexras1是否在蛛网膜下腔出血后也参与以髓鞘损伤为特征的白质损伤尚不清楚。本研究发现Dexras1在蛛网膜下腔出血后出现明显升高,同时课题组前期研究也发现蛛网膜下腔出血后会导致TNF-α及IL-1β等炎症因子显著升高,且在SAH后24 h升高最明显[25]。通过上调及下调Dexras1后构建SAH模型发现,TNF-α、IL-1β等炎症因子会出现协同上升和下降,同时伴随髓鞘碱性蛋白MBP的减少及改善,而且免疫荧光及神经脊髓固蓝染色也发生相应的髓鞘改变及炎性细胞浸润的增多和减少,这些变化与脑缺血后白质损伤所引起髓鞘的改变相似[26]。以上结果首次证实了Dexras1参与了SAH后的脑白质损伤,其机制可能与Dexras1促进炎症反应相关。
炎症反应在蛛网膜下腔出血后具有极其重要的作用,且以TNF-α、IL-1β等炎症因子升高、细胞水肿和炎症细胞浸润等为主要特征[27],SAH后的炎症反应与氧化应激有着极其密切的关系[28]。Dexras1作为由一氧化氮(NO)激活的一种小G蛋白,可以抑制腺苷酸环化酶的活性并且加重氧化应激[8, 23],因此在蛛网膜下腔出血后Dexras1正是可能通过抑制腺苷酸环化酶的活性及加重氧化应激而促进炎症反应,并进而引起SAH后的脑白质损伤。这一结论也与SONG等[29]在缺血性脑卒中模型中发现胶质细胞介导的炎性反应与白质损伤有关的结论高度类似。
综上所述,基于髓鞘损伤作为白质损伤的主要病理变化,本研究分别从分子生物学和形态学方面对Dexras1在SAH炎症反应及脑白质损伤中的作用进行了研究,阐明了Dexras1参与SAH后白质损伤的可能机制。前期研究发现Dexras1可以减轻视网膜神经节细胞铁聚集,从而改善了神经功能损害[24]。本研究尚未对SAH后Dexras1导致炎症的具体通路进行深入研究。本课题组后期将对Dexras1导致SAH后炎症的具体通路及白质损伤的其他相关机制进行更加深入的研究,以期能为临床工作提供更好的研究支持。
| [1] |
MACDONALD R L, SCHWEIZER T A. Spontaneous subarachnoid haemorrhage[J]. Lancet, 2017, 389(10069): 655-666. DOI:10.1016/s0140-6736(16)30668-7 |
| [2] |
LI R, VENKAT P, CHOPP M, et al. RP001 hydrochloride improves neurological outcome after subarachnoid hemorrhage[J]. J Neurol Sci, 2019, 399: 6-14. DOI:10.1016/j.jns.2019.02.005 |
| [3] |
STEPHENSON J, NUTMA E, VAN DER VALK P, et al. Inflammation in CNS neurodegenerative diseases[J]. Immunology, 2018, 154(2): 204-219. DOI:10.1111/imm.12922 |
| [4] |
BEVERS M B, WOLCOTT Z, BACHE S, et al. Soluble ST2 links inflammation to outcome after subarachnoid hemorrhage[J]. Ann Neurol, 2019, 86(3): 384-394. DOI:10.1002/ana.25545 |
| [5] |
LUCKE-WOLD B P, LOGSDON A F, MANORANJAN B, et al. Aneurysmal subarachnoid hemorrhage and neuroinflammation: a comprehensive review[J]. Int J Mol Sci, 2016, 17(4): 497. DOI:10.3390/ijms17040497 |
| [6] |
CHENG H Y, OBRIETAN K. Dexras1: shaping the responsiveness of the circadian clock[J]. Semin Cell Dev Biol, 2006, 17(3): 345-351. DOI:10.1016/j.semcdb.2006.03.006 |
| [7] |
THAPLIYAL A, VERMA R, KUMAR N. Small G proteins Dexras1 and RHES and their role in pathophysiological processes[J]. Int J Cell Biol, 2014, 2014: 308535. DOI:10.1155/2014/308535 |
| [8] |
GREENWOOD M P, GREENWOOD M, MECAWI A S, et al. Rasd1, a small G protein with a big role in the hypothalamic response to neuronal activation[J]. Mol Brain, 2016, 9: 1. DOI:10.1186/s13041-015-0182-2 |
| [9] |
GRAHAM T E, QIAO Z, DORIN R I. Dexras1 inhibits adenylyl cyclase[J]. Biochem Biophys Res Commun, 2004, 316(2): 307-312. DOI:10.1016/j.bbrc.2004.02.049 |
| [10] |
ONG S A, TAN J J, TEW W L, et al. Rasd1 modulates the coactivator function of NonO in the cyclic AMP pathway[J]. PLoS ONE, 2011, 6(9): e24401. DOI:10.1371/journal.pone.0024401 |
| [11] |
MO J, ENKHJARGAL B, TRAVIS Z D, et al. AVE 0991 attenuates oxidative stress and neuronal apoptosis via Mas/PKA/CREB/UCP-2 pathway after subarachnoid hemorrhage in rats[J]. Redox Biol, 2019, 20: 75-86. DOI:10.1016/j.redox.2018.09.022 |
| [12] |
CHEN J Y, QIAN C, DUAN H Y, et al. Melatonin attenuates neurogenic pulmonary edema via the regulation of inflammation and apoptosis after subarachnoid hemorrhage in rats[J]. J Pineal Res, 2015, 59(4): 469-477. DOI:10.1111/jpi.12278 |
| [13] |
GERAERTS M, EGGERMONT K, HERNANDEZ-ACOSTA P, et al. Lentiviral vectors mediate efficient and stable gene transfer in adult neural stem cells in vivo[J]. Hum Gene Ther, 2006, 17(6): 635-650. DOI:10.1089/hum.2006.17.635 |
| [14] |
XU H B, QIN W Y, HU X, et al. Lentivirus-mediated overexpression of OTULIN ameliorates microglia activation and neuroinflammation by depressing the activation of the NF-κB signaling pathway in cerebral ischemia/reperfusion rats[J]. J Neuroinflam, 2018, 15(1): 83. DOI:10.1186/s12974-018-1117-5 |
| [15] |
ZHOU K R, ENKHJARGAL B, XIE Z Y, et al. Dihydrolipoic acid inhibits lysosomal rupture and NLRP3 through lysosome-associated membrane protein-1/calcium/calmodulin-dependent protein kinase II/TAK1 pathways after subarachnoid hemorrhage in rat[J]. Stroke, 2018, 49(1): 175-183. DOI:10.1161/STROKEAHA.117.018593 |
| [16] |
TAKAHASHI E, DAI G P, ROSEN G D, et al. Developing neocortex organization and connectivity in cats revealed by direct correlation of diffusion tractography and histology[J]. Cereb Cortex, 2011, 21(1): 200-211. DOI:10.1093/cercor/bhq084 |
| [17] |
YEO S S, CHOI B Y, CHANG C H, et al. Evidence of corticospinal tract injury at midbrain in patients with subarachnoid hemorrhage[J]. Stroke, 2012, 43(8): 2239-2241. DOI:10.1161/STROKEAHA.112.661116 |
| [18] |
EGASHIRA Y, HUA Y, KEEP R F, et al. Acute white matter injury after experimental subarachnoid hemorrhage: potential role of lipocalin 2[J]. Stroke, 2014, 45(7): 2141-2143. DOI:10.1161/STROKEAHA.114.005307. |
| [19] |
ZANNO A E, ROMER M A, FOX L, et al. Reducing Th2 inflammation through neutralizing IL-4 antibody rescues myelination in IUGR rat brain[J]. J Neurodev Disord, 2019, 11(1): 34. DOI:10.1186/s11689-019-9297-6 |
| [20] |
LEONETTI C, MACREZ R, PRUVOST M, et al. Tissue-type plasminogen activator exerts EGF-like chemokinetic effects on oligodendrocytes in white matter(re)myelination[J]. Mol Neurodegener, 2017, 12(1): 20. DOI:10.1186/s13024-017-0160-5 |
| [21] |
WIXEY J A, LEE K M, MILLER S M, et al. Neuropathology in intrauterine growth restricted newborn piglets is associated with glial activation and proinflammatory status in the brain[J]. J Neuroinflammation, 2019, 16(1): 5. DOI:10.1186/s12974-018-1392-1 |
| [22] |
KUMMER T T, MAGNONI S, MACDONALD C L, et al. Experimental subarachnoid haemorrhage results in multifocal axonal injury[J]. Brain, 2015, 138(Pt 9): 2608-2618. DOI:10.1093/brain/awv180 |
| [23] |
BOUCHARD-CANNON P, LOWDEN C, TRINH D, et al. Dexras1 is a homeostatic regulator of exercise-dependent proliferation and cell survival in the hippocampal neurogenic niche[J]. Sci Rep, 2018, 8(1): 5294. DOI:10.1038/s41598-018-23673-z |
| [24] |
KHAN R S, BAUMANN B, DINE K, et al. Dexras1 deletion and iron chelation promote neuroprotection in experimental optic neuritis[J]. Sci Rep, 2019, 9(1): 11664. DOI:10.1038/s41598-019-48087-3 |
| [25] |
ZHAO Q, CHE X D, ZHANG H X, et al. Thioredoxin-interacting protein links endoplasmic Reticulum stress to inflammatory brain injury and apoptosis after subarachnoid haemorrhage[J]. J Neuroinflammation, 2017, 14(1): 104. DOI:10.1186/s12974-017-0878-6 |
| [26] |
ZHAO Y S, WANG H Y, CHEN W, et al. Melatonin attenuates white matter damage after focal brain ischemia in rats by regulating the TLR4/NF-κB pathway[J]. Brain Res Bull, 2019, 150: 168-178. DOI:10.1016/j.brainresbull.2019.05.019 |
| [27] |
OKADA T, SUZUKI H. Mechanisms of neuroinflammation and inflammatory mediators involved in brain injury following subarachnoid hemorrhage[J]. Histol Histopathol, 2020, 18208. DOI:10.14670/HH-18-208 |
| [28] |
ZHUANG K, ZUO Y C, SHERCHAN P, et al. Hydrogen inhalation attenuates oxidative stress related endothelial cells injury after subarachnoid hemorrhage in rats[J]. Front Neurosci, 2019, 13: 1441. DOI:10.3389/fnins.2019.01441 |
| [29] |
SONG S S, WANG S X, PIGOTT V M, et al. Selective role of Na+/H+ exchanger in Cx3cr1+ microglial activation, white matter demyelination, and post-stroke function recovery[J]. Glia, 2018, 66(11): 2279-2298. DOI:10.1002/glia.23456 |



