糖尿病足感染(diabetic foot infection, DFI)是糖尿病并发症之一,可导致糖尿病患者住院治疗、截肢,甚至死亡[1]。目前研究发现,地域环境、Wagner分级、溃疡病程、抗生素选择等因素可影响DFI的病原菌分布[2-3],并且抗生素的不合理应用,导致了多重耐药(multidrug resistant, MDR)菌株不断增加,如耐甲氧西林金黄色葡萄球菌(methicillin resistant Staphylococcus aureus, MRSA)、产超广谱β内酰胺酶(extended spectrum β-lactamases, ESBLs)和耐碳青酶烯类肠杆菌等[4]。耐药菌的出现导致抗生素的治疗效果明显下降,显著增加了糖尿病足患者的住院时间、诊疗费用和死亡率[5]。关于DFI病原菌谱和抗生素耐药性方面的研究众多,但营养和代谢因素对DFI的影响尚存在争议,反映糖尿病足进程的代谢标志物和危险因素的研究报道较少。为明确重庆地区DFI病原菌谱、耐药性和代谢特征,本研究基于Wagner分级标准通过回顾性分析286例DFI患者的足部病原菌培养和药敏试验结果,分析轻、重型DFI患者的病原菌谱、耐药性特征及生化指标等,以期为临床糖尿病足的管理提供更多依据。
1 资料与方法 1.1 临床资料选取从2013年1月至2019年7月在我院高血压内分泌科住院的286例DFI患者为研究对象,回顾性分析研究对象的临床信息。收集的临床信息包括性别、年龄、体质量指数(body mass index, BMI)、病程、并发症、溃疡部位、Wagner分级、糖化血红蛋白(hemoglobin A1c, HbA1c)、尿酸(uric acid, UA)、白蛋白(albumin, ALB)、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、高密度脂蛋白(high density lipoprotein cholesterol, HDL-C)、低密度脂蛋白(low density lipoprotein cholesterol, LDL-C)、门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、肌酐(creatinine, Cr)、血红蛋白(hemoglobin, Hb)、白细胞计数(white blood cell count, WBC)、中性粒细胞百分比(neutrophil percentage, NEUT%)、降钙素原(procalcitonin, PCT)、C反应蛋白(C-reactive protein, CRP)、踝肱指数(ankle brachial index, ABI)、趾肱指数(toe brachial index, TBI)、足溃疡深部组织培养鉴定及药敏试验等。纳入患者均符合世界卫生组织制定的糖尿病诊断标准[6]和国际糖尿病足工作组发布的DFI相关诊断标准[7],排除资料不全、患糖尿病足但未合并感染的患者。本研究获得了本院伦理委员会的批准(批准号201975)。
1.2 病原菌培养鉴定与药敏试验足部采样均在应用抗生素之前进行。生理盐水清洗采样部位和周围组织后,用无菌器械切取约0.5 cm× 0.5 cm的溃疡深部组织置于无菌容器内,立即送至检验科。采集的标本均严格按照《全国临床检验操作规程》进行细菌分离培养,采用法国梅里埃VITEK2全自动微生物鉴定及药敏分析系统进行病原菌鉴定和药敏试验。参照美国临床实验室标准化委员会(NCCLS)制定的相关标准,依据最低抑菌浓度(minimal inhibitory concentration, MIC)将抗菌药物的抑菌效果判定为耐药、中介和敏感。对三类及以上抗生素均耐药的菌株即为MDR菌株。
1.3 糖尿病足的严重程度分级糖尿病足的严重程度依据Wagner分级标准[8]:0级:高危足,即有发生糖尿病足溃疡的危险因素,但无溃疡;1级:浅表溃疡,无感染;2级:较深溃疡常合并软组织感染,无脓肿或骨感染;3级:深部溃疡,有脓肿或骨髓炎;4级:局限性坏疽;5级:全足坏疽。依据Wanger分级结果将DFI患者分为轻型DFI组(Wagner 2级)和重型DFI组(Wagner 3~5级)[9]。
1.4 统计学分析采用SPSS 23.0软件进行统计学分析。符合正态分布的计量资料以x±s表示,两组之间比较采用独立样本t检验;不符合正态分布的计量资料以中位数和四分位数间距表示,两组之间比较采用非参数Kolmogorov-Smirnov Z检验;计数资料的比较采用χ2检验;相关分析采用spearman相关分析;回归分析采用二分类Logistic回归分析。P < 0.05表示差异具有统计学意义。
2 结果 2.1 临床资料特征本研究共纳入DFI患者286例,其中男性196例(68.53%),女性90例(31.47%)。年龄(65.52±12.38)岁,糖尿病病程(10.44±7.99)年。其中169例(59.09%)合并高血压,65例(22.73%)合并冠心病,205例(71.68%)合并神经病变,186例(65.03%)合并周围血管病变,155例(54.20%)合并糖尿病肾病,105例(36.71%)合并视网膜病变,48例(16.78%)合并脑梗死。脚趾(67.83%)为感染好发部位,见表 1。
| 变量 | 总DFI(n=286) | 轻型DFI(n=108) | 重型DFI(n=178) | P |
| 性别(男/女) | 196/90 | 71/37 | 125/53 | 0.429 |
| 年龄/岁 | 65.52±12.38 | 66.14±13.60 | 65.15±11.60 | 0.512 |
| BMI/kg·m -2 | 23.81±3.70 | 24.41±3.69 | 23.38±3.66 a | 0.038 |
| T2DM病程/年 | 10(4, 16) | 9.50(4, 16) | 10(4, 15.25) | 0.997 |
| 并发症[例(%)] | ||||
| 高血压 | 169(59.09) | 63(58.33) | 106(59.55) | 0.839 |
| 冠心病 | 65(22.73) | 17(15.74) | 48(26.97) a | 0.028 |
| 神经病变 | 205(71.68) | 76(70.37) | 129(72.47) | 0.702 |
| 血管病变 | 186(65.03) | 64(59.26) | 122(68.54) | 0.111 |
| 糖尿病肾病 | 155(54.20) | 58(53.70) | 97(54.49) | 0.896 |
| 视网膜病变 | 105(36.71) | 39(36.11) | 66(37.08) | 0.869 |
| 脑梗死 | 48(16.78) | 13(12.04) | 35(19.66) | 0.094 |
| 溃疡部位[例(%)] | ||||
| 脚尖 | 194(67.83) | 55(50.93) | 139(78.09) a | < 0.001 |
| 脚背 | 64(22.38) | 19(17.59) | 45(25.28) | 0.130 |
| 脚掌 | 50(17.48) | 13(12.04) | 37(20.79) | 0.059 |
| 脚踝 | 34(11.89) | 11(10.19) | 23(12.92) | 0.488 |
| 脚跟 | 24(8.39) | 9(8.33) | 15(8.43) | 0.978 |
| 生化指标 | ||||
| HbA1c(%) | 9.58±2.54 | 9.60±2.55 | 9.57±2.53 | 0.939 |
| UA/μmol·L -1 | 305.24±98.61 | 301.04±92.6 | 307.77±102.24 | 0.582 |
| ALB/g·L -1 | 31.46±6.52 | 33.12±6.84 | 30.45±6.12 a | 0.001 |
| TC/mmol·L -1 | 3.93±1.26 | 4.16±1.43 | 3.79±1.13 a | 0.022 |
| TG/mmol·L -1 | 1.21(0.97, 1.60) | 1.29(0.93, 1, 79) | 1.14(0.97, 1.55) a | 0.049 |
| HDL-C/mmol·L -1 | 0.94±0.30 | 1.00±0.33 | 0.91±0.28 a | 0.017 |
| LDL-C/mmol·L -1 | 2.44±0.88 | 2.55±0.94 | 2.38±0.84 | 0.130 |
| AST/U·L -1 | 17.95(14.05, 24.35) | 17.7(14.23, 22.88) | 18.15(13.93, 26.06) | 0.281 |
| ALT/U·L -1 | 14.50(10.40, 22.98) | 15.1(11.25, 21.2) | 13.65(9.93, 23.45) | 0.262 |
| Cr/mg·dL -1 | 79.6(61.95, 108.70) | 79.7(61.9, 108.5) | 79.6(62, 109.2) | 0.965 |
| Hb/g·L -1 | 113.80±21.96 | 120.30±20.48 | 109.87±21.94 a | < 0.001 |
| WBC(×10 9/L) | 8.6(6.7, 11.41) | 8.21(6.29, 11.11) | 9.1(7.02, 12, 02) | 0.154 |
| NEUT%(%) | 74.47±11.21 | 71.78±11.81 | 76.08±10.64 a | 0.002 |
| PCT/ng·mL -1 | 0.08(0.04, 0.32) | 0.07(0.04, 0.19) | 0.12(0.05, 0.41) a | 0.027 |
| CRP/mg·L -1 | 14.00(7.03, 48.63) | 12.15(6.3, 28.25) | 17.55(8.1, 68.65) a | 0.026 |
| 指数 | ||||
| ABI(left) | 0.93±0.31 | 0.94±0.31 | 0.92±0.31 | 0.720 |
| ABI(right) | 0.97±0.29 | 0.99±0.26 | 0.96±0.31 | 0.924 |
| TBI(left) | 0.58(0.31, 0.72) | 0.64(0.41, 0.75) | 0.53(0.28, 0.70) a | 0.041 |
| TBI(right) | 0.59(0.34, 0.76) | 0.61(0.42, 0.79) | 0.57(0.29, 0.74) | 0.279 |
| a: P < 0.05,与轻型DFI组比较 | ||||
2.2 病原菌分布情况
268例(93.71%)DFI患者溃疡深部组织共培养出420株病原菌,包括革兰阳性菌185株(44.05%),革兰阴性菌211株(50.24%)和真菌24株(5.71%)。以金黄色葡萄球菌(21.90%)、铜绿假单胞菌(8.81%)和粪肠球菌(6.67%)为主(表 2)。重型DFI组混合病原菌感染率高于轻型DFI组(χ2 =3.962, P=0.047);重型DFI组革兰阳性菌感染率低于轻型DFI组,但革兰阴性菌感染率高于轻型DFI组(χ2 =8.310, P=0.016, 表 3)。
| 病原菌 | 菌数(%) |
| 革兰阳性菌 | 185(44.05) |
| 金黄色葡萄球菌 | 92(21.9) |
| 凝固酶阴性葡萄球菌 | 22(5.24) |
| 粪肠球菌 | 28(6.67) |
| 链球菌 | 17(4.05) |
| 其他革兰阳性菌 | 26(6.19) |
| 革兰阴性菌 | 211(50.24) |
| 铜绿假单胞菌 | 37(8.81) |
| 鲍曼不动杆菌 | 8(1.90) |
| 嗜麦芽窄食单胞菌 | 12(2.86) |
| 肺炎克雷伯菌 | 23(5.48) |
| 产酸克雷伯菌 | 5(1.19) |
| 大肠埃希菌 | 20(4.76) |
| 奇异变形杆菌 | 17(4.05) |
| 普通变形杆菌 | 4(0.95) |
| 彭氏变形杆菌 | 9(2.14) |
| 黏质沙雷菌 | 14(3.33) |
| 摩根摩根菌摩根亚种 | 8(1.90) |
| 弗劳地枸橼酸杆菌 | 9(2.14) |
| 雷极普罗威登斯菌 | 3(0.71) |
| 阴沟肠杆菌 | 16(3.81) |
| 产气肠杆菌 | 3(0.71) |
| 香味属菌 | 5(1.19) |
| 其他革兰阴性菌 | 18(4.29) |
| 真菌 | 24(5.71) |
| 类型 | n | 轻型DFI | 重型DFI |
| 感染类型 | 268 | ||
| 单一病原菌感染 | 63(64.29) | 88(51.76) | |
| 混合病原菌感染 | 35(35.71) | 82(48.24) a | |
| 病原菌类型 | 420 | ||
| 革兰阳性菌 | 78(53.06) | 107(39.19) a | |
| 革兰阴性菌 | 64(43.54) | 147(53.85) a | |
| 真菌 | 5(3.40) | 19(6.96) | |
| 革兰阳性菌耐药类型 | 158 | ||
| 0类抗生素耐药 | 3(4.48) | 4(4.40) | |
| 1~2类抗生素耐药 | 18(26.86) | 25(27.47) | |
| ≥3类抗生素耐药 | 46(68.66) | 62(68.13) | |
| 革兰阴性菌耐药类型 | 199 | ||
| 0类抗生素耐药 | 3(4.92) | 4(2.90) | |
| 1~2类抗生素耐药 | 42(68.85) | 66(47.83) a | |
| ≥3类抗生素耐药 | 16(26.23) | 68(49.28) a | |
| a: P < 0.05,与轻型DFI组比较 | |||
2.3 主要病原菌对抗生素的耐药情况
足溃疡深部组织样本培养出的主要革兰阳性菌为金黄色葡萄球菌和粪肠球菌(表 2)。其中14.13%的金黄色葡萄球菌为MRSA。金黄色葡萄球菌及粪肠球菌药敏试验结果见图 1。
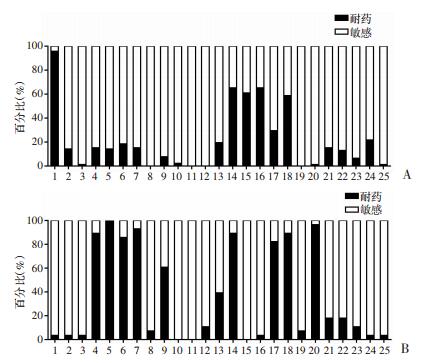
|
| 1:青霉素;2:苯唑西林;3:头孢唑啉;4:头孢克洛;5:头孢呋辛钠;6:头孢噻肟;7:头孢曲松;8:头孢克肟;9:头孢唑肟;10:头孢西丁;11:万古霉素;12:妥布霉素;13:庆大霉素;14:红霉素;15:克拉霉素;16:阿奇霉素;17:四环素;18:克林霉素;19:利奈唑烷;20:奎奴普汀/达福普汀;21:环丙沙星;22:左氧氟沙星;23:莫西沙星;24:复方新诺明;25:呋喃妥因;A:金黄色葡萄球菌的药敏试验结果;B:粪肠球菌的药敏试验结果 图 1 主要革兰阳性菌的药敏试验结果 |
足溃疡深部组织样本培养出的主要革兰阴性菌为铜绿假单胞菌、肺炎克雷伯菌和大肠埃希菌(表 2),其中43.48%的肺炎克雷伯杆菌和50.00%的大肠杆菌产ESBLs。具体药敏试验结果见图 2。
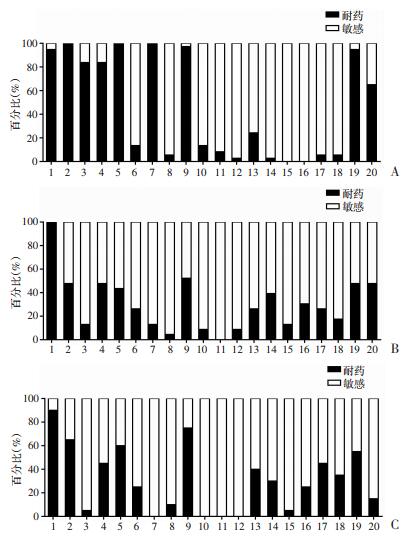
|
| 1:氨苄西林;2:头孢唑啉;3:头孢呋辛钠;4:头孢噻肟;5:头孢曲松;6:头孢他啶;7:头孢替坦;8:头孢吡肟;9:氨苄西林/舒巴坦;10:哌拉西林/他唑巴坦;11:亚胺培南;12:厄他培南;13:氨曲南;14:妥布霉素;15:阿米卡星;16:庆大霉素;17:环丙沙星;18:左氧氟沙星;19:复方新诺明;20:呋喃妥因;A:铜绿假单胞菌的药敏试验;B:肺炎克雷伯菌的药敏试验;C:大肠埃希菌的药敏试验 图 2 主要革兰阴性菌的药敏试验分析 |
依据MDR菌株定义,20.00%的革兰阴性菌和25.71%的革兰阳性菌为MDR菌株。重型DFI组MDR革兰阴性菌的感染率显著高于轻型DFI组(χ2 =9.601, P=0.006),但两组之间MDR革兰阳性菌的感染率无统计学差异(χ2 =0.094, P=1.000, 表 3)。
2.4 影响足部病变程度的代谢因素分析与轻型DFI组比较,重型DFI组NEUT%、PCT和CRP水平升高(P < 0.05),而BMI、ALB、TC、HDL-C、Hb水平降低(P < 0.05)。重型DFI组ABI和TBI水平呈下降趋势,但仅左侧TBI差异具有统计学意义(P < 0.05,表 1)
Spearman相关分析显示:糖尿病足病情严重程度与PCT(r=0.181, P=0.010), TC(r=0.144, P=0.018), WBC(r=0.121, P=0.041), NEUT%(r= 0.188, P=0.001)和CRP(r=0.156, P=0.020)呈正相关,与TBI(r=-0.157, P=0.018), ALB(r=-0.222, P=0.000), HDL-C(r=-0.131, P=0.032)和Hb(r=-0.256, P=0.000)呈负相关(图 1)。为了评估糖尿病足病情加重的危险因素,以糖尿病足的病情严重程度(Wagner分级标准)为因变量,将TBI、ALB、TG、HDL-C、Hb、PCT、WBC、NEUT%等指标纳入二分类Logistic回归模型,结果显示:高TC(OR=2.136, 95%CI: 1.352~3.372, P=0.001)是糖尿病足部病变加重的独立危险因素(图 3)。
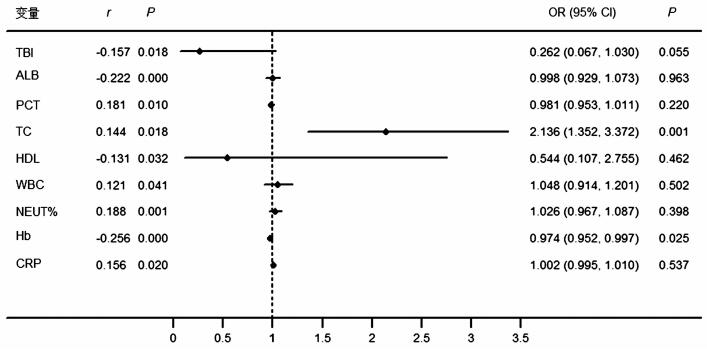
|
| 图 3 DFI患者足部病变相关代谢因素分析 |
3 讨论
为明确重庆地区DFI的病原菌谱、耐药性和代谢特征,本研究基于Wagner分级标准分析了286例DFI患者的临床资料,发现重型DFI患者革兰阴性菌混合感染和MDR革兰阴性菌感染比重增加,下肢血液循环障碍及营养不良更加严重;多种标志物(PCT、WBC、NEUT%、CRP、TBI、ALB、Hb、TC、TG和HDL-C)反映了糖尿病足病情的程度。
本研究发现,DFI患者革兰阴性菌感染率高于革兰阳性菌,但是仍以金黄色葡萄球菌为主,其次为铜绿假单胞菌;DFI常见为单一病原菌感染,与文献报道相同[3]。本研究进一步根据Wagner分级标准将研究对象分为轻型DFI组和重型DFI组,分析了两组的病原学差异,重型DFI组合并混合病原菌感染、革兰阴性菌感染比率均明显高于轻型DFI组,表明随着足部病情加重,感染类型由单一病原菌为主转变为混合病原菌为主,同时由革兰阳性菌占优势转变为革兰阴性菌占优势,此结果可能与宿主免疫力下降和长期的药物选择压力等有关。
病原菌的药敏试验结果有助于指导临床上使用针对性的抗生素。本研究发现,金黄色葡萄球菌(包括MRSA)对青霉素明显耐药,但对万古霉素、妥布霉素、利奈唑烷等抗生素敏感。所有粪肠球菌均为MDR菌株,但对万古霉素、克拉霉素等抗生素敏感。粪肠球菌的强耐药性可能与其较强的生物被膜形成能力有关,而后者可保护被膜内的细菌免受抗生素的杀伤作用,导致感染迁延不愈及抗生素耐药[10]。故糖尿病足革兰阳性菌感染建议选用抗菌能力强的万古霉素、利奈唑烷等抗生素。铜绿假单胞菌对氨苄西林和头孢菌素类抗菌药物明显耐药,甚至对部分头孢菌素的耐药率达到100%。肺炎克雷伯菌和大肠埃希菌对氨苄西林耐药,且前者的耐药率达到100%。糖尿病足革兰阴性菌感染可选用强效的第三四代头孢菌素类、碳青霉烯类、氨基糖苷类、氟喹诺酮类等抗生素。本研究进一步通过比较轻、重型DFI组的耐药情况发现,重型DFI组MDR革兰阴性菌感染率明显高于轻型DFI组。因此,临床上应重视重型DFI患者的病原菌耐药性检测,以降低致病菌的耐药率。
PCT是监测、评估感染的常用指标,亦可用于预测DFI患者截肢或死亡的结局[11]。高水平的中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio, NLR)增加长期住院治疗和截肢的风险[9]。本研究发现,重型DFI患者NEUT%、PCT和CRP水平均明显增加,且与糖尿病足病情严重程度呈正相关,表明NEUT%、PCT和CRP可用于指示DFI足部病变进程。
目前临床上广泛应用ABI和TBI指数等非侵入性检测手段,评估糖尿病下肢血运情况[12]。我们研究发现,与轻型DFI患者相比,重型DFI患者TBI呈下降趋势,但仅左侧TBI差异有统计学意义,提示重型DFI患者下肢血运障碍的状态更加严重,需注重加强下肢血管和神经的管理,而其他指数未见统计学差异的原因可能与本研究纳入患者数量有限有关。
在本研究中,重型DFI患者ALB和Hb水平明显降低,表明DFI患者可能存在由于足部血运障碍导致的营养缺乏的情况。既往研究发现糖尿病患者易发生营养不良,尤其是老年患者[13]或存在合并症的糖尿病患者[14]。与营养均衡的糖尿病足患者相比,营养不良的老年糖尿病患者发生足部外伤和足部感染的风险分别增加2倍和2.2倍[15]。YE等[16]研究发现,营养不良影响足溃疡愈合,加强营养支持可以显著改善预后。糖尿病足是全身多器官病变的标志,可极大地增加心血管事件发生风险。CAO等[17]研究发现高水平non-HDL-C可显著增加糖尿病心血管性疾病的发生风险,合理的降脂药物治疗联合饮食控制可以显著降低心血管疾病的发病率。然而,过强的降脂治疗及饮食限制可加重糖尿病患者的营养不良。本研究发现,TC是糖尿病患者足部病变加重的独立危险因素,对血脂紊乱糖尿病足患者的疾病变化可能起到早期预警作用,但重型DFI患者TC水平明显降低,这可能与降脂治疗有关,也可能是营养不良的表现[18],此类患者建议加强营养支持。
本研究是一项回顾性的横断面研究,无法评估DFI患者的预后及抗感染治疗的终点;由于DFI患者可能已就诊于基层医疗单位并进行治疗,因此增加了本研究的偏倚;本研究的样本量有限,主要集中于重庆地区,需要深入进行多中心、大样本量的研究;DFI病原菌的耐药分子机制、代谢指标的临床预后价值及深层次的调控关系需要进一步研究。
综上所述,金黄色葡萄球菌、铜绿假单胞菌和粪肠球菌是DFI的常见病原菌,且对常用抗菌药物产生了不同程度的耐药。当糖尿病足病情加重(Wagner分级越高)后,混合病原菌感染、革兰阴性杆菌感染、MDR菌株感染逐渐占据优势,下肢血液循环障碍和营养不良更加严重。对糖尿病足患者,尤其是重型DFI患者,实施多学科的管理(包括抗感染、营养支持、调脂、恢复下肢血管灌注等)有助于改善糖尿病足预后。
| [1] |
NIKOLOUDI M, ELEFTHERIADOU I, TENTOLOURIS A, et al. Diabetic foot infections: update on management[J]. Curr Infect Dis Rep, 2018, 20(10): 40. DOI:10.1007/s11908-018-0645-6 |
| [2] |
UÇKAY I, ARAGÓN-SÁNCHEZ J, LEW D, et al. Diabetic foot infections: what have we learned in the last 30 years?[J]. Int J Infect Dis, 2015, 40: 81-91. DOI:10.1016/j.ijid.2015.09.023 |
| [3] |
WU M X, PAN H, LENG W L, et al. Distribution of microbes and drug susceptibility in patients with diabetic foot infections in southwest China[J]. J Diabetes Res, 2018, 2018: 9817308. DOI:10.1155/2018/9817308 |
| [4] |
HEDE K. Antibiotic resistance: an infectious arms race[J]. Nature, 2014, 509(7498): S2-S3. DOI:10.1038/509S2a |
| [5] |
HARTEMANN-HEURTIER A, ROBERT J, JACQUEMINET S, et al. Diabetic foot ulcer and multidrug-resistant organisms: risk factors and impact[J]. Diabet Med, 2004, 21(7): 710-715. DOI:10.1111/j.1464-5491.2004.01237.x |
| [6] |
World Health Organization, International Diabetes Federation. Definition and diagnosis of diabetes mellitus and intermediate hyperglycemia: report of a WHO/IDF consultation.. |
| [7] |
International Working Group on the Diabetic Foot. IWGDF guidelines on the prevention and management of diabetic foot disease.. |
| [8] |
WAGNER F W JR. The dysvascular foot: a system for diagnosis and treatment[J]. Foot Ankle, 1981, 2(2): 64-122. DOI:10.1177/107110078100200202 |
| [9] |
ALTAY F A, KUZI S, ALTAY M, et al. Predicting diabetic foot ulcer infection using the neutrophil-to-lymphocyte ratio: a prospective study[J]. J Wound Care, 2019, 28(9): 601-607. DOI:10.12968/jowc.2019.28.9.601 |
| [10] |
FRIERI M, KUMAR K, BOUTIN A. Antibiotic resistance[J]. J Infect Public Heal, 2017, 10(4): 369-378. DOI:10.1016/j.jiph.2016.08.007 |
| [11] |
MELONI M, IZZO V, GIURATO L, et al. Procalcitonin is a prognostic marker of hospital outcomes in patients with critical limb ischemia and diabetic foot infection[J]. J Diabetes Res, 2019, 2019: 4312737. DOI:10.1155/2019/4312737 |
| [12] |
BABAEI M R, MALEK M, ROSTAMI F T, et al. Non-invasive vascular assessment in people with type 2 diabetes: Diagnostic performance of Plethysmographic-and-Doppler derived ankle brachial index, toe brachial index, and pulse volume wave analysis for detection of peripheral arterial disease[J]. Prim Care Diabetes, 2019: S1751-S9918(19)30208-6. DOI: 10.1016/j.pcd.2019.09.005.
|
| [13] |
TASCI I, SAFER U, NAHARCI M I. Multiple antihyperglycemic drug use is associated with undernutrition among older adults with type 2 diabetes mellitus: a cross-sectional study[J]. Diabetes Ther, 2019, 10(3): 1005-1018. DOI:10.1007/s13300-019-0602-x |
| [14] |
KHAN M S, CHANDANPREET S, KEWAL K, et al. Malnutrition, anthropometric, and biochemical abnormalities in patients with diabetic nephropathy[J]. J Ren Nutr, 2009, 19(4): 275-282. DOI:10.1053/j.jrn.2009.01.026 |
| [15] |
SAINTRAIN M V L, SANDRIN R L E S P, BEZERRA C B, et al. Nutritional assessment of older adults with diabetes mellitus[J]. Diabetes Res Clin Pract, 2019, 155: 107819. DOI:10.1016/j.diabres.2019.107819 |
| [16] |
YE J N, MANI R. A systematic review and meta-analysis of nutritional supplementation in chronic lower extremity wounds[J]. Int J Low Extrem Wounds, 2016, 15(4): 296-302. DOI:10.1177/1534734616674624 |
| [17] |
CAO Y C, YAN L Q, GUO N, et al. Non-high-density lipoprotein cholesterol and risk of cardiovascular disease in the general population and patients with type 2 diabetes: a systematic review and meta-analysis[J]. Diabetes Res Clin Pract, 2019, 147: 1-8. DOI:10.1016/j.diabres.2018.11.002 |
| [18] |
LI X, XIAO T, WANG Y Z, et al. Incidence, risk factors for amputation among patients with diabetic foot ulcer in a Chinese tertiary hospital[J]. Diabetes Res Clin Pract, 2011, 93(1): 26-30. DOI:10.1016/j.diabres.2011.03.014 |



