自闭症谱系障碍(autism spectrum disorder,ASD)是一组以社交障碍、语言障碍、重复性/限制性行为等为核心症状的广泛性发育障碍性疾病[1]。ASD致病原因和机制尚不清楚,目前公认的观点为ASD发生与脑发育异常密切相关,ASD患者脑发育异常的3条关键途径是:①染色质重塑;②基因转录与剪接;③突触功能异常[2]。本研究拟对与突触发育相关的信号通路进行探讨。
磷脂酶C-γ1(phospholipase C-gamma1,PLCγ1)是跨膜信号通路中重要的中介分子,在大脑中高度表达[3]。PLCγ1被激活后可分解磷脂酰肌醇4, 5双磷酸,产生二酰甘油和肌醇三磷酸(inositol 1, 4, 5-trisphosphate,IP3),IP3与其细胞内受体(IP3 receptor,IP3R)结合,并诱导内质网配体门控的Ca2+通道开放,增加细胞内Ca2+浓度[4],从而激活钙调蛋白依赖性激酶Ⅱ(calmodulin-dependent protein kinaseⅡ, CaMKⅡ),参与脑发育、突触可塑性、轴突生长[5]等调控,但关于PLCγ1/IP3R/CaMKⅡ通路在VPA诱导ASD小鼠模型中的研究鲜有报道。另外,在对于PLCγ1/IP3R/CaMKⅡ通路的研究中,已知该通路中的蛋白均与突触可塑性关系密切[5-7],所以,本研究通过改良法[8]建立VPA诱导ASD小鼠模型,在检测VPA诱导的ASD小鼠模型大脑海马区PLCγ1/IP3R/CaMKⅡ通路蛋白表达改变后,并检测了其锥体神经元突触蛋白以及树突棘密度的变化,以进一步探讨VPA诱导的青年小鼠出现自闭症样行为是否与该通路蛋白表达改变以及树突棘密度变化相关。
1 材料与方法 1.1 试剂和仪器VPA购自美国Sigma公司;75%乙醇和无水乙醇购自重庆川东化工有限公司;兔抗小鼠β-actin单克隆抗体购自中国武汉ABclonal公司;兔抗小鼠PLCγ1和兔抗小鼠PSD95单克隆抗体购自美国Cell Signaling Technology公司;兔抗小鼠IP3R和兔抗小鼠CaMKⅡ单克隆抗体购自美国Abcam公司;辣根过氧化酶标记二抗(山羊抗兔IgG)和PBS缓冲液购自武汉博士德生物公司;RIPA裂解液和BCA蛋白定量试剂盒购自碧云天公司;超敏ECL化学发光试剂盒和PVDF膜购自美国Millipore公司;蛋白质印迹凝胶制备试剂盒购自北京康为世纪科技有限公司;高尔基染色试剂盒购自美国Hitobiotec公司。
旷场箱(40 cm×40 cm×30 cm,箱底划分为16格,中间4格为中央格,周围12格为周围格),三箱社交实验箱(120 cm×20 cm×22 cm),亚克力玻璃,定制于重庆昊然实业有限公司;摄像头购自深圳市奥尼电子工业有限公司;BX50光学显微镜购自日本Olympus公司。
1.2 模型制备与分组育龄期健康C57小鼠,体质量:雌性20~30 g、雄性20~30 g,购自重庆医科大学实验动物中心,合格证号SYXK(渝)2018-0003,饲养于该中心SPF级环境中。自由饮水进食,恒定温度23 ℃,相对湿度50%~60%,12 h/12 h日/夜交替光照。小鼠适应1周后,于下午17:00将其按1雄和2雌合笼过夜,次日上午9点分笼时检查雌鼠阴道,如有阴道栓存在则视为受精成功,并记为孕0.5 d。将孕鼠随机分为2组,分别于孕10、12 d腹腔注射给予VPA 300 mg/kg或等体积无菌生理盐水,并分别命名为VPA组和正常对照组。
1.3 行为学检测雄性仔鼠出生后28 d进行为期1周的自闭症样行为学检测,与对照组相比,筛选出具有明显自闭症样行为的小鼠为VPA组。VPA组和正常对照组每组小鼠各8只。
1.3.1 三箱社交实验(three chamber sociability test)主要检测实验小鼠社交行为以及其对新鲜事物的偏好程度。雄性仔鼠出生后28 d,将受试小鼠放入三箱社交实验箱中,任其在3个连通的箱室(A、B和C箱)中自由活动10 min,以适应环境。第一阶段,在A箱中放入带有陌生小鼠1(与受试小鼠同龄雄性不同窝的同品系小鼠)的笼子,在C箱中放入空笼子,观察10 min内受试鼠的活动情况。第二阶段,在C箱中放入带有陌生小鼠2(与受试小鼠同龄雄性不同窝的同品系小鼠)的笼子,观察10 min内受试鼠的活动情况。主要记录受试小鼠与陌生鼠嗅触交流时间。
1.3.2 青年玩耍实验(youth play test)主要检测实验小鼠的社会交往能力以及刻板重复行为。雄性仔鼠出生后30 d,在旷场箱中放入约3 cm厚的清洁垫料,将受试小鼠放入旷场箱中自由活动10 min,以适应箱内环境。取出适应好的受试小鼠,同时放入受试小鼠和互动小鼠(与受试小鼠同龄雄性不同窝的同品系小鼠),记录接下来10 min内受试小鼠与互动小鼠发生社交互动行为(受试小鼠主动追随、靠近互动小鼠,并发生密切的身体接触与嗅触等行为)的时间,以及受试小鼠的自我捋毛行为和挖掘行为的时间。
1.3.3 旷场实验(open field test)主要检测实验小鼠的自主行为和对新环境的探究能力。雄性仔鼠出生后32 d,将受试小鼠放入旷场箱中任其自由活动10 min以适应箱内环境。记录接下来的10 min内受试小鼠跨中央格数的次数、跨周围格数的次数、站立数和攀墙数。
1.4 Western blot检测β-actin,PLCγ1,IP3R,CaMKⅡ和PSD95蛋白表达水平雄性仔鼠出生后35 d,腹腔注射给予3.5%水合氯醛10 mL·kg-1麻醉,开胸暴露心脏予以0.9%生理盐水心尖灌注,待全身血液被冲洗完后立即断头取脑。在冰上分离出海马组织,加RIPA裂解液(10 mL/g组织)提取总蛋白。BCA法测蛋白浓度,并调整浓度为5 g/L。在8%十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)上样25 μg总蛋白电泳,将蛋白质电转至PVDF膜,加入一抗β-actin单克隆抗体(1:100 000),PLCγ1,IP3R,CaMKⅡ和PSD95单克隆抗体(均1:1 000),4 ℃孵育过夜。次日TBST洗膜3次,10 min/次。二抗(1 :5 000)室温孵育1 h,TBST洗膜3次,10 min/次。ECL法发光,X光胶片曝光后显影并定影,使用Image-J系统对条带进行定量分析,以目标蛋白与内参蛋白灰度值比值表示蛋白的相对表达水平。VPA组和正常对照组每组小鼠各6只。
1.5 高尔基染色检测海马锥体神经元树突棘变化按照高尔基染色试剂盒说明书要求,提前24 h等体积混合溶液1、2。小鼠出生后35 d,给予适量3.5%水合氯醛将其致死。断头取脑,每1立方厘米大脑组织至少加入混合液5 mL,室温避光保存12~24 h,次日更换同等体积混合液室温避光保存14 d后转至溶液3中,4 ℃保存12 h后更换同等体积溶液3继续4 ℃保存48~72 h。从溶液3中取出组织,置于-80 ℃速冻30 min,再于-27 ℃冰冻切片机上切片,厚度为100 μm。切片于室温避光风干后避光染色,于显微镜下拍摄海马CA1区的锥体神经元的底树突,VPA组和正常对照组每组小鼠各8只。每只小鼠拍摄6个神经元,每个神经元选取30~50 μm树突进行分析。使用Image-J系统对树突进行树突长度测量和树突棘数量统计。
1.6 统计学分析采用SPSS 17.0统计软件进行数据分析,实验结果数据以x±s表示,两组间数据比较采用独立样本t检验,以P < 0.05为差异具有统计学意义。
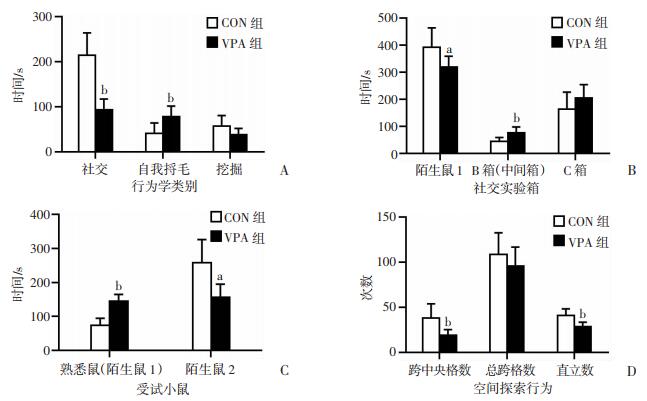
2 结果 2.1 自闭症样行为学鉴定 2.1.1 VPA致自闭症模型小鼠社交能力与兴趣偏好能力障碍青年玩耍实验中(图 1A),VPA组社交互动时间明显低于正常对照组(P < 0.01),表明VPA暴露导致仔鼠社交能力障碍。三箱实验中,与正常对照组相比,第一阶段VPA组与陌生鼠1嗅触交流时间缩短(P < 0.05),且在B箱(中间箱)停留时间明显延长(P < 0.01)(图 1B);第二阶段VPA组与陌生鼠2嗅触交流时间缩短(P < 0.05),而与陌生鼠1(即熟悉鼠)嗅触交流时间明显延长(P < 0.01, 图 1C)。提示VPA暴露导致C57小鼠雄性仔鼠社交能力障碍,以及对新鲜事物偏好障碍。
|
| A:青年玩耍实验;B:三箱社交实验第一阶段;C:三箱实验第二阶段;D:旷场实验; a: P < 0.05, b: P < 0.01,与CON组比较 图 1 孕期VPA暴露致仔鼠出现自闭症样行为 |
2.1.2 VPA致自闭症模型小鼠刻板重复行为增多
青年玩耍实验中(图 1A),VPA组自我捋毛时间明显多于正常对照组(P < 0.01),挖掘行为与正常对照组无明显差异,提示VPA暴露导致C57小鼠雄性仔鼠出现刻板重复活动。
2.1.3 VPA致自闭症模型小鼠空间探索能力障碍旷场实验中(图 1D),VPA组跨格总数与正常对照组无明显差异,提示VPA暴露不影响其运动功能。而VPA组中央跨格数和直立总数低于正常对照组(P < 0.01),提示VPA暴露导致C57小鼠雄性仔鼠对陌生环境空间探索能力障碍。
2.2 孕期VPA暴露对仔鼠大脑海马中PLCγ1/IP3R/CaMKⅡ信号通路蛋白表达水平的影响与正常对照组相比,VPA组海马组织中的PLCγ1、IP3R和CaMKⅡ表达均明显降低(P < 0.01,图 2)。

|
| A:Western blot检测小鼠大脑海马组织中PLCγ1/IP3R/CaMKⅡ信号通路蛋白表达水平; B:小鼠大脑海马组织中PLCγ1/IP3R/CaMKⅡ信号通路蛋白表达水平的半定量分析 a:P < 0.01, 与CON组比较 图 2 孕期VPA暴露对仔鼠大脑海马中PLCγ1/IP3R/CaMKⅡ信号通路蛋白表达水平的影响 |
2.3 孕期VPA暴露对仔鼠大脑海马中PSD95蛋白表达水平的影响
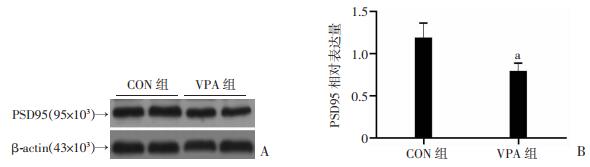
与正常对照组相比,VPA组海马组织中的PSD95的表达明显降低(P < 0.01,图 3)。
|
| A:Western blot检测小鼠大脑海马组织中PSD95蛋白表达水平; B:小鼠大脑海马组织中PSD95蛋白表达水平的半定量分析 a: P < 0.01, 与CON组比较 图 3 孕期VPA暴露对仔鼠大脑海马中PSD95蛋白表达水平的影响 |
2.4 孕期VPA暴露对仔鼠大脑海马中锥体神经元树突棘密度的影响
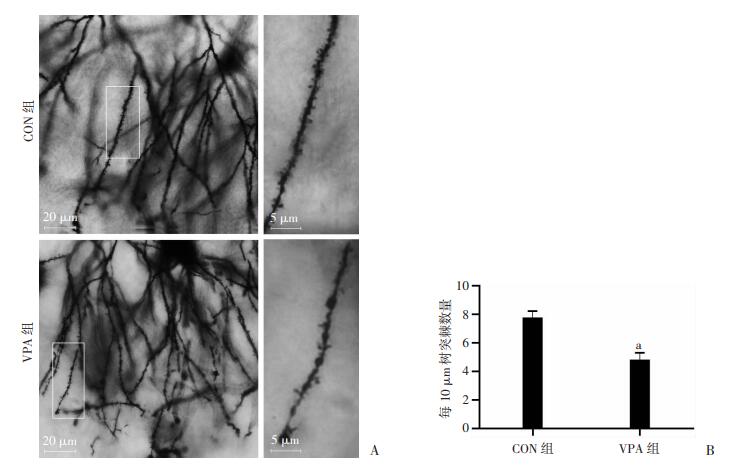
与正常对照组相比,VPA组树突棘密度较正常组明显降低(P < 0.01,图 4)。
|
| A:小鼠大脑海马CA1区椎体神经元的高尔基染色;B:小鼠大脑海马CA1区椎体神经元树突棘密度 a:P < 0.01,与CON组比较 图 4 孕期VPA暴露对仔鼠大脑海马中锥体神经元树突棘密度的影响 |
3 讨论
ASD的发生与脑发育过程中突触发育异常密切相关。在对ASD患者尸检中发现突触结构异常和可塑性改变[9]。对多种自闭症谱系障碍模型鼠的研究也证实,ASD鼠的不同脑区神经元改变不同,可出现不同的突触可塑性改变和多种行为表型,甚至出现超敏感的神经信息处理加工能力[10-12],但对其发生机制的研究知之甚少。胞外信号对靶细胞的调控,一直是神经科学研究的焦点。随着Ca2+/钙调素(calmodulin, CaM)第二信使重要性的确定,PLCγ1/IP3R信号分子对其的调控,在ASD发生中的作用也成为我们研究的焦点。
PLC表达于细胞膜,是信号转导关键酶。根据氨基酸序列同源性和相对分子质量大小,有16个同工酶/亚型,其中,PLCγ1是多种细胞生长因子信号转导的效应分子,在细胞信号转导中起关键作用[4]。PLCγ1不仅能催化分解磷脂酰肌醇4, 5双磷酸产生二酰甘油和IP3,激活Ca2+/CaM/CaMKⅡ等多条信号通路,还具蛋白质相互结合的SH区,通过这些结构域与其他蛋白质相互作用,参与更多的神经元事件,如神经元突起的生长、神经元细胞的迁移和突触可塑性等[13]。SHIMOHAMA等[14]研究证实,PLCγ1在大鼠孕19 d的胎鼠脑组织中表达达高峰,随个体的生长和老化而表达降低。在阿尔茨海默病患者大脑皮质中,PLCγ1呈低表达[3];在亨廷顿病模型小鼠海马组织中,PLCγ1活性降低、磷酸化PLCγ1表达降低[15]。我们的实验也证实,ASD模型小鼠海马组织中PLCγ1显著降低,提示VPA所致胎鼠生长发育环境的改变,可能与海马组织中PLCγ1表达降低而参与了ASD发生有关。
IP3R是介导内质网钙释放的通道,其激活受PLC/IP3信号通路调节。IP3R在神经元中高度表达[16],除了表达于海马CA1锥体神经元的胞体和树突轴外,在突触后树突棘和突触后膜也高表达,并通过调节突触前的钙稳态而参与突触的发育与神经递质释放的调节,影响突触传递的效能[7]。CaMKⅡ是钙信号转导的关键激酶,也是PLCγ1/IP3R信号通路的关键位点,CaMKⅡ主要定位细胞膜、线粒体和突触后致密物(postsynaptic density,PSD)[17]。当细胞内Ca2+浓度增高时,启动CaMKⅡ的磷酸化、自磷酸化和膜转位功能,并形成CaMKⅡ-PSD95-GluR6复合物[18],从而调控神经递质合成与释放、突触传递的效能、细胞骨架结构、长时程增强(long-term potentiation,LTP)以及基因的表达[19]。为此我们进一步采用Western印迹法检测了PLCγ1调控的IP3R和CaMKⅡ在海马组织中的表达,与对照组相比,VPA组小鼠的IP3R和CaMKⅡ明显下调。SCHMUNK等[20]研究发现,脆性X(fragile X,FXS)和结节性硬化症(tuberous sclerosis,TS)患者IP3介导的Ca2+信号明显低表达;在智力障碍(intellectual disability,ID)患者中发现了19个极其罕见的CaMKⅡA或CaMKⅡB突变[21],这些研究不但为ASD疾病中存在IP3R通道、CaMKⅡ活性缺陷提供了证据,也佐证了我们的实验结果。
神经元突触的发育是脑发育的关键指标。目前,PSD的分子组分表达改变被认为是导致神经发育障碍(如精神分裂症和自闭症)的主要病因之一[22]。PSD95是PSD的重要组分之一,也是神经发育过程中谷氨酸能传递、突触可塑性和树突棘形态形成的重要组成部分[23]。外显子组测序研究表明,PSD95是自闭症谱系障碍的高危基因[24]。PSD95敲除小鼠表现出与自闭症谱系障碍一致的表型[25]。Cntnap4敲除的ASD小鼠模型在电子显微镜下观察到其PSD厚度明显小于正常对照组,这些研究都暗示着ASD可能与PSD减少高度关联[26]。PSD95在发育过程中的功能障碍也可能会导致突触数量和密度的改变。树突棘是兴奋性突触的主要部位。在自闭症研究中观察到树突棘的分布和形态的异常改变[27]。对两位ASD患者的大脑尸检结果显示海马区的神经元的树突状明显减少[28]。Lrfn2基因敲除自闭症模型小鼠大脑海马区PSD95表达下降,并伴树突棘密度降低[29]。与自闭症相关的Tomosyn基因在小鼠海马神经元体外培养中被敲除后,表现出海马神经元树突棘密度下降[30]。本研究中VPA诱导的ASD模型小鼠海马的PLCγ1/IP3R/CaMKⅡ通路蛋白均明显低表达,我们考虑其突触关键蛋白和树突棘密度也会出现变化。Western blot和高尔基染色实验结果表明,VPA模型小鼠海马组织中PSD95蛋白的表达降低,锥体神经元树突棘密度也明显低于对照组。
综上所述,PLCγ1/IP3R/CaMKⅡ信号通路蛋白表达水平的下降,可能导致锥体神经元突触发育障碍,从而诱导了小鼠出现自闭症样行为。这也可能是VPA诱导的ASD模型小鼠出现核心症状的机制之一。
| [1] |
ROUBERTOUX P L, TORDJMAN S, CAUBIT X, et al. Construct validity and cross validity of a test battery modeling autism spectrum disorder (ASD) in mice[J]. Behav Genet, 2020, 50(1): 26-40. DOI:10.1007/s10519-019-09970-x |
| [2] |
DE RUBEIS S, HE X, GOLDBERG A P, et al. Synaptic, transcriptional and chromatin genes disrupted in autism[J]. Nature, 2014, 515(7526): 209-215. DOI:10.1038/nature13772 |
| [3] |
YANG Y R, KANG D S, LEE C, et al. Primary phospholipase C and brain disorders[J]. Adv Biol Regul, 2016, 61: 80-85. DOI:10.1016/j.jbior.2015.11.003 |
| [4] |
JANG H J, SUH P G, LEE Y J, et al. PLCγ1: Potential arbitrator of cancer progression[J]. Adv Biol Regul, 2018, 67: 179-189. DOI:10.1016/j.jbior.2017.11.003 |
| [5] |
WANG M J, JIANG L, CHEN H S, et al. Levetiracetam protects against cognitive impairment of subthreshold convulsant discharge model rats by activating protein kinase C (PKC)-growth-associated protein 43 (GAP-43)-calmodulin-dependent protein kinase (CaMK) signal transduction pathway[J]. Med Sci Monit, 2019, 25: 4627-4638. DOI:10.12659/MSM.913542 |
| [6] |
KIM H Y, YANG Y R, HWANG H, et al. Deletion of PLCγ1 in GABAergic neurons increases seizure susceptibility in aged mice[J]. Sci Rep, 2019, 9(1): 17761. DOI:10.1038/s41598-019-54477-4 |
| [7] |
RINGSEVJEN H, UMBACH HANSEN H M, HUSSAIN S, et al. Presynaptic increase in IP3 receptor type 1 concentration in the early phase of hippocampal synaptic plasticity[J]. Brain Res, 2019, 1706: 125-134. DOI:10.1016/j.brainres.2018.10.030 |
| [8] |
郑文霞, 胡宇玲, 陈笛, 等. 丙戊酸钠诱导小鼠自闭症模型的改良[J]. 南方医科大学学报, 2019, 39(6): 718-723. ZHENG W X, HU Y L, CHEN D, et al. Improvement of a mouse model of valproic acid-induced autism[J]. J South Med Univ, 2019, 39(6): 718-723. |
| [9] |
TANG G M, GUDSNUK K, KUO S H, et al. Loss of mTOR-dependent macroautophagy causes autistic-like synaptic pruning deficits[J]. Neuron, 2014, 83(5): 1131-1143. DOI:10.1016/j.neuron.2014.07.040 |
| [10] |
MARKRAM K, RINALDI T, LA MENDOLA D, et al. Abnormal fear conditioning and amygdala processing in an animal model of autism[J]. Neuropsychopharmacology, 2008, 33(4): 901-912. DOI:10.1038/sj.npp.1301453 |
| [11] |
HARA Y, AGO Y, TARUTA A, et al. Risperidone and aripiprazole alleviate prenatal valproic acid-induced abnormalities in behaviors and dendritic spine density in mice[J]. Psychopharmacology (Berl), 2017, 234(21): 3217-3228. DOI:10.1007/s00213-017-4703-9 |
| [12] |
YAMAGUCHI H, HARA Y, AGO Y, et al. Environmental enrichment attenuates behavioral abnormalities in valproic acid-exposed autism model mice[J]. Behav Brain Res, 2017, 333: 67-73. DOI:10.1016/j.bbr.2017.06.035 |
| [13] |
YANG Y R, JUNG J H, KIM S J, et al. Forebrain-specific ablation of phospholipase Cγ1 causes manic-like behavior[J]. Mol Psychiatry, 2017, 22(10): 1473-1482. DOI:10.1038/mp.2016.261 |
| [14] |
SHIMOHAMA S, SUMIDA Y, FUJIMOTO S, et al. Differential expression of rat brain phospholipase C isozymes in development and aging[J]. Biochem Biophys Res Commun, 1998, 243(1): 210-216. DOI:10.1006/bbrc.1998.8090 |
| [15] |
GIRALT A, RODRIGO T, MARTÍN E D, et al. Brain-derived neurotrophic factor modulates the severity of cognitive alterations induced by mutant huntingtin: involvement of phospholipase C gamma activity and glutamate receptor expression[J]. Neuroscience, 2009, 158(4): 1234-1250. DOI:10.1016/j.neuroscience.2008.11.024 |
| [16] |
SHARP A H, NUCIFORA F C Jr, BLONDEL O, et al. Differential cellular expression of isoforms of inositol 1, 4, 5-triphosphate receptors in neurons and Glia in brain[J]. J Comp Neurol, 1999, 406(2): 207-220. DOI:10.1002/(SICI)1096-9861(19990405)406:2<207::AID-CNE6>3.0.CO;2-7 |
| [17] |
TAKEMOTO-KIMURA S, SUZUKI K, HORIGANE S I, et al. Calmodulin kinases: essential regulators in health and disease[J]. J Neurochem, 2017, 141(6): 808-818. DOI:10.1111/jnc.14020 |
| [18] |
XU J, LIU Z A, PEI D S, et al. Calcium/calmodulin-dependent kinase II facilitated GluR6 subunit serine phosphorylation through GluR6-PSD95-CaMKII signaling module assembly in cerebral ischemia injury[J]. Brain Res, 2010, 1366: 197-203. DOI:10.1016/j.brainres.2010.09.087 |
| [19] |
PENZES P, CAHILL M E, JONES K A, et al. Convergent CaMK and RacGEF signals control dendritic structure and function[J]. Trends Cell Biol, 2008, 18(9): 405-413. DOI:10.1016/j.tcb.2008.07.002 |
| [20] |
SCHMUNK G, BOUBION B J, SMITH I F, et al. Shared functional defect in IP3 R-mediated calcium signaling in diverse monogenic autism syndromes[J]. Transl Psychiatry, 2015, 5: e643. DOI:10.1038/tp.2015.123 |
| [21] |
KÜRY S, VAN WOERDEN G M, BESNARD T, et al. De novo mutations in protein kinase genes CAMK2A and CAMK2B cause intellectual disability[J]. Am J Hum Genet, 2017, 101(5): 768-788. DOI:10.1016/j.ajhg.2017.10.003 |
| [22] |
COLEY A A, GAO W J. PSD95: a synaptic protein implicated in schizophrenia or autism?[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2018, 82: 187-194. DOI:10.1016/j.pnpbp.2017.11.016 |
| [23] |
MARDONES M D, JORQUERA P V, HERRERA-SOTO A, et al. PSD95 regulates morphological development of adult-born granule neurons in the mouse Hippocampus[J]. J Chem Neuroanat, 2019, 98: 117-123. DOI:10.1016/j.jchemneu.2019.04.009 |
| [24] |
DE RUBEIS S, HE X, GOLDBERG A P, et al. Synaptic, transcriptional and chromatin genes disrupted in autism[J]. Nature, 2014, 515(7526): 209-215. DOI:10.1038/nature13772 |
| [25] |
FEYDER M, KARLSSON R M, MATHUR P, et al. Association of mouse Dlg4 (PSD-95) gene deletion and human DLG4 gene variation with phenotypes relevant to autism spectrum disorders and Williams' syndrome[J]. Am J Psychiatry, 2010, 167(12): 1508-1517. DOI:10.1176/appi.ajp.2010.10040484 |
| [26] |
KARAYANNIS T, AU E, PATEL J C, et al. Cntnap4 differentially contributes to GABAergic and dopaminergic synaptic transmission[J]. Nature, 2014, 511(7508): 236-240. DOI:10.1038/nature13248 |
| [27] |
GOVEK E E, NEWEY S E, VAN AELST L. The role of the Rho GTPases in neuronal development[J]. Genes Dev, 2005, 19(1): 1-49. DOI:10.1101/gad.1256405 |
| [28] |
SAITOH O, COURCHESNE E, EGAAS B, et al. Cross-sectional area of the posterior Hippocampus in autistic patients with cerebellar and corpus callosum abnormalities[J]. Neurology, 1995, 45(2): 317-324. DOI:10.1212/wnl.45.2.317 |
| [29] |
MORIMURA N, YASUDA H, YAMAGUCHI K, et al. Autism-like behaviours and enhanced memory formation and synaptic plasticity in Lrfn2/SALM1-deficient mice[J]. Nat Commun, 2017, 8: 15800. DOI:10.1038/ncomms15800 |
| [30] |
SHEN W J, KILANDER M B C, BRIDI M S, et al. Tomosyn regulates the small RhoA GTPase to control the dendritic stability of neurons and the surface expression of AMPA receptors[J]. J Neurosci Res, 2020, 1-19. DOI:10.1002/jnr.24608 |



