2. 400038 重庆,陆军军医大学(第三军医大学)药学与检验医学系药理学教研室;
3. 400016 重庆,重庆医科大学药学院;
4. 400042 重庆,陆军军医大学(第三军医大学)大坪医院药剂科
2. Department of Pharmacology, Faculty of Pharmacy and Laboratory Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. College of Pharmacy, Chongqing Medical University, Chongqing, 400016;
4. Department of Pharmacy, Daping Hospital, Army Medical University (Third Military Medical University), Chongqing, 400042, China
自2019年底武汉爆发由SARS-COV-2病毒引起的2019冠状病毒病(coronavirus disease2019,COVID-19)以来,疫情蔓延迅速,已涉及超过80个国家。由于缺乏有效的抗病毒药物和有效的针对脓毒症药物,COVID-19已严重威胁到人类的健康,对我国乃至世界的公共卫生系统带来了极大的挑战。
对任何感染性疾病,我们必须解决的问题有两个:一是如何控制病原体的增殖,二是如何控制病原体入侵机体后引起的宿主免疫应答导致的机体免疫功能紊乱即脓毒症[1]。因此,基于COVID-19的临床表现去深入研究COVID-19诱导的脓毒症的病理生理机制并研究有效的防治措施具有重要意义。
1 脓毒症的病理生理过程及药物治疗现状 1.1 脓毒症的病理生理过程脓毒症(sepsis)是指由感染和/或感染因素导致的宿主反应失调所引起的危及生命的器官功能障碍综合征[1],进一步发展可导致脓毒症休克(septic shock)、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),病死率高达30%~70%[2-3]。其中感染是指存在于自然界的病原体如细菌、真菌、病毒、原虫等入侵机体定植和增殖的病理生理过程;感染因素是指构成上述病原体的基本结构分子包括病原体相关分子模式(pathogen-associated molecular patterns,PAMPs),如细菌的脂多糖/内毒素(lipopolysaccharide, LPS/endotoxin)、鞭毛蛋白、基因组DNA、酵母多糖、病毒的单链或双链RNA (ssRNA或dsRNA)等。脓毒症发生的本质是在感染过程中侵入机体的病原体及其PAMPs被存在于宿主的先天免疫系统细胞的模式识别受体(pattern recognition receptor)包括TLRs家族等受体识别,介导免疫细胞活化而引发的免疫功能紊乱[4-5]。
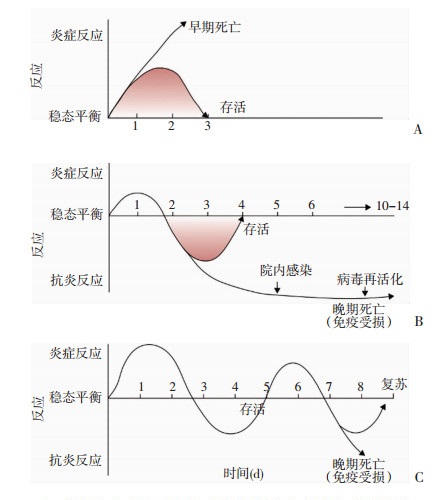
大量的实验和循证医学研究均证实,机体先天免疫系统为清除入侵的病原体而引发的全身免疫反应存在两个阶段,即以先天免疫系统参与为主的早期的细胞因子风暴/全身炎症反应综合征(cytokine storm/systemic inflammatory response syndrome,SIRS)和随后的先天和获得性免疫系统均参与的免疫抑制(immunosuppression), 即过去的代偿性炎症反应综合征(compensatory inflammatory response syndrome,CARS)[6]。
在感染过程中,如果入侵的病原体过多或增殖过快,就会导致宿主的炎症反应增强或持续时间过长;在过度的炎症反应中,以TNF-α、IL-6等致炎细胞因子释放更为显著。上述细胞因子可导致补体系统和血管内皮细胞的过度活化,并导致过度凝血等,引起组织器官的损伤甚至多器官功能衰竭的发生。因此,过度的炎症反应(SIRS)/细胞因子风暴是导致宿主早期死亡的主要原因,此期患者病死率约占脓毒症总病死率的30%。此时,机体为了维持个体的生存和内环境的稳定,会通过启动神经、体液等系列的负反馈机制,诱导免疫细胞(如T细胞)的凋亡、抑制免疫细胞的功能,同时致炎细胞因子释放相对减少而抗炎细胞因子(如TGF-β、IL-10等)释放绝对或相对增加,导致免疫抑制状态的出现,而机体免疫功能低下则直接导致机体抵抗外界病原体的能力降低而出现二次感染,甚至死亡(图 1),此期患者病死率约占脓毒症总病死率的70%[6-7]。老年或机体抵抗力较差的患者出现免疫抑制的比例较高。来自临床尸检的病理学研究显示,免疫细胞凋亡增加、具有免疫抑制作用的细胞比例或者受体表达增加等都参与脓毒症免疫抑制的发生和/或发展[8]。
需要注意的是,上述两个阶段可顺序出现,也可能混合出现[7],使得病情更加复杂多变。如果患者度过细胞因子风暴阶段则病情趋于缓解,反之则可能走向免疫抑制,出现二次感染和/或多器官功能衰竭(图 1)。
1.2 基于脓毒症病理生理机制的治疗药物的国内外研究现状 1.2.1 针对细胞因子风暴的药物研究和使用现状针对脓毒症的治疗药物研究已经进行了几十年,包括以下几类[9]:①针对单一病原分子如LPS的药物,如抗内毒素单克隆抗体等;②针对模式识别受体如TLR4的阻断药物;③针对致炎细胞因子的药物如抗TNF-α和IL-6的单抗药物;④针对凝血系统的重组人活性蛋白C(Xigris);⑤针对免疫系统的免疫抑制药,如糖皮质激素类等;⑥其他药物如阿司匹林、他汀类药物等。但遗憾的是,在上述药物过往研究中,尚无确切有效的药物上市或者是新适应证拓展成功的案例。Xigris因疗效不确切甚至诱导过度出血而导致病死率增加而撤市;糖皮质激素类药物虽然进行了多次的多中心临床研究,但是其在脓毒症中的应用仍然存在很大争议,在脓毒症指南中属于弱推荐[1]。反思上述药物的临床试验结果,学者们认为主要是细胞因子的作用非常复杂,相互作用、制衡形成网络(细胞因子网络),单一抑制某一细胞因子不仅无助于提高脓毒症患者的生存率,反而可能导致机体免疫功能的抑制而增加死亡。
1.2.2 针对免疫抑制阶段的药物研究鉴于脓毒症的本质是机体免疫反应的失衡,随着对脓毒症免疫抑制的重视,近年来欲重建脓毒症患者免疫平衡的免疫调节药物成为新的研究热点和焦点。目前,具有免疫增强作用的药物(免疫增强剂)较多,已经上市的具有免疫增强作用的药物有γ干扰素(interferon-γ,IFN-γ)、粒细胞集落刺激因子和粒细胞/巨噬细胞集落刺激因子等,但在脓毒症指南中并未推荐[1],表明其疗效受到严重质疑。其他正在研究的药物包括化学合成小分子类咪喹莫特、匹多莫德等,微生物制剂卡介苗、乌苯美司等,生物制剂干扰素、转移因子、胸腺肽、人免疫球蛋白等,天然活性成分如香菇多糖、云芝多糖、灵芝多糖等,以及PD-1(programmed cell death-1)/PD-L1(PD-ligand 1)抗体、重组人IL-7等,虽然在实验室里都具有一定免疫增强作用,或正在临床试验中,或未获批上市销售。抗PD-1和抗PD-L1抗体是具有抗肿瘤作用的抗体类药物。有临床研究结果显示,PD-1/PD-L1表达增加与脓毒症免疫功能障碍甚至衰竭密切相关;动物实验结果显示,抗PD-1和抗PD-L1抗体对脓毒症免疫功能紊乱具有一定调节作用[10]。目前二者对脓毒症的治疗作用的新药研究处在Ⅱ期临床试验阶段。此外,重组人IL-7参与B淋巴细胞和T淋巴细胞的生成、成熟、平衡和修复,并可以通过上调抑制基因凋亡的B淋巴细胞瘤2基因(Bcl-2)来增加CD4+和CD8+ T淋巴细胞,并可增加抗原T细胞受体(TCR)的多样性,目前IL-7也处于临床试验阶段。此外,其他药物如IL-3和IL-15在临床前研究中也显示出一定的效果[11]。从理论上说,在免疫抑制阶段使用免疫增强剂可能有效,但是如果使用时机不恰当则可能适得其反。
2 脓毒症免疫抑制在COVID-19中的临床表现在《新型冠状病毒肺炎诊疗方案(试行第六版)》中描述的COVID-19的临床表现包括发烧、咳嗽、肌肉疼痛、腹泻和乏力等,严重者可快速进展为急性呼吸窘迫综合征(ARDS)、脓毒症休克、难以纠正的代谢性酸中毒和出凝血功能障碍及MODS等。特别值得注意的是,重型、危重型患者病程中可表现为中低热,甚至无明显发热。
2.1 COVID-19的临床表现提示COVID-19的病理生理过程中存在脓毒症免疫抑制目前大量研究关注COVID-19诱导的细胞因子风暴阶段,但是在重型、危重型患者病程中可表现为中低热,甚至无明显发热,提示在COVID-19病程的较晚阶段或重型、危重型患者已经出现免疫抑制,与细菌引起的脓毒症免疫抑制过程相似。因此,从COVID-19的临床表现和病程上看,该疾病的病理生理过程是一典型的脓毒症的发生、发展过程。
2.2 COVID-19的实验室检查结果支持脓毒症免疫抑制的存在 2.2.1 COVID-19中存在免疫细胞减少2020年2月17日,《柳叶刀·呼吸医学》杂志发表了解放军总医院第五医学中心(302医院)王福生院士团队的病例报道,首次公布了COVID-19死亡患者的病理解剖结果:患者肺部表现为肺泡损伤伴纤维黏液性渗出、肺泡上皮脱落和肺透明膜形成,符合ARDS的表现;肺中可见到间质内以淋巴细胞为主的单个核细胞炎性浸润,其肺部总体病理学表现与SARS和MERS相似。既往有关SARS患者的病理结果表明,免疫器官的T、B淋巴细胞凋亡和单核、巨噬细胞大量增加。同样,在COVID-19死亡患者中也出现外周血淋巴细胞的减少,但淋巴细胞同时也被过度激活,而高度促炎性的CCR4+ CCR6+Th17细胞增加。上述表现提示,肺部存在严重的免疫细胞的减少、免疫损伤[12]。同样,华中科技大学同济医学院附属协和医院研究团队发表在预印版平台MedRxiv上的研究结果表明,44.4%(12/27)轻型患者、84.6%(11/13)的重型患者淋巴细胞减少。重型患者入院时外周血淋巴细胞的绝对计数显著低于轻型患者;与轻型患者组相比,重型患者组CD3+T细胞、CD4+和CD8+T细胞亚群持续下降[13]。第三军医大学陈永文及吴玉章团队发表在预印版平台MedRxiv的研究也显示,COVID-19患者中总T细胞、CD4+和CD8+ T细胞的数量显著减少[14]。
2.2.2 COVID-19危重患者出现免疫细胞的无反应性当病原体或病原分子入侵机体后,细胞因子的释放是机体免疫细胞识别病原体并做出免疫应答的表现,其目的就是清除对机体有害的病原体。来自临床的研究结果显示,免疫抑制患者存在着免疫系统的功能障碍,表现为单核/吞噬细胞系统的功能低下、T细胞反应性的降低或无反应状态,低下的免疫功能则直接导致机体抵抗入侵病原体能力的降低而出现二次感染,随之出现多器官功能衰竭甚至死亡。《新型冠状病毒肺炎诊疗方案(试行第六版)》中特别提出重型、危重型患者病程中可为中低热,甚至无明显发热,表明重症或危重患者对SARS-COV-2感染后无法做出正常的免疫应答,即先天和后天免疫系统进入非常低的反应状态。因此,在COVID-19患者中一旦出现二次感染,患者病死率将急剧升高。
综上所述,上述来自不同团队的研究结果表明,免疫细胞的减少、免疫细胞的无反应性与患者急剧恶化的多器官功能衰竭密切相关,符合脓毒症免疫抑制的特点,表明COVID-19中存在脓毒症免疫抑制!
3 COVID-19的药物治疗现状及其思考 3.1 COVID-19药物治疗现状 3.1.1 直接抗病毒药物在感染性疾病的治疗中,针对病原体的直接策略是非常有效的。但是由于病毒核酸变异快,导致病毒易对抗病毒药产生耐药性。因此,在人类针对病毒的战斗中,直接抗病毒策略即抑制或杀灭病毒的药物似乎总是处于下风,针对新出现的COVID-19更无特效药物。
《新型冠状病毒肺炎诊疗方案(试行第六版)》推荐可试用的抗病毒药物包括洛匹那韦/利托那韦片、利巴韦林、阿比多尔、磷酸/羟基氯喹等,提高机体抗病毒能力的药物则是干扰素;进展加快的或重型、危重型病例的治疗中可使用康复患者血浆。其他抗病毒药物如瑞德西韦(remdesivir)、法匹拉韦(avigan)等正在临床试验中,替考拉宁(teicoplanin)以及其他一些化合物仍处于实验室研究阶段。同样,我们需要注意的是,在感染性疾病的治疗中,直接抗病毒药物并不能解决COVID-19的全部问题,病毒引起的机体免疫功能紊乱和多器官功能衰竭尚需包括免疫调节药在内的综合治疗措施的实施。
3.1.2 针对细胞因子风暴的药物细胞因子风暴是COVID-19患者向重症和危重症发展的重要因素,阻断细胞因子风暴是目前临床研究的主要方向。目前正在研究的有抗IL-6抗体(托珠单抗)和氯喹等。
虽然在过去大规模的脓毒症研究中抗IL-6抗体并未取得令人满意的结果,但在此次COVID-19中,有报告显示抗IL-6抗体可通过阻断COVID-19的细胞因子风暴[15],进而阻止轻症患者向重症和危重症转变,从而降低病死率。目前抗IL-6抗体托珠单抗正在进行临床研究(中国临床试验注册中心注册号:ChiCTR2000029765)。鉴于COVID-19是一种新出现的病毒性疾病,人们对COVID-19的病理生理机制认识尚浅,该抗体在COVID-19的最后评价有待更多病例数的对照、随机、双盲的临床试验结果。
有趣的是,在推荐的诊疗方案中,来自COVID-19的临床研究显示,传统的抗疟药物氯喹不仅有抗炎作用,而且在体外具有直接抗SARS-COV-2作用[16]。作为具有70年历史的抗疟药,由于氯喹具有良好的抗炎作用[17-18],目前广泛用于类风湿性关节炎等自身免疫性疾病的治疗。和我们预期一致的是,目前氯喹主要用于轻型、普通型患者;鉴于氯喹的抗炎作用与其作为自噬体酸化抑制剂从而干扰自噬、抑制炎症有关,而在重症和危重症患者其细胞自噬功能已经严重降低,清除病原体的能力也已经严重受损[19],因此抑制自噬功能则会导致患者清除病原体能力的进一步降低,二次感染的风险大大增加。在此,我们强烈建议重症和危重症患者慎用氯喹。
3.1.3 中药在COVID-19防治过程中,国家大力强化中西医结合,且大力促进中医药深度介入诊疗全过程。按照中医理论,COVID-19属于中医“疫”病范畴,病因为感受“疫戾”之气,病机为内有湿、热、淤、痰。目前推荐的中药治疗汤剂清肺排毒汤适用于各个阶段的COVID-19。中医通过辨证论治对不同证候(寒湿郁肺证、湿毒郁肺证、疫毒闭肺证等)推荐了不同的中药汤剂,力图做到在不同气候条件下的不同体质特点、不同病情患者的精准个体化治疗。
3.2 COVID-19治疗药物的思考鉴于COVID-19是病毒引起的感染性疾病,因此针对COVID-19的直接抗病毒药物和调节机体免疫力的药物同等重要。但是,在缺乏特效的直接抗病毒药物的情况下,调节机体免疫力的药物可能是降低COVID-19重症、危重症病人病死率的思路之一。
由于COVID-19患者存在细胞因子风暴和免疫抑制两个状态,而且常常两个状态交叉或混合出现,导致患者的免疫状态瞬息万变,因此给予某一阶段的免疫干扰药物的“时间窗”非常狭窄,故而准确把握给药时间窗就极为困难,使得临床医生选择药物非常困难。
我们课题组一直从事脓毒症发病机制以及治疗药物的研究。我们的研究结果表明[20],脓毒症的免疫治疗需要的是一个真正的双向免疫调节药,不受治疗“时间窗”的限制,即在细胞因子风暴阶段具有一定的抗炎作用,而在免疫抑制阶段具有一定的免疫增强作用,否则就可能在细胞因子风暴阶段给予免疫增强药而发生“火上浇油”的现象,在免疫抑制阶段给予免疫抑制药而出现“雪上加霜”的现象。即使在细胞因子风暴阶段给予免疫抑制药,患者虽然度过细胞因子风暴阶段,但是由于机体免疫力低下,最终出现二次感染和多器官功能衰竭而死亡。
此次在COVID-19治疗中,中医药发挥了一定作用,提示中药中可能存在具有双向免疫调节作用的药物成分,这或许能解释至少部分解释中药对COVID-19的疗效。当然,中药是否通过其含有的双向免疫调节成分发挥作用则有待进一步研究。我们课题组研究显示,另一传统的抗疟药物青蒿琥酯(artesunate)既可显著提高处于脓毒症细胞因子风暴阶段动物的存活率,也可显著提高处于脓毒症免疫抑制阶段动物的存活率;青蒿琥酯的免疫调节机制表现为在细胞因子风暴阶段抑制细胞的过度自噬、抑制致炎细胞因子释放[20-21],而在免疫抑制阶段则可以增强机体低下的自噬功能、增强细胞清除病原体能力[22]。因此,我们认为青蒿琥酯具有良好的双向免疫调节作用,值得作为一个真正的双向免疫调节药物进行深入研究。
4 展望COVID-19具有典型的脓毒症病理生理过程特征即早期的细胞因子风暴和随后的免疫抑制阶段,如果只关注“细胞因子风暴”而忽略随后的“免疫抑制”阶段,重症和危重症患者的病死率则可能仍将居高不下,因此深入研究COVID-19的病理生理过程及其发生发展机制对发现新的治疗策略和药物靶点具有重要意义。此外,除研究针对病毒的疫苗和直接抗病毒药物外,研究具有双向免疫调节作用的药物对降低重症、危重症患者的病死率具有非常重要的作用。这不仅对COVID-19的治疗具有重要意义,而且对涉及自身免疫功能紊乱的其他疾病的治疗也有一定启示作用。
“路漫漫其修远兮,吾辈求索抗冠魔”。我们相信,基于COVID-19的病理生理机制寻找有效的治疗药物,会帮助我们取得抗击COVID-19战役的胜利!
| [1] |
SINGER M, DEUTSCHMAN C S, SEYMOUR C W, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] |
WENZEL R P, EDMOND M B. Septic shock: evaluating another failed treatment[J]. N Engl J Med, 2012, 366(22): 2122-2124. DOI:10.1056/NEJMe1203412 |
| [3] |
FLEISCHMANN C, SCHERAG A, ADHIKARI N K, et al. Assessment of global incidence and mortality of hospital-treated sepsis. Current estimates and limitations[J]. Am J Respir Crit Care Med, 2016, 193(3): 259-272. DOI:10.1164/rccm.201504-0781OC |
| [4] |
VAN DER POLL T, OPAL S M. Host-pathogen interactions in Sepsis[J]. Lancet Infect Dis, 2008, 8(1): 32-43. DOI:10.1016/S1473-3099(07)70265-7 |
| [5] |
QIU P, LIU Y, ZHANG J. Review: the role and mechanisms of macrophage autophagy in sepsis[J]. Inflammation, 2019, 42(1): 6-19. DOI:10.1007/s10753-018-0890-8 |
| [6] |
WATANABE E, THAMPY L K, HOTCHKISS R S. Immunoadjuvant therapy in sepsis: novel strategies for immunosuppressive sepsis coming down the pike[J]. Acute Med Surg, 2018, 5(4): 309-315. DOI:10.1002/ams2.363 |
| [7] |
HOTCHKISS R S, MONNERET G, PAYEN D. Immuno suppression in sepsis: a novel understanding of the disorder and a new therapeutic approach[J]. Lancet Infect Dis, 2013, 13(3): 260-268. DOI:10.1016/s1473-3099(13)70001-x |
| [8] |
TORGERSEN C, MOSER P, LUCKNER G, et al. Macroscopic postmortem findings in 235 surgical intensive care patients with sepsis[J]. Anesth Analg, 2009, 108(6): 1841-1847. DOI:10.1213/ane.0b013e318195e11d |
| [9] |
周红, 刘鑫, 郑江. 脓毒症治疗:挑战与机遇并存[J]. 第三军医大学学报, 2013, 35(2): 91-94. ZHOU H, LIU X, ZHENG J. Sepsis treatment: Challenge and chance[J]. J Third Mil Med Univ, 2013, 35(2): 91-94. DOI:10.16016/j.1000-5404.2013.02.027 |
| [10] |
HUANG X, VENET F, WANG Y L, et al. PD-1 expression by macrophages plays a pathologic role in altering microbial clearance and the innate inflammatory response to Sepsis[J]. Proc Natl Acad Sci USA, 2009, 106(15): 6303-6308. DOI:10.1073/pnas.0809422106 |
| [11] |
DELANO M J, WARD P A. Sepsis-induced immune dysfunction: can immune therapies reduce mortality?[J]. J Clin Invest, 2016, 126(1): 23-31. DOI:10.1172/JCI82224 |
| [12] |
XU Z, SHI L, WANG Y J, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome[J]. Lancet Respir Med, 2020, S2213-S2600(20)30076-X. DOI:10.1016/S2213-2600(20)30076-X |
| [13] |
LIU J, LI SM, LIU J, et al. Longitudinal characteristics of lymphocyte responses and cytokine profiles in the peripheral blood of SARS-CoV-2 infected patients[J]. MedRxiv, 2020.[2020-02-23]. |
| [14] |
DIAO B, WANG CH, TAN YJ, et al. Reduction and functional exhaustion of T cells in patients with coronavirus disease 2019 (COVID-19)[J]. MedRxiv, 2020.[2020-02-23]. |
| [15] |
ZUMLA A, HUI D S, MEMISH ZA, et al. Reducing mortality from 2019-nCoV: host-directed therapies should be an option[J]. Lancet., 2020. DOI:10.1016/S0140-6736(20)30305-6 |
| [16] |
GAO J J, TIAN Z X, YANG X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies[J]. Biosci Trends, 2020. DOI:10.5582/bst.2020.01047 |
| [17] |
ZHOU H, ZHENG J, WANG LX, et al. Chloroquine protects mice from challenge with CpG ODN and LPS by decreasing proinflammatory cytokine release[J]. Int Immuno-pharmacol, 2004, 4(2): 223-234. DOI:10.1016/j.intimp.2003.12.006 |
| [18] |
MACFARLANE D E, MANZEL L. Antagonism of immunostimulatory CpG-oligodeoxynucleotides by quinacrine, chloroquine, and structurally related compounds[J]. J Immunol, 1998, 160(3): 1122-1131. |
| [19] |
REN C, ZHANG H, WU TT, et al. A potential therapeutic target for reversing sepsis-induced immunosuppression[J]. Front Immunol., 2017, 8: 1832. DOI:10.3389/fimmu.2017.01832 |
| [20] |
CAO T H, JIN S G, FEI D S, et al. Artesunate protects against sepsis-induced lung injury via heme oxygenase-1 modulation[J]. Inflammation, 2016, 39(2): 651-662. DOI:10.1007/s10753-015-0290-2 |
| [21] |
LI B, ZHANG R, LI J, et al. Antimalarial artesunate protects sepsis model mice against heat-killed Escherichia coli challenge by decreasing TLR4, TLR9 mRNA expressions and transcription factor NF-kappa B activation[J]. Int Immunopharmacol, 2008, 8(3): 379-389. DOI:10.1016/j.intimp.2007.10.024 |
| [22] |
SHANG S L, WU J, LI X L, et al. Artesunate interacts with vitamin D receptor to reverse mouse model of sepsis-induced immunosuppression via enhancing autophagy[J]. bioRxiv, 2020. DOI:10.1101/2020.02.26.966143 |