2. 414000 湖南 岳阳,岳阳职业技术学院;
3. 410078 长沙,中南大学高等研究中心细胞生物学研究室
2. Yueyang Vocational Technical College, Yueyang, Hunan Province, 414000;
3. Department of Cell Biology, Center for Advanced Research, Central South University, Changsha, Hunan Province, 410078, China
血吸虫病(schistosomiasis)是一种在全球78个国家有流行的主要热带病之一,每年因患该病而致死的有数万多人[1]。在血吸虫病流行区,控制疫情和防止病情发生与发展的主要措施是化学疗法。当前,用于临床治疗和现场消除传染源的药物仍然是使用了40余年的吡喹酮,用于预防性治疗的仅有用了20余年的青蒿素类药物(如蒿甲醚和青蒿琥酯)。吡喹酮的杀虫作用主要是针对尾蚴入侵终宿主(人和某些哺乳动物)皮肤后4~6 h内童虫[2]和35 d以上成虫,而对1~7 d童虫效果较差,且对2~4周的童虫效果最差[3]。青蒿素类药物仅有杀肝期童虫作用[4]。迄今,尚无高效杀终宿主体内1~6 d童虫的药物被临床和现场应用。
血吸虫对终宿主的感染阶段是尾蚴,以水为媒介经皮肤或黏膜入侵后转化为童虫。依据童虫在宿主体内移行和寄生部位常被分为皮肤期童虫、肺期童虫和肝期童虫;依据童虫生长、发育和分化较快及移行于宿主器官组织中的生物学特性,可将皮肤期童虫进入血液经肺移行至肝内门静脉之前的虫体统称为移行期童虫(migratory-stage schistosomula)。童虫所经历部位可引起组织炎症病变,但不会导致肝、肠等器官的纤维化病理损害,只有发育为成虫产出的虫卵到成熟后才可引起严重的组织病变,即血吸虫病发生与发展的根本。不同种血吸虫童虫移行期长短有差异,日本血吸虫(Schistosoma japonicum,S.j)为2~7 d[5]。在学者们研究抗血吸虫童虫新药中,仅发现甲氟喹有杀各期虫体的作用,但主要杀伤对象为感染后6 d的虫体,且毒副作用(引起神经精神症状)较大[6-7]。研发或寻找一种高效杀血吸虫移行期童虫的药物对于血吸虫感染的临床早期治疗具有实用意义。
为筛选一种抗血吸虫移行期童虫的药物,本文在前期研究中从新的大环内酯类化合物中发现了一种具显著杀S.j童虫的效果,只因生产困难而终止。本研究依据其构效关系,从临床应用于抗其他病原的大环内酯类药物中选取了3种,首先对体外S.j脱尾童虫的杀伤效果作了观察,发现其中的伊维菌素具有显著杀虫效果,进而取其对S.j感染小鼠体内24~96 h的童虫做了治疗效果观察,获得了有意义的结果,现报告如下。
1 材料与方法 1.1 试验药物及试剂材料 1.1.1 试验药物来源及母液配制克拉霉素(ClM)江苏恒瑞医药股份有限公司产;阿奇霉素(AzM)东北制药股份有限公司产;伊维菌素(IVM)南京金盾动物药业有限责任公司产;吡喹酮(PZQ)南京制药有限公司产;青蒿琥酯(ARS)桂林南药股份有限公司产。在试验前24 h内,将各药物分别用二甲基亚砜(DMSO, Gibic产品)和无菌生理盐水配制成2 mg/mL母液。体外杀伤试验的各药应用液均采用含双抗(2 000 UI/mL青霉素和链霉素2 000 μg/mL)的RPMI1640培养基按实验设计稀释为所需浓度。
1.1.2 试验器材和试剂来源及配制24孔培养板(美国Corning公司),胎牛血清(杭州四季青公司),RPMI1640(Gibic产品),青霉素(哈药集团制药总厂)和链霉素(华北制药股份有限公司),改良美蓝溶液取美蓝(国产)用0.38%的柠檬酸三钠溶液配制成4%的母液备用。日本血吸虫(S.j)阳性钉螺由湖南省血吸虫病防治所提供。钉螺释放S.j尾蚴方法按常规进行。收集S.j尾蚴按照文献[8]制备脱尾童虫,使脱尾率达85%以上。
1.1.3 实验动物对S.j易感的单雌性清洁级健康昆明鼠(购自中南大学实验动物中心)42只,体质量为(25±1)g。在试验期间均按常规饲养于清洁级恒温动物实验室。
1.2 体外杀伤实验实验设7组:除3种大环内酯类药物各一组之外,还设青蒿琥酯和吡喹酮两药对照组、DMSO对照组和无药空白对照组。ClM、AzM、IVM、PZQ和ARS 5个组的药物终浓度设为10、20、40 μg/mL 3个不同剂量小组,每个剂量小组设3个复孔。除无药空白对照组外,其他各组的DMSO终浓度为5 μg/mL。无药空白对照组仅含双抗的RPMI1640培养基。采用48孔培养板,每孔加1.0 mL培养基后,按设计在各培养孔中加入相应药品溶液,再将每孔加入0.2 mL含100~200条S.j脱尾童虫悬液。然后,将培养板置于37 ℃的二氧化碳培养箱内培养24 h后每天更换培养基0.5 mL/孔。虫体杀伤效果观察:在加药后24 h和48 h时,分别在倒置显微镜下判别药物作用后的虫体活力及行为变化。虫体活力判定标准参照文献[9]。在加药后72 h时,加终浓度为0.05%的改良柠檬酸-美兰于培养孔内,在37 ℃培养箱作用1 h后置于倒置镜下观察(虫体呈紫红色的为活虫,虫体呈蓝色和无色的为死虫)计算死亡虫数,并用Motic-BA400 CCD系统采集低、高倍镜下的图像。虫体死亡率的计算公式为:死亡率=3个平行孔(平均总虫数-平均活虫数)/平均总虫数×100%。在加药后96 h,仅对1640培养基对照组、PZQ组和IVM组的虫体形态作比较观察。
1.3 体内杀虫实验取阳性钉螺,释放S.j尾蚴方法同1.1.2项。对42只昆明小鼠按常规法[2, 7]经腹部去毛皮肤感染S.j活尾蚴(30±1)尾/鼠。在感染后将小鼠编序号后随机取号分为6组(7只/组)。各组按感染后不同时点分别给药:设计方案为:A组[IVM 0.4 mg/(kg·次),24 h和48 h两时点各1次];B组[IVM 0.4 mg/(kg·次),72 h和96 h两时点各1次];C组[IVM 0.2 mg/(kg·次),24 h和48 h两时点各1次];D组[联合用药为IVM 0.2 mg/(kg·次),24 h和48 h时点+PZQ 150 mg/kg, 46 h时点];E组[联合用药为IVM 0.2 mg/(kg·次),24 h和48 h时点+ARS 125 mg/kg,26 h时点];F组(不给药感染对照)。药物配制:除PZQ用吐温80乳化外,其他药物均用注射用水配制所需剂量浓度。给药途径为经口灌胃给药。在感染后第28天对实验小鼠经戊巴比妥钠麻醉后,作眼眶放血,解剖小鼠,用0.38%柠檬酸三钠生理盐水灌注冲虫,仔细检查并收集肠系膜静脉内和肝门静脉内的虫体,记录每鼠检获虫体数,统计各组虫体均数。与感染对照组比,计算各组的减虫率。
1.4 统计学分析采用SPSS 17.0软件进行统计学分析,计量资料以x±s表示。虫体死亡率在组间作χ2检验分析。检验水准α=0.05。
2 结果 2.1 体外杀伤效果用克拉霉素(ClM)、阿奇霉素(AzM)和伊维菌素(IVM) 3种大环内酯类药物分别对体外S.j脱尾童虫的杀伤效果差异见表 1。表 1显示IVM 20 μg/mL和IVM 40 μg/mL两剂量水平的杀伤效果达100%。依据死虫率作统计学分析:IVM两剂量组与DMSO组或1640组相比,以及与ClM组和AzM组相比,差异有统计学意义(P < 0.01);IVM 20 μg/mL组与PZQ和ARS两组相比,差异有统计学意义(P < 0.05)。5种不同药物在20 μg/mL浓度体外作用S.j童虫72 h时,经改良美兰溶液染色1 h后的虫体死与活状态见图 1,以呈深蓝或紫红色反应者判为活虫体和未见显色或浅蓝色反应者判为死虫体的标准,可见在体外杀虫作用最强的是IVM(见不到有着色的虫体),其次是ARS。
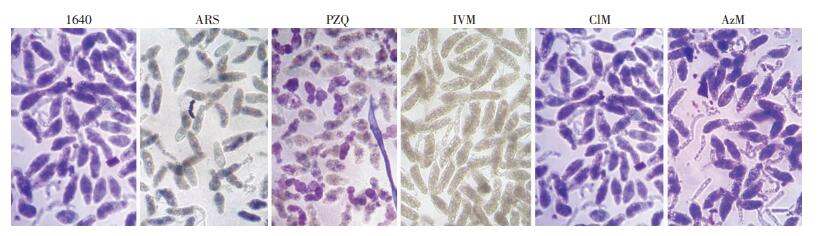
|
| 呈深蓝或紫红色反应者为活虫体,未见显色或浅蓝色反应者为死虫体 图 1 不同药物对体外S.j脱尾童虫作用72 h的改良美兰染色观察(×100) |
| 组别 | 40 μg·mL-1 | 20 μg·mL-1 | 10 μg·mL-1 | 无药对照 | ||||
| 虫数/x±s | 死虫数(%) | 虫数/x±s | 死虫数(%) | 虫数/x±s | 死虫数(%) | 虫数/x±s | 死虫数(%) | |
| ClM | 98.60±26.12 | 21.23(21.5) | 168.50±10.61 | 34.42(20.4) | 173.00±15.56 | 32.78(19.0) | ||
| AzM | 146.00±18.49 | 34.89(23.9) | 127.40±4.95 | 28.58(22.4) | 118.50±12.02 | 37.36(31.5) | ||
| IVM | 137.40±26.18 | 137.40(100)b | 124.00±5.66 | 124.00(100)b | 100.50±13.44 | 66.00(66.0)c | ||
| ARS | 106.50±21.42 | 86.45(81.2)ab | 98.50±20.51 | 39.16(39.7)a | 100.00±72.12 | 26.7(26.7) | ||
| PZQ | 102.70±18.52 | 79.41(77.4)abc | 99.15±28.66 | 37.49(37.8)a | 127.80±14.42 | 51.28(40.1) | ||
| DMSO | 89.00±2.83 | 30.97(34.8) | ||||||
| RPMI1640 | 90.50±3.5 | 14.29(15.8) | ||||||
| a:P < 0.05,与IVM组比较; b: P < 0.01,c: P < 0.05,与无药对照DMSO组或1640组比较 | ||||||||
PZQ作用的虫体行为变化(收缩成团)与IVM作用(伸展呈砍刀状)的虫体行为变化明显不同。PZQ和IVM作用虫体不同时点的行为和形态变化观察结果见表 2。其中作用96 h时的虫体形态学比较见图 2。其形态差异表现:RPMI1640对照组的虫体活跃,具光泽,体壁完整,有的肠管清晰可见,生长发育好;PZQ组的虫体活跃度及光泽相对较低,体壁及肠管稍欠清晰,部分虫体生长发育良好。IVM组的虫体失去光泽,表膜欠完整或出现泡状物,结构退变,无生长发育迹象。
| 加药后观察时点 | PZQ 20 μg·mL-1体外作用 | IVM 20 μg·mL-1体外作用 |
| 2 h | 虫体显著收缩成团,活力减低 | 虫体形态无变化,活动能力迅速停止 |
| 24 h | 多数虫体稍有伸展并出现蠕动 | 多数虫体僵硬呈砍刀状,极少数稍有蠕动 |
| 48 h | 活虫数有增加,死虫数减少 | 虫体维持原形,未见有活动的虫体 |
| 72 h | 多数虫体有伸展,活动力有增强 | 虫体形状未改变,体壁和内容结构失去光泽 |
| 96 h | 较多虫体活力明显并有生长发育 | 虫体结构模糊,退变,部分虫体体壁有空泡 |
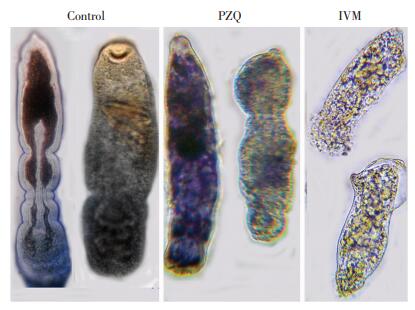
|
| 图 2 PZQ和IVM体外作用S.j脱尾童虫96 h时的形态学比较(×400) |
2.2 体内杀虫效果
取IVM对小鼠体内S.j移行期童虫的治疗效果见表 3、图 3。与感染对照组比:用0.4 mg/kg×2次的IVM杀感染后24~48 h童虫效果(减虫率53.37%)强于72~96 h(减虫率39.98%),但差异无统计学意义;用0.2 mg/kg×2次的IVM杀感染后24~48 h童虫效果(减虫率32.90%)显著低于IVM 0.4 mg/kg×2次(P < 0.01)。用IVM+PZQ或IVM+ARS联合治疗两组的杀虫效果不仅未能发挥增效或相加作用,反而显著减低了单用IVM的杀虫效果。
| 组别 | 鼠数 | 药物剂量/mg·kg-1·次-1 | 感染后给药时点 | 检获虫数(x±s) | 减虫率(%) |
| IVM | 5* | 0.4 | 24 h, 48 h | 5.33±3.31a | 53.37 |
| IVM | 7 | 0.4 | 72 h, 96 h | 6.86±1.07b | 39.98 |
| IVM | 7 | 0.2 | 24 h, 48 h | 7.67±3.83 | 32.90 |
| IVM+PZQ | 7 | 0.2, 150 | 24 h, 48 h, 46 h | 10.00±3.81 | 12.51 |
| IVM+ARS | 7 | 0.2, 125 | 24 h, 48 h, 26 h | 9.71±2.63 | 15.05 |
| 感染对照 | 7 | 11.43±5.16 | |||
| a: P < 0.01, b: P < 0.05, 与感染对照比较; *:在用药期间死亡2只(可能为IVM的毒性反应) | |||||
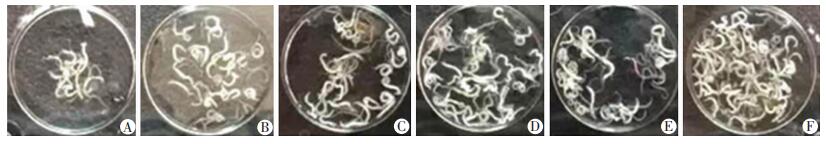
|
| A:IVM 0.4 mg/kg 24 h和48 h用药组;B:IVM 0.4 mg/kg 72 h和96 h用药组;C:IVM 0.2 mg/kg 24 h和48 h用药组;D:IVM 0.2 mg/kg 24 h和48 h用药+PZQ 150 mg/kg 26 h用药联合组;E:IVM 0.2 mg/kg 24 h和48 h用药+ARS 125 mg/kg 26 h用药联合组;F:不用药的感染对照组 图 3 S.j尾蚴感染后第28天各实验组小鼠体内检获虫体总数 |
3 讨论
伊维菌素(IVM)是一种由阿维链霉菌(streptomyces avermitilis)发酵产生的半合成大环内酯类抗生素,是阿维菌素的衍生物,具有广谱、高效、低毒的特点[10],为美国1996年被批准应用于人类的抗虫药物。迄今为止,尽管在中国生产的IVM还停留在用于对家畜体内外寄生线虫和节肢动物感染的治疗,但在国外生产的IVM早已被广泛应用于对人体圆线虫病、棘颚口线虫病、盘尾丝虫病、淋巴丝虫症、疥疮和酒渣鼻的治疗[11-12]。近年有研究发现:将IVM与阿苯达唑联合用于治疗合并有淋巴丝虫病或盘尾丝虫病、圆线虫病或土源性线虫病的人群治疗,具有安全增效和成本低的优势[13];制备成IVM-PZQ复合剂用于治疗丝虫病和血吸虫病同一流行区的儿童人群,但对血吸虫病的治疗未获得优于单用PZQ的效果[12, 14-15];发现IVM可逆转肿瘤细胞耐药性、抑制体内肿瘤生长[16-17]和用大剂量IVM[1.6 mg/(kg·d)]可有效缓解脊髓损伤患者严重肌肉痉挛症状的新用途[11];用0.5 μg/mL浓度的IVM对血吸虫中间宿主蜗牛及尾蚴有很好的杀伤效果[18]。
从临床应用的商品化药物中寻找新用途是一种经济快捷的途径。本研究旨在从临床应用的老药中寻找对血吸虫移行期童虫有杀伤效果的制剂。经初步研究发现IVM对体外S.j脱尾童虫的杀伤作用可达100%,对S.j感染小鼠体内早期童虫有显著抗虫效果(减虫率为53.37%)。然而,值得一提的是采用IVM与PZQ或ARS联合治疗的结果,未能发挥其增效或协同作用,其原因尚不明了。此外,本研究在体外杀伤实验中还发现在体外培养环境中,IVM和PZQ二者对血吸虫脱尾童虫作用体现在行为上有显著不同。其原因可能与各自杀虫机制不同有关。PZQ的杀虫机制是作用钙通道, 使钙离子内流致虫体发生痉挛性收缩等[19],但在体外不能有效杀死作用。而IVM是作用于神经受体(对线虫幼虫的作用机制)[20],使虫体在体外迅速发挥麻痹,维持原形而不可逆转的致死作用。
在血吸虫病流行区,用于预防感染的药物早已研发出不少制剂。只要在接触疫水前涂抹其药膏或防护剂于皮肤上就可防止血吸虫经皮侵入。常被现场采用的有皮避敌、9311防护霜、载体霜药膏等(其成分主要为敌百虫或氯硝柳胺或吡喹酮)[4]。近年经实验研究获得较好预防效果的制剂有大蒜油、血水草生物碱、吡喹酮透皮、左旋咪唑涂肤剂等[21-24]。然而,值得指出的是这些制剂只能阻止或杀死入侵人体皮肤后数小时之内的虫体,仅适用于接触疫水的现场人群,而不适合对临床对象的治疗。为满足临床对血吸虫感染者早期治疗用药,本研究发现的IVM作用有可能弥补了长期以来存在的空白,即可将IVM用于在临床遇到2 d内有明确接触疫水的人群对象,从理论上可达到部分杀早期移行期童虫的目的,发挥较好的治疗和预防的双重作用,但其在临床应用中的效果如何有待于进一步研究验证。
| [1] |
LACKEY E K, HORRALL S. Schistosomiasis (Schistosoma Haematobium)[M]. Treasure Island (FL): Stat Pearls Publishing, 2020: 21-32.
|
| [2] |
张娟, 李闻文, 曾庆仁, 等. 吡喹酮对血吸虫感染小鼠前后早期预防或治疗作用的时点观察[J]. 实用预防医学, 2013, 20(2): 129-131. ZHANG J, LI W W, ZENG Q R, et al. Observation of the time point of praziquantel administration before and after Schistosoma japonicum infection in mice for early prevention and treatment[J]. Pract Prev Med, 2013, 20(2): 129-131. DOI:10.3969/j.issn.1006-3110.2013.02.001 |
| [3] |
邓伟成, 曾庆仁. 临床寄生虫病学[M]. 北京: 人民卫生出版社, 2015: 423-436. DENG W C, ZENG Q R. Clinical parasitology[M]. Beijing: People's Medical Publishing House, 2015: 423-436. |
| [4] |
李岳生. 血吸虫病实用防治技术[M]. 北京: 人民卫生出版社, 2010: 181-189. LI Y S. Practical control techniques for Schistosomiasis[M]. Beijing: People's Medical Publishing House, 2010: 181-189. |
| [5] |
吴观陵. 人体寄生虫学[M]. 3版. 北京: 人民卫生出版社, 2005: 312-340. WU G L. Human parasitology[M]. 3rd ed. Beijing: People's Medical Publishing House, 2005: 312-340. |
| [6] |
XIAO S H, MEI J Y, JIAO P Y. Further study on mefloquine concerning several aspects in experimental treatment of mice and hamsters infected with Schistosoma japonicum[J]. Parasitol Res, 2009, 106(1): 131-138. DOI:10.1007/s00436-009-1640-5 |
| [7] |
XIAO S H. Mefloquine, a new type of compound against schistosomes and other helminthes in experimental studies[J]. Parasitol Res, 2013, 112(11): 3723-3740. DOI:10.1007/s00436-013-3559-0 |
| [8] |
王大坤, 赵慰先. 一种简便的日本血吸虫体外童虫转化法[J]. 中国人兽共患病杂志, 1988, 4(4): 61-62. WANG D K, ZHAO W X. A simple method for transformation of Schistosoma japonicum into Schistosoma japonicum in vitro[J]. Chin J Zoonoses, 1988, 4(4): 61-62. |
| [9] |
陈岩勤, 张庆远, 李笑然, 等. 白头翁总皂苷对体外培养的日本血吸虫幼虫及成虫的作用[J]. 中国血吸虫病防治杂志, 2013, 25(6): 604-609. CHEN Y Q, ZHANG Q Y, LI X R, et al. Effect of Pulsatilla chinensis(Bunge)Regel saponins against juvenile and adult Schistosoma japonicum in vitro[J]. Chin J Schistosomiasis Control, 2013, 25(6): 604-609. DOI:10.16250/j.32.1374.2013.06.027 |
| [10] |
VAN HEES S, RAIMON S, FODJO J N S, et al. Safety of ivermectin during pregnancy[J]. Lancet Glob Health, 2020, 8(3): e338. DOI:10.1016/S2214-109X(19)30555-8 |
| [11] |
LAING R, GILLAN V, DEVANEY E. Ivermectin-old drug, new tricks?[J]. Trends Parasitol, 2017, 33(6): 463-472. DOI:10.1016/j.pt.2017.02.004 |
| [12] |
OSMAN M, SHOKEIR H A, HASSAN A M, et al. Pulsed dye laser alone versus its combination with topical ivermectin 1% in treatment of Rosacea: a randomized comparative study[J]. J Dermatolog Treat, 2020, 1-7. DOI:10.1080/09546634.2020.1737636 |
| [13] |
BONNEAU S, MAYNARD L, TOMCZUK K, et al. Anthelmintic efficacies of a tablet formula of ivermectin—praziquantel on horses experimentally infected with three Strongylus species[J]. Parasitol Res, 2009, 105(3): 817-823. DOI:10.1007/s00436-009-1460-7 |
| [14] |
ZAMMARCHI L, GOBBI F, ANGHEBEN A, et al. Schistosomiasis, strongyloidiasis and Chagas disease: the leading imported neglected tropical diseases in Italy[J]. J Travel Med, 2020, 27(1): taz100. DOI:10.1093/jtm/taz100 |
| [15] |
REHBEIN S, VISSER M, YOON S, et al. Efficacy of a combination ivermectin/praziquantel paste against Nematodes, cestodes and bots in naturally infected ponies[J]. Vet Rec, 2007, 161(21): 722-724. DOI:10.1136/vr.161.21.722 |
| [16] |
JIANG L, WANG P, SUN Y J, et al. Ivermectin reverses the drug resistance in cancer cells through EGFR/ERK/Akt/NF-κB pathway[J]. J Exp Clin Cancer Res, 2019, 38: 265. DOI:10.1186/s13046-019-1251-7 |
| [17] |
MELOTTI A, MAS C, KUCIAK M, et al. The river blindness drug ivermectin and related macrocyclic lactones inhibit WNT-TCF pathway responses in human cancer[J]. EMBO Mol Med, 2014, 6(10): 1263-1278. DOI:10.15252/emmm.201404084 |
| [18] |
KATZ N, ARAÚJO N, COELHO P M Z, et al. Ivermectin efficacy against Biomphalaria, intermediate host snail vectors of Schistosomiasis[J]. J Antibiot, 2017, 70(5): 680-684. DOI:10.1038/ja.2017.31 |
| [19] |
CIOLI D, PICA-MATTOCCIA L, BASSO A, et al. Schistosomiasis control: praziquantel forever?[J]. Mol Biochem Parasitol, 2014, 195(1): 23-29. DOI:10.1016/j.molbiopara.2014.06.002 |
| [20] |
LEE C H, CHANG H W, YANG C T, et al. Sensory Cilia as the Achilles heel of Nematodes when attacked by carnivorous mushrooms[J]. Proc Natl Acad Sci USA, 2020, 117(11): 6014-6022. DOI:10.1073/pnas.1918473117 |
| [21] |
姜玲, 彭飞, 黄琼瑶, 等. 血水草生物碱防治日本血吸虫病的实验研究[J]. 湖南中医杂志, 2010, 26(1): 90-92. JIANG L, PENG F, HUANG Q Y, et al. An experimental study on the Eomecon chionantha alkaloids control of Schistosoma japonicum[J]. Hunan J Tradit Chin Med, 2010, 26(1): 90-92. DOI:10.16808/j.cnki.issn1003-7705.2010.01.056 |
| [22] |
杜幼芹, 汪鋆植, 冯天艳, 等. 大蒜油杀灭日本血吸虫尾蚴作用研究[J]. 中国病原生物学杂志, 2011, 6(9): 666-667. DU Y Q, WANG J Z, FENG T Y, et al. Extraction of garlic oil and its activity against Schistosoma japonicum cercariae[J]. J Pathog Biol, 2011, 6(9): 666-667. DOI:10.13350/j.cjpb.2011.09.012 |
| [23] |
李小红, 张大治, 杨艺, 等. 吡喹酮透皮给药治疗小鼠日本血吸虫病效果[J]. 中国血吸虫病防治杂志, 2012, 24(2): 155-159. LI X H, ZHANG D Z, YANG Y, et al. Effect of praziquantel transdermal delivery on infection of Schistosoma japonicum of mice[J]. Chin J Schistosomiasis Control, 2012, 24(2): 155-159. DOI:10.16250/j.32.1374.2012.02.020 |
| [24] |
杨明瑾, 漏磊君, 严晓岚, 等. 左旋咪唑防御日本血吸虫尾蚴感染的实验研究[J]. 中国血吸虫病防治杂志, 2004, 16(6): 436-439. YANG M J, LOU L J, YAN X L, et al. Experimental studies on efficacy of levamisole in prevention from schistosoma japonicum Cercaria infection[J]. Chin J Schistosomiasis Control, 2004, 16(6): 436-439. DOI:10.16250/j.32.1374.2004.06.013 |



