2. 730030 兰州,兰州大学第二医院急危重症科3病区
2. Ward 3 of Department of Critical Care Medicine, Lanzhou University Second Hospital, Lanzhou, Gansu Province, 730030, China
脓毒症是指一系列异常复杂的事件,包括炎症和抗炎过程、体液和细胞反应以及心脏循环异常(例如交感神经过度激活)。严重的脓毒症是一种以一个或多个器官功能障碍(特别是心脏功能障碍)和血流动力学障碍为特征的复杂综合征。脓毒症诱导的心功能障碍(sepsis-induced myocardial dysfunction, SIMD)主要是指左心室收缩力下降,严重脓毒症会导致持续性血管麻痹和高死亡率[1]。交感神经系统(sympathetic nerve system, SNS)在这一初始级联中起重要作用,使宿主对入侵病原体做出反应。然而,在脓毒症患者中,不受调节的交感神经张力会对机体造成损害,这激发了人们对交感神经张力选择性抑制的研究。几十年来感染性休克治疗的基石是儿茶酚胺的补充,从而潜在地进一步延续这种交感神经失调,脓毒性超肾上腺素能驱动导致持续性心动过速,心肌氧供需失衡,心脏舒张期明显缩短,造成心肌缺血损伤,组织灌注不足。目前,最有力的临床证据是在败血性休克患者中使用β1-受体阻滞剂艾司洛尔治疗继发于儿茶酚胺的持续性心动过速[2]。脓毒症时大量儿茶酚胺可以介导包括高分解代谢状态、炎症反应、氧化应激、钙离子超载等在内的心肌细胞毒性作用,进而导致心肌细胞损伤、凋亡甚至坏死[3]。心肌细胞内含有非常丰富的线粒体,线粒体在体内的主要作用包括通过氧化磷酸化为细胞提供ATP,调节Ca2+平衡,维持细胞氧化还原平衡以及介导细胞凋亡等作用。细胞凋亡的主要途径包括由TNF-α等介导的死亡受体途径(外源性途径)、Bcl-2家族介导参与的线粒体途径(内源性途径)及内质网途径[4-5]。而无论是哪一种凋亡途径,最终汇聚于Caspase-3执行凋亡,Caspase-3在整个细胞凋亡过程中处于核心地位[6]。经外源性途径激活的Caspase-8通过Bcl家族调节型蛋白Bid,激活促凋亡蛋白Bax,Bax易位至线粒体外膜,形成Bax-Bax同源二聚体,或通过在线粒体外膜打孔,或通过介导线粒体通透性转换孔(mPTP)的开放,增加线粒体膜通透性,介导了线粒体释放细胞色素C(Cyt-C),Cyt-C激活下游Caspase-9,最终由Caspase-3执行凋亡,这是细胞凋亡的经典线粒体途径[7],而Bcl-2通过与Bax形成异源二聚体则抑制细胞凋亡。Bcl-2/Bax为细胞凋亡的线粒体途径主要的调控介导者。外源性途径的凋亡信号往往经线粒体通过内源性途径不断扩大,发生细胞凋亡级联反应,诱导心功能障碍。线粒体通透性改变后,活性氧家族(ROS)不仅仅是细胞凋亡伴随过程的产物,同时也是调控细胞凋亡的重要物质,ROS可通过对Bax等促凋亡蛋白激活造成线粒体通透性转换孔(mPTP)的开放,也可直接攻击线粒体膜,通过脂质过氧化反应造成损伤,激活下游Caspase途径,导致细胞凋亡。ROS-mPTP-ROS环的形成,使细胞凋亡处于恶性循环[8]。丙二醛(MDA)与超氧化物歧化酶(SOD)则分别作为生物膜受ROS氧化攻击程度、机体清除ROS抗氧化能力的典型代表[9]。艾司洛尔是一种超短效高选择性β1受体阻滞剂,具有起效快、代谢快的特点。因为其选择性较强,越来越多的基础及临床研究证实艾司洛尔可保护脓毒症心肌细胞功能,改善脓毒症心功能障碍,其机制可能与改善高分解代谢状态、降低氧耗、调节炎症、免疫反应、改善β肾上腺素能受体敏感性、抑制细胞凋亡等方面相关[10-11]。关于其抑制心肌细胞凋亡的研究依然较少,本研究通过对脓毒症大鼠应用艾司洛尔,观察其对脓毒症心肌细胞凋亡的影响及可能的作用机制,为未来临床治疗脓毒症提供更为广阔的思路。
1 材料与方法 1.1 实验动物和分组63只清洁等级的雄性Wistar大鼠购自兰州大学医学院实验动物中心,体质量250~300 g。实验室自由进食,实验前在室温下适应性喂养1周。实验前1 d将大鼠禁食,但不禁水。根据随机数字表法将所有大鼠分为3组:假手术组(Sham组),脓毒症组(CLP组)和艾司洛尔组(ES组)(n=21)。根据时间点,每组21只大鼠3再分为6、12、24 h三个亚组,每组7只。从每个亚组中选择1只大鼠制作心肌电子显微镜标本,并在透射电子显微镜下观察心肌线粒体损伤。
1.2 主要试剂与设备分别有:TNF-α、BNP ELISA试剂盒(上海酶联生物科技有限公司);SOD、MDA检测试剂盒(南京建成生物工程研究所);兔抗鼠多克隆抗体Caspase-3、Bcl-2、Bax(Proteintech Group, Inc);兔抗鼠β-actin多克隆抗体(北京奥博森生物技术有限公司);盐酸艾司洛尔注射液10 mL:0.1 g (齐鲁制药有限公司);RIPA裂解液、PMSF、BCA蛋白浓度测定试剂盒(北京酷来搏科技有限公司);预染蛋白Marker、辣根过氧化物酶标记的山羊抗兔IgG(北京中杉金桥生物技术有限公司);PVDF膜(Millipore);超敏ECL化学发光试剂盒(新赛美生物科技有限公司);戊二醛固定液(美国Spi-Chem EM级别);磷酸氢二钠(中国国药试剂AR级别);无水乙醇(中国国药试剂AR级别);环氧丙烷(中国国药试剂AR级别);812树脂套装(美国Spi-Chem);酶标仪(Molecular Devices);微量蛋白电泳电转系统EPS300(Tanon);透射电子显微镜JEM1230(日本JEOL公司);超薄切片机Leica EM UC6(德国莱卡切片厚度: 70 nm)。
严格按照试剂说明制备实验过程所需的试剂。制备成功后,按照说明储存或者现配现用。
1.3 盲肠结扎穿孔术(cecal ligation and puncture, CLP)建立大鼠脓毒症模型实验用大鼠术前停止喂食12 h,不禁水。手术器械消毒备用,称取体质量后2.5%水合氯醛腹腔注射麻醉,麻妥,仰卧位固定四肢于手术台,腹部备皮、碘附常规消毒、铺巾,于腹正中线做一纵向切口,长约2 cm,钝性分离筋膜,逐层开腹,寻找盲肠,仔细游离盲肠及盲肠系膜血管,缝合线结扎盲肠根部中外1/3处,20 mL无菌注射器针头反复贯穿盲肠末端2次(注意避免损伤盲肠血管),轻轻挤出部分肠内容物避免损伤盲肠,并与盲肠一并还纳回腹腔,逐层关腹,消毒切口,缝合。各组大鼠术后均腹腔注射0.9%氯化钠溶液(20 mL/kg)抗休克。CLP、ES组均采用上述方法制备脓毒症模型,Sham组仅开腹后翻动盲肠,后缝合关腹[12]。
1.4 脓毒症大鼠模型评估及血流动力学监测造模完成后,观察大鼠一般情况,如逐渐出现精神、活动差、寒战、竖毛、蜷缩、眼角分泌物增多等反应提示造模成功。将CLP大鼠固定于操作台,正确连接肢体导联,启动生物机能测定生理信号采集处理系统后监测大鼠心率,会出现心率增快,当心率大于基础心率2个标准差时证明造模成功。同时术后开腹后可见肠管肿胀、发黑、出血、粘连,腹腔有血性恶臭味渗出液,也提示造模成功。
1.5 显微镜下股静脉置管及用药右侧股静脉置管术:CLP造模成功后,麻妥大鼠,固定,于右侧腹股沟区触摸股动脉搏动,确定位置后,备皮、消毒、铺巾,沿动脉走向做一长约1 cm切口,钝性分离周围肌肉、筋膜组织,充分暴露股动、静脉。于小动物手术操作显微镜下轻柔缓慢地分离股动、静脉,用静脉夹夹闭股静脉近心端,细线结扎股静脉远心端,眼科剪做一“V”形切口,导管预充肝素钠生理盐水(25 U/mL)后,于显微镜下经“V”型切口缓慢送入股静脉内,打开静脉夹,回抽注射器有回血后继续将导管向内送入一部分,置管成功后结扎固定导管,后缓慢静脉注射0.5 mL肝素钠生理盐水。切口做简单缝合,生理盐水湿润纱布覆盖手术切口。置管完成后,即Sham组及CLP组以1 mL/h速度微量泵持续泵入0.9%氯化钠溶液,持续6 h。ES组以1 mL/h速度持续泵入艾司洛尔稀释溶液[15 mg/(kg·h)],共计6 h。泵药结束后,结扎血管、拔出导管,缝合切口,于各时间点处死大鼠,留取血浆、组织标本。
1.6 标本采集与检测 1.6.1 采集标本各亚组大鼠分别于对应时间点处死,迅速剪开胸骨,钝性分离,充分暴露心脏,一次性采血针直视快速取血约4 mL,静置40 min,离心机3 000 r/min离心10 min,取上清液,标记后分装保存于-80 ℃冰箱。迅速摘取心脏,生理盐水反复冲洗,冲洗无血色后滤纸吸干水分,迅速分装保存于-80 ℃冰箱。手术剪、弯盘、2.5%戊二醛4 ℃预冷,每亚组随机抽取1只大鼠,预冷的剪刀沿左室长轴剪开心肌,迅速于冰上取一小块的心尖组织,放入盛有预冷2.5%戊二醛的弯盘中,将组织修剪为体积约为1 mm3的正方体形状,分装入盛有预冷2.5%戊二醛的冻存管中,4 ℃冰箱保存,以备透射电镜观察用[13]。
1.6.2 采用酶联免疫吸附法(ELISA)法检测TNF-α、BNP水平取出冻存血清,室温融化,严格按照检测试剂盒说明书操作:加样本及试剂、孵育、洗板、显色、终止。酶标仪于450 nm处测光密度值D(450),绘制标准曲线,根据标准曲线公式求样品实际浓度。BNP浓度用同样方法测定。
1.6.3 采用Western blot检测心肌组织中Caspase-3、Bcl-2、Bax的蛋白水平先采用BCA法检测心肌组织总蛋白含量,绘制出标准曲线,根据标准曲线计算出心肌组织蛋白含量。具体操作严格按照试剂说明书进行。在样品中加入上样缓冲液,混匀,沸水煮5 min使蛋白变性,冷却后50 μL/管-80 ℃冻存。安装好玻璃板,分别配制分离胶、浓缩胶,灌胶、加电泳液。按照每孔总蛋白50 μg上样量上样,浓缩胶80 V电压、分离胶130 V电压下分别电泳30、90 min。电泳后PVDF膜湿转法转膜,后5%脱脂奶粉封闭1 h、TBST洗涤3次,加入稀释后的一抗,4 ℃封闭过夜,过夜后TBST洗涤3次,加入辣根过氧化物酶标记的二抗,常温孵育2 h,洗涤同上。ECL发光法凝胶成像仪曝光成像显示电泳条带,计算机保存图像,ImageJ软件测定图像灰度值,目的蛋白与内参灰度值比值即为蛋白相对含量。
1.6.4 WST-1法、分光光度法分别测MDA含量、SOD活力BCA法检测心肌组织蛋白含量后严格按照试剂说明书操作,根据说明书公式分别计算MDA含量、SOD活力。
1.6.5 透射电镜观察取材后依次经过漂洗、固定、清洗、脱水、包埋、聚合、切片等过程,染色后透射电镜下观察并拍片。
1.7 统计学分析数据分析采用SPSS 22.0统计学软件,计量资料采用x±s表示,组间比较采用单因素方差分析,计算P值,检验水准α=0.05。
2 结果 2.1 血清TNF-α、BNP水平术后6、12、24 h,CLP与ES组血清TNF-ɑ水平与Sham组相比明显升高(P < 0.05);术后6、12、24 h,ES组血清TNF-ɑ水平与CLP组相比明显降低(P < 0.05)。术后6、12、24 h,CLP与ES组血清BNP水平与Sham组相比明显升高(P < 0.05),术后6、12 h,ES组血清BNP水平与CLP组相比明显降低(P < 0.05)。术后24h,ES组血清BNP水平较CLP组差异无统计学意义(P>0.05,表 1)。
| 组别 | n | TNF-α/pg·mL-1 | BNP/pg·mL-1 |
| Sham组 | 6 | ||
| 6 h | 166.44±10.05 | 103.46±21.43 | |
| 12 h | 165.19±6.87 | 101.46±14.94 | |
| 24 h | 174.85±2.46 | 104.90±20.45 | |
| CLP | 6 | ||
| 6 h | 206.78±4.62a | 133.67±25.68a | |
| 12 h | 232.42±8.03a | 176.98±32.58a | |
| 24 h | 258.55±4.72a | 199.06±22.12a | |
| ES | 6 | ||
| 6 h | 185.89±3.71ab | 98.45±12.45ab | |
| 12 h | 214.6±5.24ab | 160.83±21.19ab | |
| 24 h | 235.3±4.65ab | 198.00±21.60a | |
| a:P < 0.05, 与Sham组同时间点比较; b:P < 0.05, 与CLP组同时间点比较 | |||
2.2 心肌组织氧化应激结果
心肌SOD活力:术后6、12、24 h,CLP与ES组心肌SOD活力与Sham组相比明显降低(P < 0.05);术后6、12、24 h,ES组心肌SOD活力与CLP组相比明显升高(P < 0.05)。心肌MDA含量:术后6、12、24 h,CLP与ES组心肌MDA含量与Sham组相比明显升高(P < 0.05);术后6、12、24 h,ES组心肌MDA含量与CLP组相比明显降低(P < 0.05,表 2)。
| 组别 | n | SOD/U·mgprot-1 | MDA/nmol·mgprot-1 |
| Sham组 | 6 | ||
| 6 h | 180.12±21.00 | 0.87±0.29 | |
| 12 h | 180.92±15.12 | 0.90±0.59 | |
| 24 h | 181.49±19.66 | 0.95±0.04 | |
| CLP | 6 | ||
| 6 h | 174.88±15.32a | 0.96±0.50a | |
| 12 h | 168.11±12.59a | 1.15±0.53a | |
| 24 h | 158.12±10.19a | 1.46±0.11a | |
| ES | 6 | ||
| 6 h | 179.05±12.14ab | 0.90±0.29ab | |
| 12 h | 176.53±11.14ab | 1.06±0.37ab | |
| 24 h | 166.39±10.49ab | 1.28±0.04ab | |
| a:P < 0.05, 与Sham组同时间点比较; b:P < 0.05, 与CLP组同时间点比较 | |||
2.3 Western blot检测心肌组织凋亡相关蛋白表达水平变化
术后6、12、24 h,CLP组与ES组心肌促凋亡蛋白Caspase-3、Bax表达与Sham组相比显著增加(P < 0.05),术后6、12、24 h,ES组心肌促凋亡蛋白Caspase-3、Bax表达与CLP组相比显著减少(P < 0.05)。术后6、12、24 h,CLP组与ES组心肌抗凋亡蛋白Bcl-2表达与Sham组相比显著降低(P < 0.05),术后6、12、24 h,ES组心肌抗凋亡蛋白Bcl-2蛋白表达与CLP组相比显著增加(P < 0.05,图 1-4)。
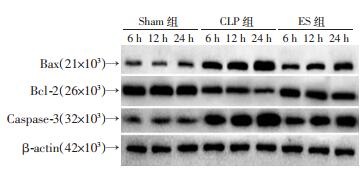
|
| 图 1 Western blot检测心肌组织中Caspase-3、Bcl-2、Bax的表达 |
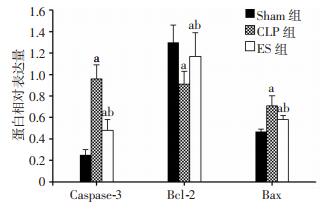
|
| a:P < 0.05, 与Sham组同时间点比较; b: P < 0.05, 与CLP组同时间点比较 图 2 6 h亚组大鼠心肌Caspase-3、Bcl-2、Bax蛋白相对表达水平 |
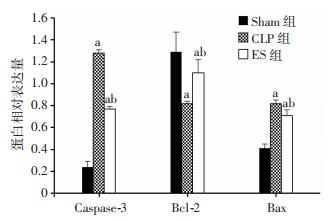
|
| a:P < 0.05,与Sham组同时间点比较;b: P < 0.05, 与CLP组同时间点比较 图 3 12 h亚组大鼠心肌Caspase-3、Bcl-2、Bax蛋白相对表达水平 |
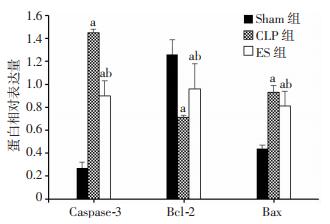
|
| a:P < 0.05,与Sham组同时间点比较;b: P < 0.05, 与CLP组同时间点比较 图 4 24 h亚组大鼠心肌Caspase-3、Bcl-2、Bax蛋白相对表达水平 |
2.4 电镜观察
Sham组各亚组肌原纤维排列紧密,缝隙小,线粒体数量丰富,脊线完好无损,没有肿胀和空泡变等损害。ES组中,6 h:肌原纤维密集,线粒体丰富,脊基本完整,无明显肿胀或破裂。12 h:肌原纤维排列松散,线粒体数量丰富,一些线粒体略有肿胀,脊显示不清,少数线粒体破裂。24 h:线粒体数量减少,肌原纤维排列疏松,部分线粒体肿胀、结构损伤,少数破裂。部分内质网囊泡化扩张。CLP组中,6 h:肌原纤维排列疏松,少数线粒体轻度肿胀,组织间隙大,内质网扩张。12 h:肌原纤维排列疏松,部分肌原纤维结构消失,线粒体数量减少,一些脊不清晰,细胞中出现较大的髓样小体,肌浆网扩张。24 h:线粒体严重肿胀、空泡化、破碎,肌浆网囊泡化扩张,细胞内形成较多嗜锇性髓样小体。依照透射电镜结果,脓毒症组大鼠心肌肌原纤维、线粒体损伤严重,且随时间点增加,损伤程度也加重,艾司洛尔组肌原纤维、线粒体损伤较脓毒症组减轻。见图 5。
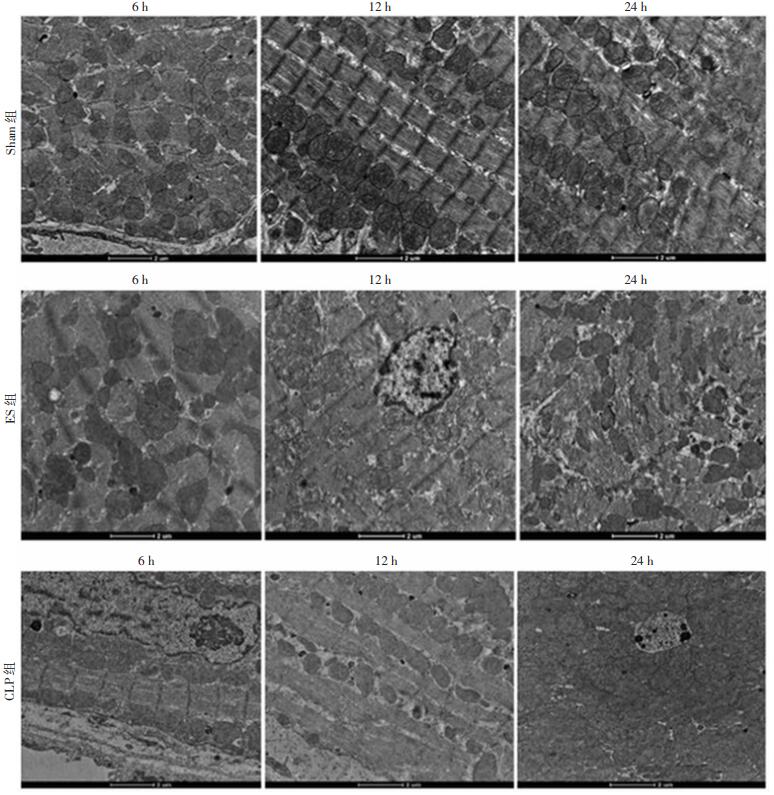
|
| 图 5 电镜观察各组大鼠心肌线粒体变化(标尺:2 μm) |
3 讨论
脓毒症的源头是感染,各种病原体的侵入导致机体全身性炎症反应综合征[14]。细菌、病毒及真菌等微生物感染人体后,大量产生的内外毒素与刺激机体产生的TNF-α、IL-6等炎症介质相互作用,诱发全身炎症反应综合征,机体出现代谢障碍、微循环损伤、免疫障碍等一系列病理生理学变化,最终诱导脓毒症性休克和或多器官功能障碍[15-16]。越来越多研究报道心肌细胞凋亡在脓毒症发病过程中可能起重要作用,细胞凋亡数量减少,心肌细胞凋亡会导致脓毒性心功能不全[17]。细胞凋亡又称细胞程序性死亡(programmed cell death,PCD),目前认为细胞凋亡信号传导通路主要包括3种:内源性途径(线粒体凋亡途径)、外源性途径(死亡受体凋亡途径)以及内质网途径。心肌细胞表面存在有TNF-R1、TNF-R2两种肿瘤坏死因子特异性受体[18],TNF-α通过与受体结合进一步发挥其诱导凋亡、抑制心肌收缩、诱导心功能障碍的作用。TNF-α抑制心肌收缩机制与心肌细凋亡密切相关,TNF-α与TNFR1受体结合,后诱导受体激活,经接头蛋白TRADD(TNF受体相关死亡结构域蛋白)发出信号,募集、激活Caspase家族中凋亡的启动分子Caspase-8,作为Caspase家族中凋亡的启动分子,procaspase-8先进行前体自我激活,再切割、活化下游效应分子Caspase-3,随后活化的Caspase-3切割底物,诱导凋亡[19]。
线粒体才是凋亡信号扩大级联反应的核心场所[20],死亡受体诱导的外源性途径凋亡信号相对较弱,往往通过线粒体参与的内源性凋亡途径的放大效应来实现。线粒体介导的内源性凋亡途径主要是由Bcl-2家族调控mPTP实现的,接收到凋亡信号后,诱导凋亡蛋白Bax由细胞质易位至线粒体外膜,通过在线粒体外膜打孔或介导mPTP的开放等一系列机制,增加线粒体膜通透性,Bcl-2家族对mPTP开放的调控机制最终使Caspase-9介导的内源性途径也通过Caspase-3,切割底物,导致细胞凋亡[6]。而抗凋亡蛋白Bcl-2则抑制mPTP的开放,Bcl-2/Bax的表达在内源性凋亡途径中起决定性作用。研究表明,脓毒症心功能障碍时Caspase-3被激活、Bax/Bcl-2比值升高、心肌细胞凋亡指数进行性增加[21]。TNF-α还可直接通过膜受体介导的信号转导途径生成神经酰胺,而神经酰胺可促进线粒体mPTP的开放,诱发凋亡。在这项研究中,我们发现CLP组大鼠的TNF-α水平升高、促凋亡蛋白Bax、Caspase-3表达增加,且随着时间的推移也在逐渐增加,抑凋亡蛋白Bcl-2表达随时间推移逐渐减少。Sham组大鼠TNF-α水平、Bax、Caspase-3等水平最低,Bcl-2表达最高。通过应用艾司洛尔后,上述因子均较脓毒症组大鼠明显下降。这表明脓毒症时心肌细胞发生了凋亡,艾司洛尔可能通过抑制凋亡诱导因子TNF-α、调节凋亡相关蛋白Bcl-2/Bax、Caspase-3的表达起到抑制心肌细胞凋亡的作用。
线粒体不仅是氧化产物产生的场所,也是氧化损伤的靶细胞器,氧化应激反应不仅是线粒体凋亡途径的重要过程,也是诱发线粒体凋亡途径的重要原因。内源性途径介导的mPTP异常开放,还会导致ROS的大量产生。研究显示[22]脓毒症早期线粒体出现氧化/亚硝化应激,大量ROS、RNS的产生与释放造成线粒体损害。大量ROS、无机磷酸盐、RNS可能导致mPTP上结构蛋白构象改变,mPTP病理性开放,线粒体通透性增加,激活线粒体下游途径,也可导致心肌细胞凋亡[23]。所以ROS的产生并非仅仅是线粒体凋亡途径的产物,同时也是介导参与、持续扩大线粒体凋亡途径的重要参与者。ROS-mPTP-ROS环的形成,使得细胞凋亡处于恶性循环过程。大量ROS的生成通过脂质过氧化反应形成脂质过氧化物,从而破坏包括线粒体膜在内的生物膜的结构与功能,MDA便是ROS氧化产物中的典型代表。抗氧化酶SOD可将O2-转化为H2O2以清除体内氧自由基,发挥其抗氧化作用[24-25]。MDA与SOD为机体氧化/抗氧化平衡能力的典型指标[26]。脓毒症时细胞氧化与抗氧化失衡,SOD的活性则明显降低,而ROS和MDA大量生成,引起细胞氧化损伤、导致凋亡发生[27]。我们比较了各组大鼠心肌氧化应激因子的水平,CLP组心肌组织SOD活力明显降低,MDA水平明显升高,且随着时间的推移逐渐上升,24 h组最高。应用艾司洛尔后大鼠心肌SOD活力增加、MDA水平降低,这表明艾司洛尔通过抑制细胞凋亡途径,不仅提高了脓毒症时心肌细胞清除ROS的能力,而且还降低了氧化产物MDA的生成。而氧化应激反应作为线粒体凋亡途径的又一重要因素,艾司洛尔也可能通过抑制氧化应激反应起到抑制心肌细胞凋亡的作用。
线粒体结构完整性的破坏是细胞凋亡与氧化应激发生的必要前提,同时也是凋亡与氧化应激主要损伤的靶细胞器。本研究线粒体透射电镜结果显示Sham组大鼠心肌线粒体结构基本正常,CLP组大鼠心肌细胞线粒体损伤严重,且随时间推移损伤逐渐加重,而应用艾司洛尔后各组线粒体的损伤均较CLP轻, 说明艾司洛尔具有保护脓毒症大鼠心肌线粒体结构的作用。
BNP目前是临床上评判心力衰竭的重要指标,在脓毒症诱导的心功能障碍中BNP经常作为心衰程度、预后的一个重要指标。正常人心房细胞会产生、分泌BNP,并存储于心肌细胞内[28]。当心功能障碍时心室容量负荷、压力负荷增加,心壁受到牵拉,左室功能障碍,心室会分泌产生BNP[29]。心肌细胞作为不可再生细胞,脓毒症时出现的心肌细胞凋亡会导致心肌收缩抑制及心功能不全,导致BNP水平的升高[30]。而线粒体作为心肌细胞的能量泵,结构破坏后的氧化磷酸化解耦联亦会导致心肌细胞能量供应不足而诱发心功能障碍。在这项研究中,我们发现脓毒症组大鼠的BNP水平最高,且随着时间的推移也在逐渐上升。而Sham组大鼠BNP水平最低。通过应用艾司洛尔后,BNP的水平较脓毒症组明显下降。但是术后ES 24 h组BNP水平较CLP组差异无统计学意义(P>0.05)。该研究为急性动物实验,只造模初期抗休克,后期未进行液体复苏,且艾司洛尔只用药6 h即停止,这可能是24 h艾司洛尔组与CLP组大鼠BNP水平无统计学差异的原因。因此在脓毒症的治疗中强调液体复苏保障血容量前提下进行选择性β受体阻滞治疗,同时脓毒症应当遵循指南进行综合治疗。
脓毒症时TNF-α为主要的细胞凋亡诱导因子,Bax/Bcl-2及Caspase-3等则是细胞凋亡过程中至关重要的凋亡相关蛋白,氧化应激反应及线粒体结构的破坏贯穿于整个细胞凋亡过程中,上述各个因子并非相互独立的,而是互为因果、相互影响、相互促进,最终诱导脓毒症心功能障碍。既往鲜有研究者针对艾司洛尔对脓毒症心肌细胞凋亡影响的研究,而本次研究多层次多角度的从氧化应激反应、细胞凋亡、线粒体结构保护及心功能改变等多个方面选取经典的指标,相互佐证、互相验证,初步探讨了艾司洛尔对脓毒症心肌细胞凋亡的抑制作用,为未来临床应用艾司洛尔提供了更广阔的思路。但本研究依然有不足的地方,目前多数文献表明无论是动物实验还是临床研究,β受体阻滞治疗究竟对心血管系统具有积极作用还是有害作用还是不明了的。在本实验中艾司洛尔用药剂量单一,干预时机及干预持续时间单一。艾司洛尔在脓毒症中的研究,应进一步对比艾司洛尔的最佳剂量、干预时机、干预持续时间,除了需要更多更深入的基础研究,同时也需要进行大规模的、多中心、随机对照临床试验,关于其在改善左室功能的同时是否会对右室产生一些有害或者有利的影响,也需我们进一步关注。
| [1] |
ZAKY A, DEEM S, BENDJELID K, et al. Characterization of cardiac dysfunction in sepsis: an ongoing challenge[J]. Shock, 2014, 41(1): 12-24. DOI:10.1097/SHK.0000000000000065 |
| [2] |
FERREIRA J A, BISSELL B D. Misdirected sympathy: the role of sympatholysis in sepsis and septic shock[J]. J Intensive Care Med, 2018, 33(2): 74-86. DOI:10.1177/0885066616689548 |
| [3] |
SANFILIPPO F, SANTONOCITO C, MORELLI A, et al. Beta-blocker use in severe sepsis and septic shock: a systematic review[J]. Curr Med Res Opin, 2015, 31(10): 1817-1825. DOI:10.1185/03007995.2015.1062357 |
| [4] |
NAGATA S, TANAKA M. Programmed cell death and the immune system[J]. Nat Rev Immunol, 2017, 17(5): 333-340. DOI:10.1038/nri.2016.153 |
| [5] |
VANDEN BERGHE T, LINKERMANN A, JOUAN-LANHOUET S, et al. Regulated necrosis: the expanding network of non-apoptotic cell death pathways[J]. Nat Rev Mol Cell Biol, 2014, 15(2): 135-147. DOI:10.1038/nrm3737 |
| [6] |
SHOSHAN-BARMATZ V, BEN-HAIL D. VDAC, a multi-functional mitochondrial protein as a pharmacological target[J]. Mitochondrion, 2012, 12(1): 24-34. DOI:10.1016/j.mito.2011.04.001 |
| [7] |
思飞, 张玲, 李盼, 马莉.脓毒症心肌细胞凋亡的线粒体机制研究进展[J].中国医药导报, 2020, 17(02): 44-47. SI F, ZHANG L, LI P, et al.Research progress on mitochondrial mechanism of septic cardiomyocytes Apoptosis[J]. Chin Med Herald, 2020, 17(02): 44-47. |
| [8] |
廖永晖, 汤雨, 千年松, 等. 氧化应激与细胞凋亡[J]. 新乡医学院学报, 2011, 28(1): 110-113. LIAO Y H, TANG Y, QIAN N S, et al. Oxidative stress and apoptosis[J]. J Xinxiang Med Coll, 2011, 28(1): 110-113. |
| [9] |
DIKALOV S I, HARRISON D G. Methods for detection of mitochondrial and cellular reactive oxygen species[J]. Antioxid Redox Signal, 2014, 20(2): 372-382. DOI:10.1089/ars.2012.4886 |
| [10] |
SUZUKI T, SUZUKI Y, OKUDA J, et al. Sepsis-induced cardiac dysfunction and β-adrenergic blockade therapy for Sepsis[J]. J Intensive Care, 2017, 5: 22. DOI:10.1186/s40560-017-0215-2 |
| [11] |
SCHMITTINGER C A, DÜNSER M W, TORGERSEN C, et al. Histologic pathologies of the myocardium in septic shock: a prospective observational study[J]. Shock, 2013, 39(4): 329-335. DOI:10.1097/SHK.0b013e318289376b |
| [12] |
GONG Y, YAN X, SUN X, et al. Oncostatin-M is a prognostic biomarker and inflammatory mediator for sepsis[J]. J Infect Dis, 2020, 13. pii: jiaa009. DOI:10.1093/infdis/jiaa009 |
| [13] |
ZHU J, KANG J, LI X, et al. Chronic intermittent hypoxia vs chronic continuous hypoxia: Effects on vascular endothelial function and myocardial contractility[J]. Clin Hemorheol Microcirc, 2019, 1. DOI:10.3233/CH-190706 |
| [14] |
PRESCOTT H C, ANGUS D C. Enhancing recovery from sepsis: A review[J]. JAMA, 2018, 319(1): 62-75. DOI:10.1001/jama.2017.17687 |
| [15] |
POSTON J T, KOYNER J L. Sepsis associated acute kidney injury[J]. BMJ, 2019, 364: k4891. DOI:10.1136/bmj.k4891 |
| [16] |
VEACH R A, LIU Y, ZIENKIEWICZ J, et al. Survival, bacterial clearance and thrombocytopenia are improved in polymicrobial Sepsis by targeting nuclear transport shuttles[J]. PLoS ONE, 2017, 12(6): e0179468. DOI:10.1371/journal.pone.0179468 |
| [17] |
BUERKE U, CARTER J M, SCHLITT A, et al. Apoptosis contributes to septic cardiomyopathy and is improved by simvastatin therapy[J]. Shock, 2008, 29(4): 497-503. DOI:10.1097/shk.0b013e318142c434 |
| [18] |
FUJITA M, IKEGAME S, HARADA E, et al. TNF receptor 1 and 2 contribute in different ways to resistance to Legionella pneumophila-induced mortality in mice[J]. Cytokine, 2008, 44(2): 298-303. DOI:10.1016/j.cyto.2008.08.015 |
| [19] |
HALESTRAP A P, RICHARDSON A P. The mitochondrial permeability transition: a current perspective on its identity and role in ischaemia/reperfusion injury[J]. J Mol Cell Cardiol, 2015, 78: 129-141. DOI:10.1016/j.yjmcc.2014.08.018 |
| [20] |
LIU L, ZHANG Z Z, XING D. Cell death via mitochondrial apoptotic pathway due to activation of Bax by lysosomal photodamage[J]. Free Radic Biol Med, 2011, 51(1): 53-68. DOI:10.1016/j.freeradbiomed.2011.03.042 |
| [21] |
CHOPRA M, SHARMA A C. Distinct cardiodynamic and molecular characteristics during early and late stages of sepsis-induced myocardial dysfunction[J]. Life Sci, 2007, 81(4): 306-316. DOI:10.1016/j.lfs.2007.05.021 |
| [22] |
GONZALEZ A S, ELGUERO M E, FINOCCHIETTO P, et al. Abnormal mitochondrial fusion-fission balance contributes to the progression of experimental Sepsis[J]. Free Radic Res, 2014, 48(7): 769-783. DOI:10.3109/10715762.2014.906592 |
| [23] |
XU Y F, MA H B, FANG Y L, et al. Cisplatin-induced necroptosis in TNFα dependent and independent pathways[J]. Cell Signal, 2017, 31: 112-123. DOI:10.1016/j.cellsig.2017.01.004 |
| [24] |
CHANG F M, FLAVAHAN S, FLAVAHAN N A. Superoxide inhibition restores endothelium-dependent dilatation in aging arteries by enhancing impaired adherens junctions[J]. Am J Physiol Heart Circ Physiol, 2018, 314(4): H805-H811. DOI:10.1152/ajpheart.00681.2017 |
| [25] |
MANSUROǧLU B, DERMAN S, YABA A, et al. Protective effect of chemically modified SOD on lipid peroxidation and antioxidant status in diabetic rats[J]. Int J Biol Macromol, 2015, 72: 79-87. DOI:10.1016/j.ijbiomac.2014.07.039 |
| [26] |
DIKALOV S I, HARRISON D G. Methods for detection of mitochondrial and cellular reactive oxygen species[J]. Antioxid Redox Signal, 2014, 20(2): 372-382. DOI:10.1089/ars.2012.4886 |
| [27] |
SHEERAN F L, PEPE S. Mitochondrial bioenergetics and dysfunction in failing heart[J]. Adv Exp Med Biol, 2017, 982: 65-80. DOI:10.1007/978-3-319-55330-6_4 |
| [28] |
YANDLE T G, RICHARDS A M. B-type Natriuretic Peptide circulating forms: Analytical and bioactivity issues[J]. Clin Chim Acta, 2015, 448: 195-205. DOI:10.1016/j.cca.2015.07.004 |
| [29] |
ZACHARIAH J P, ALIKU T, SCHEEL A, et al. Amino-terminal pro-brain natriuretic peptide in children with latent rheumatic heart disease[J]. Ann Pediatr Cardiol, 2016, 9(2): 120-125. DOI:10.4103/0974-2069.180668 |
| [30] |
PAPANIKOLAOU J, MAKRIS D, MPAKA M, et al. New insights into the mechanisms involved in B-type natriuretic peptide elevation and its prognostic value in septic patients[J]. Crit Care, 2014, 18(3): R94. DOI:10.1186/cc13864 |



