2. 518055 广东 深圳,深圳大学总医院心血管内科;
3. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院心血管内科
2. Department of Cardiology, Shenzhen University General Hospital, Shenzhen, Guangdong Province, 518055;
3. Department of Cardiology, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
左心功能不全是高血压、冠心病、心脏瓣膜病等多种心血管疾病发展的结果,通常认为主要累及心脏左心系统和体循环。然而,临床上约60%~70%左心功能不全患者会出现肺循环高压,称为左心疾病相关性肺高压(pulmonary hypertension due to left heart diseases, PH-LHD) [1-2]。心肌重构、心力衰竭和肺高压是左心疾病进展的不同阶段,通常认为有效控制左心疾病能减少肺血管重构和肺高压的发生。然而,目前临床用于左心疾病的治疗却并不能有效改善肺血管重构和肺高压的现象,提示左心疾病导致肺血管重构可能涉及新的生物学机制。骨形成蛋白(bone morphogenetic protein, BMPs)信号与心肌重构和肺动脉高压均相关,BMPs最早是作为诱导异位成骨的分泌型蛋白被发现的,后来发现其与心肌重构和肺高压两个过程均有关,其中BMP7参与了左心压力超负荷导致左心重构的过程[3],也有研究报道BMP7存在于肺动脉内皮和平滑肌细胞[4],循环BMP7能预测遗传性和特发性肺动脉高压患者病死率[5]。基于BMP7同时参与左心重构和肺动脉高压的过程,我们推测其可能与PH-LHD的形成也有关。为深入探讨左心疾病对肺血管重构的影响和机制,本研究拟通过大鼠主动脉弓缩窄(transverse aortic constriction, TAC)建立左心重构和左心功能不全模型,探讨左心压力负荷增高对肺血流动力学和肺血管重构的影响及与肺组织BMP7表达的关系。
1 材料与方法 1.1 实验材料 1.1.1 实验动物Sprague-Dawley (SD)大鼠(雄性,6周龄)16只,体质量(200±20)g,由重庆医科大学实验动物中心提供并饲喂于重庆医科大学动物实验中心IVC级动物饲养室,健康状况良好。
1.1.2 主要试剂主要包括:戊巴比妥钠粉剂(美国Sigma公司),BSA(深圳艾伟迪公司),BCA蛋白浓度测定试剂盒(23227,美国Thermo公司),BMP7抗体(ab56023,美国Abcam公司),GAPDH(10494-1-AP,美国Proteintech公司),Primescript RT reagent Kit(日本TaKaRa公司),BMP7 (上海吉凯基因化学技术有限公司)。
1.2 方法 1.2.1 TAC模型制备及分组采用6周龄SD大鼠,腹腔注射戊巴比妥(60 mg/kg)麻醉后,仰卧位将其固定于37 ℃的加热垫上。行气管插管,潮气量:4~ 6 mL/200 g;呼吸频率:70次/min;呼吸比:1 :1。在手术区域消毒备皮,从左胸部剪开皮肤,钝性分离胸大肌和胸小肌,暴露出肋骨。在近左胸骨旁第2~3肋间无菌操作下剪开约1.0 cm水平切口,钝性分离血管,筋膜拨开胸腺,暴露主动脉弓。用特殊制备的弯镊在右无名和左颈总动脉之间挑起主动脉弓穿一2-0丝线后,在主动脉弓旁边放置去掉针尖的弯曲的16G针头(直径1.6 mm),结扎主动脉弓后迅速取出针头,将胸腺放回胸腔。结扎确认无出血后逐层关胸,缝合皮肤。继续通气10 min左右,待大鼠恢复自主呼吸后,拔出气管插管,放回动物房饲养。假手术组手术过程与手术组相同,但不结扎主动脉弓。大鼠分成两组:手术组(TAC组),假手术组(Sham组),每组8只。实验动物操作均获重庆医科大学伦理委员会批准。
1.2.2 超声心动图检测主动脉弓缩窄9周后,各组大鼠行超声心动图检测。采用加拿大VisualSonics公司的VeVo2100型高分辨小动物超声仪,由陆军军医大学第二附属医院超声科具有小动物超声操作经验的实验技师实施检测。将各组检测大鼠用2%戊巴比妥腹腔注射麻醉后,四肢固定于泡沫板上,仔细脱去大鼠胸前毛发,充分暴露胸骨和左胸廓位置,然后行M型超声心动图检测肺动脉直径(pulmonary artery diameter,PAD)、舒张期室间隔厚度(diastole interventricular septum thickness,IVST;d)、收缩期室间隔厚度(systole interventricular septum thickness,IVST;s)、左室舒张末期内径(diastole left ventricular internal diameter,LVID;d)、左室收缩末期内径(systole left ventricular internal diameter,LVID;s)、左室舒张后壁厚度(diastole left ventricular posterior wall,LVPW;d)、左室收缩后壁厚度(systole left ventricular posterior wall,LVPW;s)、左室射血分数(left ventricular ejection fraction,LVEF)、左室短轴缩短率(left ventricular fractional shortening,LVFS)、左室心肌质量(LV Mass)、左室舒张容积(left ventricular end diastolic volume,LVEDV)。
1.2.3 血流动力学参数测定 1.2.3.1 心率和血压检测主动脉弓缩窄9周后,使用大鼠尾部测量仪,通过检测大鼠根部的血流、血压、红外和脉搏等各种参数,准确测量大鼠心率和血压。
1.2.3.2 血流动力学检测主动脉弓缩窄9周后,对各组大鼠行血流动力学检测。大鼠采用2%戊巴比妥腹腔注射麻醉后, 仰卧于操作台上,固定四肢,消毒后纵向切开颈部皮肤2 cm,钝性分离皮下筋膜。暴露大鼠右颈外静脉,结扎远端,于近端作一斜切口,用充盈肝素的导管于结扎点近心侧,顺血管走向插入1 mL注射器针头,沿针头切口插入右心导管并顺势拔出针头,将测压管与血压换能器连接(与心脏位置同高)。将血压换能器与三通管连接好,并确认连接牢靠,然后打开三通管的阀门,依据计算机屏幕显示的图像和波幅的变化,区别导管尖端所处的位置,经右颈外静脉、右锁骨下静脉、上腔静脉到达右心房、右心室。进入右心室后逆时针缓慢旋转导管,使导管进入肺动脉主干。1 mg/mL肝素钠生理盐水冲管后,压力调零,出现稳定典型压力曲线波时,分别记录右心室收缩压(right ventricular systolic pressure,RVSP)、肺动脉收缩压(pulmonary arterial systolic pressure, PASP)及平均肺动脉压(mean pulmonary arterial pressure,mPAP),每次间隔2~3 min,记录波形,取5个连续波形测平均值。
1.2.4 组织病理学检测血流动力学检测结束后,立即开胸,暴露出胸腔,迅速、准确地取出心肺组织。将取下的组织放入有PBS缓冲液的玻璃器皿中,分离心肺组织,将心脏里残留的血液通过轻轻挤压的方式排出,再将心肺组织经多次PBS冲洗干净后,仔细剪除心脏残余的主动脉弓和心包膜等组织,用眼科剪顺着房室沟剪下两心房,紧靠室间隔右下侧剪下右心室游离壁,剩下的为左心室和室间隔。将心肺组织浸泡于4%多聚甲醛中,固定24 h,用于病理组织学检测。
1.2.5 RT-qPCR检测血流动力学检测结束后,立即开胸,迅速准确取出肺组织,提取肺门周围肺组织进行RT-qPCR检测。将提取的肺组织放入预冷瓷研钵中碾磨至粉碎状,然后于EP管溶于适量的TRIzol试剂中,待核酸与蛋白分离后加入适量氯仿,混匀静置后在4 ℃、1 000×g离心10 min,吸取上层水相于新的EP管中,再加入与水相等体积的异丙醇,混匀静置,待RNA充分沉淀后4 ℃、1 000×g离心10 min;弃上清,加入适量75%乙醇,4 ℃、7 500×g离心5 min;弃上清,乙醇挥发后得到干燥的RNA沉淀。提取到总RNA后用Primescript RT reagent Kit进行cDNA逆转录,然后进行RT-qPCR,BMP7正义链为5′-CGCC-CATGTTCATGTTGGAC-3′,反义链为5′-TCGATGGTGGTATC-GAGGGT-3′,实时荧光定量PCR仪进行扩增并测量荧光信号:Stage 1(预变性)-Reps:1 95 ℃ 30 s;Stage 2(PCR反应)-Reps:40, 60 ℃ 30 s,最后用2-ΔΔCt方法评估mRNA的表达变化。
1.2.6 Western blot检测血流动力学检测结束后,立即开胸,迅速准确取出肺组织,提取肺门周围肺组织进行目的蛋白检测:取适量组织加RIPA裂解液,冰上操作,裂解30 min,12 000 r/min 4 ℃离心10 min,取上清备用。BCA蛋白浓度测定试剂盒测定总蛋白。调节蛋白浓度和上样体积,100 ℃水浴变性5 min,冷却后上样。200 mA电转2 h,再用5%脱脂牛奶的TBST封闭2 h。用5%BSA的TBST稀释一抗BMP7(1 :1 000),4 ℃孵育过夜。用5%脱脂牛奶的TBST稀释二抗(1 :10 000),室温2 h。最后配置显色液,采用凝胶成像仪进行观察并成像。
1.3 统计学分析采用SPSS 19.0统计软件,符合正态分布的计量资料采用x±s表示,两组间比较采用配对t检验。P < 0.05为差异具有统计学意义。
2 结果 2.1 一般情况主动脉弓缩窄9周后,TAC组与Sham组相比,体质量和心率差异均无统计学意义[(394±16)vs (429±13)g;(384±3) vs (377±9)次/min];TAC组血压显著高于Sham组[(201.00±19.35) vs (144.00±6.30) mmHg,P < 0.01],血压增加与主动脉弓缩窄后左心压力负荷增加有关。
2.2 两组大鼠术后9周左心重构和左心功能的变化与Sham组相比,TAC组左室后壁增厚,肺动脉直径增加(P < 0.05),舒张期室间隔厚度增加(P < 0.05),左室射血分数下降(P < 0.01),左室舒张容积增加(P < 0.01),左室心肌质量增加(P < 0.01, 表 1,图 1)。
| 组别 | PAD/mm | IVS/d·mm-1 | IVS/s·mm-1 | LVID/d·mm-1 | LVID/s·mm-1 | LVPW/d·mm-1 | LVPW/s·mm-1 | LVEDV/μL | LVEF(%) | LVFS(%) | LV Mass/mg |
| Sham组 | 3.14±0.86 | 2.41±0.96 | 4.06±0.18 | 6.22±0.61 | 2.85±0.53 | 2.11±0.27 | 3.07±0.62 | 199.30±45.96 | 84.31±3.07 | 63.25±3.15 | 849.36±73.19 |
| TAC组 | 3.76±0.10a | 2.86±0.34 | 4.43±0.29 | 6.47±0.88 | 3.56±0.62a | 2.64±0.30a | 3.71±0.54a | 278.57±43.09b | 67.09±2.61b | 42.67±4.48b | 1224.96±166.02b |
| a: P < 0.05,b: P < 0.01, 与Sham组比较 | |||||||||||
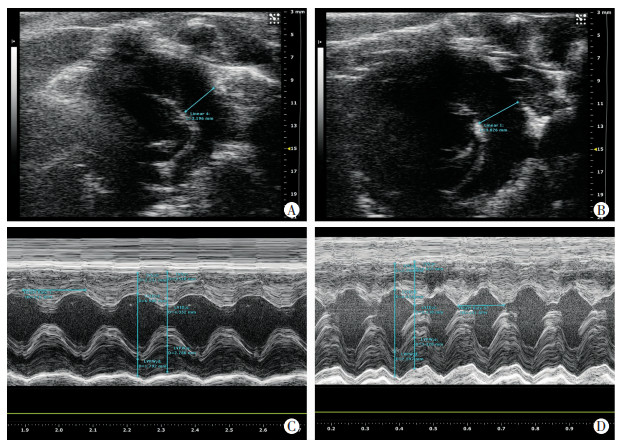
|
| A:假手术组肺动脉直径;B:TAC组肺动脉直径与假手术组相比,TAC组肺动脉直径增加;C:假手术组左室后壁厚度;D:TAC组左室后壁厚度与假手术组相比,TAC组左室后壁增厚 图 1 超声心动图检测主动脉弓缩窄9周后大鼠左心结构和功能变化 |
2.3 两组大鼠术后9周肺血流动力学和右心功能的变化
与Sham组相比,TAC组肺动脉压和右心室收缩压显著升高(P < 0.01,图 2)。
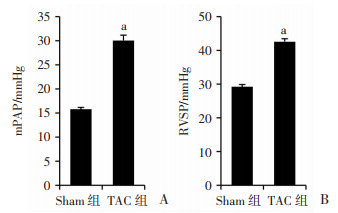
|
| A:肺动脉压;B:右心室收缩压 a:P < 0.01,与Sham组比较 图 2 主动脉弓缩窄9周后大鼠血流动力学变化 |
2.4 左心压力超负荷对大鼠左心和肺血管重构的影响
主动脉弓缩窄9周后,左室心肌HE染色结果显示:与Sham组相比,TAC组左室心肌细胞横截面积显著增大(P < 0.01);Masson染色结果显示:与Sham组相比,TAC组左室心肌纤维化程度显著增加(P < 0.01),提示左室心肌发生了重构。同时分析肺血管的病理变化,发现TAC组肺小动脉中层厚度与Sham组相比显著增厚,肺小动脉中层增厚程度(肺小动脉管壁厚度与血管直径比值)显著增加(P < 0.01,图 3、4)。
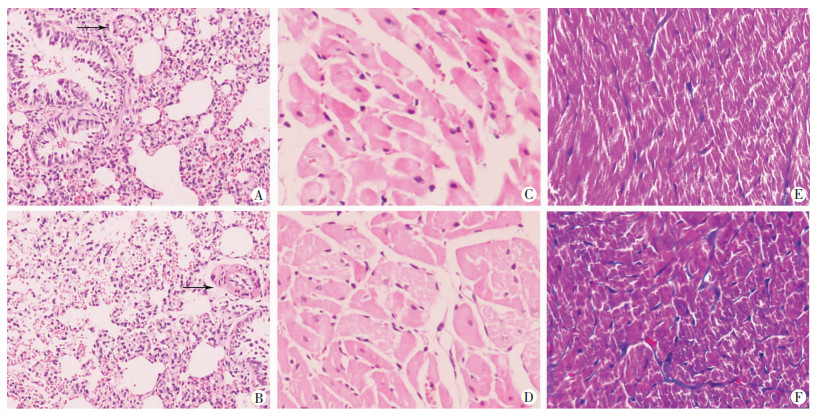
|
| A、B:分别为Sham组、TAC组肺组织HE染色(×100)箭头示肺小动脉;C、D:分别为Sham组、TAC组左心室心肌HE染色(横切,×200);E、F:分别为Sham组、TAC组左心室心肌Masson染色(×200) 图 3 主动脉弓缩窄9周后大鼠肺和左心室病理学观察 |
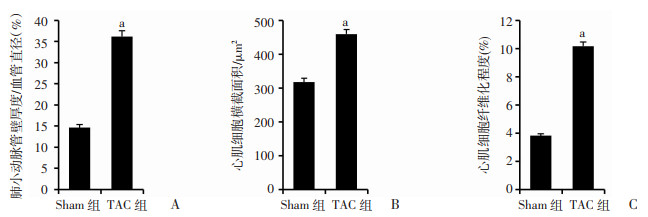
|
| A:肺小动脉中层增厚百分比;B:左心室心肌细胞横截面积;C:左心室心肌纤维化百分比 a: P < 0.01, 与Sham组比较 图 4 主动脉弓缩窄9周后大鼠肺和左心室病理学检测结果 |
2.5 两组大鼠术后9周肺组织中BMP7的表达
主动脉弓缩窄9周后,采用Western blot、RT-qPCR检测两组大鼠肺组织BMP7 mRNA和蛋白表达,结果显示:与Sham组相比,TAC组BMP7 mRNA表达和蛋白表达均降低(P < 0.05,图 5)。
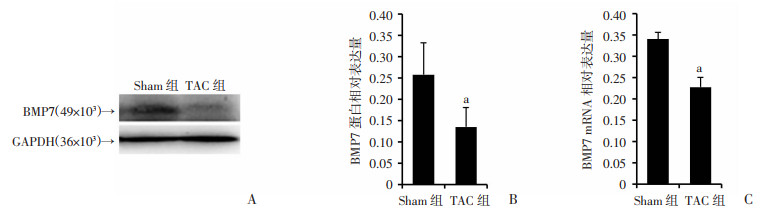
|
| A:Western blot检测BMP7蛋白表达;B:BMP7蛋白相对表达量;C:BMP7 mRNA相对表达量 a: P < 0.05,与Sham组比较 图 5 主动脉弓缩窄9周后大鼠肺组织中BMP7的表达 |
3 讨论
以高血压、冠心病和心脏瓣膜病等疾病为代表的心脏左心系统疾病是目前心血管疾病谱中的主流疾病,发病率高、危害大。通常认为左心疾病主要引起体循环异常和左心重构,近年发现其对肺循环的影响也不容忽视。本研究通过缩窄大鼠主动脉弓复制左心重构和左心功能不全模型,发现左心压力负荷增高引起左心重构和左心功能下降的同时,就会引起肺血管重构和肺循环压力升高,可能与BMP7表达减少有关。
既往认为肺高压是慢性左心功能不全发展的终末阶段,近年发现PH-LHD真实发病率高,发病也并非在左心疾病终末阶段,是临床上最常见的肺高压类型。关于PH-LHD患病率的报道差异较大,与引起左心疾病的病因、研究人群、用于诊断肺高压的方法等因素均相关。据统计,约60%的慢性心衰患者和30%~80%心脏瓣膜病患者往往并发PH[6]。LAM等[7]用心脏多普勒超声的方法,对224名射血分数正常的心衰(HFpEF)患者进行了为期3年的随访,发现这组患者中有83%合并PH。SHAH等[8]于2014年开展的TOPCAT试验是一项评估螺内酯对HFpEF临床效果的随机双盲临床研究,共纳入6个国家233个中心的3 445例患者,超声检查发现其中935例(36%)有PH证据。LEUNG等[9]对入选的455例HFpEF患者进行RHC检查,发现52.5%合并PH。这些研究提示肺高压并不是少见情况,而是左心疾病患者的常见并发症,其在左心疾病基础上发生、发展过程隐匿。由于其症状如呼吸困难、疲乏、气短等表现并不特异,容易与左心疾病的症状混淆,仅凭临床表现难于在左心疾病基础上早期发现。同时,由于肺高压是一个血流动力学概念,右心导管是诊断肺高压的金标准。然而,由于右心导管为有创性检测,目前也不是左心疾病患者的常规临床检查,因此,长期以来临床上PH-LHD的早期识别和治疗均未被重视。
在本研究中,我们通过主动脉弓缩窄引起左心压力负荷增高,发现与Sham组相比,术后9周时TAC组大鼠左室后壁显著增厚、左室舒张容积增大、射血分数降低,病理学观察结果显示:TAC组大鼠左室心肌肥大,纤维化程度显著增高,提示出现了左室心肌重构和心功能降低,说明左心重构和左心功能不全模型构建成功。同时,与Sham组相比,术后9周时TAC组即出现了肺动脉管径增大、肺小动脉管壁显著增厚,甚至出现肺小动脉管腔闭塞,血流动力学检测结果显示mPAP明显增高,提示出现了肺血管重构和肺动脉高压。关于PH-LHD的发生,通常认为血流动力学异常是左心疾病导致PH-LHD的重要初始和直接因素,心脏左心疾病常可引起左室和左房负荷增高,增高的左心负荷逆向传递使肺静脉压升高,肺血管内压力持续升高会引起肺小动脉收缩及肺血管重构[2]。然而,临床上能有效改善体循环高压和心衰的肾素-血管紧张素系统抑制剂和β受体阻滞剂,却不能有效改善肺血流动力学。提示左心疾病导致肺血管重构的机制除血流动力学因素外还有其他机制参与。
BMPs属TGF-β超家族成员之一,目前已发现并鉴定的BMPs有20余种,其生理作用广泛,不仅与成骨相关,与心肌重构和肺血管重构均有关的现象引起了关注。其中在心肌发育和心肌重构中发挥作用的主要有BMP2、BMP4、BMP7和BMP10,分别参与心肌收缩性和心肌肥大等过程的调节[10-12]。MERINO等[3]发现主动脉弓缩窄后,引起左心压力超负荷的同时,左室心肌BMP7表达减少、BMP7/TGF-β比例失衡,而给予rBMP-7能减轻左室重构,改善左室功能。然而,也有研究报道BMP7可能参与了遗传性和特发性肺动脉高压的进展过程,LIU等[5]观察了43例遗传性肺动脉高压和113例特发性肺动脉高压患者,发现外周血BMP7水平明显高于对照组,且BMP7水平增高与遗传性和特发性肺动脉高压患者病死率增加相关。然而,BMP7是否参与了左心疾病导致肺血管重构的过程目前尚不清楚。本研究中,我们发现主动脉弓缩窄9周后,TAC组肺组织BMP7蛋白和mRNA表达均减少,提示独立于血流动力学因素外,心脏和左心系统对肺的调节可能参与了PH-LHD肺血管重构的过程。然而,关于BMP7的作用尚存在争议。LONG等[13]发现其可能通过BMPR-Ⅱ抑制肺动脉内皮凋亡发挥保护作用,有学者提出BMP7可能是一个内源性保护因子;但也有研究发现BMP7增高可能促进肺动脉平滑肌增殖,血浆BMP7水平增高与肺动脉高压的病死率增高相关[5]。关于BMP7作用的争议,有研究者认为可能与BMP7本身是致病因素有关,也有人认为BMP7本身是保护性因子,可能与疾病状态下BMP7增高的水平不足以拮抗致病因素的作用有关。
本研究也存在一定局限性,我们仅观察了左心重构和左心功能不全时局部肺组织BMP7蛋白和mRNA表达的变化,关于肺组织中BMP7的定位表达及其在肺血管重构发展中的作用机制尚需进一步研究。然而,本研究结果初步提示:除体循环对肺循环血流动力学的直接影响外,心脏和左心系统对肺的器官间调节可能也参与了左心疾病相关肺高压的形成。关于BMP7在器官间联系和调节中的作用及其是否能成为PH-LHD预测和治疗新靶点,有待进一步研究探明。
| [1] |
WEITSMAN T, WEISZ G, FARKASH R, et al. Pulmonary hypertension with left heart disease: prevalence, temporal shifts in etiologies and outcome[J]. Am J Med, 2017, 130(11): 1272-1279. DOI:10.1016/j.amjmed.2017.05.003 |
| [2] |
FAYYAZ A U, EDWARDS W D, MALESZEWSKI J J, et al. Global pulmonary vascular remodeling in pulmonary hypertension associated with heart failure and preserved or reduced ejection fraction[J]. Circulation, 2018, 137(17): 1796-1810. DOI:10.1161/circulationaha.117.031608 |
| [3] |
MERINO D, VILLAR A V, GARCÍA R, et al. BMP-7 attenuates left ventricular remodelling under pressure overload and facilitates reverse remodelling and functional recovery[J]. Cardiovasc Res, 2016, 110(3): 331-345. DOI:10.1093/cvr/cvw076 |
| [4] |
DIN S, SARATHCHANDRA P, YACOUB M H, et al. Interaction between bone morphogenetic proteins and endothelin-1 in human pulmonary artery smooth muscle[J]. Vascul Pharmacol, 2009, 51(5/6): 344-349. DOI:10.1016/j.vph.2009.09.001 |
| [5] |
LIU D, WU B X, SUN N, et al. Elevated levels of circulating bone morphogenetic protein 7 predict mortality in pulmonary arterial hypertension[J]. Chest, 2016, 150(2): 367-373. DOI:10.1016/j.chest.2016.03.007 |
| [6] |
ROSENKRANZ S, GIBBS J S R, WACHTER R, et al. Left ventricular heart failure and pulmonary hypertension[J]. Eur Heart J, 2016, 37(12): 942-954. DOI:10.1093/eurheartj/ehv512 |
| [7] |
LAM C S, ROGER V L, RODEHEFFER R J, et al. Pulmonary hypertension in heart failure with preserved ejection fraction: a community-based study[J]. J Am Coll Cardiol, 2009, 53(13): 1119-1126. DOI:10.1016/j.jacc.2008.11.051 |
| [8] |
SHAH A M, CLAGGETT B, SWEITZER N K, et al. Cardiac structure and function and prognosis in heart failure with preserved ejection fraction: findings from the echocardiographic study of the Treatment of Preserved Cardiac Function Heart Failure with an Aldosterone Antagonist (TOPCAT) Trial[J]. Circ Heart Fail, 2014, 7(5): 740-751. DOI:10.1161/CIRCHEARTFAILURE.114.001583 |
| [9] |
LEUNG C C, MOONDRA V, CATHERWOOD E, et al. Prevalence and risk factors of pulmonary hypertension in patients with elevated pulmonary venous pressure and preserved ejection fraction[J]. Am J Cardiol, 2010, 106(2): 284-286. DOI:10.1016/j.amjcard.2010.02.039 |
| [10] |
WANG Y X, QIAN L X, LIU D, et al. Bone morphogenetic protein-2 acts upstream of myocyte-specific enhancer factor 2a to control embryonic cardiac contractility[J]. Cardiovasc Res, 2007, 74(2): 290-303. |
| [11] |
SUN B, HUO R, SHENG Y, et al. Bone morphogenetic protein-4 mediates cardiac hypertrophy, apoptosis, and fibrosis in experimentally pathological cardiac hypertrophy[J]. Hypertension, 2013, 61(2): 352-360. DOI:10.1161/HYPERTENSIONAHA.111.00562 |
| [12] |
SUN L J, YU J, QI S, et al. Bone morphogenetic protein-10 induces cardiomyocyte proliferation and improves cardiac function after myocardial infarction[J]. J Cell Biochem, 2014, 115(11): 1868-1876. DOI:10.1002/jcb.24856 |
| [13] |
LONG L, ORMISTON M L, YANG X, et al. Selective enhancement of endothelial BMPR-Ⅱ with BMP9 reverses pulmonary arterial hypertension[J]. Nat Med, 2015, 21(7): 777-785. DOI:10.1038/nm.3877 |



