2. 650224 昆明,云南省昆明云桥医院急诊医学科
2. Department of Emergency, Yunqiao Hospital, Kunming, Yunnan Province, 650224, China
在全球范围内,肺癌因其高发病率和病死率成为威胁人类生命健康的恶性肿瘤之一。近年来,肺癌在临床防治和发病机理研究方面均取得了长足进展,但遗憾的是因肺癌早期转移造成肺癌患者预后不良的状况依然是肺癌防治中的难点之一[1],常造成临床治疗困难且社会经济负担严重。因此,深入研究和探索肺癌转移的分子机制,对肺癌治疗过程中新的治疗靶点的确定及有效诊治肺癌、改善肺癌患者临床预后具有重要意义。
作为甲基胞嘧啶双加氧酶家族(ten-eleven translocation family)重要的成员之一,TET1能够产生催化氧化作用并具备改写表观基因组的功能,可通过催化5-甲基胞嘧啶转化为5-羟甲基胞嘧啶进而调控脱氧核糖核酸甲基化的平衡进程[2-3]。研究表明TET1基因还广泛参与了包括生长发育、干细胞功能等多种生物学进程[4-5]。近年研究发现包括肺癌在内的许多肿瘤的发生、发展过程与TET1表达水平变化关系密切[6-7],提示该基因可能在肺癌发生、发展过程中发挥重要作用。因此,本研究采用多种生物学技术和实验方法观测该基因在肺癌细胞中表达水平及对肺癌细胞迁移和侵袭能力的影响,并初步探讨其调控的主要信号通路,为深入研究TET1基因与肺癌发生、发展的关系提供实验室数据和资料。
1 材料与方法 1.1 材料 1.1.1 主要试剂DMEM及RPMI 1640完全培养基购自美国HyClone公司,胎牛血清购自美国Gibco公司,Opti-MEM培养基购自美国Gibco公司。ViaFectTM Transfection Reagent、GoScriptTM逆转录试剂盒、2×GoTaq® qPCR GreenMaster Mix购自美国Promega公司。BCA蛋白浓度测定试剂盒、RIPA蛋白裂解液、SDS-PAGE配胶试剂盒购自中国上海碧云天公司。鼠来源TET1抗体、β-catenin抗体、MMP7抗体购自美国Santa Cruz公司,鼠来源β-actin抗体购自中国上海碧云天公司。
1.1.2 细胞株人正常支气管上皮细胞株(human bronchial epithelial,HBE)及肺癌细胞株H460、H358、95D、LTEP-a-2均购自于中国科学院上海细胞库。使用DMEM培养基(含10%胎牛血清)培养HBE细胞,使用RPMI 1640培养基(含10%胎牛血清)培养肺癌细胞株细胞(培养条件:温度37℃、湿度70%~80%、95%空气、5%CO2),细胞达80%~90%时进行传代培养并冻存(每个冻存管细胞数目大于1×106个细胞)。
1.2 实验方法 1.2.1 总RNA提取细胞生长达到提取要求(80%~90%),去培养基后磷酸盐缓冲液冲洗1次,加入总RNA提取试剂(TRIzol 1 mL)吹打细胞至细胞脱落,移液器将溶液转移至离心管,加入氯仿后静置离心,取上层水相置入离心管,加入等体积异丙醇混匀,静置再次离心后去上清加75%乙醇清洗晾干,加入焦碳酸二乙酯水溶解沉淀RNA,测定浓度后于低温(-80 ℃)保存。
1.2.2 反转录和实时荧光定量PCR(quantitative real-time PCR,RT-qPCR)使用GoScriptTM逆转录试剂盒,按照试剂盒说明书上的方法步骤进行逆转录合成cDNA;然后使用2×GoTaq® qPCR GreenMaster Mix进行RT-qPCR试验,引物序列见表 1。反应条件如下:①1个循环,预变性:95 ℃,40 s;②共45个循环,变性:95 ℃,40 s;退火:60 ℃,40 s;延伸:72 ℃,50 s;③72 ℃,5 min。以β-actin为内参,采用相对定量2-ΔΔCt法对数据进行分析。
| 基因 | 引物序列(5′- 3′) | 产物长度/bp |
| TET1 | 正向:CCTTTGGGAACCGACTCCTC | 230 |
| 反向:CACAAGGTTTTGGTCGCTGG | ||
| CTNNB1 | 正向:GCGCCATTTTAAGCCTCTCG | 183 |
| 反向:AAATACCCTCAGGGGAACAGG | ||
| MMP7 | 正向:CATGATTGGCTTTGCGCGAG | 150 |
| 反向:AGACTGCTACCATCCGTCCA | ||
| β-actin | 正向:CATGTACGTTGCTATCCAGGC | 250 |
| 反向:CTCCTTAATGTCACGCACGAT |
1.2.3 蛋白质印迹法(Western blot)
取适量细胞加入RIPA蛋白裂解液进行裂解,低温离心后提取细胞蛋白。按照BCA蛋白浓度测定试剂盒说明书步骤测定蛋白浓度。配制SDS-PAGE凝胶后取样本(每个样本80 μg)进行电泳,转移至PVDF膜封闭,分别加入鼠来源TET1抗体(1:1 000)、鼠来源β-catenin抗体(1:1 000)、鼠来源MMP7抗体(1:1 000)、鼠来源β-actin抗体(1:1 000)后4 ℃低温孵育过夜,TBST缓冲液冲洗3次后室温孵育二抗,最后曝光显影分析。
1.2.4 细胞转染采用带有绿色荧光蛋白标记的重组质粒构建TET1过表达和TET1敲低表达载体。接种适量细胞,待细胞生长达到70%~80%时,配制转染体系进行细胞转染:ViaFectTM Transfection Reagent、质粒和Opti-MEM按3 μL:1 μg:100 μL的比例混合,室温孵育20 min后加入培养皿中,充分混匀并将细胞放至5%CO2,37 ℃恒温培养箱中培养。转染后48 h采用抗性标记G418筛选10~14 d,挑选阳性克隆扩大培养,采用荧光显微镜观察细胞内绿色荧光蛋白报告基因表达情况,提取细胞RNA和蛋白采取RT-PCR和Western blot检测TET1表达,证明基因在细胞中的稳定表达。TET1敲低表达质粒的转染使用TET1过表达稳定转染细胞进行。
1.2.5 划痕愈合实验使用6孔板接种适量细胞待细胞贴壁,使用TET1差异表达质粒进行细胞转染,24 h后去掉培养基用牙签在孔内均匀的划痕,加入无血清培养基进行培养并于划痕后0、24、48 h时在同一位置观察拍照,分析细胞迁移距离。
1.2.6 Transwell实验TET1差异表达质粒进行细胞转染24 h后,胰酶消化、离心并重悬细胞。基质胶和无血清培养基按1:8混匀,均匀加入Transwell细胞小室中,细胞小室于37℃恒温培养箱中放置1 h,使基质胶充分凝固。加基质胶Transwell小室接种细胞(3×104/孔)检测细胞的侵袭能力;无基质胶Transwell小室接种细胞用于检测细胞迁移能力;24 h后取出细胞小室,多聚甲醛固定1 h后用结晶紫染色20 min,随机选取5处视野用显微镜拍照、计数。
1.3 统计学分析采用SPSS 19.0统计软件进行分析,计量资料以x±s表示,组间比较应用Student’s t检验(正态分布)或Mann-Whitney U检验(非正态分布)。检验水准α=0.05。
2 结果 2.1 人肺癌细胞及正常支气管上皮细胞中TET1基因表达水平通过RT-qPCR检测HBE细胞和LTEP-a-2、H460、H358、95D等4株肺癌细胞中TET1基因的mRNA表达水平。结果发现,与正常支气管上皮细胞HBE比较,各肺癌细胞中TET1基因的mRNA表达水平均表现出不同程度下降,其中LTEP-a-2细胞中TET1基因表达水平下降最明显(P < 0.01,图 1)。
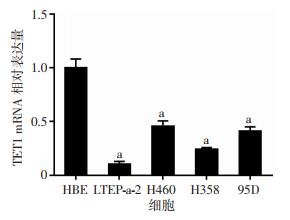
|
| a: P < 0.01,与HBE细胞比较 图 1 TET1基因在正常支气管上皮细胞株及肺癌细胞株中的表达水平 |
2.2 TET1表达水平对肺癌细胞迁移和侵袭能力的影响
为探究TET1基因对肺癌细胞迁移和侵袭能力的影响,构建了TET1基因过表达载体,并选择TET1表达下降最明显的LTEP-a-2细胞进行功能检测。划痕愈合实验结果显示,过表达TET1的LTEP-a-2细胞迁移距离较对照组细胞明显降低(P < 0.01,图 2A)。Transwell实验结果显示,在未加基质胶和加基质胶的小室中,过表达TET1后穿过细胞小室膜的LTEP-a-2细胞数量较对照组均明显减少(P < 0.01,图 2B)。提示TET1过表达能明显抑制肺癌细胞的迁移和侵袭。
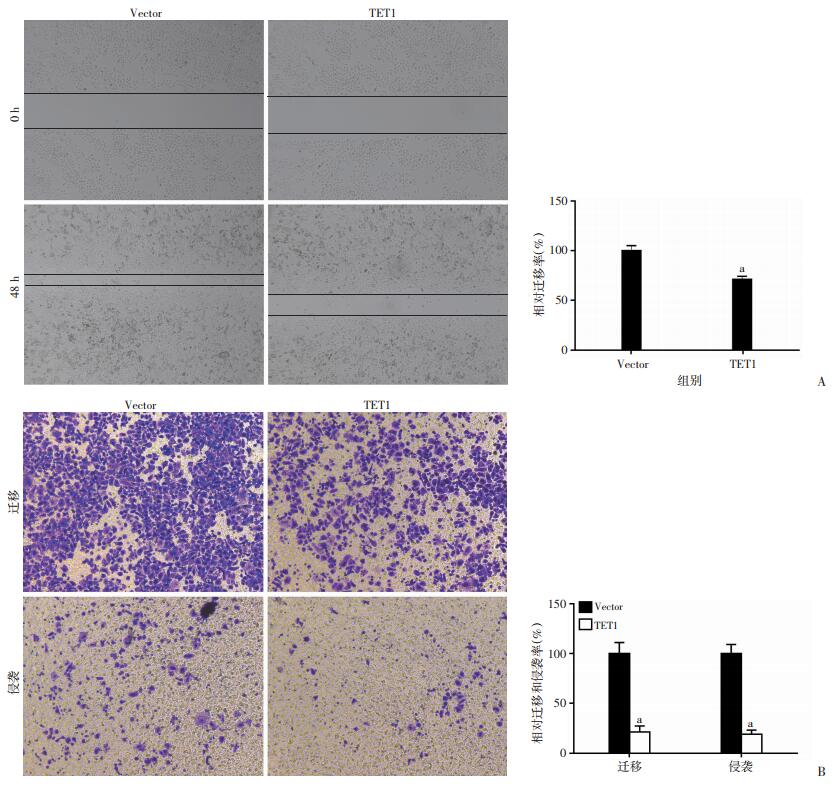
|
|
a: P < 0.01, 与Vector对照组比较 A:划痕愈合实验(×100, 左)及定量分析(右); B:Transwell实验(结晶紫×200, 左)及定量分析(右) 图 2 过表达TET1对肺癌细胞迁移及侵袭能力的影响 |
选取TET1过表达稳转的LTEP-a-2细胞构建TET1敲低表达细胞模型,通过划痕愈合实验和Transwell实验验证TET1对肺癌细胞迁移和侵袭的影响。实验结果显示LTEP-a-2稳转细胞的迁移距离在敲低表达TET1后显著大于对照组细胞的迁移距离(P < 0.01,图 3A)。同时敲低表达TET1后,穿过细胞小室膜的LTEP-a-2稳转细胞的数量较对照组穿过小室膜的细胞数量均明显增多(P < 0.01,图 3B)。提示敲低TET1基因的表达可显著促进肺癌细胞的迁移和侵袭能力。进一步证实TET1基因具有抑制肺癌细胞迁移和侵袭的功能。
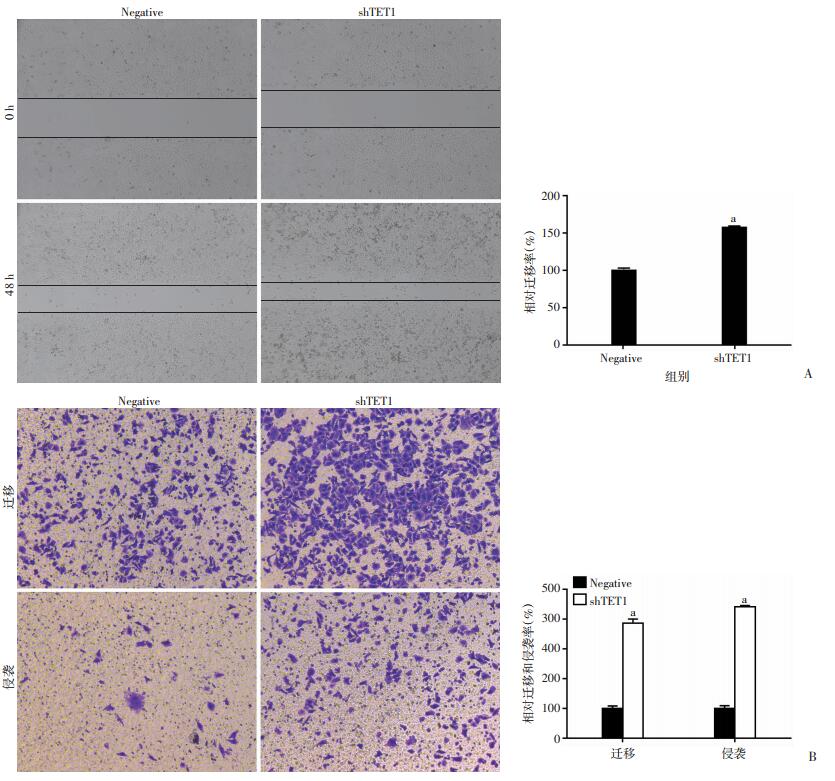
|
|
a: P < 0.01,与Negative对照组比较 A:划痕愈合实验(×100,左)及定量分析(右);B:Transwell实验(结晶紫×200,左)及定量分析(右) 图 3 敲低TET1表达对肺癌细胞迁移及侵袭能力的影响 |
2.3 TET1基因下游分子β-catenin(CTNNB1)和MMP7的表达
采用RT-qPCR和Western blot检测TET1下游分子β-catenin(CTNNB1)和MMP7的表达。结果显示,过表达TET1后基因CTNNB1和MMP7的mRNA水平和蛋白水平均显著下调(P < 0.01,图 4A、C);敲低TET1表达后,基因CTNNB1和MMP7的mRNA水平和蛋白水平均显著上调(P < 0.01,图 4B、C)。提示TET1基因可能通过调控Wnt/β-catenin信号通路抑制肺癌细胞的迁移和侵袭。
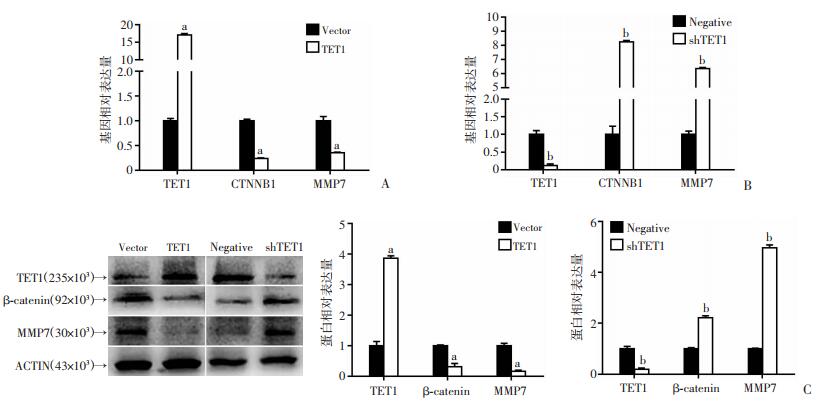
|
|
a: P < 0.01,与Vector对照组比较;b: P < 0.01,与Negative对照组比较 A:RT-qPCR检测过表达TET1对下游基因CTNNB1及MMP7 mRNA表达的影响;B:RT-qPCR检测干扰TET1对下游基因CTNNB1及MMP7 mRNA表达的影响;C:Western blot检测过表达及干扰TET1基因后下游基因CTNNB1及MMP7蛋白表达及半定量分析 图 4 TET1下游基因CTNNB1及MMP7的表达水平 |
2.4 β-catenin抑制剂对肺癌细胞迁移、侵袭能力的影响
在敲低TET1表达的同时加入β-catenin抑制剂ICG-001(原理是拮抗Wnt/β-catenin/TCF介导的转录,并特异性结合到启动子结合蛋白)进行处理,采用Transwell实验检测细胞迁移和侵袭的能力。结果显示敲低表达TET1时,促进细胞迁移和侵袭(P < 0.01,图 5);同时加入β-catenin抑制剂处理后细胞迁移能力和侵袭能力明显的受到抑制(P < 0.01,图 5)。进一步证实TET1基因主要通过调控Wnt/β-catenin信号通路抑制肺癌细胞的迁移和侵袭。
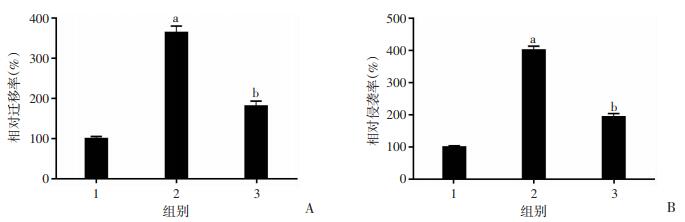
|
| a: P < 0.01,与Negative对照组比较;b: P < 0.01,与shTET1组比较1:Negative对照组;2:shTET1组;3:shTET1+β-catenin Inhibitor;A:各组肺癌细胞迁移能力;B:各组肺癌细胞侵袭能力 图 5 β-catenin抑制剂处理对肺癌细胞迁移和侵袭能力的影响 |
3 讨论
DNA甲基化作为表观遗传调控的主要调控方式与肿瘤发生、发展过程密切相关。α-酮戊二酸依赖型DNA双加氧酶TET1基因可通过氧化5-甲基胞嘧啶为5-羟甲基胞嘧啶而参与DNA甲基化调节过程。随着对该基因研究的不断深入,研究发现该基因在肿瘤的发生、发展过程中发挥重要作用[7-8],TET1基因过表达后可以明显抑制宫颈癌细胞增殖和迁移能力[8]。我们前期研究表明TET1在肺癌细胞中出现了表达异常。因此,我们推测该基因与肺癌发生过程关系密切,有深入研究的必要。
本研究采用RT-qPCR检测不同肺癌细胞及正常支气管上皮细胞中该基因的表达水平,结果显示TET1基因在肺癌细胞中出现了不同程度的表达下降,表明该基因与肺癌的发生发展关系密切。为明确TET1基因表达水平对肺癌细胞的迁移和侵袭能力的影响,我们构建了TET1差异表达细胞模型,通过细胞迁移侵袭实验证实过表达TET1基因后可以明显抑制肺癌细胞迁移和侵袭能力,而干扰TET1基因则使肺癌细胞的迁移及侵袭能力增强。研究报道TET1在多种肿瘤中发挥作用都与Wnt/β-catenin等信号通路密切相关[6-8]。为探索TET1基因抑制肺癌迁移和侵袭能力的可能信号通路,本研究对该基因可能调控的下游基因的表达水平进行了检测,结果发现当过表达TET1基因后其下游基因CTNNB1、MMP7蛋白及mRNA表达水平下降,而干扰TET1基因后CTNNB1、MMP7蛋白及mRNA表达水平上升。证实TET1基因表达水平可以对其下游基因CTNNB1、MMP7的表达水平造成影响。由于CTNNB1、MMP7是Wnt/β-catenin信号通路的重要成员,而Wnt/β-catenin信号通路是恶性肿瘤转移过程中重要的信号通路之一[9-10],我们认为TET1对肺癌细胞迁移和侵袭能力的抑制作用可能主要是通过抑制Wnt/β-catenin信号通路的结果,但相关作用机制仍需进一步研究证实。
K-ras通过抑制TET1表达而促进DNA甲基化发生和细胞恶性转化。进一步机制研究发现,TET1下调后可导致聚集在抑癌基因启动子区的TET1减少,羟甲基化水平降低,甲基化水平升高从而导致基因转录沉默。TET1表达恢复后可以诱导抑癌基因重新表达并抑制细胞恶性转化。提示TET1介导的DNA去甲基化是K-ras介导的细胞恶性转化中至关重要的环节[11]。最新研究表明,TET1还可通过结合p53、NF-κB等信号通路中关键基因的启动子区导致其羟甲基化水平升高和甲基化水平降低,促使基因表达水平升高,从而参与调控肿瘤细胞的生长和转移[12-14]。芯片聚类分析发现,TET1介导羟甲基化水平修饰主要富集在参与细胞增殖、运动和血管生成、DNA损伤修复等基因的启动子区[15]。TET1可通过调控β-catenin通路抑制结肠癌的生长[16]及胰腺癌的EMT过程[7]。结合本研究发现和最新研究进展,我们推测:TET1可能通过降低β-catenin通路基因的羟甲基化水平,从而导致其甲基化水平上升抑制基因表达水平,参与肺癌发生发展过程。后续我们将进一步围绕TET1如何调控该通路介导肺癌发生发展的分子机制进行深入探讨与研究。
综上所述,本研究结果显示TET1基因在肺癌细胞中表达下降。TET1基因在肺癌中具有显著的抑癌基因的特征,明显抑制肺癌细胞迁移和侵袭且与Wnt/β-catenin信号通路密切相关。深入开展该基因的生物学功能及机制研究不仅对阐明肺癌发生发展机制、减少肺癌患者早期转移和改善肺癌患者预后意义重大,也为寻找肺癌诊疗及预后的早期生物标志物、研究靶点及相关策略提供了新思路。
| [1] |
BIRKBAK N J, MCGRANAHAN N. Cancer genome evolutionary trajectories in metastasis[J]. Cancer Cell, 2020, 37(1): 8-19. DOI:10.1016/j.ccell.2019.12.004 |
| [2] |
SUN Z X, XU X G, HE J L, et al. EGR1 recruits TET1 to shape the brain methylome during development and upon neuronal activity[J]. Nat Commun, 2019, 10(1): 3892. DOI:10.1038/s41467-019-11905-3 |
| [3] |
YANG X W, WONG M P M, NG R K. Aberrant DNA methylation in acute myeloid leukemia and its clinical implications[J]. Int J Mol Sci, 2019, 20(18): E4576. DOI:10.3390/ijms20184576 |
| [4] |
ALOIA L, MCKIE M A, VERNAZ G, et al. Epigenetic remodelling licences adult cholangiocytes for organoid formation and liver regeneration[J]. Nat Cell Biol, 2019, 21(11): 1321-1333. DOI:10.1038/s41556-019-0402-6 |
| [5] |
ZHANG Y P, ZHANG Y D, CHEN D M, et al. Genome-wide alteration of 5-hydroxymethylcytosine in hypoxic-ischemic neonatal rat model of cerebral palsy[J]. Front Mol Neurosci, 2019, 12: 214. DOI:10.3389/fnmol.2019.00214 |
| [6] |
WU H X, CHEN Y X, WANG Z X, et al. Alteration in TET1 as potential biomarker for immune checkpoint blockade in multiple cancers[J]. J Immunother Cancer, 2019, 7(1): 264. DOI:10.1186/s40425-019-0737-3 |
| [7] |
WU J, LI H Z, SHI M M, et al. TET1-mediated DNA hydroxymethylation activates inhibitors of the Wnt/β-catenin signaling pathway to suppress EMT in pancreatic tumor cells[J]. J Exp Clin Cancer Res, 2019, 38(1): 348. DOI:10.1186/s13046-019-1334-5 |
| [8] |
SU P H, HSU Y W, HUANG R L, et al. TET1 promotes 5hmC-dependent stemness, and inhibits a 5hmC-independent epithelial-mesenchymal transition, in cervical precancerous lesions[J]. Cancer Lett, 2019, 450: 53-62. DOI:10.1016/j.canlet.2019.01.033 |
| [9] |
KAHN M. Can we safely target the WNT pathway?[J]. Nat Rev Drug Discov, 2014, 13(7): 513-532. DOI:10.1038/nrd4233 |
| [10] |
PATEL S, ALAM A, PANT R, et al. Wnt signaling and its significance within the tumor microenvironment: novel therapeutic insights[J]. Front Immunol, 2019, 10: 2872. DOI:10.3389/fimmu.2019.02872 |
| [11] |
WU B K, BRENNER C. Suppression of TET1-dependent DNA demethylation is essential for KRAS-mediated transformation[J]. Cell Rep, 2014, 9(5): 1827-1840. DOI:10.1016/j.celrep.2014.10.063 |
| [12] |
FILIPCZAK P T, LENG S G, TELLEZ C S, et al. P53-suppressed oncogene TET1 prevents cellular aging in lung cancer[J]. Cancer Res, 2019, 79(8): 1758-1768. DOI:10.1158/0008-5472.CAN-18-1234 |
| [13] |
YOKOYAMA S, HIGASHI M, TSUTSUMIDA H, et al. TET1-mediated DNA hypomethylation regulates the expression of MUC4 in lung cancer[J]. Genes Cancer, 2017, 8(3/4): 517-527. DOI:10.18632/genesandcancer.139 |
| [14] |
COLLIGNON E, CANALE A, AL WARDI C, et al. Immunity drives TET1 regulation in cancer through NF-κB[J]. Sci Adv, 2018, 4(6): eaap7309. DOI:10.1126/sciadv.aap7309 |
| [15] |
PUTIRI E L, TIEDEMANN R L, THOMPSON J J, et al. Distinct and overlapping control of 5-methylcytosine and 5-hydroxymethylcytosine by the TET proteins in human cancer cells[J]. Genome Biol, 2014, 15(6): R81. DOI:10.1186/gb-2014-15-6-r81 |
| [16] |
GUO H L, ZHU H Y, ZHANG J, et al. TET1 suppresses colon cancer proliferation by impairing β-catenin signal pathway[J]. J Cell Biochem, 2019, 120(8): 12559-12565. DOI:10.1002/jcb.28522 |



