原发不明转移瘤(cancer of unknown primary,CUP)指转移灶经组织学确认,并全面常规检查后,仍无法确认原发部位的一组异质性较大的恶性肿瘤,占所有恶性肿瘤的2%~3%。因为异源发生,CUP临床表现大不相同,包括身体任何部位淋巴结肿大、胸腹腔积液、肝脾肿大、不明原因发热或骨痛等。由于无法有效识别原发肿瘤,大多数患者在临床实践中被予以经验性治疗,虽然某些个体可从中获益[1],但总体预后不容乐观,中位生存时间仅1年[2]。根据DAVIS等[3]的回顾性研究,与未发现原发灶的患者相比,明确原发灶位置的患者总体生存率得到明显改善(HR=0.125,P=0.030)。
明确肿瘤来源对患者治疗方式选择至关重要,为针对原发部位的手术切除、放化疗和个体化特异性靶向治疗提供了明确依据。目前常规手段为病理学检查和影像学检查,病理学检查主要区分首检组织是否为肿瘤,对原发灶的寻找不能提供更多帮助;常规影像学检查可以发现多处疑似肿瘤灶,但对于检查部位的判断多依据临床经验,存在漏诊可能。同时,CT/MRI可能会遗漏小的和未强化的且器官结构正常的原发病灶。然而组织代谢改变往往早于形态学改变,所以利用氟-18-氟脱氧葡萄糖正电子发射计算机断层扫描显像(18F-FDG PET/CT)可以同时获取人体各器官、组织的代谢信息和解剖学信息,弥补了CT/MRI对肿瘤代谢活性判断的缺陷,临床上常用于肿瘤的分期、再灌注、治疗前评估和治疗监测等[4-5]。目前已有大量证据表明在常规影像检查无果后,18F-FDG PET/CT全身显像是发现原发灶的有力工具,特别是对于一些无典型临床症状的CUP患者,采用PET/CT全身显像可以避免检查针对性不强引起的漏诊[6]。近年来18F-FDG PET/CT对CUP患者原发灶的检出能力已有广泛报道,但样本量普遍较小,各个研究间纳排标准、观察方式及研究类型不完全统一,导致诊断CUP的灵敏度和特异度在不同研究间的异质性较大。因此,本研究检索相关诊断性研究,采用Meta分析的方法了解当前研究18F-FDG PET/CT全身显像对原发灶不明转移瘤患者原发灶检出临床价值的文献质量,是否存在异质性以及异质性的来源,以期为不明原发灶转移瘤患者的分期、治疗方案提供参考。
1 资料与方法 1.1 检索策略使用计算机检索PubMed/Medline、Cochrane Library、EMBASE、EBSCO、中国知网、维普、万方等数据库,研究对象为进行18F-FDG PET/CT全身显像的原发不明转移瘤患者。中文检索词:氟脱氧葡萄糖、FDG、PET/CT、正电子发射型计算机断层显像、原发不明转移癌、不明原发灶转移瘤、原发病灶;英文检索词:fluorodeoxyglucose、2-fluoro-2-deoxy-D-glucose、FDG、positron emission tomography、positron-emission tomography、PET、Unknown primary、unidentified primary、occult primary、unknown origin、unidentified origin。
1.2 纳入和排除标准纳入标准:①评价18F-FDG PET/CT全身显像在寻找CUP的原发病灶的诊断价值已发表的文献;②每位患者必须接受过18F-FDG PET/CT全身扫描;③有明确的数据可以从文章中提取出来;④选择英文或中文文献;⑤为了不漏掉潜在的符合标准的文献,筛入文献的参考文献也在筛选范围内;⑥当数据出现在不止一篇文献中时,纳入最近发表且包含数据信息最多的文献;⑦限定日期为2010年1月至2019年3月;⑧试验设计严谨,金标准为病理活检或长期随访。排除标准:①病例数≤10的文献;②综述、系统评价、Meta分析、个案报道、指南、会议类文献等;③仅有摘要无法获取全文的文献。
1.3 文献筛选和数据提取由两名研究者独立筛选检索所得的文献,不一致时通过讨论解决,对难以解决的分歧向第三名研究者咨询,直至达成一致意见。使用NoteFirst 5.0和人工去重,逐篇阅读文献的标题和摘要,初步排除不符合纳入标准的文献,在排除明显不相关或资料不全的文献后,进一步全文阅读文献确定最终纳入文献。
根据预先设计的列表,提取的资料主要有:第一作者、国籍、发表年份、研究类型、纳入样本量、随访时间、转移灶的部位和病理类型、金标准、待评价试验参数、真阳性病例数(true positives,TP)、假阳性病例数(false positives,FP)、假阴性病例数(false negatives,FN)、真阴性病例数(true negatives,TN)等。
1.4 纳入文献的质量评价按照2011年的诊断性试验质量评价(quality assessment of studies of diagnostic accuracy included in systematic reviews,QUADAS-2)[7]对纳入的原始文献进行质量评估。该量表分为:①病例的选择;②待评价试验;③金标准;④病例流程和进展情况。
根据本研究的特点和KWEE等[8]的荟萃分析,讨论后决定:移除量表中的“金标准结果的判读是否使用了盲法”,因为阳性的PET/CT结果可以通过指导活检或手术获得的组织病理学结果来验证;移除“所有病例是否接受了同样的金标准”,因为阳性结果可以通过组织学检查证实,但阴性结果需要临床随访。
1.5 统计学处理和分析通过计算Spearman相关系数判断是否存在阈值效应,如果各研究间不存在阈值效应,则采用stata 15.1软件中双变量混合效应模型计算PET/CT全身显像对原发不明转移瘤患者原发灶检出的合并灵敏度(sensitivity)、特异度(specificity)、阳性似然比(positive likelihood ratio, +LR)、阴性似然比(negative likelihood ratio, -LR)、诊断比值比(diagnostic odds ratio,DOR)及相应的95%可信区间(95% confidence intervals,CIs)。绘制SROC曲线,计算SROC曲线下面积(the area under the curve,AUC)。通过I2和Q检验确定研究的异质性。在I2小于50%时采用固定效应模型计算效应值,否则采用随机效应模型。分析异质性的来源,采用Deek’s漏斗图评价发表偏倚,并进行敏感性分析和回归分析。
2 结果 2.1 文献检索结果经过初步检索,得到了3 158篇相关文献,按照纳入和排除标准进行筛选。基于标题、摘要(2 609篇)和重复的文献(489篇)删除3 044篇,剩下的87篇文献,通过阅读全文,排除了69篇,排除原因主要有:同一研究中病例数较少者、部分研究对象未接受金标准试验、无法提取四格表数据、纳入了淋巴瘤等血液系统疾病、样本量不足10篇、联系原作者后仍无法获得全文、语言不符等。最终有18篇符合标准文献纳入本研究,其中中文文献6篇[9-14],英文文献12篇[15-26]。
2.2 文献质量评价使用QUADAS-2进行质量评价,风险偏倚条目和适用性总结图及质量评价条形图见图 1。主要的不确定风险:病例的选择,原因是大部分研究未明确说明纳入研究对象的方式是连续还是随机(77.78%);待评价试验,归因于多数研究未事先确定阈值(66.67%)。主要的高风险:病例流程和进展情况,是前瞻性研究中纳入的研究对象空腹血糖不符合标准、患者拒绝参加临床研究、后期资料失访等原因引起的未将所有病例纳入所致(22.2%)。
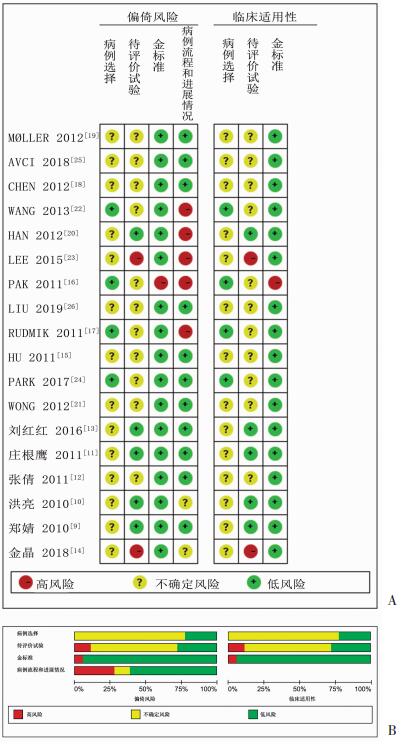
|
| 图 1 纳入文献风险偏倚条目和适用性(A)及质量评价(B) |
2.3 纳入文献的基本特征
纳入的18个诊断试验共1 237例患者,包括14篇回顾性研究和4篇前瞻性研究。纳入文献的基本特征见表 1。
| 文献 | 出版年 | 国籍 | 研究类型 | 病例数 | 年龄/岁 | 男/女 | 药物剂量 |
| 郑婧等[9] | 2010 | 中国 | 回顾性 | 17 | 39~76(59.6±11.2) | 9/8 | 4.4~5.6 MBq/kg |
| 洪亮等[10] | 2010 | 中国 | 回顾性 | 37 | 23~76(53) | 26/11 | 5 MBq/kg |
| 庄根鹰[11] | 2011 | 中国 | 回顾性 | 20 | 32~79(55.2±12.5) | 14/6 | 5.92 MBq/kg |
| 张倩等[12] | 2011 | 中国 | 回顾性 | 31 | NR | NR | 5.55 MBq/kg |
| 刘红红等[13] | 2016 | 中国 | 回顾性 | 137 | 24~84(55.77±11.71) | 95/42 | 3.7~5.5 MBq/kg |
| 金晶等[14] | 2018 | 中国 | 回顾性 | 87 | NR | 60/27 | 5.5~6.6 MBq/kg |
| HU等[15] | 2011 | 中国 | 回顾性 | 149 | 32~75(59) | 84/65 | 350-425 MBq |
| PAK等[16] | 2011 | 韩国 | 回顾性 | 51 | NR | 32/19 | 370 MBq |
| RUDMIK等[17] | 2011 | 加拿大 | 前瞻性 | 20 | 38~85(58) | 16/4 | 500 MBq |
| CHEN等[18] | 2012 | 中国 | 回顾性 | 27 | 30~73(48.2±16.3) | 21/6 | 222~370 MBq |
| MØLLER等[19] | 2012 | 丹麦 | 前瞻性 | 135 | 32~81(62) | 65/70 | 400 MBq |
| HAN等[20] | 2012 | 中国 | 回顾性 | 120 | 28~72 | 66/54 | 400 MBq |
| WONG等[21] | 2012 | 英国 | 回顾性 | 78 | 34~95(61) | NR | 4.5 MBq/kg |
| WANG等[22] | 2013 | 中国 | 回顾性 | 142 | 13~89(56) | NR | 270~370 MBq |
| LEE等[23] | 2015 | 韩国 | 前瞻性 | 56 | 39~86(55) | 43/13 | 370~555 MBq |
| PARK等[24] | 2017 | 韩国 | 前瞻性 | 54 | 31~84(53) | 44/10 | 370~555 MBq |
| AVCI等[25] | 2018 | 土耳其 | 回顾性 | 36 | 25~92(62) | 23/13 | 185~370 MBq |
| LIU等[26] | 2019 | 美国 | 回顾性 | 40 | 35~72(53.9±8.5) | 33/7 | NR |
| NR:未报道 | |||||||
2.3.1 转移灶特征
15篇文献[9-11, 13, 15, 17-26]共报道1 159处转移灶的位置,见表 2。其中颈部为CUP最常见的转移部位,其次是颈外淋巴结转移和骨转移。13篇文献[9-10, 13-19, 21, 23-24, 26]共报道862处转移灶经穿刺活检病理得到的病理类型,见表 2。主要类型分别是鳞癌、腺癌及低分化或未分化癌。
| 转移灶 | 例数 | 占比(%) |
| 部位 | 1159 | 100.00 |
| 颈部淋巴结 | 601 | 51.86 |
| 颈外淋巴结a | 155 | 13.37 |
| 骨 | 100 | 8.63 |
| 肝 | 76 | 6.56 |
| 肺 | 73 | 6.30 |
| 腹膜 | 66 | 5.70 |
| 胸膜 | 23 | 1.98 |
| 脑 | 19 | 1.64 |
| 皮肤 | 15 | 1.29 |
| 肾上腺 | 8 | 0.70 |
| 其他b | 23 | 1.98 |
| 病理类型 | 862 | 100.00 |
| 鳞癌 | 443 | 51.40 |
| 腺癌 | 308 | 35.73 |
| 低分化或未分化癌 | 94 | 10.90 |
| 其他 | 17 | 1.97 |
| a:腋窝、纵隔、盆腔等部位的淋巴结转移;b:阑尾、腰肌脓肿等 | ||
2.3.2 原发灶特征
17篇文献[9-18, 20-26]经18F-FDG PET/CT全身显像共检出499例原发灶,具体位置见表 3。PET/CT检出的原发灶中,最常见的部位是咽部,其次是肺。有16篇文献[9-11, 13-18, 20-26]发现假阳性结果为99个,以口、鼻咽部(40.4%)和肺部(12.1%)为主。有14篇文献[9-11, 13-15, 17-18, 20, 22-26]发现假阴性结果为73个,最常见的部位是口咽部(38.4%),其次是肺(12.3%)和乳腺(8.2%)。
2.4 Meta分析 2.4.1 数据分析结果
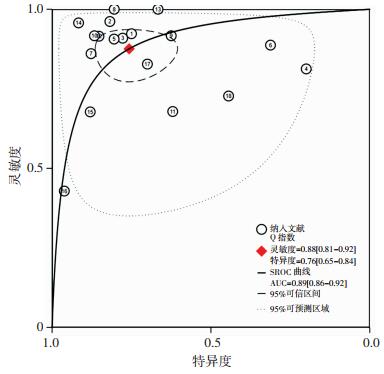
计算灵敏度和特异度的Spearman相关系数,结果提示不存在阈值效应(Spearman correlation coefficient: -0.063,P=0.804),故可以直接合并评价指标。根据同质性检验,18项研究的灵敏度和特异度的I2值分别为80.56%,(95%CI:72.21~88.90)和82.31%(95%CI:74.91~89.71),统计学异质性均较高,故采用随机效应模型计算合并效应值,森林图见图 2~4。18F-FDG PET/CT全身显像对原发不明转移瘤患者原发灶检出的合并灵敏度为0.88 (95%CI:0.81~0.92),合并特异度为0.76(95%CI:0.65~0.84),合并阳性似然比为3.61(95%CI:2.4~5.4),合并阴性似然比为0.16(95%CI:0.10~0.27),合并诊断比值比为22(95%CI:11~46)。SROC曲线下面积AUC=0.89(95%CI:0.86~0.92),见图 5。
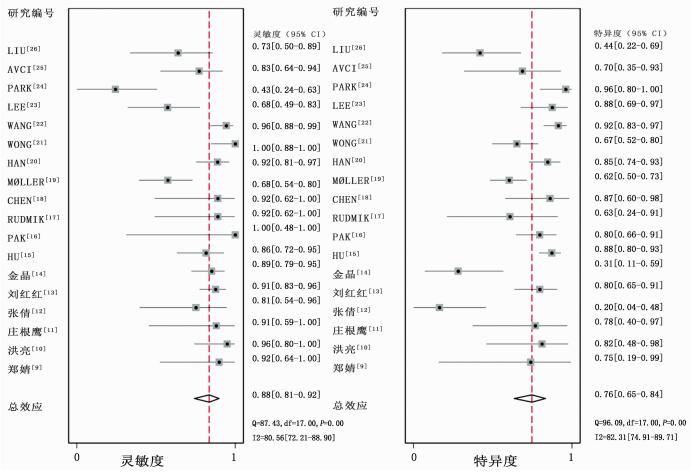
|
| 图 2 18F-FDG PET/CT全身显像检出CUP的灵敏度(左)和特异度(右)森林图 |
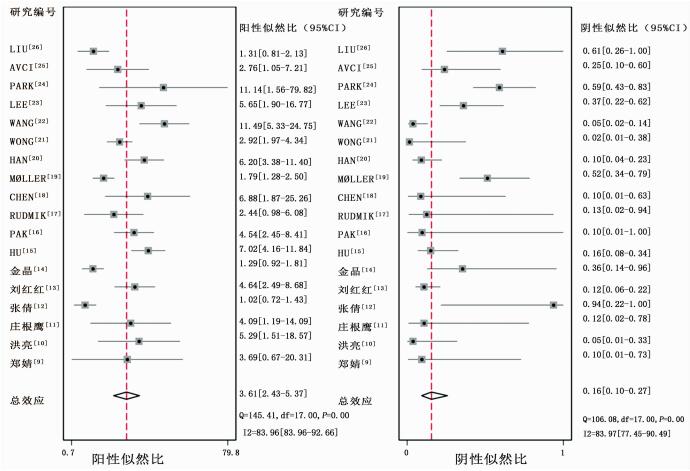
|
| 图 3 18F-FDG PET/CT全身显像检出CUP的阳性似然比(左)和阴性似然比(右)森林图 |
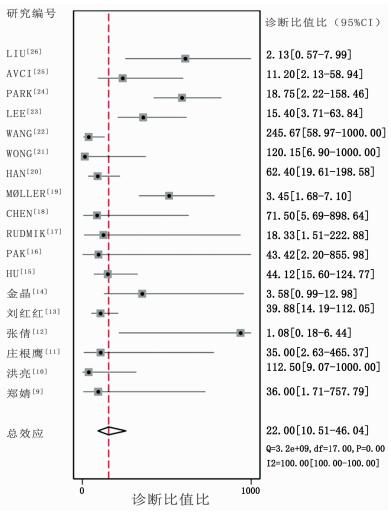
|
| 图 4 18F-FDG PET/CT全身显像检出CUP的诊断比值比森林图 |
|
| 图 5 18F-FDG PET/CT全身显像对CUP检出价值的SROC曲线 |
2.4.2 异质性来源的探讨
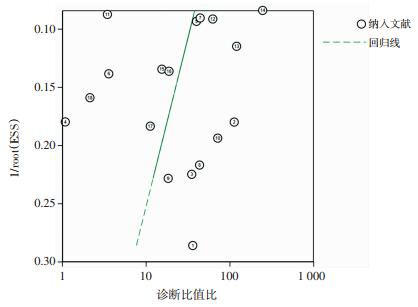
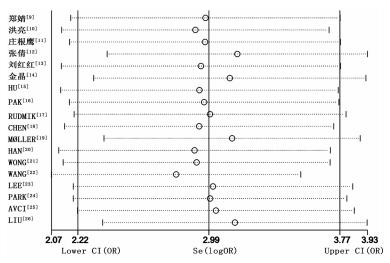
采用Deek’s法绘制漏斗图评价发表偏倚,见图 6。结果显示,P=0.347>0.10,t=-0.97,(95%CI:-25.31~9.42)。提示漏斗图对称,纳入文献不存在发表偏倚。敏感性分析结果显示,没有单个研究对整体有明显的影响,敏感性分析结果稳健(图 7)。
|
| 图 6 纳入文献的Deek’s发表偏倚漏斗图 |
|
| Se(logOR)表示总合并效应量(OR)的对数值;Upper CI(OR)和Lower CI(OR)分别表示总合并效应量(OR)对数值的95%可信区间的上下限;每项研究对应的横线表示删除该研究后剩余其他研究的合并效应量的对数值 图 7 纳入文献的敏感性分析 |
根据纳入研究18F-FDG PET/CT检查前是否经过病理活检确认、检查前常规检查的完整性、研究类型、是否预先设定阈值、未知原发灶的转移部位、转移灶的病理类型、检查前空腹时间及研究所在地官方语言,将纳入的研究以DOR为效应量进行回归分析,见表 4、5。分析发现,检查前是否经过病理活检确认(P=0.01)、研究类型(P=0.00)、转移灶部位(P=0.03)和转移灶的病理类型(P=0.01)是灵敏度异质性的主要来源,检查前是否经过病理活检确认(P=0.05)也是特异度异质性的来源。同时,来自韩国研究(P=0.00)造成的异质性也不容忽视。
| 因素 | 研究数 | 灵敏度(95%CI) | P1 | 特异度(95%CI) | P2 |
| 检查前病理活检 | |||||
| 是 | 14 | 0.85(0.78~0.92) | 0.01 | 0.72(0.61~0.83) | 0.05 |
| 否 | 4 | 0.93(0.87~0.99) | 0.86(0.73~0.98) | ||
| 检查前常规检查的完整性 | |||||
| 是 | 14 | 0.86(0.79~0.93) | 0.07 | 0.73(0.62~0.85) | 0.12 |
| 否 | 4 | 0.91(0.81~1.00) | 0.83(0.67~0.98) | ||
| 研究类型 | |||||
| 前瞻性 | 4 | 0.66(0.53~0.79) | 0.00 | 0.81(0.65~0.98) | 0.86 |
| 回顾性 | 14 | 0.91(0.87~0.94) | 0.74(0.63~0.85) | ||
| 设置阈值 | |||||
| 是 | 5 | 0.93(0.87~0.99) | 0.67 | 0.82(0.67~0.97) | 0.88 |
| 否 | 13 | 0.84(0.77~0.92) | 0.73(0.62~0.85) | ||
| 转移灶位置 | |||||
| 头颈部 | 10 | 0.86(0.78~0.94) | 0.03 | 0.75(0.61~0.88) | 0.22 |
| 全身 | 8 | 0.89(0.82~0.96) | 0.77(0.64~0.90) | ||
| 转移灶病理类型 | |||||
| 鳞癌为主 | 8 | 0.84(0.75~0.94) | 0.01 | 0.74(0.59~0.89) | 0.20 |
| 非鳞癌为主 | 10 | 0.90(0.83~0.96) | 0.77(0.65~0.89) | ||
| 空腹时间≥6 h | |||||
| 是 | 14 | 0.88(0.81~0.94) | 0.28 | 0.80(0.73~0.88) | 0.20 |
| 否 | 4 | 0.87(0.75~0.99) | 0.52(0.28~0.76) | ||
| 语言 | 研究数 | 灵敏度(95%CI) | P1 | 特异度(95%CI) | P2 |
| 中文 | |||||
| 是 | 10 | 0.91(0.87~0.96) | 0.51 | 0.77(0.64~0.89) | 0.38 |
| 否 | 8 | 0.78(0.68~0.88) | 0.75(0.60~0.89) | ||
| 丹麦语 | |||||
| 是 | 1 | 0.68(0.31~1.00) | 0.15 | 0.62(0.17~1.00) | 0.49 |
| 否 | 17 | 0.88(0.83~0.94) | 0.77(0.67~0.86) | ||
| 英语 | |||||
| 是 | 3 | 0.92(0.81~1.00) | 1.00 | 0.58(0.30~0.86) | 0.09 |
| 否 | 15 | 0.87(0.80~0.93) | 0.79(0.70~0.88) | ||
| 韩语 | |||||
| 是 | 3 | 0.63(0.41~0.84) | 0.00 | 0.89(0.77~1.00) | 0.52 |
| 否 | 15 | 0.89(0.85~0.93) | 0.72(0.62~0.83) | ||
| 土耳其语 | |||||
| 是 | 1 | 0.84(0.56~1.00) | 0.84 | 0.71(0.23~1.00) | 0.98 |
| 否 | 17 | 0.88(0.82~0.94) | 0.76(0.66~0.86) | ||
3 讨论
本研究发现,PET/CT检出原发灶的灵敏度和特异度分别为88%、76%,与2011年的研究[27]结果相比(Sen 90%、Spe 84%),呈下降趋势。这种趋势可能与常规影像、实验室检查等技术的进步,使得曾经无法使用常规检查技术检出的未知原发灶被发现;以及以前相当一部分研究未排除淋巴瘤和血液系统恶性疾病,使得检出率被高估等原因有关。
任何非金标准检查均存在假阴性及假阳性可能,本研究也存在一定的假阳性和假阴性,其中最常见的假阳性部位是咽部,其次是肺,与以往研究的结果相似[8]。考虑与声带、咽扁桃体和韦氏环等结构的生理性摄取有关,检查前嘱患者减少吞咽、说话等可以减少这种误差。肺是PET/CT诊断恶性肿瘤较易发生假阳性的部位,穿刺活检与检查间隔6周可以减少炎症所致的假阳性[28]。除炎症、感染或梗死病变外,还可能与给药时针头回血引起微小的血栓栓塞,造成肺内18F-FDG摄取增加有关[12],参考CT图像可以提高诊断效能。二者同样也是假阴性常见的部位。假阴性的常见因素为病灶组织代谢被低估及病灶过小。针对代谢被低估导致的假阴性可采用延迟显像、使用其他示踪剂或CT造影剂,如11C标记的胆碱(11C-CH)[29]、68Ga标记生长抑素示踪剂(68Ga -DOTATATE)[30]等。研究报道[23]假阴性病灶大小中位数为9 mm,针对该类病灶可以同时完善高分辨CT协助诊断。
本研究中,3篇文献[11, 19, 25]将PET/CT与CT/MRI对诊断不明原发灶的能力进行了比较,PET/CT的约登指数(0.69、0.29、0.53)均高于CT/MRI(0.64、0.26、0.32)。根据庄根鹰[11]的报道,PET/CT发现所有的5例鼻咽癌患者,CT只识别了其中3例,其中1例虽提示鼻咽部恶性肿瘤可能,但3次穿刺活检均未能发现肿瘤组织,经PET/CT显像并根据其放射性摄取增高的部位进行深部活检后最终确诊。PET/CT还可辅助鉴别诊断,陈彩龙等[31]报道,1例MRI诊断脊柱骨转移的患者经PET/CT扫描后无摄取增加,结果提示陈旧性骨折。
研究显示,SUVmax、受转移灶影响的器官及其数目是CUP重要影响因素,原发灶SUVmax≤6.5的患者预后好于SUVmax>6.5的患者(AUC=0.627)[13]。无远处转移的患者1、3、5年生存率(89.0%、76.8%、74.4%)明显高于发生远处转移的患者(63.6%、43.6%、36.4%)[13]。凭借全身显像的优势,PET/CT不仅可以找到原发灶,还能提供关于远处转移和第二原发癌的信息,本研究有10篇文献[9, 10, 13, 15, 18, 20-23, 25]观察到PET/CT发现了常规检查未能发现的远处淋巴结或组织器官转移及第二原发肿瘤共183例,占10个研究总例数的23.0%(183/799),并改变了患者的治疗方案。
本研究异质性较大,与近年的Meta分析[32](I2= 95.9%)类似。原因主要归结于研究方法的不同,纳入的文献多为回顾性(14/18),可能存在对病例的选择性偏倚,此外,金晶等[14]研究显示,待评价试验是在金标准之后进行解释,虽然作者声明阅片人员采用双盲法,但实际施行过程中难以保证,这些因素可能使诊断准确性人为地提高。其次,不同研究对CUP的定义不同,有的研究包括“经病理证实”和“临床高度怀疑转移瘤”的患者,有的研究只包括“经病理证实的转移瘤”。回归分析显示,PET/CT对经病理活检证实的和经常规检查无阳性发现的CUP灵敏度更低(P=0.01,0.07),分析其可能的原因为转移灶经病理活检证实并进行了完整的全身常规检查后并未发现原发灶,说明其原发灶存在一定隐匿性,如病灶过小或假性低代谢,导致PET/CT亦不能检出原发灶。
转移灶部位、转移灶病理类型也是影响异质性的指标。转移灶来自全身的研究较仅来自头颈部的研究原发灶的检出灵敏度稍高(0.89 vs 0.86,P=0.03),可能原因是原发灶靠近生理性摄取和排泄较高的器官,且头颈部结构复杂,易漏诊。而头颈部恶性肿瘤中鳞状细胞癌占多数。金标准设置也各有不同,多数随访时间为6~84个月,但MØLLER等[19]在设置研究方法时为避免错误的假阴性结果,将随访时间设置为2个月,但这也会导致假阳性例数的增加。
根据研究所在地官方语言的回归分析发现韩国的3篇研究[16, 23-24]异质性较大,灵敏度低于其他语种国家(0.63 vs 0.89,P=0.00)。这三项研究的共同点是没有严格的SUV截断值,对摄取增加的程度实行评分制,是基于视觉和半定量分析异常增加对病灶评分,采用四分制或五分制。根据回归的结果,这种方式的诊断效能可能不如传统的截断值(SUVmax=2.5)。但在预后分层方面有更多的优势。
与之前的同类研究比较,均显示18F-FDG PET/CT全身显像较常规方式更能有效地检出CUP原发灶。但杨忠毅等[27]的研究未使用QUADAS进行质量评价,采用Q值统计量进行异质性检验,Q值检验法虽然应用广泛,但受到纳入研究数量、总体信息量和不同研究权重等因素的影响,检验效能较低,结果不那么可靠。杨忠毅等[27]和BURGLIN等[32]的研究均未对异质性来源进行统计学分析,KWEE等[8]针对存在的异质性进行了亚组分析,但未能发现异质性来源。本研究应用最新的QUADAS-2工具,使用的I2统计量描述研究间变异占总变异的百分比,利用自由度校正了研究文献数目对Q值的影响,其大小不会随文献数量变化而变化,检验结果更加稳健[33],且对异质性的来源进行了分析。
本研究存在一些不足:Meta回归分析的对象是单个研究所含病例的综合特征,但每个研究内转移灶和部位、病理类型、注射造影剂剂量和随访时间等都不完全相同,未来可以尝试使用线性回归、Logistic回归等进行具体分析。除此之外,还存在一些其他难以避免的局限性,如语言偏倚、混杂偏倚、测量误差、生态学谬误(ecological fallacy)以及因为无法获取原始数据最终被舍弃的数据造成的偏倚等。
综上所述,18F-FDG PET/CT全身显像对原发不明转移瘤患者原发灶的检出较常规影像检查具有更好的诊断价值,应尽早在临床实践中推广应用。因结合本研究结果和分析原始研究的局限,我们对于今后的临床研究以及我们自己拟设计开展的临床研究得到了一些启示和建议:①试验实施前应该有严格的顶层设计,规范研究方法和标准,有明确的定义、结局指标、足够的随访时间和合理的统计学分析表达方式,尽可能减少试验各个环节带来的偏倚。②积极开展多中心、大样本、前瞻性的研究,积累更多的临床病例资料,这既能充分体现研究的临床价值,又能为循证医学和临床实践提供宝贵、高质量的证据。③规范结局指标的报告形式,采用客观的评分或者临床普遍接受的评分标准,便于统计分析,充分利用每一个数据。
| [1] |
HAINSWORTH J D, DAUGAARD G, LESIMPLE T, et al. Paclitaxel/carboplatin with or without belinostat as empiric first-line treatment for patients with carcinoma of unknown primary site: a randomized, phase 2 trial[J]. Cancer, 2015, 121(10): 1654-1661. DOI:10.1002/cncr.29229 |
| [2] |
BOCHTLER T, LÖFFLER H, KRÄMER A. Diagnosis and management of metastatic neoplasms with unknown primary[J]. Semin Diagn Pathol, 2018, 35(3): 199-206. DOI:10.1053/j.semdp.2017.11.013 |
| [3] |
DAVIS K S, BYRD J K, MEHTA V, et al. Occult primary head and neck squamous cell carcinoma: utility of discovering primary lesions[J]. Otolaryngol Head Neck Surg, 2014, 151(2): 272-278. DOI:10.1177/0194599814533494 |
| [4] |
SCARSBROOK A F, BARRINGTON S F. Evidence-based indications for the use of PET-CT in the United Kingdom 2016[J]. Clin Radiol, 2016, 71(7): e171-e188. DOI:10.1016/j.crad.2016.05.001 |
| [5] |
SCARSBROOK A F, BARRINGTON S F. PET-CT in the UK: current status and future directions[J]. Clin Radiol, 2016, 71(7): 673-690. DOI:10.1016/j.crad.2016.02.023 |
| [6] |
张冬萍. 18F-FDG PET/CT显像对原发灶不明的淋巴结转移患者寻找原发灶的临床价值[D].广州: 南方医科大学, 2010. ZHANG D P. Clinical value of 18F-FDG PET/CT for detection of the unknown primary tumor in the patients with lymph node metastasis[D]. Guangzhou: Southern Medical University, 2010. |
| [7] |
WHITING P F, RUTJES A W, WESTWOOD M E, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies[J]. Ann Intern Med, 2011, 155(8): 529-536. DOI:10.7326/0003-4819-155-8-201110180-00009 |
| [8] |
KWEE T C, KWEE R M. Combined FDG-PET/CT for the detection of unknown primary tumors: systematic review and meta-analysis[J]. Eur Radiol, 2009, 19(3): 731-744. DOI:10.1007/s00330-008-1194-4 |
| [9] |
郑婧, 高硕. 全身18F-FDGPET/CT在原发灶不明的颈淋巴结转移性腺癌中的应用[J]. 天津医药, 2010, 38(3): 204-206, 260. ZHENG J, GAO S. Whole body 18F-FDG PET/CT imaging for detecting primary tumors of cervical metastatic adenocarcinoma from unknown primary site[J]. Tianjin Med J, 2010, 38(3): 204-206, 260. DOI:10.3969/j.issn.0253-9896.2010.03.015 |
| [10] |
洪亮, 徐校成, 潘建虎, 等. PET-CT在原发灶不明转移癌诊断中的价值[J]. 肿瘤学杂志, 2010, 16(10): 787-790. HONG L, XU X C, PAN J H, et al. The value of PET-CT in the diagnosis for cancer of unknown primary site[J]. J Oncol, 2010, 16(10): 787-790. |
| [11] |
庄根鹰. 18F-FDG PET/CT在头颈部恶性肿瘤中的临床应用价值[D].杭州: 浙江大学, 2011. ZHUANG G Y. The clinical value of the application of 18F-FDG PET/CT in head and neck cancers[D]. Hangzhou: Zhejiang University, 2011. |
| [12] |
张倩, 李亚明, 李雪娜. 18F-FDG PET/CT显像在不明原发灶淋巴结转移癌中的应用价值[J]. 中国临床医学影像杂志, 2011, 22(6): 412-414. ZHANG Q, LI Y M, LI X N. Value of 18F-FDG PET/CT imaging in metastatic lymph node carcinoma of unknown primary site[J]. J China Clin Med Imaging, 2011, 22(6): 412-414. DOI:10.3969/j.issn.1008-1062.2011.06.009 |
| [13] |
刘红红, 兰晓莉, ANAND G, 等. 18F-FDGPET/CT对原发灶不明颈部淋巴结转移癌的诊断及预后价值[J]. 中华核医学与分子影像杂志, 2016, 36(1): 48-53. LIU H H, LAN X L, ANAND G, et al. Diagnostic and prognostic values of 18F-FDG PET/CT in cervical nodal metastatic carcinoma of unknown primary site[J]. Chin J Nucl Med, 2016, 36(1): 48-53. DOI:10.3760/cma.j.issn.2095-2848.2016.01.012 |
| [14] |
金晶, 王振光, 杨光杰, 等. 18F-FDG PET/CT在原发灶不明的颈部淋巴结转移瘤中的应用研究[J]. 医学影像学杂志, 2018, 28(10): 1638-1642. JIN J, WANG Z G, YANG G J, et al. Cervical nodal metastases from carcinoma of unknown primary: the clinical value of 18F-fluorodeoxyglucose positron emission tomography/computed tomography[J]. J Med Imaging, 2018, 28(10): 1638-1642. |
| [15] |
HU M, ZHAO W, ZHANG P L, et al. Clinical applications of 18F-fluorodeoxyglucose positron emission tomography/computed tomography in carcinoma of unknown primary[J]. Chin Med J, 2011, 124(7): 1010-1014. DOI:10.3760/cma.j.issn.0366-6999.2011.07.011 |
| [16] |
PAK K, KIM S J, KIM I J, et al. Clinical implication of 18F-FDG PET/CT in carcinoma of unknown primary[J]. Neoplasma, 2011, 58(2): 135-139. DOI:10.4149/neo_2011_02_135 |
| [17] |
RUDMIK L, LAU H Y, MATTHEWS T W, et al. Clinical utility of PET/CT in the evaluation of head and neck squamous cell carcinoma with an unknown primary: a prospective clinical trial[J]. Head Neck, 2011, 33(7): 935-940. DOI:10.1002/hed.21566 |
| [18] |
CHEN Y H, YANG X M, LI S S, et al. Value of fused positron emission tomography CT in detecting primaries in patients with primary unknown cervical lymph node metastasis[J]. J Med Imaging Radiat Oncol, 2012, 56(1): 66-74. DOI:10.1111/j.1754-9485.2011.02331.x |
| [19] |
MØLLER A K, LOFT A, BERTHELSEN A K, et al. A prospective comparison of 18F-FDG PET/CT and CT as diagnostic tools to identify the primary tumor site in patients with extracervical carcinoma of unknown primary site[J]. Oncologist, 2012, 17(9): 1146-1154. DOI:10.1634/theoncologist.2011-0449 |
| [20] |
HAN A Q, XUE J, HU M, et al. Clinical value of 18F-FDG PET-CT in detecting primary tumor for patients with carcinoma of unknown primary[J]. Cancer Epidemiol, 2012, 36(5): 470-475. DOI:10.1016/j.canep.2012.03.002 |
| [21] |
WONG W L, SONODA L I, GHARPURHY A, et al. 18F-fluorodeoxyglucose positron emission tomography/computed tomography in the assessment of occult primary head and neck cancers: an audit and review of published studies[J]. Clin Oncol, 2012, 24(3): 190-195. DOI:10.1016/j.clon.2011.11.001 |
| [22] |
WANG G H, WU Y P, ZHANG W D, et al. Clinical value of whole-body F-18 fluorodeoxyglucose positron emission tomography/computed tomography in patients with carcinoma of unknown primary[J]. J Med Imaging Radiat Oncol, 2013, 57(1): 65-71. DOI:10.1111/j.1754-9485.2012.02441.x |
| [23] |
LEE J R, KIM J S, ROH J L, et al. Detection of occult primary tumors in patients with cervical metastases of unknown primary tumors: comparison of 18F FDG PET/CT with contrast-enhanced CT or CT/MR imaging-prospective study[J]. Radiology, 2015, 274(3): 764-771. DOI:10.1148/radiol.14141073 |
| [24] |
PARK G C, ROH J L, CHO K J, et al. 18F-FDG PET/CT vs. human papillomavirus, p16 and Epstein-Barr virus detection in cervical metastatic lymph nodes for identifying primary tumors[J]. Int J Cancer, 2017, 140(6): 1405-1412. DOI:10.1002/ijc.30550 |
| [25] |
AVCI N C, HATIPOGLU F, ALACACIOGLU A, et al. FDG PET/CT and conventional imaging methods in cancer of unknown primary: an approach to overscanning[J]. Nucl Med Mol Imaging, 2018, 52(6): 438-444. DOI:10.1007/s13139-018-0544-7 |
| [26] |
LIU Y Y. FDG PET/CT for metastatic squamous cell carcinoma of unknown primary of the head and neck[J]. Oral Oncol, 2019, 92: 46-51. DOI:10.1016/j.oraloncology.2019.03.014 |
| [27] |
杨忠毅, 徐俊彦, 胡四龙. 18F-FDG PET和PET/CT显像对原发不明转移癌诊断价值的系统性综述和Meta分析[J]. 中国临床医学影像杂志, 2011, 22(5): 328-333. YANG Z Y, XU J Y, HU S L. Role of 18F-FDG PET and PET/CT in detection of unknown primary tumor: a systematic review and Meta-analysis of the literature[J]. J China Clin Med Imaging, 2011, 22(5): 328-333. DOI:10.3969/j.issn.1008-1062.2011.05.008 |
| [28] |
AGRAWAL K, GNANASEGARAN G, SKOURA E, et al. 18F-FDG PET/CT imaging: normal variants, pitfalls and artefacts[M]. Cham: Springer International Publishing, 2016: 69-93. DOI:10.1007/978-3-319-29249-6_8
|
| [29] |
罗家伦, 徐慧琴. 11C标记的放射性药物在PET/CT中的应用[J]. 安徽医学, 2009, 30(7): 728-731. LUO J L, XU H Q. Application of 11C labeled radiopharmaceuticals in PET/CT[J]. Anhui Med J, 2009, 30(7): 728-731. DOI:10.3969/j.issn.1000-0399.2009.07.010 |
| [30] |
JANSSEN I, CHEN C C, TAIEB D, et al. 68Ga-DOTATATE PET/CT in the localization of head and neck paragangliomas compared with other functional imaging modalities and CT/MRI[J]. J Nucl Med, 2016, 57(2): 186-191. DOI:10.2967/jnumed.115.161018 |
| [31] |
陈彩龙, 林美福, 陈文新, 等. 18F-FDGPET/CT在原发灶不明的转移癌患者中的诊断价值[J]. 福建医科大学学报, 2013, 47(4): 253-254, 256. CHEN C L, LIN M F, CHEN W X, et al. Diagnostic value of 18F-FDGPET/CT in patients with unknown primary metastases[J]. J Fujian Med Univ, 2013, 47(4): 253-254, 256. DOI:10.3969/j.issn.1672-4194.2013.04.019 |
| [32] |
BURGLIN S A, HESS S, HØILUND-CARLSEN P F, et al. 18F-FDG PET/CT for detection of the primary tumor in adults with extracervical metastases from cancer of unknown primary[J]. Medicine, 2017, 96(16): e6713. DOI:10.1097/md.0000000000006713 |
| [33] |
张天嵩, 钟文昭, 李博. 实用循证医学方法学[M]. 2版. 长沙: 中南大学出版社, 2014: 241-243. ZHANG T S, ZHONG W Z, LI B. Applied methodology for evidence-based medicine[M]. 2th ed. Changsha: Central South University Publishing House, 2014: 241-243. |



