肝硬化患者在肠道生态失调细菌移位[1]、肝硬化相关的免疫缺陷(cirrhosis-associated immune dysfunction,CAID)[2]以及基因易感性[3-4]等多种病理生理机制作用下很容易发生感染,而感染会使肝硬化患者病死率升高4倍,30%的患者在感染后1个月内死亡,有30%在1年内死亡[5]。自发性细菌性腹膜炎(spontaneous bacterial peritonitis,SBP)是失代偿性肝硬化伴腹水患者最常见的感染[6], 在肝硬化住院患者中占细菌感染病例的10%~30%[7],尤其是60岁以上老年人因本身免疫力低下且常常合并多种疾病,更易发生感染且预后更差,病死率更高,早期使用抗生素治疗能极大改善患者预后,但是抗生素的普遍使用,使得肝硬化患者对常用抗生素的细菌耐药性增加[8],这将进一步增加SBP的病死率。SBP患者大部分都缺乏典型的临床表现,早期不易识别,且腹水培养阳性率很低[9],血清PCT、血清CRP等常用的感染指标对SBP的诊断缺乏针对性,临床医生面临着既要充分防治SBP又要避免抗生素过度使用的挑战,这就需要探索更多的识别SBP的证据,特别是对那些年龄较大、预后较差患者的识别,从而更有针对性地使用抗生素,达到精准治疗目的,改善患者预后的同时最大限度地合理使用抗生素。
Endocan,也称内皮细胞特异性分子-1 (endothelial cell specific molecule 1,ESM-1),是由激活的内皮细胞分泌的一种可溶性的50×103的蛋白多糖[10],在调节细胞黏附、炎症和肿瘤进展方面发挥着关键作用[11],主要由促炎因子如白介素-1β (IL-1β)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和革兰阴性细菌的脂多糖(lipopolysaccharide,LPS)刺激endocan基因表达[12]。近年来研究发现菌血症患者的血清endocan水平显著高于非菌血症患者[13],脓毒血症患者血清endocan水平升高,参与了机体的自然抗炎反应,可能是脓毒症的一种新的标志物,与脓毒症的严重程度和预后有关[14-15], 目前也有研究显示血清endocan可能是失代偿性肝硬化患者发生感染的指标[16],但尚不清楚该因子在腹水中的情况,因此本研究将探索腹水中endocan水平对失代偿性肝硬化患者SBP的诊断价值。我们知道高龄SBP患者的预后会更差,而目前还没有关于不同年龄SBP患者诊断方面的报道,因此我们将同时比较腹水endocan在不同年龄段SBP患者的诊断价值。
1 对象与方法 1.1 研究对象连续纳入2018年1月至2019年6月在重庆医科大学附属第一医院住院的失代偿性肝硬化伴腹水患者。纳入标准为:年龄大于或等于18岁,根据血液生化、肝脏超声影像资料等结合临床表现,或根据肝活检时组织学标准,明确诊断肝硬化腹水的患者,且腹水可穿刺抽取。排除标准为:继发性腹膜炎、结核性腹膜炎以及其他除肝硬化外的原因所致的腹水患者;脓毒血症患者;伴有肺部、泌尿系等腹水以外部位感染的患者;近期发生过急性呼吸窘迫的患者;近期有手术史的患者。本研究符合本院伦理学标准并经本院伦理委员会批准[2019年科研伦理(2019-036号)],已征得患者的知情同意。
1.2 资料收集患者入院后立即收集患者的临床资料及实验室检查资料,包括年龄、性别、肝硬化病因、症状体征、合并疾病、血白细胞计数、血中性粒细胞百分比(N%)、血肌酐、血胆红素、血白蛋白、凝血象、血C反应蛋白(C-reactive protein,CRP)、血PCT、腹水细胞计数及腹水蛋白定量资料等,并计算出患者的MELD(model for end-stage liver disease)评分和Child-Pugh评分。
1.3 病例分组目前国际指南推荐SBP的诊断是根据腹水培养阳性或者腹水中多形核白细胞(polymor phonuclear leukocytes,PMN)的绝对数等于或大于250/mm3,并排除继发性腹膜炎、结核性腹膜炎[17, 18]。按此标准将入组的患者分为非SBP组和SBP组。
1.4 腹水收集及endocan水平测定患者入院后进行腹腔穿刺抽取腹水时,用无菌容器收集腹水约10 mL,立即到实验室以1 000×g离心20 min,取上清液分装于2毫升的冻存管,置于-80 ℃保存备用。腹水endocan浓度用酶联免疫吸附实验(Enzyme-linked immunosorbent assay,ELISA)检测[ELISA Kit for Endothelial Cell SPecific Molecule 1 (ESM1),USCN,武汉,中国]。
1.5 统计分析方法运用SPSS 24.0和MedCalc 18.9进行统计分析。用ShaPiro-Wilk检验对连续变量进行正态性检验,符合正态分布的用均值±标准差描述,组间比较采用t检验;不符合正态分布的用中位数(四分位数间距)描述,其组间比较采用秩和检验。分类变量采用例(百分数)表示,组间比较采用卡方检验。用二元logistic回归模型分析SBP的影响因素,采用接收者工作特征曲线(receiver operating characteristic curve,ROC curve)分析比较腹水endocan对SBP的诊断价值。P < 0.05为差异有统计学意义。
2 结果 2.1 患者临床基本特征共入组符合标准的肝硬化腹水患者161例,其中男性119例(占73.9%),女性42例,年龄分布在(57.98± 11.53)岁,其中年龄大于等于60岁的76例,小于60岁的85例,肝硬化病因为慢性乙型肝炎82例(占50.93%),酒精性肝病42例(占26.09%),其他病因37例(占22.98%)。按腹水培养阳性或(和)腹水PMN≥250/mm3分组,非SBP组126例,SBP组35例。两组患者年龄、性别、肝硬化病因分布均无显著差异,MELD评分和Child-Pugh评分在SBP组显著高于非SBP组(P=0.005),Child-Pugh C级例数占比在SBP组明显高于非SBP组(65.71% vs 42.06%, P=0.013)(表 1)。入组患者中,合并冠心病12例,高血压29例,肾病31例,糖尿病34例,肿瘤55例,消化道出血26例,为了解这些合并疾病是否对腹水endocan浓度有影响,分别逐一比较是否合并以上疾病患者腹水中endocan浓度,未发现显著差异(表 2)。
| 组别 | n | 年龄 | 性别 | 肝硬化病因 | Child-Pugh C级 | MELD 评分 |
Child-Pugh 评分 |
||||||
| 男 | 女 | 乙肝 | 酒精肝 | 其他 | 否 | 是 | |||||||
| 非SBP组 | 126 | 56.4±10.438 | 94(74.6%) | 32(25.4%) | 61(48.41%) | 34(26.98%) | 31(24.61%) | 73(57.94%) | 53(42.06%) | 14(10~18) | 9(8~11) | ||
| SBP组 | 35 | 58.42±11.811 | 25(71.43%) | 10(28.57%) | 21(60.00%) | 8(22.86%) | 6(17.14%) | 12(34.29%) | 23(65.71%) | 17(13~23) | 11(9~11) | ||
| χ2/Z/t | 0.917 | 0.143 | 1.564 | 6.148 | -2.782 | -2.809 | |||||||
| P | 0.36 | 0.705 | 0.457 | 0.013 | 0.005 | 0.005 | |||||||
| 因素 | n | 腹水endocan浓度/pg·mL -1 | Z | P |
| 冠心病 | ||||
| 无 | 149 | 243.736(168.9735~383.003) |
-0.811 |
0.417 |
| 有 | 12 | 202.9705(104.32925~371.1) | ||
| 高血压 | ||||
| 无 | 132 | 225.3785(152.2615~395.67625) |
-0.449 |
0.654 |
| 有 | 29 | 258.21(184.3115~324.5685) | ||
| 消化道出血 | ||||
| 无 | 135 | 229.56(167.93~398.217) |
-0.384 |
0.701 |
| 有 | 26 | 264.803(182.6925~334.44625) | ||
| 肾病 | ||||
| 无 | 130 | 241.606(147.7295~390.59475) |
-0.701 |
0.483 |
| 有 | 31 | 254.715(196.402~376.732) | ||
| 肿瘤 | ||||
| 无 | 106 | 244.2905(175.34~387.53125) |
-0.374 |
0.708 |
| 有 | 55 | 240.261(134.455~377.013) | ||
| 糖尿病 | ||||
| 无 | 127 | 229.56(137.811~398.217) |
-0.435 |
0.664 |
| 有 | 34 | 262.6735(183.54775~311.14725) | ||
2.2 SBP影响因素分析
将入组的161例患者入院时临床资料,包括年龄、性别、肝硬化病因、MELD评分、Child-Pugh评分、血中性粒细胞百分比(N%)、血CRP、血PCT及本研究所检测的腹水endocan水平等,用Logistic回归模型进行SBP的影响因素分析。单因素分析结果显示与SBP发生有关的因素有:MELD评分(粗OR=1.075,P=0.011)、Child-Pugh评分(粗OR=1.386,P=0.007)、血N%(粗OR=1.071,P=0.002)、血CRP(粗OR=1.034,P=0.001)、血PCT(粗OR=1.906,P < 0.001)、腹水endocan(粗OR=1.01,P < 0.001)。将以上筛选出的对SBP发生有显著影响的6个指标纳入多因素分析,结果显示仅腹水endocan对是否SBP有显著影响(校正OR=1.008,P < 0.001),其余指标的P值均大于0.05(表 3),因此从综合来看,腹水endocan与SBP的发生密切相关,为SBP的独立危险因素,腹水endocan浓度越高,发生SBP的可能性越大。
| 因素 | 单因素分析 | 多因素分析 | |||||||
| B | P | 粗OR | OR的95%CI | B | P | 校正OR | OR的95%CI | ||
| 年龄 | -0.015 | 0.359 | 0.985 | 0.954~1.017 | |||||
| 性别 | 0.161 | 0.705 | 1.175 | 0.509~2.711 | |||||
| 肝硬化病因 | -0.303 | 0.223 | 0.739 | 0.454~1.202 | |||||
| MELD评分 | 0.072 | 0.011 | 1.075 | 1.016~1.137 | 0.013 | 0.787 | 1.013 | 0.92~1.117 | |
| Child-Pugh评分 | 0.326 | 0.007 | 1.386 | 1.095~1.754 | 0.286 | 0.15 | 1.331 | 0.902~1.964 | |
| 血N% | 0.069 | 0.002 | 1.071 | 1.026~1.118 | 0.034 | 0.139 | 1.035 | 0.989~1.083 | |
| 血CRP | 0.033 | 0.001 | 1.034 | 1.014~1.053 | 0.018 | 0.176 | 1.019 | 0.992~1.046 | |
| 血PCT | 0.645 | < 0.001 | 1.906 | 1.35~2.691 | 0.252 | 0.146 | 1.287 | 0.916~1.808 | |
| 腹水endocan | 0.01 | < 0.001 | 1.01 | 1.006~1.013 | 0.008 | <0.001 | 1.008 | 1.004~1.012 | |
| SBP:自发性细菌性腹膜炎;N%:中性粒细胞百分比;CRP:C反应蛋白;PCT:降钙素原;MELD评分:终末期肝病模型 | |||||||||
2.3 腹水endocan对SBP的诊断价值分析
腹水endocan为发生SBP的独立危险因素,进一步用ROC曲线分析其对SBP的诊断价值,结果提示腹水endocan诊断SBP的曲线下面积(area under the cure, AUC)为0.822 (95%CI=0.747~0.897, P < 0.001,图 1),临界值为280.983pg/mL时敏感性为88.57%,特异性为70.63%。为进一步探索腹水endocan在不同年龄段患者中的诊断价值,将入组病例按年龄分为大于等于60岁组及小于60岁组,大于等于60岁组共76例,其中SBP病例17例(22.3%),小于60岁组共85例,其中SBP病例18例(21.1%),两组患者再分别进行ROC曲线分析结果提示在大于等于60岁组,腹水endocan诊断SBP的AUC为0.852(95%CI=0.747~0.957, P < 0.001, 图 2),临界值为317.371 pg/mL时敏感性为81.2%,特异性为85.0%。在小于60岁组,腹水endocan诊断SBP的AUC为0.789(95%CI=0.677~0.902, P < 0.001, 图 3),临界值为290.203 pg/mL时敏感性为89.47%,特异性为69.7%。可见腹水endocan在大于等于60岁患者中诊断SBP的准确度更高。
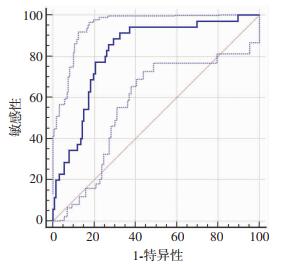
|
| 图 1 腹水中endocan对SBP的诊断价值 |
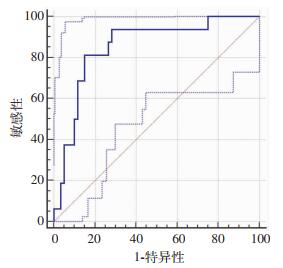
|
| 图 2 腹水endocan在年龄大于等于60岁患者中诊断SBP的ROC分析 |
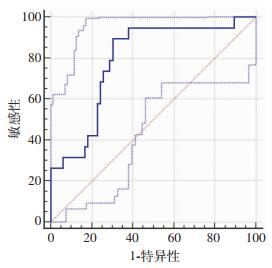
|
| 图 3 腹水endocan在年龄小于60岁患者中诊断SBP的ROC分析 |
3 讨论
Endocan是激活的内皮细胞分泌的一种糖蛋白,是脓毒症的一种新的标志物,反映了内皮细胞活化和损伤的程度,参与了机体的自然抗炎反应[14]。本研究探讨了肝硬化失代偿患者腹水中endocan浓度是否与SBP的发生有关以及其对SBP的诊断价值。
研究结果显示失代偿肝硬化患者MELD评分和Child-Pugh评分、血CRP、血PCT、血N%均与SBP的发生有显著关系。患者MELD评分和Child-Pugh评分为SBP的危险因素,SBP组Child-Pugh C级例数占比明显高于非SBP组(65.71% vs 42.06%, P=0.013),这提示肝硬化患者肝病程度越重发生SBP的可能性越大,这与SCHWABL等[19]的研究结论一致。腹水endocan水平在SBP组显著高于非SBP组(P < 0.001),亦为SBP的危险因素,而将这些对SBP有显著影响的因素纳入logistic回归模型多因素分析结果显示只有腹水endocan是SBP的独立危险因素,其浓度越高,则为SBP的可能性越大。血CRP、血PCT、血N%均为临床最常用的感染指标,对SBP有一定诊断价值, 但他们均为通用的感染指标,对SBP的诊断无针对性,在用这些指标诊断SBP时需要排除患者的其他部位感染,而临床实践中失代偿肝硬化患者往往不只有一个部位感染,常常会有泌尿道、呼吸道、皮肤软组织、腹膜腔等多个部位感染且往往症状不明显,此时血CRP、血PCT、血N%的浓度变化对SBP的诊断就有一定局限性。将多个指标综合来看,本研究得出腹水endocan为SBP的独立危险因素,由此我们推测腹水endocan对SBP的诊断可能会更有针对性,便于分辨失代偿肝硬化伴感染患者的感染部位,以精准治疗,针对性选择抗生素,本课题组将会对此进一步研究验证。
ROC曲线分析显示腹水endocan诊断SBP的曲线下面积(AUC)为0.822(95%CI=0.747~0.897,P < 0.001),临界值为280.983 pg/mL时敏感性为88.57%,特异性为70.63%,可见腹水endocan水平对肝硬化腹水患者SBP诊断准确度、敏感性较高,有较好的诊断价值。SBP为肝硬化失代偿患者最常见的感染,特别是年龄较大的患者其预后更差、病死率更高,本研究得出在大于等于60岁和小于60岁两组患者中,腹水endocan诊断SBP的ROC曲线AUC分别为0.852(95%CI=0.747~0.957, P < 0.001)和0.789(95%CI=0.677~0.902, P < 0.001),可见腹水endocan在大于等于60岁的失代偿肝硬化患者中诊断准确度更高,价值更大,这为预后更差的60岁以上失代偿性肝硬化SBP患者的精准诊断和治疗提供了新的依据,利于更合理使用抗生素,更大限度的改善高龄患者的预后。
近年来关于SBP诊断的研究较多,比如腹水钙卫蛋白测定[20]、腹水乳铁蛋白测定[21]、聚合酶链式反应(polymerase chain reaction, PCR)法检测腹水中细菌DNA[22]、腹水白细胞酯酶条带试纸[23]等,目前国际公认的诊断SBP的方法是腹水培养和腹水PMN计数[17-18],但是因为腹水中细菌含量极少,加上大量腹水的稀释作用,使得腹水培养的阳性率很低[24],目前国际上推荐诊断SBP主要基于腹水PMN计数。有研究提示腹水在运送至实验室过程中可能会发生裂解导致假阴性结果,PMN计数主要依靠人工细胞计数,其质量控制不好把握[25-26],这也是本研究SBP组病例数较少的一个原因,现迫切需要探索更敏感的、易于操作的指标来识别SBP。我国相关指南明确提出,进一步探索敏感性和特异性更高的腹水感染早期快速诊断方法及病原菌检测方法是目前需要解决的重要问题[27]。本研究Endocan是一种稳定的糖蛋白,endocan浓度是稳定、准确、可靠的[28],且采用ELISA方法测量,耗时少、易操作,结果客观可靠,是一个值得推荐的备选指标。
Endocan可反映内皮细胞活化和损伤的程度,也是血管生成的标志物,在糖尿病、肾病、冠心病、高血压患者的病理过程及多种肿瘤的发展中有一定作用[14, 29],而在本研究所入组患者中,分别逐一比较了是否合并以上疾病患者腹水中endocan浓度,未发现显著差异,表明以上合并疾病对腹水中endocan浓度无显著影响,这可能是因为endocan反映内皮细胞活化和损伤的程度,而这些合并疾病都与血管内皮损伤和血管生成有关,其差异表现于血液中而非腹水中。
本研究不足之处一是SBP组患者例数较少,但是按统计学方法进行样本量估计后表明现有样本量及样本的组间比例符合统计学要求。二是没能同时收集到患者入院时的血液标本,endocan在血清和腹水中的水平不能做对比分析,虽然没有收集到患者的血清标本,但近年有研究表明肝硬化伴感染(包括SBP、肺感染、泌尿系感染、皮肤软组织感染等)的患者血清中endocan水平较不伴有感染的患者会显著升高[16],参照该研究结论,同腹水endocan一样,SBP患者血清endocan浓度较非SBP患者会显著升高。本课题组将进一步增加样本量,同时收集患者的腹水及血清标本,研究endocan浓度随着抗生素使用及SBP好转后的变化情况,进一步探索endocan对SBP患者识别及预后判断等价值。
综上,本研究结果显示腹水中endocan是失代偿性肝硬化腹水患者发生SBP的独立危险因素,对SBP有较好的诊断价值,特别是对年龄大于等于60岁的失代偿性肝硬化患者的诊断价值更大,准确度更高。这给临床早期识别SBP及合理使用抗生素精准治疗SBP方面带来一些新的思路。
| [1] |
TSIAOUSSIS G I, ASSIMAKOPOULOS S F, TSAMANDAS A C, et al. Intestinal barrier dysfunction in cirrhosis: Current concepts in pathophysiology and clinical implications[J]. World J Hepatol, 2015, 7(17): 2058-2068. DOI:10.4254/wjh.v7.i17.2058 |
| [2] |
SIPEKI N. Immune dysfunction in cirrhosis[J]. World J Gastroenterol, 2014, 20(10): 2564. DOI:10.3748/wjg.v20.i10.2564 |
| [3] |
APPENRODT B, GRVNHAGE F, GENTEMANN M G, et al. Nucleotide-binding oligomerization domain containing 2 (NOD2) variants are genetic risk factors for death and spontaneous bacterial peritonitis in liver cirrhosis[J]. Hepatology, 2010, 51(4): 1327-1333. DOI:10.1002/hep.23440 |
| [4] |
MAI M, STENGEL S, AL-HERWI E, et al. Genetic variants of TRAF6 modulate peritoneal immunity and the risk of spontaneous bacterial peritonitis in cirrhosis: a combined prospective-retrospective study[J]. Sci Rep, 2017, 7(1): 4914. DOI:10.1038/s41598-017-04895-z |
| [5] |
ARVANITI V, D'AMICO G, FEDE G, et al. Infections in patients with cirrhosis increase mortality four-fold and should be used in determining prognosis[J]. Gastroenterology, 2010, 139(4): 1246-1256, 1256.e1-5. DOI: 10.1053/j.gastro.2010.06.019.
|
| [6] |
SINGAL A K, SALAMEH H, KAMATH P S. Prevalence and in-hospital mortality trends of infections among patients with cirrhosis: a nationwide study of hospitalised patients in the United States[J]. Aliment Pharmacol Ther, 2014, 40(1): 105-112. DOI:10.1111/apt.12797 |
| [7] |
WIEST R, KRAG A, GERBES A. Spontaneous bacterial peritonitis: recent guidelines and beyond[J]. Gut, 2012, 61(2): 297-310. DOI:10.1136/gutjnl-2011-300779 |
| [8] |
FERNÁNDEZ J, ACEVEDO J, CASTRO M, et al. Prevalence and risk factors of infections by multiresistant bacteria in cirrhosis: a prospective study[J]. Hepatology, 2012, 55(5): 1551-1561. DOI:10.1002/hep.25532 |
| [9] |
BIECKER E. Diagnosis and therapy of ascites in liver cirrhosis[J]. World J Gastroenterol, 2011, 17(10): 1237. DOI:10.3748/wjg.v17.i10.1237 |
| [10] |
BÉCHARD D, SCHERPEREEL A, HAMMAD H, et al. Human endothelial-cell specific molecule-1 binds directly to the integrin CD11a/CD18 (LFA-1) and blocks binding to intercellular adhesion molecule-1[J]. J Immunol, 2001, 167(6): 3099-3106. DOI:10.4049/jimmunol.167.6.3099 |
| [11] |
KALI A, SHETTY K S. Endocan: a novel circulating proteoglycan[J]. Indian J Pharmacol, 2014, 46(6): 579-583. DOI:10.4103/0253-7613.144891 |
| [12] |
LASSALLE P, MOLET S, JANIN A, et al. ESM-1 is a novel human endothelial cell-specific molecule expressed in lung and regulated by cytokines[J]. J Biol Chem, 1996, 271(34): 20458-20464. DOI:10.1074/jbc.271.34.20458 |
| [13] |
SEO K, KITAZAWA T, YOSHINO Y, et al. Characteristics of serum endocan levels in infection[J]. PLoS ONE, 2015, 10(4): e0123358. DOI:10.1371/journal.pone.0123358 |
| [14] |
SCHERPEREEL A, DEPONTIEU F, GRIGORIU B, et al. Endocan, a new endothelial marker in human sepsis[J]. Crit Care Med, 2006, 34(2): 532-537. DOI:10.1097/01.ccm.0000198525.82124.74 |
| [15] |
HSIAO S Y, KUNG C T, TSAI N W, et al. Concentration and value of endocan on outcome in adult patients after severe sepsis[J]. Clin Chim Acta, 2018, 483: 275-280. DOI:10.1016/j.cca.2018.05.007 |
| [16] |
ZUWALA-JAGIELLO J, SIMON K, KUKLA M, et al. Increased circulating endocan in patients with cirrhosis: relation to bacterial infection and severity of disease[J]. J Physiol Pharmacol, 2017, 68(2): 273-282. |
| [17] |
European Association for the Study of the Liver. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis[J]. J Hepatol, 2010, 53(3): 397-417. DOI:10.1016/j.jhep.2010.05.004 |
| [18] |
PLEGUEZUELO M, BENITEZ J M, JURADO J, et al. Diagnosis and management of bacterial infections in decompensated cirrhosis[J]. World J Hepatol, 2013, 5(1): 16-25. DOI:10.4254/wjh.v5.i1.16 |
| [19] |
SCHWABL P, BUCSICS T, SOUCEK K, et al. Risk factors for development of spontaneous bacterial peritonitis and subsequent mortality in cirrhotic patients with ascites[J]. Liver Int, 2015, 35(9): 2121-2128. DOI:10.1111/liv.12795 |
| [20] |
BURRI E, SCHULTE F, MUSER J, et al. Measurement of calprotectin in ascitic fluid to identify elevated polymorphonuclear cell count[J]. World J Gastroenterol, 2013, 19(13): 2028-2036. DOI:10.3748/wjg.v19.i13.2028 |
| [21] |
PARSI M A, SAADEH S N, ZEIN N N, et al. Ascitic fluid lactoferrin for diagnosis of spontaneous bacterial peritonitis[J]. Gastroenterology, 2008, 135(3): 803-807. DOI:10.1053/j.gastro.2008.05.045 |
| [22] |
潘红英, 孙洪运, 谌翠容, 等. 16S rRNA基因检测在自发性细菌性腹膜炎快速诊断中的应用[J]. 中国医学科学院学报, 2010, 32(05): 85-88. PAN H Y, SUN H Y, CHEN C R, et al. Determination of ascitic bacterial 16S rRNA gene in the rapid diagnosis of spontaneous bacterial peritonitis[J]. Acta Acad Med Sin, 2010, 32(5): 557-560. DOI:10.3881/j.issn.1000-503X.2010.05.017 |
| [23] |
MENDLER M H, AGARWAL A, TRIMZI M, et al. A new highly sensitive point of care screen for spontaneous bacterial peritonitis using the leukocyte esterase method[J]. J Hepatol, 2010, 53(3): 477-483. DOI:10.1016/j.jhep.2010.04.011 |
| [24] |
BOARETTI M, CASTELLANI F, MERLI M, et al. Presence of multiple bacterial markers in clinical samples might be useful for presumptive diagnosis of infection in cirrhotic patients with culture-negative reports[J]. Eur J Clin Microbiol Infect Dis, 2016, 35(3): 433-441. DOI:10.1007/s10096-015-2556-x |
| [25] |
RUNYON B A. Strips and tubes: improving the diagnosis of spontaneous bacterial peritonitis[J]. Hepatology, 2003, 37(4): 745-747. DOI:10.1053/jhep.2003.50178 |
| [26] |
RUNYON B A. The evolution of ascitic fluid analysis in the diagnosis of spontaneous bacterial peritonitis[J]. Am J Gastroenterol, 2003, 98(8): 1675-1677. DOI:10.1111/j.1572-0241.2003.07600.x |
| [27] |
Chinese Society of Hepatology of Chinese Medical Association, XU X Y, DUAN Z P, et al. Chinese guidelines on the management of ascites and its related complications in cirrhosis[J]. Hepatol Int, 2019, 13(1): 1-21. DOI:10.1007/s12072-018-09923-2 |
| [28] |
GAUDET A, CHENEVIER-GOBEAUX C, PARMENTIER E, et al. Endocan is a stable circulating molecule in ICU patients[J]. Clin Biochem, 2017, 50(15): 870-877. DOI:10.1016/j.clinbiochem.2017.04.011 |
| [29] |
AFSAR B, TAKIR M, KOSTEK O, et al. Endocan: a new molecule playing a role in the development of hypertension and chronic kidney disease?[J]. J Clin Hypertens (Greenwich), 2014, 16(12): 914-916. DOI:10.1111/jch.12440 |



