2. 400016 重庆, 重庆医科大学附属第一医院肝胆外科
2. Department of Hepatobillary Surgery, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
肝细胞癌(hepatocellular carcinoma,HCC)因高发病率和高死亡率而成为全世界十大癌症之一[1]。多年来,随着化疗手段和手术技巧的不断提高,肝癌患者的生命周期得到了大大延长[2-4]。尽管如此,仍然有许多问题亟待解决,例如肝癌转移和复发的高发生率。虽然已研究了几种HCC生物标志物,但是这些标记物的预测能力并不是最佳的。因此,鉴定新肿瘤生物标志物,揭示肝癌转移的机制,制定更有效的预防肝癌转移的策略显得更加重要。
泛素样含PHD和环指域蛋白2(ubiquitin-like with PHD and ring finger domain 2,UHRF2)是新发现的E3泛素蛋白连接酶,是UHRF家族的重要成员,由UBL(ubiquitin-like domain)、TTD(tandem tudor domain)、PHD(plant homeodomain finger domain)、SRA(set-and ring-associated domain)和RING指结构域(RING finger domain)组成[5-7]。越来越多的证据表明,UHRF2与多种癌症的发生、发展有关。有研究发现,UHRF2通过修饰DNA甲基化来影响组蛋白进而促进乳腺癌的发生[8];UHRF2与转录因子E2F1相互作用可以诱导肺癌细胞的凋亡[9];UHRF2通过稳定乙酰转移酶TIP60调节组蛋白H3第9位和14位赖氨酸乙酰化来促进肝癌细胞的发展[10]。
目前,虽然UHRF2对HCC的影响已有报道,但其在HCC中的作用及机制尚不清楚。因此,本研究通过分析UHRF2在HCC中的表达,从磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号通路方面探讨UHRF2促进HCC增殖和转移的机制,旨在为研究HCC的发病机制、治疗和预测等提供新的理论基础。
1 材料与方法 1.1 材料 1.1.1 UHRF2相关数据UHRF2的mRNA及相关临床数据来自the Cancer Genome Atlas (TCGA)(http://tcga-data.nci.nih.gov/tcga/)数据库。
1.1.2 HCC组织及癌旁组织来自重庆医科大学附属第一医院2018年7月至2019年12月接受HCC切除手术的20例患者病理组织样本。获得的临床组织标本经病理学确诊,在患者手术过程中切除的每例组织标本立即冷冻并保存在液氮罐中以备后用。本研究符合医学伦理规定,经重庆医科大学伦理委员会批准(2018027),所有患者签署知情同意书。
1.1.3 细胞及质粒HCC细胞系HepG2和HepG2.2.15均为重庆医科大学感染病生物医学教育部重点实验室保存。pCDNA3.1-3×Flag-UHRF2和空载vector-pCDNA3.1-3×Flag质粒购自武汉金开瑞生物技术有限公司。
1.1.4 主要试剂转染试剂LipofectamineTM 2000和质粒小提试剂盒购自美国Invitrogen公司,DMEM(高糖)培养基和胎牛血清购自美国HyClone公司,结晶紫染料购自美国Thermo Pierce公司,PMSF、RIPA强裂解液、SDS-PAGE凝胶配制试剂盒、免疫组化S-P试剂盒均购自碧云天生物公司,多聚甲醛购自上海生工生物公司,TRIzol、逆转录试剂盒和SYBR Green试剂购自TaKaRa公司。抗体:UHRF2抗体、Akt抗体、p-Akt抗体、PI3K抗体、p-PI3K抗体均购自美国Abcam公司,β-actin抗体购自碧云天生物公司,山羊抗兔二抗、山羊抗小鼠二抗均购自北京中杉金桥生物科技公司。
1.2 方法 1.2.1 生物信息学分析TCGA (the Cancer Genome Atlas)数据库下载424例(正常标本50例,癌标本374例)组织标本的基因表达谱和临床病理资料。利用limma软件包对下载的mRNA level 3的FPKM数据进行整合和标准化,分析差异表达基因及其表达水平,差异基因筛选条件为|LogFC|>1或P < 0.05。使用“survival”和“survminer”软件包对单基因进行生存分析,根据基因表达水平的中位值分组,绘制生存曲线。最佳生存截点分析通过遍历所有分组情况,计算P值和风险比。以UHRF2表达水平的中位数为临界值,将数据集中包含的HCC患者,分为URHF2高表达组与低表达组,进行GSEA富集分析,观察各通路的富集情况。
1.2.2 免疫组化检测采用免疫组织化学分析20例HCC病理组织中UHRF2的表达。根据标准程序,将组织样品固定在4%的多聚甲醛中,组织切片在65 ℃烤箱中熔蜡2 h,二甲苯脱蜡2次,在100%、95%、80%、70%的酒精中水化,100 ℃,121 kPa的条件下用柠檬酸钠缓冲液进行抗原修复20 min,H2O2阻断内源性过氧化物酶活性,用组化笔在组织周围画圈,组织上滴加山羊血清封闭2 h,UHRF2抗体(1 :200)孵育过夜,次日用山羊抗兔二抗孵育,快速滴入DAB进行显色,观察并随时终止显色,复染,脱水,透明后封片。
1.2.3 RT-qPCR检测用TRIzol试剂提取细胞总RNA,按照Primer-ScriptTM说明书逆转录成cDNA。根据Taq PCR Master Mix试剂盒说明书,以cDNA作为模版,在iQTM SYBR Green Supermix PCR体系中进行RT-qPCR反应,体系为10 μL。PCR反应程序为:95 ℃预变性3 min,95 ℃变性10 s,55 ℃退火30 s,72 ℃延伸60 s,共39个循环,选用2-ΔΔCt法分析UHRF2的相对定量数据。引物序列,UHRF2上游:5′-CAAGATGTGGATACAGGTTCGC-3′,下游:5′-TATCCATTTTCCAACTGCTTGCC-3′;GADPH上游:5′-GCTGTCCCTGTACGCCTCTG-3′,下游:5′-TGCCGATGGTGATGACCTGG-3′。每个检测指标设置3个复孔。
1.2.4 Western blot检测收获各组细胞,加入适量的RIPA强裂解液,低温超声,4 ℃离心提取总蛋白,用BCA试剂盒检测浓度。将蛋白与5×loading buffer以4 :1的比例混匀,100 ℃变性5 min,瞬时离心后,取适量样品进行10% SDS-PAGE电泳,电泳结束后电转至PVDF膜上,用TBST稀释的5%脱脂牛奶封闭膜2 h,一抗与条带在4 ℃冰箱摇床孵育过夜,TBST洗3次,二抗孵育2 h,TBST漂洗3次。在条带上滴加适量配制好的发光液,LAS-4000成像系统进行显影,分析结果。
1.2.5 细胞划痕实验接种细胞前,在6孔板底部均匀地画3条横线。细胞接种至6孔板中,待细胞达到合适的汇合度时用200 μL的枪头垂直划线,使所画的线与6孔板上记号笔画的线相互垂直。PBS洗2次,每孔添加2 mL无血清培养基;于0、12、24、48 h观察拍照。
1.2.6 平板克隆实验0.25%的胰酶消化对数生长期细胞,进行细胞计数,在6孔板每孔中接种1 000个细胞。每隔1周换1次新鲜培养基。培养3周后,小心地将6孔板中的培养基吸弃。PBS洗涤3次,1 mL甲醇固定细胞15 min,结晶紫染色,PBS洗涤,拍照计数。
1.3 统计学分析TCGA数据采用R语言(version 3.6)进行分析,其他数据采用SPSS 19.0统计软件进行分析,GraphPad Prism 5.0软件作图。数据以x±s表示,采用t检验、χ2检验,Cox风险回归模型进行生存相关的多因素分析,并筛选独立预后因素。P < 0.05为差异具有统计学意义,每项实验均独立重复至少3次。
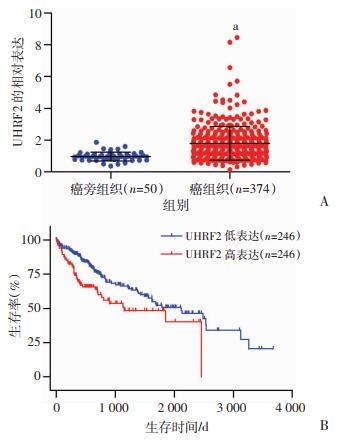
2 结果 2.1 TCGA数据库中UHRF2在HCC组织的表达水平及预后情况通过从TCGA数据库中下载HCC的基因表达谱数据和患者的临床数据,分析UHRF2的表达差异与HCC患者的预后情况。结果发现,比对50例癌旁组织和374例HCC组织,UHRF2 mRNA表达水平在HCC中显著上调(P < 0.0001,图 1A);生存分析结果显示,在UHRF2高表达组中,HCC患者的预后更差(P= 0.002,图 1B)。整理患者的临床数据,多因素Cox回归分析结果显示,UHRF2表达(风险比=1.24,P=0.035)是影响患者预后的独立危险因素(表 1),提示UHRF2可能作为一个促进HCC发生发展的相关因素。
|
| A:UHRF2在癌旁组织和HCC组织中的表达;B:UHRF2与HCC患者总体生存期相关性;a:P < 0.0001,与癌旁组织比较;b:P= 0.002,与UHRF2低表达患者比较 图 1 TCGA数据库中UHRF2的表达情况 |
| 变量 | 危险比 | 95%置信区间 | P值 |
| 年龄 | 1.01 | 0.99-1.0 | 0.268 |
| 性别 | 1.09 | 0.65-1.8 | 0.734 |
| 病理分级 | 1.11 | 0.79-1.5 | 0.556 |
| 临床分期 | 1.20 | 0.44-3.3 | 0.724 |
| 肿瘤大小 | 1.50 | 0.59-3.8 | 0.391 |
| 肿瘤转移 | 1.52 | 0.40-5.8 | 0.540 |
| 淋巴结转移 | 0.99 | 0.15-6.4 | 0.998 |
| UHRF2表达 | 1.24 | 1.02-1.5 | 0.035 |
2.2 UHRF2在20例临床组织样本及HCC细胞系中的表达
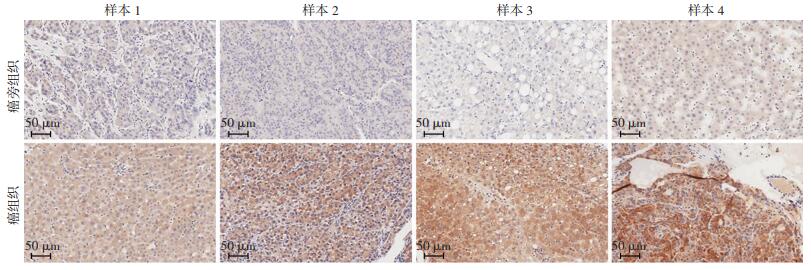
免疫组化检测20例被确诊为HCC患者的临床组织样本中URHF2蛋白的表达,结果显示,HCC组织中URHF2的表达明显高于癌旁组织(图 2)。随后,分析UHRF2蛋白表达水平与患者临床参数之间的关系。统计结果显示,UHRF2的表达与HCC患者的转移(P=0.002)与肿瘤大小(P=0.002)有关,而UHRF2表达与HCC患者年龄、性别、AFP、HBsAg、肝硬化、临床分期、血管侵犯无关(P>0.05,表 2)。相比肿瘤体积较小(≤5 cm)或不转移的HCC患者,UHRF2蛋白在肿瘤体积较大(>5 cm)或转移患者中的表达明显升高(P=0.002)。
|
| 图 2 免疫组化分析UHRF2在癌旁组织和HCC组织中的表达 |
| 临床参数 | 总例数 | UHRF2表达/例 | χ2值 | P值 | |
| 低(n=8) | 高(n=12) | ||||
| 年龄/岁 | 0.159 | 0.690 | |||
| <51 | 6 | 2 | 4 | ||
| ≥51 | 14 | 6 | 8 | ||
| 性别 | 0.065 | 0.798 | |||
| 女性 | 3 | 1 | 2 | ||
| 男性 | 17 | 7 | 10 | ||
| 肿瘤大小/cm | 9.731 | 0.002 | |||
| ≤5 | 9 | 7 | 2 | ||
| >5 | 11 | 1 | 10 | ||
| AFP/ng·mL-1 | 0.135 | 0.714 | |||
| ≤20 | 9 | 4 | 5 | ||
| >20 | 11 | 4 | 7 | ||
| HBsAg | 0.065 | 0.798 | |||
| 阴性 | 3 | 1 | 2 | ||
| 阳性 | 17 | 7 | 10 | ||
| 肝硬化 | 0.556 | 0.456 | |||
| 有 | 12 | 4 | 8 | ||
| 无 | 8 | 4 | 4 | ||
| 临床分期 | 0.000 | 1 | |||
| Ⅰ/Ⅱ | 10 | 4 | 6 | ||
| Ⅲ/Ⅳ | 10 | 4 | 6 | ||
| 肿瘤转移 | 9.731 | 0.002 | |||
| 有转移 | 11 | 1 | 2 | ||
| 无转移 | 9 | 7 | 10 | ||
| 血管侵犯 | 0.093 | 0.761 | |||
| 有 | 2 | 1 | 1 | ||
| 无 | 18 | 7 | 11 | ||
2.3 UHRF2对HepG2和HepG2.2.15细胞迁移和增殖的影响
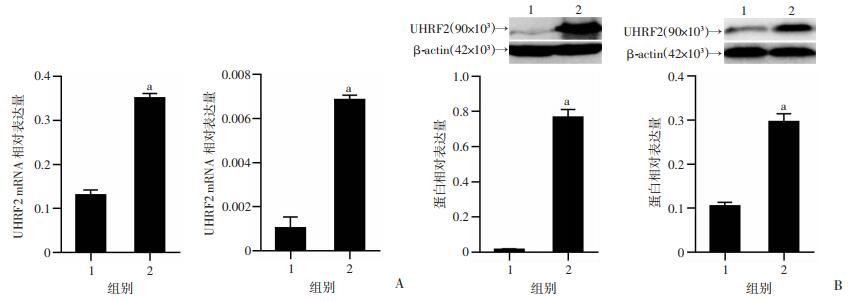
构建UHRF2的表达质粒,将表达质粒转染到HCC细胞系HepG2和HepG2.2.15中,通过RT-qPCR和Western blot分别检测两种细胞系中UHRF2的过表达效率。结果显示,与空载体组比较,HepG2和HepG2.2.15中UHRF2 mRNA和蛋白表达水平均显著升高(P < 0.01,图 3)。
|
| 1:pCDNA3.1-3×Flag空载体组;2:pCDNA3.1-3×Flag-UHRF2载体组;a:P < 0.01,与空载体组比较A:HepG2(左)和HepG2.2.15(右)细胞中UHRF2 mRNA表达;B:HepG2(左)和HepG2.2.15(右)细胞中UHRF2蛋白表达 图 3 RT-qPCR和Western blot检测UHRF2在HCC细胞系的过表达情况 |
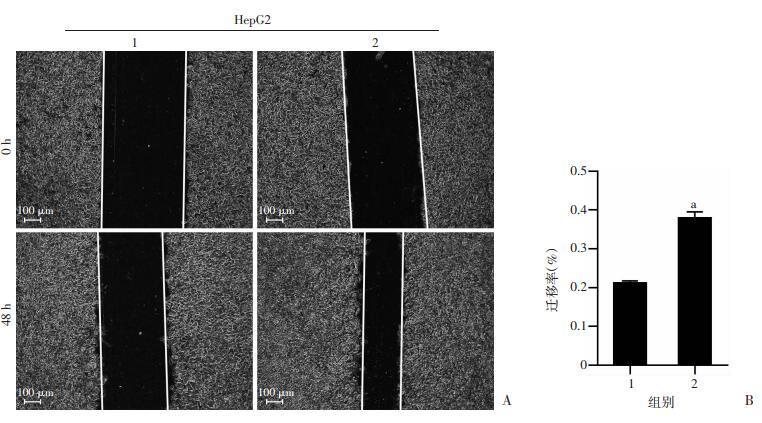
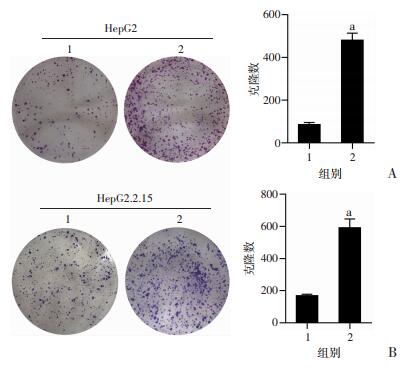
为了验证UHRF2是否参与了HCC的增殖和转移,将空载体与UHRF2的表达质粒分别转染到两种HCC细胞系中进行细胞划痕实验和平板克隆实验,结果显示,过表达UHRF2可显著促进HCC细胞HepG2和HepG2.2.15的迁移(P < 0.01,图 4、5)和增殖(P < 0.01,图 6)。
|
| 1:pCDNA3.1-3×Flag空载体组;2:pCDNA3.1-3×Flag-UHRF2载体组;a:P < 0.01,与空载体组比较 图 4 划痕实验(A)观察HepG2细胞的迁移及其定量分析(B) |

|
| 1:pCDNA3.1-3×Flag空载体组;2:pCDNA3.1-3×Flag-UHRF2载体组;a:P < 0.01,与空载体组比较 图 5 划痕实验(A)观察HepG2.2.15细胞的迁移及其定量分析(B) |
|
| 1:pCDNA3.1-3×Flag空载体组;2:pCDNA3.1-3×Flag-UHRF2载体组;a:P < 0.01,与空载体组比较 图 6 平板克隆增殖实验观察HepG2细胞(A)和HepG2.2.15细胞(B)的增殖 |
2.4 UHRF2过表达对PI3K/Akt信号通路相关蛋白的影响
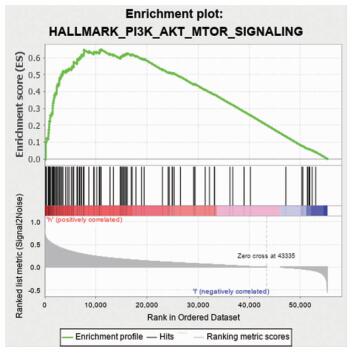
为了进一步研究UHRF2是通过何种机制来影响HCC的增殖和转移,通过GSEA基因富集分析,结果显示:高表达UHRF2的HCC患者中,基因集HALLMARK—PI3K—AKT—MTOR—SIGNALING显著富集。其中ENS=2.0267,NOM P=0,FOR q=0.0006(图 7)。
|
| 图 7 基于UHRF2表达差异的GSEA分析 |
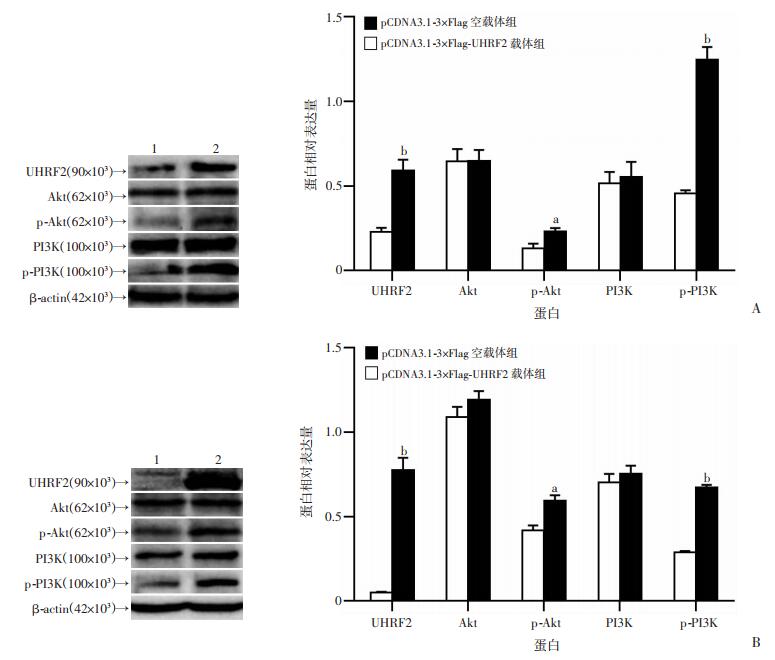
Western blot检测PI3K、Akt、p-PI3K、p-Akt的表达水平。与对照组比较,过表达组的p-PI3K、p-Akt水平显著上调(P < 0.05,图 8),提示UHRF2可以激活PI3K和Akt蛋白,说明UHRF2可能通过PI3K/Akt信号途径来调节HCC细胞的迁移和增殖。
|
| 1:pCDNA3.1-3×Flag空载体组;2:pCDNA3.1-3×Flag-UHRF2载体组;a:P < 0.05,b:P < 0.01,与空载体组比较 图 8 Western blot检测在HepG2细胞(A)和HepG2.2.15细胞(B)中UHRF2过表达对PI3K、Akt及其磷酸化蛋白的影响 |
3 讨论
作为E3泛素连接酶,UHRF2的功能解释经历了一个复杂而漫长的过程。UHRF2参与调控细胞周期、表观遗传系统,影响基因在分化和发育中的表达[11]。UHRF2能与DNA甲基转移酶和组蛋白甲基转移酶结合,调控DNA和组蛋白的甲基化状态[8]。它能调节组蛋白翻译后修饰,包括H3K9ac和H3K14ac,诱导肿瘤的发生[10]。同时,发现UHRF2与乙型肝炎病毒核心蛋白相互作用后可以下调乙型肝炎病毒cccDNA的甲基化[12]。UHRF2通过其RING指结构域泛素化P21进而促进DNA的损伤[13]。多项研究表明,UHRF2在不同癌症中的表达有所不同,甚至出现完全相反的结果。例如,UHRF2在非小细胞肺癌、食管鳞癌、脑和中枢神经系统癌中下调,在结直肠癌、乳腺癌和肝内胆管癌中上调[6, 14-16]。虽然很多研究报道了UHRF2与癌症之间的关系,但是UHRF2在癌症发展中的具体机制作用尚不清楚,尤其是UHRF2在HCC的机制还未有报道。本研究结果显示,与癌旁组织相比,UHRF2基因在HCC组织中显著升高,提示UHRF2可能参与了HCC的发生和发展。
本研究通过TCGA公共数据库挖掘得知UHRF2在HCC组织中高表达,重要的是,UHRF2的高表达提示HCC患者的预后较差,Cox多因素回归分析显示,UHRF2的表达是影响HCC患者预后的独立危险因素。同时,对20例HCC患者的临床组织样本进行免疫组化,结合患者相关临床参数分析,发现UHRF2的表达水平与HCC患者的肿瘤大小与肿瘤转移密切相关。这表明UHRF2在肝癌的发生、发展中是一个促癌基因,同时其极有可能参与HCC的增殖和转移。为了证实我们的猜想,表型研究在HCC细胞系中过表达UHRF2,进行细胞的划痕和平板克隆实验,结果显示,UHRF2的确可以明显促进HCC细胞的增殖和迁移。
在癌症发生、发展的各个阶段,癌细胞的迁移和增殖都被认为是肿瘤发生的重要原因,而对细胞迁移和增殖的分子机制进行深入研究可以为癌症的临床治疗奠定基础。PI3K/Akt、Akt/mTOR、Wnt /β-catenin和ERK / JNK信号通路对细胞增殖、分化、侵袭、迁移和凋亡有着非常重要的作用,同时也有证据表明这些通路与HCC的发展存在潜在的关系[17-21]。例如,Akt/mTOR信号通路对细胞增殖、凋亡和肝脏再生中有非常重要的作用,EGF可通过Akt磷酸化促进肝细胞的增殖[22]。也有研究发现,Akt是肝癌发生、发展的重要分子,Akt的激活能促进肝癌细胞的增殖,抑制Akt信号通路的激活,就可抑制肿瘤的增殖和生长[18]。PI3K是一种细胞内磷脂酰肌醇激酶。研究表明,PI3K在细胞增殖、分化及迁移的过程中发挥关键作用,其活性的提高与恶性肿瘤的发生密切相关[22]。这意味着可以通过降低PI3K和Akt的磷酸化水平来抑制癌细胞的增殖,抑制Akt相关信号通路被认为可以有效地进行癌症的治疗。本研究显示,UHRF2与HCC的迁移和增殖表型有关,深入探讨其机制,发现过表达UHRF2能够上调下游蛋白PI3K和Akt蛋白的磷酸化水平。也就是说UHRF2可以促进PI3K/Akt信号通路的激活,是UHRF2对HCC细胞HepG2和HepG2.2.15迁移和增殖发挥促进作用的途径。但是,UHRF2是通过何种蛋白对PI3K/Akt信号通路进行调节,UHRF2是否还可以影响HCC的其他恶性表型指标等问题还需要进一步研究。
综上所述,本研究探讨UHRF2在HCC中的表达及临床意义,证实了UHRF2在HCC中的高表达,并且与HCC患者的不良预后紧密相关,其可能是激活PI3K/Akt信号途径影响HCC细胞系的迁移和增殖能力。这对HCC患者的预后具有指导意义,同时也为其作为HCC新的诊断标志物和治疗靶点提供了新的思路。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
HAN L L. Implications of biomarkers in human hepatocellular carcinoma pathogenesis and therapy[J]. World J Gastroenterol, 2014, 20(30): 10249-10261. DOI:10.3748/wjg.v20.i30.10249 |
| [3] |
KAMP W M, SELLERS C M, STEIN S, et al. Impact of direct acting antivirals on survival in patients with chronic hepatitis C and hepatocellular carcinoma[J]. Sci Rep, 2019, 9(1): 1-8. DOI:10.1038/s41598-019-53051-2 |
| [4] |
OSAKI Y, NISHIKAWA H. Treatment for hepatocellular carcinoma in Japan over the last three decades: Our experience and published work review[J]. Hepatol Res, 2015, 45(1): 59-74. DOI:10.1111/hepr.12378 |
| [5] |
SANCHEZ-FERNANDEZ C, LORDA-DIEZ C I, GARCÍA-PORRERO J A, et al. UHRF genes regulate programmed interdigital tissue regression and chondrogenesis in the embryonic limb[J]. Cell Death Dis, 2019, 10(5): 347. DOI:10.1038/s41419-019-1575-4 |
| [6] |
WANG F, ZHANG P, MA Y L, et al. NIRF is frequently upregulated in colorectal cancer and its oncogenicity can be suppressed by let-7a microRNA[J]. Cancer Lett, 2012, 314(2): 223-231. DOI:10.1016/j.canlet.2011.09.033 |
| [7] |
CHEN X R, SUN S C, TENG S W, et al. Uhrf2 deletion impairs the formation of hippocampus-dependent memory by changing the structure of the dentate gyrus[J]. Brain Struct Funct, 2018, 223(2): 609-618. DOI:10.1007/s00429-017-1512-1 |
| [8] |
LUO T, CUI S J, BIAN C J, et al. Uhrf2 is important for DNA damage response in vascular smooth muscle cells[J]. Biochem Biophys Res Commun, 2013, 441(1): 65-70. DOI:10.1016/j.bbrc.2013.10.018 |
| [9] |
LU H R, HALLSTROM T C. The nuclear protein UHRF2 is a direct target of the transcription factor E2F1 in the induction of apoptosis[J]. J Biol Chem, 2013, 288(33): 23833-23843. DOI:10.1074/jbc.m112.447276 |
| [10] |
ZENG S Y, WANG Y Y, ZHANG T, et al. E3 ligase UHRF2 stabilizes the acetyltransferase TIP60 and regulates H3K9ac and H3K14ac via RING finger domain[J]. Protein Cell, 2017, 8(3): 202-218. DOI:10.1007/s13238-016-0324-z |
| [11] |
CHEN W B, WU M H, HANG T R, et al. Structure insights into the molecular mechanism of the interaction between UHRF2 and PCNA[J]. Biochem Biophys Res Commun, 2017, 494(3/4): 575-580. DOI:10.1016/j.bbrc.2017.09.102 |
| [12] |
金芳敏, 钱冠华, 杨艳, 等. 人NIRF蛋白与HBV核心蛋白相互作用的初步研究[J]. 生命科学研究, 2011, 15(1): 1-5. JIN F M, QIAN G H, YANG Y, et al. Preliminary study on the interaction between human NIRF protein and HBV core protein[J]. Life Sci Res, 2011, 15(1): 1-5. DOI:10.16605/j.cnki.1007-7847.2011.01.001 |
| [13] |
WANG Y Y, YAN X K, ZENG S Y, et al. UHRF2 promotes DNA damage response by decreasing p21 via RING finger domain[J]. Biotechnol Lett, 2018, 40(8): 1181-1188. DOI:10.1007/s10529-018-2577-5 |
| [14] |
PENG R, HUANG X Y, ZHANG C, et al. Overexpression of UHRF2 in intrahepatic cholangiocarcinoma and its clinical significance[J]. Oncotargets Ther, 2017, 10: 5863-5872. DOI:10.2147/ott.s149361 |
| [15] |
JIN C, XIONG D, LI H R, et al. Loss of UHRF2 is associated with non-small cell lung carcinoma progression[J]. J Cancer, 2018, 9(17): 2994-3005. DOI:10.7150/jca.25876 |
| [16] |
IGUCHI T, UEDA M, MASUDA T, et al. Identification of UHRF2 as a negative regulator of epithelial-mesenchymal transition and its clinical significance in esophageal squamous cell carcinoma[J]. Oncology, 2018, 95(3): 179-187. DOI:10.1159/000488860 |
| [17] |
YANG S X, POLLEY E, LIPKOWITZ S. New insights on PI3K/AKT pathway alterations and clinical outcomes in breast cancer[J]. Cancer Treat Rev, 2016, 45: 87-96. DOI:10.1016/j.ctrv.2016.03.004 |
| [18] |
AKKOÇ Y, BERRAK Ö, ARıSAN E D, et al. Inhibition of PI3K signaling triggered apoptotic potential of curcumin which is hindered by Bcl-2 through activation of autophagy in MCF-7 cells[J]. Biomedecine Pharmacother, 2015, 71: 161-171. DOI:10.1016/j.biopha.2015.02.029 |
| [19] |
REDDY D, KUMAVATH R, TAN T Z, et al. Peruvoside targets apoptosis and autophagy through MAPK Wnt/β-catenin and PI3K/AKT/mTOR signaling pathways in human cancers[J]. Life Sci, 2020, 241: 117147. DOI:10.1016/j.lfs.2019.117147 |
| [20] |
FU X, WEN H Q, JING L, et al. MicroRNA-155-5p promotes hepatocellular carcinoma progression by suppressing PTEN through the PI3K/Akt pathway[J]. Cancer Sci, 2017, 108(4): 620-631. DOI:10.1111/cas.13177 |
| [21] |
MOHAMED E A, AHMED H I, ZAKY H S. Protective effect of irbesartan against doxorubicin-induced nephrotoxicity in rats: implication of AMPK, PI3K/Akt, and mTOR signaling pathways[J]. Can J Physiol Pharmacol, 2018, 96(12): 1209-1217. DOI:10.1139/cjpp-2018-0259 |
| [22] |
HOROWITZ J C, OSTERHOLZER J J, MARAZIOTI A, et al. "Scar-cinoma": viewing the fibrotic lung mesenchymal cell in the context of cancer biology[J]. Eur Respir J, 2016, 47(6): 1842-1854. DOI:10.1183/13993003.01201-2015 |



